Газета «Новости медицины и фармации» 2(307) 2010
Вернуться к номеру
Эффективность Виферона® в терапии и профилактике гриппа и других ОРВИ у детей
Авторы: Т.А. Чеботарева, к.м.н., доцент кафедры детских инфекционных болезней ГОУ ДПО РМАПО Росздрава; Л.Н. Мазанкова, Российская медицинская академия последипломного образования Росздрава, г. Москва
Версия для печати
Широкое распространение острых респираторно-вирусных инфекций (более 70 % от всей инфекционной патологии, регистрируемой у детей), рост заболеваемости, несмотря на успехи специфической профилактики гриппа, частота тяжелых форм и неблагоприятных исходов у детей требуют постоянного совершенствования их профилактической и лечебной тактики.
Известная роль системы интерферона в этиопатогенезе ОРВИ и широкий спектр противовирусной активности интерферонов обусловливают целесообразность их применения при ОРВИ.
Одним из широко применяемых в последние годы интерфероновых препаратов является Виферон®, разработанный в НИИЭМ им. Н.Ф. Гамалеи РАМН и содержащий в своем составе интерферон человеческий рекомбинантный альфа-2b и мембраностабилизирующие компоненты (токоферола ацетат, аскорбиновую кислоту). Препарат выпускается в виде ректальных суппозиториев и мази, что обеспечивает удобные способы его применения у детей, в том числе раннего возраста. Рандомизированное исследование по оценке клинико-иммунологической эффективности Виферона® у детей от 1 года до 14 лет, проведенное под руководством проф. В.П. Тиминой (1998–2000 гг.), убедительно доказало целесообразность его использования при ОРВИ 5-дневным курсом по 1 суппозиторию 2 раза в день [1]. Выявлен протективный эффект виферонотерапии острого периода ОРВИ в отношении частоты последующих острых респираторно-вирусных инфекций. В исследовании получено обоснование клинически эффективной разовой дозы препарата, дифференцированной возрастом пациентов: для детей 1–7 лет — Виферон® 500 тыс. МЕ в суппозитории, 7–14 лет — Виферон® 1 млн МЕ в суппозитории.
В данном исследовании выявлены следующие клинические эффекты виферонотерапии. Отмечено ускорение купирования лихорадки и преобладание во всех возрастных группах критического типа снижения температуры (в среднем у 53 % детей). Этот эффект объясняется противовирусным действием препарата и подтверждается в работах, указывающих на сокращение длительности выявления вирусного антигена в мазках со слизистой оболочки носа [2–5]. Данный механизм терапевтического действия Виферона® реализуется, по-видимому, также в тенденции к сокращению сроков исчезновения интоксикации, что проявляется достоверным ускорением восстановления двигательной активности у детей. Достоверно сокращается длительность насморка и кашля. Отмечено также ускорение темпов исчезновения синдрома крупа, что согласуется с данными других авторов об эффективности и целесообразности применения препаратов ИФН (например, реаферона) при ОРВИ, протекающих с обструктивным синдромом [4].
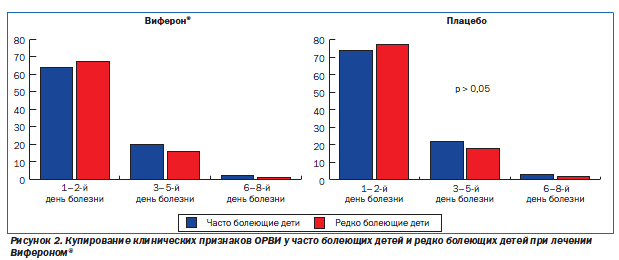
 Положительное влияние виферонотерапии на купирование клинических признаков ОРВИ у детей (рис. 1) может на 1–2 дня сократить длительность стационарного лечения и с учетом распространенности этой патологии дать существенный экономический эффект.
Положительное влияние виферонотерапии на купирование клинических признаков ОРВИ у детей (рис. 1) может на 1–2 дня сократить длительность стационарного лечения и с учетом распространенности этой патологии дать существенный экономический эффект.
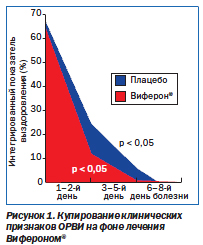
Назначение Виферона® часто болеющим детям позволило ускорить темпы их выздоровления и сделало их сопоставимыми с редко болеющими детьми (рис. 2). Это является дополнительным подтверждением эффективности виферонотерапии и целесообразности ее проведения у часто болеющих детей, доля которых, по нашим данным, составляет 35 %.
Побочных реакций не наблюдали ни в одном случае.
Выраженная клиническая эффективность виферонотерапии ОРВИ у детей сопровождалась протективным эффектом в отношении последующих респираторных заболеваний в течение 6 месяцев. Число эпизодов ОРВИ на одного наблюдаемого ребенка оказалось в 3 раза меньше у получавших терапию Вифероном®. Достоверного влияния на тяжесть последующих ОРВИ выявлено не было.
Иммунозаместительный и иммуномодулирующий эффекты виферонотерапии были подтверждены нами при изучении динамики интерферонового и иммунологического статуса. Исследование интерферонового статуса у больных ОРВИ выявило определенные закономерности его изменений, коррелирующих, с одной стороны, с периодом и тяжестью болезни, с другой — с возрастом пациентов. У больных в первые дни болезни отмечено достоверное повышение уровня сывороточного интерферона по сравнению с нормой, однако у тяжело болевших и у детей раннего возраста этот показатель оставался в пределах нормальных величин. В динамике болезни у детей младшего возраста (1–7 лет) повышенный уровень сывороточного интерферона сохранялся недолго и с 3-го дня болезни происходило его быстрое снижение. У детей старшего возраста (7–14 лет) он сохранялся более длительно — до 6–8-го дня от начала болезни. Наряду с этим у половины обследованных начиная с ранних сроков болезни наблюдалось угнетение способности лейкоцитов к продукции интерферонов. Более слабой способность лейкоцитов синтезировать α- и γ-интерфероны оказалась у детей раннего возраста. Среди тяжелобольных преобладали пациенты с выраженным угнетением интерфероногенеза, особенно по γ-интерферону, причем более половины из них, как и при исследовании сывороточного интерферона, составили дети раннего возраста.
Интерфероновый статус у большинства из группы часто болеющих ОРВИ детей характеризовался низким стартовым уровнем сывороточного интерферона и выраженным угнетением интерферонпродуцирующей функции клеток. Это согласуется с данными других авторов [6], которые выявили параллелизм степени депрессии интерфероногенеза и частоты ОРВИ у детей. Отмеченное подтверждает значимую патогенетическую роль нарушений системы интерферона в формировании названной группы детей.
Включение в терапию наблюдаемых больных Виферона® оказывает существенное влияние на их интерфероновый статус. Через 1–2 суток после начала лечения (3–4-й дни болезни) у большинства отмечается повышение концентрации сывороточного интерферона, которое сохраняется в части случаев и к периоду реконвалесценции.
На фоне виферонотерапии наблюдается также активизация интерферонсинтезирующей функции лейкоцитов как по α-, так и по γ-ИФН (52,3 ± 2,4 против 40,0 ± 2,8 МЕ/мл (р < 0,05) и 15,9 ± 2,8 против 4,0 ± 2,3 МЕ/мл (р < 0,05) соответственно).
Основываясь на полученных данных и данных литературы [7], мы предположили целесообразность применения Виферона® при специфической профилактике гриппа и других ОРВИ у часто и длительно болеющих детей совместно с противогриппозной вакцинацией. В период предэпидемического подъема заболеваемости гриппом и другими ОРВИ дети в возрасте от 3 до 6 лет были привиты инактивированной противогриппозной вакциной расщепленного (сплит) типа (ваксигрипп). Вакцину вводили внутримышечно однократно в дозе 0,5 мл. Однократное введение вакцины было обосновано тем, что большинство детей вакцинировались против гриппа в предшествующий эпидемический сезон, а у части детей тогда же регистрировалось само заболевание, что позволило предположить у них наличие иммунологической памяти со времени предыдущих контактов с вирусом и срабатывания бустерного механизма усиления иммунного ответа.
Дополнительно к вакцине ваксигрипп пациентам был назначен Виферон® 500 тыс. МЕ в суппозитории 5-дневным курсом по 1 суппозиторию дважды в сутки. Получавшие Виферон® составили три группы, различающиеся по срокам назначения препарата относительно вакцинации: I группа — в 5 предшествующих дней; II группа — за 2 дня накануне, в день вакцинации и 2 дня после нее; III — 5 последующих дней. Дети IV группы (группа контроля) получали плацебо.
Исследование интерферонового статуса часто и длительно болеющих детей в предэпидемический период (октябрь — ноябрь) выявило некоторые его особенности: отмечались более высокая концентрация сывороточного интерферона и продукция γ-интерферона, значительное снижение синтеза γ-интерферона по сравнению с общепринятыми нормами. По-видимому, это можно объяснить повышенным уровнем заболеваемости респираторно-вирусными инфекциями и наблюдающейся у детей, несмотря на отсутствие манифестных проявлений болезни, естественной иммунизацией [8]. Однако у части детей (38,3 %) такие отклонения были значительно выражены и сочетались с регистрацией кислотолабильных белков, обладающих противовирусной активностью. Корреляционный анализ выявил взаимосвязь между интерфероновым статусом и показателями иммунитета. Выраженная прямая связь установлена между уровнем кислотолабильного интерферона, с одной стороны, и концентрацией CD25, параметров фагоцитарной активности — с другой (r = +0,77; +0,84 соответственно). Исследование противогриппозного иммунитета до вакцинации показало, что у более 93 % детей регистрируются специфические высокоавидные иммуноглобулины (Ig) класса G против гриппа А и у более 60 % — против гриппа В. Диапазон величин, установленных в этот срок, составил 0–1 : 1280, причем по указанным параметрам группы детей с отмеченными отклонениями в иммунной системе и без таковых оказались сопоставимыми.
Динамика иммунного вакцинального ответа у детей с нормальной иммунной системой значимо не различалась во всех группах. Нарастание титра противогриппозных IgG отмечалось как у серонегативных, так и у серопозитивных пациентов, но достоверным оно оказалось только по отношению к вирусу гриппа В — с 60,5 ± 6,8 % детей до вакцинации до 86, 8 ± 7,6 % через 30 дней после вакцинации (р < 0,05). Сроки появления ранних антител класса М также не различались, и в целом у 84,2 ± 7,5 % детей к 14-му дню после вакцинации регистрировался защитный титр в диапазоне 1 : 40–1 : 320. Эти данные свидетельствуют о незначительной длительности противогриппозного иммунитета и согласуются со сведениями других авторов о целесообразности ежегодной вакцинации [9]. Вместе с тем у детей с отклонениями в иммунной системе выявлены существенные различия. При применении только вакцины концентрация IgM на 14-й день после вакцинации отмечалась достоверно ниже, чем в группе детей без отклонений иммунитета, — количество пациентов, имеющих титр 1 : 20–1 : 40, было 42,8 ± 6,4 против 15,8 ± 6,2 % соответственно, р < 0,05). В сравниваемых группах на 30-й день после вакцинации количество детей с защитным титром антител против вируса гриппа А не различалось, а против гриппа В оказалось значительно меньшим.
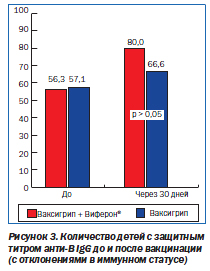
Особенности вакцинального иммунитета детей с отклонениями иммунной системы и положительного влияния Виферона® на вышеназванные параметры позволяют считать целесообразным его использование в качестве адъюванта к противогриппозной вакцине. Препарат следует назначать за 5 дней до вакцинации против гриппа в дозе 500 000 МЕ в суппозитории детям 3–6 лет по 1 суппозиторию дважды в сутки. Катамнестическое наблюдение за всеми обследованными детьми в течение 3–6 месяцев подтвердило клинико-эпидемиологические преимущества в отношении последующих респираторно-вирусных заболеваний комбинированной вакцинопрофилактики. Получавшие Виферон® болели достоверно реже, чем дети из группы плацебо, и количество эпизодов ОРВИ в указанный период оказалось существенно меньшим. Тяжелых и осложненных случаев болезни не было во всех наблюдаемых группах.
Часто и длительно болеющие дети являются группой повышенного педиатрического диспансерного наблюдения, поэтому новые подходы к профилактике гриппа и ОРВИ являются для них особенно актуальными. Применение препарата Виферон® в виде мази интраназально в полной мере демонстрирует антивирусный и иммуномодулирующий эффекты интерферона.
По данным З.С. Макаровой, интраназальное введение мази в дозе
При использовании нами мази Виферон® в остром периоде ОРВИ интраназально 3 раза в день 5-дневным курсом выявлена клиническая эффективность препарата. Получено влияние на динамику купирования лихорадки: в 3–4-й дни болезни у детей, получавших Виферон® в виде мази, лихорадка регистрировалась на достоверно более низких показателях, но вместе с тем влияния на длительность лихорадки при неосложненном ОРВИ не выявлено. Синдром интоксикации у получавших мазь
Виферон® имел тенденцию к более быстрому купированию: через 1–2 суток от начала лечения его наглядные проявления отсутствовали у 66,7 ± 5,5 % наблюдаемых, а в группе плацебо — у 54,4 ± 7,1 % (p > 0,05); общая продолжительность интоксикации составила соответственно 2,33 ± 0,55 и 3,29 ± 0,66 дня (p > 0,05). Существенных различий этих показателей в возрастных группах также не отмечено. Наряду с этим значимым оказалось различие в сроках восстановления двигательной активности у детей старше 7 лет (1,67 ± 0,41 дня на фоне терапии мазью Виферон®, 2,84 ± 0,35 — плацебо, p < 0,05).
Влияние терапии мазью Виферон® на респираторный синдром выражалось в сокращении длительности насморка (в среднем 3,53 ± 0,22 дня против 4,35 ± 0,45 дня в группе плацебо, p < 0,05). У детей с длительно сохранявшимся ринитом на фоне виферонотерапии его выраженность (отек, слизистое отделяемое) была достоверно меньшей. Особо следует отметить, что число детей, у которых проявления ринита исчезли через 1–3 суток от начала лечения, среди получавших мазь Виферон® было существенно большим, чем в контрольной группе: 59,7 ± 5,7 и 38,4 ± 7,1 %, p < 0,05.
Значимого влияния на продолжительность кашля, так же как и на длительность синдрома крупа, не отмечено.
Важным преимуществом терапии мазью Виферон® явился профилактический эффект в отношении наслоения вторичной бактериальной флоры: у получавших мазь Виферон® осложнения регистрировались достоверно реже (23,7 %) по сравнению с плацебо (45 %) (р < 0,05). Оценка трансформации формы ринита в гнойный достоверно подтвердила указанный эффект — 7,9 % на фоне терапии мазью Виферон® и 20 % — плацебо.
Не выявлено различий между вариантами терапии при развитии суперинфекции. За время пребывания детей в стационаре как в основной, так и в контрольной группе с одинаковой частотой регистрировались признаки новой инфекции (ОРВИ, вирусная диарея клинически) до купирования основного заболевания (8–11 % детей). Однако у детей, получавших мазь Виферон®, суперинфекция была обусловлена преимущественно вирусами, тропными к эпителию кишечника, а не респираторными.
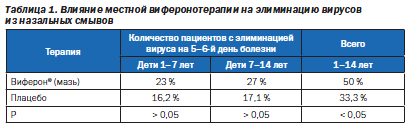
Оценка противовирусного эффекта мази Виферон® проводилась на основании данных ПЦР-диагностики, осуществляемой в 1–2-й и 5–6-й дни болезни. В половине случаев этиология заболевания у детей была представлена как моноинфекция: в 15 % — риновирус, в 13,3 % — РС-вирус, в 10 % — аденовирус, в 1,7 % — вирус парагриппа, в 1,7 % — вирус гриппа В. У 33,3 % больных диагностирована смешанная вирусная инфекция, которая была представлена вирусом гриппа А в сочетании с другими тестированными вирусами. В ряде случаев проводилось парное вирусологическое исследование назальных смывов и сыворотки крови, позволившее расшифровать этиологию регистрируемых суперинфекций. У 23,3 % больных этиология заболевания осталась нерасшифрованной. Отмечено достоверное положительное влияние виферонотерапии мазью на элиминацию этиологически значимого вируса из назальных смывов (табл. 1). У половины пациентов, получавших мазь Виферон®, этиологический агент на 5–6-й день болезни не обнаруживался, тогда как в группе плацебо — у трети больных (p < 0,05).
Выявленная клиническая эффективность местной виферонотерапии коррелировала с изменениями цитокинового статуса слизистой носа, определяемого в назальных смывах. Индуцированная продукция α-ИФН у пациентов, получавших мазь Виферон®, увеличивалась в 2 раза в динамике и достоверно отличалась в периоде реконвалесценции по сравнению с детьми, получавшими плацебо (9,8 ± 1,4 и 4,9 ± 0,6 соответственно, p < 0,05). В динамике ОРВИ у детей, получавших мазь
Виферон®, не изменялась концентрация ИЛ-8 в назальных смывах, тогда как на фоне плацебо она достоверно увеличивалась (386,4 ± 49,0 против 640,9 ± 122,6, p < 0,05), что свидетельствует о регуляции иммунного ответа мазью Виферон® по клеточному типу и коррелирует с быстрой элиминацией этиологически значимого вируса со слизистой носа. Кроме этого, у детей, получавших мазь Виферон®, в динамике болезни достоверно увеличивалась концентрация секреторного IgА, которая оказалась достоверно более высокой в периоде реконвалесценции по сравнению с детьми, получавшими плацебо. Влияния местной виферонотерапии на концентрацию γ-ИФН, ИЛ-1β, ФНО и лизоцима в назальных смывах не выявлено.
Таким образом, Виферон® (суппозитории и мазь) является высокоэффективным средством для лечения и профилактики гриппа и других ОРВИ у детей и обладает адъювантными свойствами при противогриппозной вакцинации.
1. Чеботарева Т.А., Тимина В.П., Малиновская В.В. Применение Виферона при гриппе и других острых респираторных вирусных инфекциях у детей // Детский доктор. — 2000. — 5. — С. 16-18.
2. Гапонюк П.Я., Щипанова А.И. Применение интерферона α-2b в педиатрической практике // Сб. материалов ХI конгресса педиатров России «Актуальные проблемы педиатрии». — 2007. — 159 с.
3. Кладова О.В., Замахина Е.В., Учайкин В.Ф. Иммунокорригирующая терапия при ОРЗ // Практика педиатра. — 2006. — 12. — С. 8-11.
4. Меркулова Л.Н. Клинико-иммунологические показатели у больных гриппом при лечении реафероном: Автореф. диссертации канд. мед. наук. — М., 1994. — 25 с.
5. Позднякова М.Г., Максакова В.Л., Колыванова И.Л. и др. Оценка эффективности экстренной профилактики гриппа и других острых респираторных вирусных инфекций у детей с помощью рекомбинантного α-2b интерферона при пероральном применении // Педиатрическая фармакология. — 2006. — 3. — С. 10-13.
6. Самсыгина Г.А. Часто болеющие дети: проблемы патогенеза, диагностики и терапии // Практика педиатра. — 2005. — 12.
7. Чеботарева Т.А. Сезонная интерпретация показателей интерферонового статуса // Тезисы докладов I Конгресса педиатров-инфекционистов. — М., 2002. — 185 с.
8. Гольдштейн А.В. Целесообразность ежегодной вакцинации против гриппа // Вакцинация. Информационный бюллетень. — 2003. — 3. — С. 8-10.
9. Tovey M.G., Bloch F., Launay O. and other. Adjuvant activity of interferon alpha in influenza vaccination // Cytokines. — 2006. — 17. — 132.
10. Макарова З.С., Доскин В.А., Малиновская В.В. Эффективность применения мази виферон при реабилитации часто болеющих детей // Лечащий врач. — 2006. — 1. — С. 86-87.