Газета «Новости медицины и фармации» Гастроэнтерология (313) 2010 (тематический номер)
Вернуться к номеру
Перианальный отек в послеоперационном периоде у проктологических больных: патофизиология и пути профилактики
Авторы: И.С. Риткис, А.Ф. Элин, Е.А. Герасименко, С.Л. Авраимов. Медицинский центр «Добробут — Донецк», Донецкий городской проктологический центр
Версия для печати
Актуальность вопроса
В настоящее время общепризнанным фактом является то, что единственным и радикальным способом лечения как хронической, так и острой формы геморроя является хирургическое пособие. Дискутабельным и не до конца решенным является вопрос о выборе способа и объема оперативного вмешательства. Обсуждаются вопросы о месте традиционной операции Миллигана — Моргана в различных модификациях в общей структуре геморроидэктомий, а также целесообразность использования малотравматичных (мини-инвазивных) технологий. Несмотря на преимущества и недостатки тех и других способов, не существует единой точки зрения в определении показаний и противопоказаний к применению данных способов коррекции геморроидальной болезни. Весомым аргументом сторонников использования традиционных способов (модификации операции Миллигана — Моргана) является ее радикализм. По литературным данным, отсутствие рецидива заболевания в последующем отмечено у 95–98 % пациентов [4]. Данный показатель при применении мини-инвазивных технологий значительно ниже и варьирует в зависимости от используемого метода. В то же время, с учетом анализа ранних послеоперационных осложнений и качества жизни оперированных больных, неоспоримым является тот факт, что количество ранних послеоперационных осложнений в первой группе значительно выше, что, безусловно, склоняет многих проктологов к использованию менее травматичных технологий [1–3]. Еще в 1994 году М. Cormann и соавт. предложили дифференцированный подход к выбору объема и способа хирургической коррекции геморроидальной болезни. По мнению авторов [8, 14], мини-инвазивные технологии показаны при 1–3-й стадии (редко 4-й), а именно: склеротерапия — 1-я стадия, инфракрасная коагуляция — 1–2-я стадии; латексное лигирование — 1–3-я стадии; трансанальная геморроидальная деартериализация (ТНD) или операция Лонго — 2–3-я стадии, а «стандартное» хирургическое лечение — 4-я стадия.
Мы убеждены, что выбор оптимальной хирургической тактики должен базироваться не только на личном опыте хирурга, но, прежде всего, на научной доказательной базе, которая показывает преимущества определенного хирургического метода по сравнению с другими.
Результаты хирургического лечения геморроя оцениваются на основании эффективности многих показателей, а именно: послеоперационная боль, время реабилитации, пребывание в стационаре, частота ранних и поздних осложнений, эстетические и функциональные результаты, частота рецидивов и, наконец, стоимость лечения.
Принципы доказательной медицины, основанные на современных представлениях о достоверности полученных результатов, а именно их уровне и степени рекомендаций, позволяют оптимизировать показания к выбору способа (консервативный или хирургический) и объема оперативного вмешательства при хроническом геморрое. Уровни научных данных при выборе какого-либо лечения и, как следствие, степень рекомендации данного метода были зарегистрированы в 1992 году и уже приняты большинством научных обществ, в том числе Американской ассоциацией колоректальных хирургов.
При первой стадии заболевания подавляющее большинство проктологов считают, что лечение необходимо начинать с консервативных мероприятий (уровень доказательности рекомендаций В). Основой лечения является коррекция рациона, а именно увеличение употребления клетчатки и воды с целью облегчения опорожнения и назначение флавоноидов [13, 16], что способствует уменьшению симптомов болезни (уровень доказательности рекомендаций В). В то же время отсутствие положительных результатов, по мнению Е. Benzoni и соавт. (2006), является показанием к проведению инфракрасной коагуляции или лигированию латексными кольцами.
Проведенный H.M. Macre и R.S. McLeod в 1995 г. метаанализ хирургического лечения хронического геморроя второй стадии показал, что методикой, давшей наилучшие долгосрочные результаты по сравнению с
другими способами, является лигирование латексными кольцами по Barron [3, 4] (уровень доказательности рекомендаций А). Другие малотравматичные методики, в частности склеротерапия и фотокоагуляция, проведенные отдельно или в комплексе, имели удовлетворительные результаты, но при условии выполнения их опытными специалистами. В дальнейшем данные способы были отклонены большинством проктологов в пользу операции Баррона.
Достаточно хорошо зарекомендовал себя метод лечения хронического внутреннего геморроя второй стадии с использованием ультразвуковой допплерометрии (проксимальное лигирование) — трансанальная геморроидальная деартериализация [1, 15]. Данный способ завоевывает все большее число сторонников благодаря незначительному количеству осложнений, малотравматичности и положительным краткосрочным результатам. В первом рандомизированном исследовании операции с применением техники THD, в сравнении с геморроидэктомией по Миллигану — Моргану, получены достоверно лучшие краткосрочные результаты в группе, где было использовано THD, по следующим показателям: уменьшение послеоперационных болей, сроков пребывания в стационаре и восстановления трудоспособности [17]. В то же время, по данным G. Bursics и соавт. (2004), результаты лечения пациентов после года наблюдений оказались аналогичными (уровень доказательности рекомендаций В).
Наиболее частой причиной обращения пациентов за хирургической помощью является хронический геморрой третьей стадии [6]. Четыре проведенных метаанализа установили преимущество метода циркулярного степлера Лонго перед операцией по Миллигану — Моргану на данной стадии заболевания. Это подтверждается менее выраженной послеоперационной болью и быстрым восстановлением трудоспособности [10, 11]. Однако возникновение таких наиболее распространенных осложнений после геморроидэктомии, как кровотечение и нарушения континенции, существенно не отличались от тех, которые возникали после операции по Миллигану — Моргану. В то же время имеются данные о тяжелых осложнениях после операции Лонго — ректовагинальные свищи, уменьшение просвета анального канала, затруднение при дефекации, стриктура прямой кишки по типу «песочных часов», интрамуральная гематома, хроническая боль в зоне операции, забрюшинная флегмона и сепсис. G. Aumann (2004) и К. Blous (2007) описали случаи внутрибрюшного кровотечения, а Nardelli и Pulvirenti d''Urso (2006) — тромбоз нижней полой вены, требующий нефрэктомии. Кроме того, по данным М. Rowsell (2000), D. Lomanto и соавт. (2007), отрицательным моментом метода Лонго является высокий уровень диагностики резидуальных геморроидальных узлов или их ранних рецидивов, что привело к снижению уровня доказательности до рекомендаций С. G. Felice и соавт. (2005) указывают, что альтернативным методом лечения больных с третьей стадией заболевания является THD, дополненный методом «анального лифтинга».
Практически не обсуждается вопрос о хирургической тактике при лечении пациентов с четвертой стадией заболевания. Подавляющее число проктологов склоняются к геморроидэктомии по Миллигану — Моргану, используя преимущества радиочастотного или ультразвукового скальпеля [7]. С целью снижения травматизма и, как следствие, уменьшения интенсивности болевого симптома в послеоперационном периоде рассматривается использование сшивающих аппаратов, лазерных технологий [3, 4] и т.д. В литературе сообщается о положительных результатах при использовании метода Лонго при лечении геморроя четвертой степени [10], однако, по всей видимости, возникают разночтения в классификации, поскольку истинный мукогеморроидальный пролапс при четвертой степени не имеет достаточной подвижности для проведения геморроидопексии. Проведенное M.S. Wilson, V. Pope, H.E. Dor и соавт. (2002) рандомизированное исследование долгосрочных результатов показало, что при четвертой стадии геморроя частота возникновения рецидивов и неудовлетворенности пациентов после операции Лонго значительно выше, чем после операции по Миллигану — Моргану (уровень доказательности рекомендаций С).
По сводной статистике, опубликованной В.Г. Мишаловым и соавт. (2008), при использовании операции по Миллигану — Моргану в структуре ранних послеоперационных осложнений значительное место занимает выраженный послеоперационный перианальный отек. Частота его возникновения при применении различных модификаций операции Миллигана — Моргана колеблется, по данным различных авторов, от 1,8 до 24 %, составляя в среднем 7–7,5 % и уступая лишь температурной реакции, острой задержке мочи (9,8–16,3 %) и выраженному болевому симптому (10,3–20,8 %) [4].
С данным осложнением раннего послеоперационного периода сталкиваются проктологи и при выполнении малотравматичных хирургических вмешательств, в частности при латексном лигировании и ТНD [5, 15, 17]. Методы, позиционируемые как амбулаторные, зачастую требуют последующего упорного и длительного консервативного лечения в связи с острым наружным тромбозом, а в некоторых случаях — и стационарной хирургической помощи. Если в литературе широко освещены вопросы профилактики и лечения послеоперационного болевого симптома и других ранних осложнений, то, на наш взгляд, проблема перианального отека не нашла должного внимания.
Необходимо отметить, что с данным осложнением проктологи сталкиваются не только при геморроидэктомии, но и при выполнении других хирургических вмешательств в области анального канала, в частности иссечения хронической анальной трещины, прямокишечных свищей и т.д. В любом случае имеет место процесс травматизации тканей (анодермы, слизистой оболочки, кавернозных телец) как в месте непосредственного приложения оперативного пособия, так и в окружающих тканях. В связи с этим явления перианального отека возможны в той или иной степени после каждого оперативного пособия в данной зоне.
Целью данного исследования явилось изучение причин и разработка комплекса мер по профилактике перианального отека в послеоперационном периоде у проктологических больных. Мы отдаем себе отчет, что отек в зоне операции той или иной степени выраженности — явление частое, и к настоящему времени накоплен богатый клинический материал, указывающий на то, что большое значение при заживлении ран имеет характер отека тканей зоны травмы. Посттравматический (послеоперационный) отек, с одной стороны, обеспечивает эффект иммобилизации поврежденной ткани и плотность смыкания краев раны, способствует гемостазу, но с другой — при выраженности и длительности его существования вызывает грубые нарушения в микроциркуляторном русле, ухудшая процесс заживления раны и формируя в последующем грубую рубцовую ткань. Исследованию подлежали только те пациенты, у которых развившийся в послеоперационном периоде перианальный отек оценивался как патологический и влиял на ход послеоперационной реабилитации. В изученную группу вошли больные как с отеком перианальной кожи (анодермы), так и пациенты с развившимся флебитом наружных геморроидальных узлов, которые были не выражены при первичном осмотре или не нуждались в удалении.
Материалы и методы
Проанализирован опыт хирургического лечения 136 пациентов с хроническим геморроем 2–3-й стадии в возрасте от 26 до 52 лет: из них 59 женщин и 77 мужчин. 1-ю группу составили 74 пациента, которые были оперированы с использованием геморроидэктомии по Миллигану — Моргану. Во 2-ю группу вошли 62 пациента, в хирургическом лечении которых использовались малотравматичные хирургические вмешательства (циркулярное латексное лигирование и THD). Каждая из групп была разбита на 2 равные подгруппы: в первую подгруппу вошли пациенты, к которым применялась разработанная нами программа профилактики развития перианального отека (флебита) в раннем послеоперационном периоде, вторую подгруппу составили пациенты, оперированные до начала применения указанной программы.
Результаты и обсуждение
Следуя канонам патологической физиологии, отеком считается патологическое скопление и задержка жидкости в тканях и тканевых пространствах вследствие нарушения обмена воды между кровью и тканями. Согласно классической теории Старлинга, обмен воды между капиллярами и тканями определяют следующие факторы: 1) гидростатическое давление крови капилляра и величина тканевого сопротивления; 2) коллоидно-осмотическое давление плазмы крови и тканевой жидкости; 3) проницаемость капиллярной стенки. Если принять за факт, что большинство из оперированных больных компенсированы по белковому и электролитному балансу, то есть отсутствовала декомпенсированная кардиальная и т.п. патология, то с определенной долей уверенности можно исключить из исследования коллоидно-осмотический фактор — онкотический отек. Таким образом, учитывая особенности анатомии и физиологии анального канала, а также особенности хирургического вмешательства в этой зоне, оставшиеся две причины развития перианального отека являются актуальными. Гидростатический фактор: при возрастании величины гидростатического давления в сосудах возрастает фильтрационное давление, а также площадь сосудов, с которой происходит фильтрация жидкости из сосуда в ткань. Площадь же, с которой осуществляется обратный переход жидкости, уменьшается. Возникает задержка жидкости, развивается так называемый механический, или застойный, отек (по аналогии — отеки при тромбофлебитах, синдроме нижней полой вены у беременных и т.д.) [9]. Указанный механизм полностью соответствует гемодинамической теории развития геморроидальной болезни, описанной W. Thomson (1975), Л.Л. Капуллер, Ю.В. Дульцевым и соавт. (1994), — дисфункция сосудов, приводящая к усиленному притоку артериальной крови и уменьшению оттока по кавернозным венам, что способствует увеличению размеров кавернозных телец и развитию геморроидальных узлов.
Проницаемость капиллярной стенки: основной физиологической концепцией развития данного фактора является развитие дисбаланса между артериальной капиллярной фильтрацией и венозной резорбцией. Возникновению отека способствует тот факт, что в области поврежденных тканей (а речь идет об операционной травме) резко возрастает проницаемость капилляров для белков плазмы крови, что приводит к местному повышению онкотического давления тканевой жидкости [9]. По данным А.Д. Адо, уже через 5 минут после воздействия травмирующего фактора достоверно повышается проницаемость капиллярной стенки и появляются условия для развития местного отека, а через 35–40 минут отмечается второй пик возрастания пороговой концентрации межтканевых белков и, как следствие, прогрессирование отека.
Рассматривая нарушение проницаемости сосудистой стенки как одну из ведущих причин развития перианального отека у проктологических больных, следует упомянуть, что прогрессированию данного механизма способствуют следующие факторы: 1) неврогенный отек — нарушение проницаемости сосудистой стенки, обусловленное расстройством нервной регуляции, — послеоперационный болевой синдром; 2) токсический отек — воздействие на сосудистую стенку бактериальных токсинов — инфицированность ран анального канала; 3) лимфатический отек — развитие регионарного лимфостаза и так называемой динамической лимфатической недостаточности, обусловленной развитием прессорного рефлекса на лимфатические сосуды из-за высокого гидростатического сосудистого давления, о чем говорилось выше.
Таким образом, понимая патофизиологические пусковые механизмы и анализируя хирургические аспекты развития перианального отека у данной категории больных, следует обратить внимание на следующие моменты.
Обязательным условием большинства проктологических вмешательств является девульсия анального жома с целью ревизии, санации прямой кишки, а в последующем — выполнения хирургического пособия. Данная манипуляция особенно важна с позиции интраоперационной визуализации структур анального канала, не только анатомического, но и так называемого хирургического, длина которого составляет от 3 до 5 см. С этой целью на территории стран бывшего СССР традиционно используют ректальные зеркала, наложение зажимов Алиса на анодерму с их тракцией или предлагаемых различными авторами колец-дилататоров, к которым фиксируют растягивающие лигатуры, наложенные у края заднего прохода.
Использование щадящих зарубежных операционных аноскопов типа Pratt, Eisenhammer и Fansler, а также специальных зеркал-ретракторов с дополнительными крючками (типа Parks) для предотвращения пролапса противоположной ректальной стенки достаточно удобно, но в связи с высокой стоимостью они применяются крайне редко. Попытка максимальной визуализации операционной зоны зачастую приводит к необходимости избыточной и неконтролируемой девульсии анального жома и, как следствие, излишней травме сфинктерного и связочного аппарата, что приводит в последующем к усилению послеоперационного болевого синдрома, дизурическим расстройствам и является пусковым механизмом развития перианального отека. При выполнении малоинвазивных хирургических вмешательств при геморроидальной болезни, в частности латексного лигирования, ТНD и операции Лонго, степень травмы анального сфинктера минимальна. Однако если исключить технические ошибки в виде наложения латексного кольца при операции Баррона на близлежащую крипту или чрезмерно глубокое прошивание при ТНD с попаданием в лигатуру внутреннего сфинктера или низкое наложение степлера при операции Лонго, проявляющиеся выраженным болевым симптомом, отеком и другими клиническими признаками, то все же вероятность развития перианального отека (флебита) остается достаточно высокой. С.Д. Трухмановым (2006) указываются такие причины перианального отека, как травмирование анального канала и отдельных наружных узлов тубусом аноскопа с их повреждением и тромбозом при любом виде оперативного вмешательства из перечисленных выше, а также значительное замедление кровотока при ТНD и операции Лонго, приводящее к дистальному тромбозу и отеку, особенно при значительных размерах кавернозной ткани. Попытки профилактики наружного тромбоза путем удаления наружных узлов сводят на нет малоинвазивность вмешательства со всеми вытекающими из этого проблемами.
При длительном проктологическом анамнезе, в запущенных случаях, как правило при хроническом геморрое 3–4-й степени, имеющиеся геморроидальные узлы располагаются не только типично — в проекции трех главных групп кавернозных телец анального канала (зоны, проецирующиеся на 3, 7 и 11-м часах условного циферблата), но имеются дополнительные, зачастую множественные как внутренние, так и наружные геморроидальные узлы [2, 12]. В связи с этим в ходе оперативного пособия зачастую, дабы избежать обширной циркулярной раневой поверхности и рубцовой стриктуры анального канала в последующем, вынужденно не удаляются мелкие, единичные и атипично расположенные геморроидальные узлы. Нельзя не согласиться с мнением W. Thomson (1975), что «геморроидальные сплетения — это нормальная анатомическая структура у человека, и не нужно стремиться во что бы то ни стало их все убрать». Именно эти единичные кавернозные образования, оставленные в перианальной области, зачастую и являются причиной развития перианального отека в послеоперационном периоде. Попытки дополнить операцию Миллигана — Моргана коагуляцией остаточной кавернозной ткани не нашли широкого распространения.
У длительно и хронически болеющих пациентов, а также при операциях у больных с острым тромбозом геморроидальных узлов выраженное перианальное воспаление имеет место изначально [12]. Послеоперационное распространение изначально существующего тромбоза в венах слизистой оболочки приводит к отеку, кровоизлиянию, а зачастую и некрозу участков слизистой оболочки, иными словами — к картине венозного инфаркта. При морфологическом исследовании в местах повреждения (некроза) слизистой оболочки определяется лейкоцитарная инфильтрация, распространяющаяся на подслизистый слой, а иногда и на всю ее глубину. Нарушается барьерная функция слизистой оболочки, происходит инфицирование тканей, запускается механизм токсического отека, о чем говорилось выше. При этом даже при максимально радикально выполненной операции в послеоперационном периоде возможно развитие выраженного отека в перианальной области.
Таким образом, исходя из анатомофизиологических особенностей анального канала, патофизиологических канонов формирования отека, а также этиологических и хирургических аспектов геморроидальной болезни формируется программа профилактики развития перианального отека (флебита) в раннем послеоперационном периоде.
1. Максимально щадящая девульсия анального жома. Известно, что чрезмерная девульсия ануса более его диаметра на 30 % может привести к необратимым изменениям в его мышечных структурах. Насильственное перерастяжение заднего прохода приводит к окончательному разрыву связок Паркса и нарушению поддерживающего каркаса слизистой анального канала, происходит травма мышечных волокон сфинктеров, возникают кровоизлияния и гематомы и, как следствие, оптимальные условия для развития перианального отека.
2. Улучшение тканевой перфузии в перианальной зоне. В ходе предоперационной подготовки, а также после проведения оперативного вмешательства в раннем послеоперационном периоде с целью профилактики отека тканей в перианальной области необходимо комбинирование общей и местной терапии. Учитывая, что субстратом данной патологии является сосудистое русло и процесс локализуется в кавернозных тканях терминального отдела прямой кишки, имеющих характерные морфо-физиологические особенности, в плане общей терапии мы использовали в первую очередь флебо- и лимфотропные препараты: диосмин, геспередин и т.п. Их применение оказывает следующие вазопротекторные эффекты: нормализуется проницаемость капилляров и уменьшается их ломкость; повышается венозный тонус и скорость кровотока; улучшается микроциркуляция; увеличивается скорость лимфооттока, тем самым происходит стимуляция лимфодренажа; создается препятствие адгезии, миграции и активации лейкоцитов. По нашему глубокому убеждению, данную терапию следует начинать в дооперационном периоде, в максимальных дозировках, а именно за 3–4 суток до планового оперативного вмешательства и продолжать в раннем послеоперационном периоде. Интересным и перспективным, на наш взгляд, является использование непрямых антикоагулянтов или низкомолекулярных гепаринов с целью улучшения периферического кровотока и тканевой перфузии. Однако использование последних целесообразно при выполнении малотравматичных вмешательств, в частности при наложении латексных колец (операции Баррона) и ТНD, из-за минимального риска развития кровотечения в раннем послеоперационном периоде.
Если говорить о местной терапии, то мы длительное время использовали стандартные подходы, основываясь на литературных данных: наряду с ежедневной тщательной санацией раневых поверхностей растворами антисептиков применяли те или иные свечи и мази. Однако значимого клинического эффекта не получили. Значительный клинический эффект был получен при применении препарата безорнил. Безорнил является комплексным препаратом, в состав которого входят борнеол, каламин, бурситин, мускус, безоар, а также вазелин, ланолин, тетраборат натрия. Действие этого препарата обусловлено комбинированным действием биологически активных веществ, входящих в состав природных компонентов. Препарат обладает выраженным вяжущим, противовоспалительным и регенеративным эффектом. Обрабатывая безорнилом анальный канал и перианальную область, включая раневые поверхности, сразу же по окончании операции и повторяя данную процедуру через 4–5 часов и при ежедневных перевязках, мы смогли значительно снизить частоту развития перианального отека. Данный эффект получен благодаря выраженному селективному спазмолитическому действию препарата на внутренний анальный сфинктер. Отсутствие гипертонуса последнего создает в послеоперационном периоде оптимальные условия для нивелирования гидростатического фактора развития перианального отека. Используя данный эффект безорнила, мы широко применяем одновременное латексное лигирование 3 и более внутренних геморроидальных узлов, что является неоспоримым преимуществом в отличие от этапных манипуляций у больных с упорными кровотечениями и анемизирующим геморроем.
3. Предупреждение инфицирования раневых поверхностей. Данный постулат условен. Конечно же, добиться полной стерильности при операциях на прямой кишке невозможно, однако использование ряда простых способов позволяет у большинства больных избежать инфекционных осложнений и предотвратить развитие токсического отека, особенно это актуально при выполнении геморроидэктомии в модификациях Миллигана — Моргана. На начальном этапе операции в нижнеампулярный отдел прямой кишки устанавливаем марлевый тампон-обтуратор, который не только устраняет инфицирование операционного поля кишечным содержимым, но и, самое главное, восстанавливает нормальное анатомическое взаиморасположение тканей при скольжении и частом выпадении слизистой анального канала. К профилактическим мерам мы относим тщательную подготовку кишечника перед операцией и послеоперационную тампонаду анального канала узким марлевым мазевым дренажем. Целью подобной тампонады является, кроме окончательного гемостаза, плотная фиксация слизистой на своем месте и профилактика болезненного послеоперационного спазма сфинктера. Считаем нецелесообразным использование широких («4-пальцевых») тампонов, применяли узкий марлевый тампон, который удаляли через 4–5 часов после операции, безболезненно в связи с продолжением действия анестезии, а у некоторых больных сохраняли его и до 12 часов. Вместо традиционных водорастворимых антибиотикосодержащих мазей используем безорнил. Борнеол, входящий в препарат, оказывает выраженное бактериостатическое действие в отношении кишечной палочки, гемолитического и зеленящего стрептококка, золотистого стафилококка. Кроме того, каламин, как один из компонентов безорнила, не только уменьшает образование экссудата в зоне операции и адсорбирует его, но и формирует нежную пленку, обволакивая и защищая раневые поверхности. Данное свойство каламина является неоспоримым плюсом по сравнению с традиционными мазями при выполнении открытой геморроидэктомии. Системные антибактериальные препараты считаем показанными лишь при операциях на уже заведомо инфицированных тканях: при остром тромбозе геморроидальных узлов с некрозом и т.п. Трансанальная геморроидальная деартериализация и латексное лигирование сопряжены с наименьшей вероятностью инфицирования, однако, как говорилось выше, не исключают возможности развития флебита и отека в раннем послеоперационном периоде и в некоторых случаях нуждаются в анальной тампонаде. Использование с этой целью узких тампонов с мазью безорнил, а зачастую просто введение его в просвет кишки с обработкой анодермы оправдало себя с фармакологической и клинической точки зрения.
4. Продленная анестезия. Обращает на себя внимание, что частота развития послеоперационного отека у проктологических больных, оперированных под внутривенным обезболиванием, значительно выше, чем при проводниковой анестезии. С целью нивелирования неврогенного фактора в механизме развития перианального отека считаем методом выбора эпидурально-сакральную (спинальную) анестезию как оптимальный способ интраоперационного обезболивания и ведения раннего послеоперационного периода. Ни применение местных анестезирующих гелей, ни внутривенное обезболивание, ни тем более местная анестезия не дадут такого эффекта релаксации анального жома, как проводниковая блокада, обеспечив возможность атравматичной девульсии, о чем говорилось ранее. Использование безорнила позволило нам получить дополнительный положительный эффект. Искусственный безоар и жемчуг, входящие в безорнил, обладая выраженным анальгетическим и противовоспалительным эффектом, пролонгируют действие проводниковой анестезии, снижают уровень болевой чувствительности, создавая условия для более комфортного и безболезненного раннего послеоперационного периода и перевязок.
Если необходимость госпитализации при выполнении традиционного хирургического вмешательства при геморроидальной болезни практически не обсуждается, то наш опыт выполнения малотравматичных вмешательств с учетом проведенного анализа возникновения послеоперационного флебита показывает, что кратковременная госпитализация данной категории пациентов в специализированное лечебное учреждение оправданна и обоснованна. «Гладкий», безболезненный послеоперационный период, не омраченный осложнениями, которых можно было избежать, принесет удовлетворение как пациенту, так и врачу.
Проведенный анализ лечения больных обеих групп показал следующее. В первой группе (74 пациента), где геморроидэктомия выполнялась с использованием операции Миллигана — Моргана, из 37 пациентов, оперированных до начала использования программы профилактики развития перианального отека, данное осложнение возникло у 6 больных (18,7 %). Во второй подгруппе, которую составили 37 пациентов, где применялась профилактика перианального отека, он отмечен лишь у 2 больных, что составило 5,4 % (рис. 1).
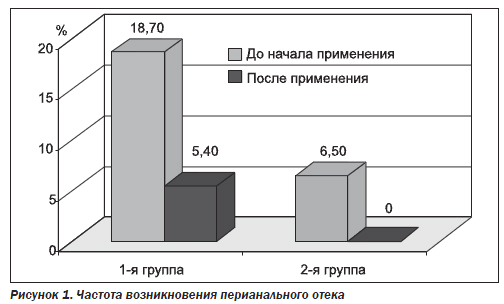
Во второй группе, 62 пациента которой были оперированы с применением малотравматичных хирургических вмешательств (циркулярное латексное лигирование и THD), в первой подгруппе (без применения профилактических мер) частота возникновения выраженного перианального отека составила 6,5 % (2 больных). После же начала применения программы профилактики перианального отека возникновения данного осложнения у пациентов 2-й подгруппы отмечено не было.
Выводы
Таким образом, применение комплекса мер по профилактике перианального отека в послеоперационном периоде позволило сократить частоту данного осложнения у больных, оперированных с использованием операции Миллигана — Моргана, с 18,7 до 5,4 %. У больных второй группы частота возникновения такого осложнения, как выраженный перианальный отек, изначально (до начала применения профилактической программы) невысокая — у 2 больных (6,5 %) из 31 пациента первой подгруппы 2-й группы. Это объясняется малым травматизмом тканей при применении циркулярного латексного лигирования или THD. Применение же разработанной нами программы позволило вообще избежать возникновения данного осложнения у больных второй подгруппы 2-й группы. Мы отдаем себе отчет, что полученный результат далек от совершенства и требует дальнейших изысканий.
1. Канаметов М.Х. Шовное лигирование терминальных ветвей верхней прямокишечной артерии под контролем ультразвуковой допплерометрии в лечении геморроя: Автореф. дис... канд. мед. наук. — М., 2002. — 18 с.
2. Кондратенко П.Г., Губергриц Н.Б., Элин Ф.Э., Смирнов Л.В. Клиническая колопроктология: Руководство для врачей. — Х.: Факт, 2006. — 385 с.
3. Мамчич В.І., Палієнко Р.К., Андрієць В.С. та ін. Лікування гострого геморою з використанням міні-інвазивних методик // Хірургія України. — 2006. — № 2. — C. 72-74.
4. Мішалов В.Г., Діброва В.А., Цема Є.В. Хірургічне лікування геморрою // Хірургія України. — 2008. — № 3. — С. 76-86.
5. Палієнко Р.К., Пироговський В.Ю., Андрієць В.С. Особливості вакуумного лігування гемороїдальних вузлів // Матеріали ІІ з''їзду колопроктологів України. — К.: Медицина, 2006.
6. Подпрятов С.С., Подпрятов С.Є., Новжова М.М. Оптимізація сучасної тактики оперативного лікування геморою III–IV cт. // Клін. хірургія. — 2006. — № 2. — С. 14-18.
7. Тимербулатов В.М. и др. Использование генератора LigaSure при геморроидэктомии // Хирургия. Журн. им. Н.И. Пирогова. — 2004. — № 9. — С. 44-46.
8. Шелыгин Ю.А., Благодарный Л.А., Хмылов Л.М. Выбор способа геморроидэктомии при хроническом геморрое // Хирургия. Журн. им. Н.И. Пирогова. — 2003. — № 8. — С. 39-45.
9. Aigner F., Bodner G., Gruber H., Conrad F., Fritsch H., Margreiter R., Bonatti H. The vascular nature of hemorrhoids // J. Gastrointest. Surg. — 2006. — 10(7). — P. 1044-1150.
10. Ascanelli S. et al. Long stapled haemorrhoidectomy versus Milligan — Morgan procedure: short- and long-term results of a randomized, controlled, prospective trial // Chin. Ital. — 2005. — Vol. 57, № 4. — P. 439-447.
11. Candela G. et al. The gold standard in the treatment of haemorrhoidal disease. Milligan-Morgan haemorrhoidectomy vs Longo mucoprolapsectomy: comparing techniques // Minerva Chin. — 2007. — Vol. 62, № 3. — P. 151-159.
12. Faccini M., Caputo P., Lavezzoli A. et al. Hemorrhoid disease. Physiopathology, etiopathology and surgical approach // Minerva Chir. — 2000. — Vol. 55, № 4. — P. 253-259.
13. Herold A. Therapy of hemorrhoidal disease // Chin. — 2006. — Vol. 77, № 8. — P. 737-747.
14. Herold A., Kirsch J.J. Differential surgical therapy in hemorrhoids // Kongressbd. Dtsch. Ges. Chir. Kongr. — 2001. — Vol. 118. — P. 315-318.
15. Lienert M., Ulrich B. Die dopplergefuhter Hammoridalarterien-ligatur Erfahrungsbericht uber 248 Patient // Dtch med Wochenschr. — 2004. — 129. — 947-950.
16. Lyseng-Williamson K.A., Perry C.M. Micronised purified flavonoid fraction: a review of its use in chronic venous insufficiency, venous ulcers and haemorrhoids // Drugs. — 2003. — Vol. 63, № 1. — P. 71-100.
17. Sohn N., Aronoff J.S., Cohen F.S., Weinstein M.A. Transanal hemorroidal dearterilization is an alternativ the operativ hemorroidectomy // Am. J. Surgery. — 2001 Nov. —182(5). — 515-519.
