Газета «Новости медицины и фармации» Гастроэнтерология (313) 2010 (тематический номер)
Вернуться к номеру
Микробиоценоз кишечника и его роль в развитии и поддержании заболеваний желудочно-кишечного тракта
Авторы: М.Д. Ардатская. Учебнонаучный медицинский центр управления делами Президента Российской Федерации, г. Москва, Россия
Версия для печати
Со времени открытия микроорганизмов постоянно возникал вопрос о роли и механизмах воздействия микрофлоры на организм человека. Воззрения на микрофлору менялись в зависимости от уровня ее познания. Можно условно выделить несколько основных этапов в развитии учения о микробиоценозе.
Первый — «эвристический» — это открытие Левенгуком (XVII век) присутствия в организме человека и животных микроорганизмов.
Второй — «накопительный» — включает исследования по обнаружению и идентификации микроорганизмов в различных биотопах. Начинается изучение не только агрессивной, но и защитной роли отдельных видов микроорганизмов в жизни человека и животных (A. Nissle, И.И. Мечников, Л.Г. Перетц, Н.Ф. Гамалея, Г.Н. Габричевский и т.д.). Третий (80–90-е годы ХХ столетия) — этап «детализации», когда широкое использование современных методов культивирования облигатно анаэробных бактерий и использование принципов гнотобиологии дало возможность начать прицельное изучение роли нормальной микрофлоры и ее отдельных представителей в поддержании гомеостаза макроорганизма, а также оценить ее роль в возникновении некоторых патологических состояний, вызванных различными представителями микрофлоры (О.В. Чахава, А.О. Тамм, Б.А. Шендеров и др.).
Четвертый этап (конец 90-х годов ХХ столетия) — «аналитический (И.В. Домарадский, В.Н. Бабин, А.В. Дубинин, О.Н. Минушкин, М.Д. Ардатская и др.), основанный на изучении молекулярных и биохимических механизмов, управляющих связью микробиоты и организма-хозяина, позволил констатировать масштаб той пользы, которую получает человек от симбиоза с микрофлорой, и выяснить возможные причины перехода от «благополучного сосуществования» к взаимной агрессии.
Необходимо отметить, что именно на этом этапе была создана основа для формулирования принципиально нового воззрения на состояние микробиоценоза с позиций клинической медицины. Однако, несмотря на успехи, достигнутые в конце ХХ века, среди большинства практикующих врачей бытует устаревшее представление о «дисбактериозе», что приводит к его гиперболизации и недооценке основной патологии, приведшей к нарушениям микрофлоры.
1. Закономерности расселения микрофлоры в кишечнике
Общая численность микроорганизмов, обитающих в различных биотопах человеческого организма, достигает величины порядка 1015, т.е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма. Отношения в этом сообществе имеют филогенетически древнее происхождение и жизненно важны для обеих частей системы «организм — микробиота».
Значительная часть (более 60 %) микрофлоры заселяет различные отделы желудочно-кишечного тракта (ЖКТ). Примерно 15–16 % микроорганизмов приходится на ротоглотку. Урогенитальный тракт, исключая вагинальный отдел (9 %), заселен довольно слабо (2 %); остальная часть приходится на кожные покровы (12 %).
Как было указано, желудочно-кишечный тракт заселен наиболее обильно. Причем популяционный состав микроорганизмов и численность зависят от его уровня.
В желудке обнаруживают в основном представителей родов Lactobacillus, Stomatococcus и Sarcina. В небольшом количестве встречаются стафилококки, стрептококки, дрожжеподобные грибы и др.
У здоровых людей в двенадцатиперстной кишке микроорганизмы определяются в небольшом количестве — не более 104–105 микробных клеток в 1 мл содержимого, а видовой состав представлен лактобактериями, бифидобактериями, бактероидами, энтерококками и дрожжеподобными грибами (в ряде случаев).
В физиологических условиях содержание бактерий в тонкой кишке колеблется от 104 на 1 мл содержимого в тощей кишке до 107 на 1 мл — в подвздошной. При этом в проксимальных отделах тонкой кишки обнаруживаются преимущественно грамположительные аэробные бактерии, в дистальных — грамотрицательные энтеробактерии и анаэробы (табл. 1).
В любом микробиоценозе, в том числе и кишечном, всегда имеются постоянно обитающие виды бактерий (главная, автохтонная, индигенная, резидентная микрофлора), составляющие 90 % от всех микроорганизмов, а также добавочные (сопутствующая, факультативная микрофлора), на которые приходится около 10 %, и транзиторные (случайные виды, аллохтонная, остаточная микрофлора) — 0,01 %.
Главная микрофлора толстой кишки включает в себя анаэробные бактерии родов Bacteroides, Вifidobacterium, непатогенные штаммы клостридий. Аэробные бактерии (кишечные палочки, лактобациллы, энтерококки и др.) составляют сопутствующую микрофлору. К остаточной микрофлоре относят стафилококки, клостридии, протей, грибы (Н. Нaenel (1970), Н.Н. Лизько (1972), Л.С. Безрукова (1975)). По мнению В.М. Бондаренко, Н.М. Грачева, Т.В. Мацелевич (2003), к главной флоре можно отнести бифидобактерии, лактобактерии, пропионибактерии, эшерихии, пептострептококки и энтерококки, а к факультативной и транзиторной флоре — бактероиды, пептококки, стафилококки, стрептококки, бациллы (аэробные спорообразующие бактерии и анаэробы рода клостридий), фузобактерии, неферментирующие бактерии (псевдомонады, ацинетобактер), дрожжеподобные грибы, представители семейства Enterobacteriaceae, относящиеся к группе условно-патогенных бактерий (рода Klebsiella, Hafnia, Enterobacter, Proteus и др.).
Однако такое деление крайне условно.
В толстой кишке человека в различном количестве присутствуют также бактерии родов Actinomyces, Сitrobacter, Сorynebacterium, Veillonella, Аcidominococcus, Аnaerovibrio, Вutyrivibrio, Acetivibrio, Campylobacter, Disulfomonas, Eubacterium, Roseburia, Ruminococcus, Selenomonas, Spirochetes, Succinomonas, Wolinella. Помимо указанных групп микроорганизмов, можно обнаружить также представителей и других анаэробных бактерий (Gemmiger, Anaerobiospirillum, Metanobrevibacter, Megasphaera, Bilophila), различных представителей непатогенных простейших родов (Chilomastix, Endolimax, Entamoeba, Enteromonas) и более десяти кишечных вирусов (табл. 1).
Анализируя видовой, численный состав и инфраструктуру микробного ценоза макроорганизма, можно кратко сформулировать три основных положения: 1) общее число видов — более 600 (по мнению некоторых авторов — до 1000); 2) к основным по своей патогенетической сущности следует отнести род бифидобактерий и семейство бактероидов (последнее — в связи с трудностью анаэробного культивирования и, следовательно, с высокой стоимостью исследования — во многих лабораториях не определяется);
3) отношение анаэробов к аэробам в норме постоянно — 10 : 1 (или 102–3 : 1), зависимо от биотопа. Облигатных и факультативных анаэробов всегда на порядок больше аэробов как в «анаэробных органах» — толстая кишка, так и на кожных покровах. Это связано с наличием своеобразной зоны в области, непосредственно прилегающей к эпителию, в которой благодаря работе натриевых насосов на плазматических мембранах эпителиоцитов и своеобразию структуры поверхностных гликопротеидов поддерживается отрицательный потенциал. В различных отделах величины его колеблются от –50 до –220 мВ. Кислород и его токсичные метаболиты (супероксид-ион и т.д.) в этой зоне в норме отсутствуют. Этим же объясняется и «этажность» расселения различных видов бактерий: в непосредственном адгезивном контакте с эпителием находятся строгие анаэробы (бифидобактерии, бактероиды), далее располагаются факультативные анаэробы, еше выше — аэробы.
Между колониями микроорганизмов и кишечной стенкой имеется тесная взаимосвязь, что позволяет объединять их в единый микробно-тканевой комплекс, который образуют микроколонии бактерий и продуцируемые ими метаболиты, слизь (муцин), эпителиальные клетки слизистой оболочки и их гликокаликс, а также клетки стромы слизистой оболочки (фибробласты, лейкоциты, лимфоциты, нейроэндокринные клетки, клетки микроциркуляторного русла и др.).
Необходимо помнить о существовании еще одной популяционной части микрофлоры — полостной, которая является более изменчивой и зависит от скорости поступления пищевых субстратов по пищеварительному каналу, в частности пищевых волокон, являющихся питательным субстратом и играющих роль матрицы, на которой фиксируются и образуют колонии кишечные бактерии. Полостная флора доминирует в фекальной микрофлоре, что заставляет с особой осторожностью оценивать изменения в различных микробных популяциях, выявляемых при бактериологическом исследовании (Ю.В. Конев, 2001; Е.И. Ткаченко, А.Н. Суворова, 2007).
2. Функциональное значение микробиоты для организма человека
Физиологические эффекты, оказываемые микробиотой, т.е. всей совокупностью живых микроорганизмов (бактерий, вирусов, простейших и др.), влияющих на организм хозяина, названы ниже. Прежде всего, это трофическая (пищеварительная) функция, представленная симбионтным пищеварением, которое осуществляется ферментами микрофлоры. На нем основано энергообеспечение клеток эпителиальных тканей человека, которое базируется на утилизации в рамках цикла Кребса низкомолекулярных метаболитов (короткоцепочечных жирных кислот (КЖК), в первую очередь уксусной, пропионовой, масляной), получающихся в результате отщепления моносахаридных фрагментов слизи, гликокаликса и продуктов экзогенного происхождения посредством внеклеточных гликозидаз анаэробов-сахаролитиков с последующим брожением этих сахаров.
Локальные и системные функции микробиоты (В.Н. Бабин, О.Н. Минушкин, А.В. Дубинин и др., 1998):
1. Трофические и энергетические функции — тепловое обеспечение организма.
10. Обеспечение цитопротекции.
11. Повышение резистентности эпителиальных клеток к мутагенам (канцерогенам).
12. Ингибирование роста патогенов.
13. Ингибирование адгезии патогенов к эпителию.
14. Перехват и выведение вирусов.
15. Поддержание физико-химических параметров гомеостаза приэпителиальной зоны.
16. Поставка субстратов глюконеогенеза.
17. Поставка субстратов липогенеза.
18. Участие в метаболизме белков.
20. Участие в рециркуляции желчных кислот, стероидов и других макромолекул.
21. Хранилище микробных плазмидных и хромосомных генов.
22. Регуляция газового состава полостей.
22. Синтез и поставка организму витаминов группы В, пантотеновой кислоты и др.
Кроме того, при расщеплении полисахаридов и гликопротеидов внеклеточными гликозидазами микробного происхождения образуются моносахариды (глюкоза, галактоза и т.д.), при окислении которых в окружающую среду выделяется в виде тепла не менее 60 % их свободной энергии.
Другой важный эффект — стимуляция локального иммунитета в основном за счет продукции секреторного IgА.
Низкомолекулярные метаболиты сахаролитической микрофлоры, в первую очередь КЖК, лактат и другие, обладают заметным бактериостатическим эффектом. Они способны ингибировать рост сальмонелл, дизентерийных шигелл, многих грибов. В то же время бактериостатический эффект не распространяется на резидентную микрофлору. Однако низкомолекулярные метаболиты, блокируя своими адгезинами рецепторы эпителиоцитов, препятствуют адгезии патогенной микрофлоры к эпителию и обладают способностью индуцировать хемотаксис бактерий. Этот эффект, с одной стороны, дает возможность нормальной микрофлоре, не обладающей локомоторным аппаратом (например, бактероидам), но ассоциированной с подвижными видами, заселять свои экологические ниши. С другой стороны, низкомолекулярные метаболиты и некоторые короткие пептиды играют роль репеллентов по отношению к ряду болезнетворных бактерий.
Многие резидентные бактерии имеют специализированные лигандные структуры, обеспечивающие адгезию, — адгезины. Бактериальные колонии и ассоциации также укрепляются за счет ионных, полярных и гидрофобных взаимодействий в гликопротеидном слое гликокаликса и оказываются резидентами, проявляя естественный антагонизм чужеродным агентам. Это обеспечивается путем контактных взаимодействий, представленных обычной адгезией бактериальных клеток к эпителию, где играют роль как неспецифические (физико-химические) факторы, так и специфические лиганд-рецепторные взаимодействия.
Обсуждается вопрос о ключевом участии микрофлоры в обеспечении противовирусной защиты хозяина. Благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора приобретает способность перехвата и выведения вирусов, обладающих соответствующими лигандами.
Следует также подчеркнуть, что резидентные виды микрофлоры помогают эпителию поддерживать необходимые значения физико-химических параметров гомеостаза: редокс-потенциал, рН, реологические характеристики в контактной зоне.
По результатам экспериментальных данных, опубликованных в зарубежной литературе, активно обсуждается участие микрофлоры в обеспечении и контроле моторной активности кишечника посредством продукции монокарбоновых (короткоцепочечных) жирных кислот.
Системные функции микробиоты осуществляются путем реализации дистанционных и внутриклеточных взаимодействий. Дистанционные взаимодействия поддерживаются за счет обмена метаболитами, в основном низкомолекулярными и сигнальными молекулами микробиотного происхождения: монокарбоновыми и дикарбоновыми кислотами и их солями, циклическими нуклеотидами, оксикислотами, аминокислотами, аминами и др. Например, g-аминомасляная кислота — антистрессорный медиатор, продуцируется в больших количествах бактериальной микрофлорой, образует единый пул с эндогенной фракцией ГАМК. Изменение уровня ГАМК у больных с синдромом раздраженного кишечника (СРК), возможно, объясняет наличие низких порогов возбуждения, склонность к повышенной возбудимости и тревожности, пониженный порог болевой чувствительности у данной группы пациентов по сравнению со здоровыми субъектами.
Микробиота является своего рода хранилищем микробных плазмидных и хромосомных генов, обмениваясь генетическим материалом с клетками хозяина. Реализуются внутриклеточные взаимодействия путем эндоцитоза, фагоцитоза и др. При внутриклеточных взаимодействиях достигается эффект обмена клеточным материалом. В результате этого микробиота приобретает рецепторы и другие антигены, присущие хозяину и делающие ее «своей» для иммунной системы макроорганизма. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены.
Системная стимуляция иммунитета — одна из важнейших функций микробиоты, при отсутствии которой происходит инволюция иммунокомпетентных органов. Другая важнейшая функция — участие в поддержании ионного гомеостаза организма, поскольку всасывание эпителием монокарбоновых кислот тесно сопряжено с транспортом натрия.
Еще один эффект обусловлен продуцированием вторичных метаболитов, т.е. веществ стероидной природы — конъюгат желчных кислот с образованием эстрогеноподобных субстанций, оказывающих влияние на дифференцировку и пролиферацию эпителиальных и некоторых других тканей посредством влияния на экспрессию генов или изменения характера их действия.
Микробиота выполняет витаминосинтезирующую функцию (витамины группы В, К), является поставщиком коферментов (токоферолов, b-аланина, необходимого для синтеза пантотеновой кислоты, и т.д.).
Участие в регуляции газового состава кишечника и других полостей организма хозяина осуществляется функционированием метанообразующих бактерий, использующих водород для своего метаболизма. Известно, что водород создает восстановительную среду в просвете кишечника, а чрезмерное понижение окислительно-восстановительного потенциала приводит к блокированию ферредоксинсодержащих терминальных ферментов редокс-цепей анаэробов. Газы диффундируют в кровоток, образуя нестабильные комплексы с гемоглобином, впоследствии высвобождаются в легких, влияя на регуляцию кислородного обмена.
Микробиота также принимает участие в детоксикации экзогенных и эндогенных субстратов и метаболитов (аминов, меркаптанов, фенолов, мутагенных стероидов и др.), с одной стороны, представляя собой массивный сорбент, выводя из организма токсические продукты с кишечным содержимым, с другой стороны, утилизируя их в реакциях метаболизма для своих нужд.
Итак, взаимоотношения «хозяин — микробиота» носят сложный характер, реализующийся на метаболическом, регуляторном, внутриклеточном и генетическом уровнях.
Участие микробиоты в формировании целого ряда функций (или в их поддержании) доказано на моделях безмикробных животных. Экспериментальные данные свидетельствуют, что у безмикробных животных истончена в кишечнике собственная пластинка (Lamina propria) за счет уменьшения числа клеточных элементов и сниженной гидратации тканей. Это приводит к уменьшению удельной и общей площади поверхности слизистой оболочки кишечной ткани, увеличению секреции желудочного сока, экскреции ионов натрия и общего количества белка в поджелудочной железе. Заметно снижена митотическая активность энтероцитов и скорость их миграции по микроворсинкам. У безмикробных животных на 25 % по сравнению с физиологической нормой снижен основной обмен, нарушены перистальтика кишечника, всасывание воды, усвоение насыщенных жирных кислот, продукция витаминов групп В, К и др., печеночно-кишечная циркуляция желчных кислот, холестерина, желчных пигментов. У гнотобиотических животных отмечена ареактивность гладкой мускулатуры сосудов и кишечника к воздействию катехоламинов, имеет место мышечная гипотония. Вазодилатация обусловливает снижение ударного объема сердца и циркулирующей крови. Снижение гемопоэтической функции проявляется в снижении числа лейкоцитов и лимфоцитов в крови. У подобных животных изменены функции гипофиза, надпочечников и поджелудочной железы, отмечается гипоплазия лимфоидной ткани, нарушены организация и созревание ретикулоэндотелиальной системы, понижены уровни комплемента, лизоцима, снижена фагоцитарная активность лейкоцитов.
Таким образом, микрофлора выполняет ряд важнейших функций как на местном, так и на системном уровнях и не может не участвовать в развитии и поддержании заболеваний ЖКТ.
Кроме того, можно отметить, что основная часть функций осуществляется участием в различных биологических процессах макроорганизма ее метаболитов, в частности короткоцепочечных жирных кислот, которые обеспечивают многочисленные физиологические эффекты (табл. 2).

Нормальный состав кишечной микрофлоры может быть только при нормальном физиологическом состоянии организма.
К наиболее значимым причинам, приводящим к нарушению микробиоценоза, можно отнести:
Приведем примеры изменения микробиоценоза кишечника при различной патологии ЖКТ.
Так, при изучении КЖК в кале при синдроме раздраженного кишечника с преобладанием запора (СРК-З) и диареи (СРК-Д) нами были установлены противоположные изменения в родовом составе кишечной микрофлоры. При СРК-З происходит активизация родов аэробных бактерий, в частности обладающих протеолитической активностью (так как кишечные палочки, фекальные стрептококки рассматриваются как сильнейшие протеолитики); при СРК-Д наблюдается повышение активности анаэробных микроорганизмов родов бактероидов, пропионибактерий, клостридий и т.д. Это связано с переключением метаболизма колоноцитов с цикла Кребса на активацию гексозомонофосфатного шунтирования, что при СРК-З приводит к увеличению продукции активных форм кислорода и «аэробизации» среды, способствующих активизации аэробных микроорганизмов; при СРК-Д — к активации анаэробного типа гликолиза, приводящего к угнетению жизнедеятельности облигатных анаэробов за счет блокирования терминальных ферредоксинсодержащих ферментов и активизации условно-патогенных штаммов анаэробов, в частности бактероидов.
При неспецифическом язвенном колите также отмечается усиление активности анаэробных микроорганизмов, однако при этом превалируют клостридии, фузобактерии, эубактерии, причем штаммы, обладающие гемолитической активностью. Однако надо отметить, что изменение качественного состава КЖК, характеризующего родовой состав микрофлоры кишечника, находится в четкой зависимости от локализации воспаления, активности патологического процесса и степени тяжести заболевания. Объясняется это тем, что в различных отделах толстой кишки доминируют различные популяции микроорганизмов, утилизация и абсорбция данных кислот в различных отделах толстой кишки протекает по-разному, кроме того, с повышением активности процесса и, соответственно, кровоточивости происходит нарастание активности гемолитической флоры.
У больных с повышенным риском камнеобразования в желчном пузыре и при желчнокаменной болезни по результатам изучения КЖК в кале нами было выявлено изменение качественного состава микрофлоры, выражающееся в повышении активности тех родов микроорганизмов, которые задействованы в 7-альфа-дегидроксилировании желчных кислот, а именно аэробных микроорганизмов (в частности, E.сoli и т.д.) и анаэробов: некоторых штаммов родов бактероидов, клостридий, эубактерий.
Как видно из представленных примеров, нарушение микробиоценоза кишечника является следствием органической или функциональной патологии органов ЖКТ.
Но и заболевания других систем макроорганизма могут приводить к опосредованному нарушению качественного и количественного состава микрофлоры кишечника. Например, в наших работах по изучению короткоцепочечных жирных кислот, являющихся метаболитами индигенной микрофлоры, у больных с бронхолегочной патологией мы отметили выраженные изменения со стороны микробиоценоза кишечника, которые связали с изменением динамики водорода. Неполное высвобождение Н2 в легких, обусловленное наличием патологии, приводит к возврату и накоплению его в полости кишечника. Это, в свою очередь, вызывает смещение окислительно-восстановительного потенциала внутрипросветной среды в сторону резкоотрицательных значений, при которых блокируются ферредоксинсодержащие ферменты, обеспечивающие жизнедеятельность облигатных анаэробов.
С другой стороны, микрофлора не может не участвовать в поддержании функциональных расстройств или патологического процесса.
Например, в экспериментах in vitro Т. Yajima (1985) установил влияние аппликации пропионовой, масляной, валериановой кислот на возникновение сокращений изолированных сегментов толстой кишки. Наши результаты изучения содержания КЖК в кале у больных с различными вариантами СРК подтверждают данную концепцию, а именно: увеличение или уменьшение концентраций кислот, продуцируемых микрофлорой, четко соотносится с типом моторно-эвакуторных расстройств кишечника при данной патологии.
Приведем другой пример. В последнее время большое значение уделяется роли индигенной микрофлоры в качестве одной из причин поддержания патологического процесса при неспецифическом язвенном колите (НЯК). Объясняется это тем, что в результате нарушения муцинообразования и т.п. просветные микробные агенты и/или продукты их жизнедеятельности получают доступ к слизистой оболочке через нарушенный слизистый барьер, где они активируют кишечные воспалительные клетки, секретирующие цитокины, метаболиты арахидоновой кислоты, протеазы, окись азота и токсические кислородные радикалы, закрепляя воспалительный ответ. При этом нарушенное регулирование местного и системного звеньев иммунной системы приводит к активации самоподдерживающегося воспалительного каскада. Этот каскад может вовлекать некоторые или все провоспалительные и противовоспалительные медиаторы. Увеличение всасывания бактериальных агентов, нарушение симбионтных отношений между микрофлорой и организмом оказывают стимулирующий эффект на иммунную систему, поддерживают и усиливают воспаление.
Как было указано выше, микрофлора продуцирует огромное количество метаболитов, в том числе эндогенных нейротрансмиттеров (аммиак, меркаптаны, коротко- и среднецепочечные кислоты и т.д.), не только полезных, но и потенциально опасных для макроорганизма. Так, при заболеваниях печени, в частности при развитии портосистемного шунтирования (цирроз печени), они не метаболизируются гепатоцитами в связи с их функциональной несостоятельностью и, проникая в центральный кровоток, оказывают токсическое влияние на астроглию, вызывая клинику печеночной энцефалопатии.
Нельзя не учитывать и потенциальную опасность самой микрофлоры (а не только ее метаболитов), когда происходит транслокация микроорганизмов в нерезидентные биотопы и стерильные полости. В частности, проникновение кишечной микрофлоры в брюшную полость приводит к ее инфицированности и развитию спонтанного бактериального перитонита. Причем смертность больных с циррозом печени классов В, С по Чайльд- Пью в этом случае достигает 50 %, а у 69 % больных наблюдается рецидив в течение года.
Например, в настоящее время доказана значимость энтерогенной транслокации микроорганизмов и их участия в развитии острого калькулезного холецистита как наиболее частого осложнения желчнокаменной болезни.
Можно было бы продолжить перечень иллюстраций, однако даже из этих примеров видно, какая тесная взаимосвязь существует между макроорганизмом и населяющей его микрофлорой.
Таким образом, как только в организме происходят патологические изменения, меняются состав и свойства кишечной микрофлоры.
Согласно различным этапам учения о микробиоценозе кишечника было принято несколько определений «дисбактериоза». Необходимо помнить о том, что дисбиоз — понятие более широкое, включающее в себя наличие изменений со стороны не только бактериального пула микроорганизмов, но и вирусов, простейших, грибов. Кроме того, понятие дисбиоза применяется для обозначения нарушений состава микробиоты в разных биотопах организма человека.
Впервые термин «дисбактериоз» был введен в 1916 году A. Nissle, который под дисбактериозом первоначально понимал изменения, касающиеся только кишечной палочки.
Л.Г. Перетц (1962) определял дисбактериоз как патологическое состояние кишечной микрофлоры, которое характеризуется уменьшением общего количества типичных кишечных палочек, понижением их антагонистической и ферментативной активности, появлением лактозонегативных эшерихий и кишечных палочек, дающих гемолиз на кровяном агаре, увеличением количества гнилостных, гноеродных, спороносных и других видов микробов.
В определении А.М. Уголева (1972) дисбактериоз характеризовался как изменение качественного и количественного состава бактериальной флоры кишечника, возникающее под влиянием различных факторов: характера питания, изменения перистальтики кишечника, возраста, воспалительных процессов, лечения антибактериальными препаратами, изменения физико-химических условий жизнедеятельности бактерий (физический, психический стресс, тяжелые заболевания, оперативные вмешательства, экстремальные условия, которым подвергается человек при длительном пребывании в нехарактерных для него зонах обитания (спелеологические, высокогорные, подводные, арктические и антарктические зоны); различные загрязнения окружающей среды; иммунодефицитные состояния; нарушения пищеварения с попаданием значительного количества питательных веществ в среду микробного обитания; голодание и т.д.).
Главными особенностями, позволяющими отнести это биологическое явление к дисбактериозу, по мнению А.М. Уголева, являются его стойкий характер и нарушенные механизмы аутостабилизации.
До настоящего времени широко использовалось и другое определение дисбактериоза — состояния, характеризующегося нарушением подвижного равновесия кишечной микрофлоры и возникновением качественных и количественных изменений в микробном пейзаже кишечника (Красноголовец В.Н., 1989).
Некоторыми авторами (О.Н. Минушкин, М.Д. Ардатская, В.Н. Бабин, А.В. Дубинин, 2000) дисбактериоз (не только кишечника, но и других нестерильных полостей и трактов) рассматривался как изменение микробиоценозов различных биотопов человеческого организма, выражающееся в нарушении инфраструктурного отношения «анаэробы/аэробы», популяционных изменениях численности и состава микробных видов биотопов, в том числе появлении нерезидентных для данного биотопа видов (контаминация, транслокация), изменении их метаболической активности, и являющееся следствием и/или одним из патогенетических механизмов различных патологических состояний.
В отраслевом стандарте (Приказ МЗ РФ № 231 от 2003 г.) «Протокол ведения больных. Дисбактериоз кишечника» под дисбактериозом кишечника понимают клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений и с возможным развитием желудочно-кишечных расстройств.
Термин «дисбактериоз» присутствует только в отечественной литературе. Анализ литературных источников, проведенный В.В. Василенко, приводит в выводу, что «он присутствует в заголовках 257 научных работ, опубликованных с 1966 по 2000 годы, 250 из них — в русскоязычных медицинских журналах, еще 4 принадлежат авторам из стран прежнего социалистического лагеря» .
В зарубежной литературе применяется термин bacterial overgrowth syndrome — синдром избыточного бактериального роста, включающий в себя изменение количественного и видового состава микроорганизмов, характерных для биотопа; в ряде случаев включает феномены контаминации и транслокации.
Основное различие понятия «синдром избыточного бактериального роста» и «дисбактериоз кишечника» заключается не столько в терминологических нюансах, сколько в том содержании, которое в него вкладывается: при синдроме избыточного бактериального роста речь идет не об изменении микробного пейзажа толстой кишки, а об изменении состава микрофлоры тонкой кишки.
К причинам синдрома избыточного бактериального роста можно отнести: снижение желудочной секреции, нарушение функции или резекцию илеоцекального клапана, нарушение кишечного переваривания и всасывания, нарушение иммунитета, непроходимость кишечника, последствия оперативных вмешательств (синдром приводящей петли, энтеро-энтероанастомозы, структурные нарушения стенки кишечника (А.И. Парфенов, 1999).
Однако необходимо отметить, что практически всегда «дисбактериоз» и «синдром избыточного бактериального роста» не первичны, а являются следствием влияния различных факторов, в том числе имеющейся функциональной или органической патологии различных систем макроорганизма, но при этом нарушения микробиоценоза могут способствовать ее утяжелению и в ряде случаев участвовать в формировании осложнений.
Кроме того, в практическом отношении следует подчеркнуть, что такой самостоятельной нозологической формы, как дисбактериоз, в Международной классификации болезней 10-го пересмотра нет.
Преходящие нарушения микробиоценоза под влиянием различных факторов рассматриваются с позиции дисбактериальных реакций и требуют в большей степени проведения профилактических мероприятий.
3. Классификации «дисбактериоза»
Накопленные десятилетиями бактериологические данные позволили создать несколько классификаций дисбактериоза кишечника, основанных на следующих принципах:
Но возникает вопрос: можно ли верифицировать по 15–25 показателям какие-либо изменения микрофлоры, состоящей из огромного числа видов, находящихся в иммобилизационном состоянии, тем более если речь идет не о количественной доказательности, а в основном имеет место описательный характер изложения («более», «менее»). Как уже упоминалось, микрофлора хозяина представлена более чем 600 видами микроорганизмов. Наиболее доступными методами (о них будет сказано ниже) выявляется несравненно меньшее их число. Положение осложняется еще и тем, что используемый методический подход в лучшем случае является полуколичественным. Отсюда следует, что в реальных условиях очень сложно классифицировать нарушения микробиоценоза.
В последнее время предприняты попытки создания принципиально новой классификации, отражающей пусковые молекулярно-биохимические механизмы нарушений метаболизма как всей популяции микроорганизмов, так и ее отдельных представителей (С.Д. Митрохин, 1997), однако и в ней нет
количественной доказательности. Поэтому взаимосвязанные проблемы диагностики и классификации «дисбактериоза» остаются крайне актуальными.
4. Современные методы диагностики нарушений микрофлоры кишечника
Существуют общие и специфические методы оценки микробной экологии и колонизационной резистентности: гистохимические, морфологические, молекулярно-генетические методы исследования микроорганизмов, комбинированные методы исследования биоматериала, нагрузочные пробы и др. Однако эти методы, находящиеся в арсенале крупных НИИ микробиологии, не могут быть полностью использованы в общей практике.
Наиболее обсуждаемые и применяемые методы диагностики состояния микробиоценоза (дисбактериоза) — рутинное бактериологическое исследование кала, ПЦР-диагностика, хромато-масс-спектрометрия и исследование микробных метаболитов.
В результате многолетнего изучения кишечной микрофлоры Р.В. Эпштейн-Литвак и Ф.Л. Вильшанская (1970) разработали методы лабораторной диагностики дисбактериоза. В зависимости от оснащения лаборатории количество определяемых показателей колеблется от 14 до 25. Частота выделения и среднее количество основных представителей кишечной микрофлоры в 1 грамме кала практически здоровых лиц представлены в табл. 3.
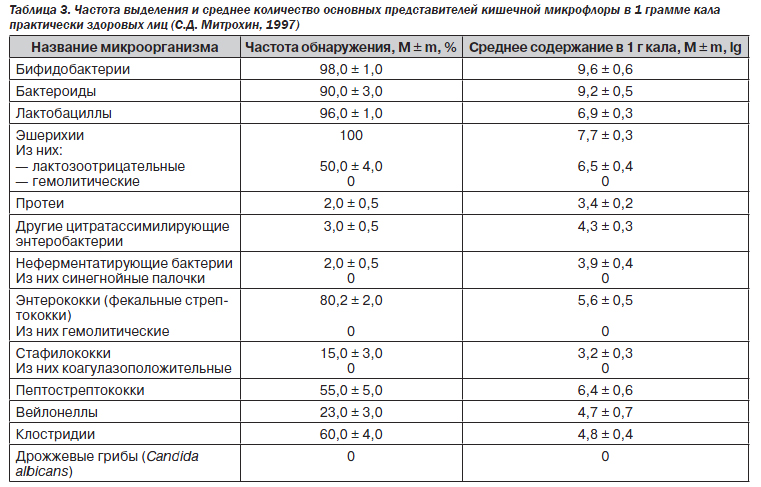
Основным достоинством метода является точная верификация патогенных бактерий, семейства кишечных бактерий.
Однако результаты исследования зависят от соблюдения сроков транспортировки и качества используемых для посева сред.
Необходимо также помнить о возможности получения ложноположительных и ложноотрицательных результатов, объясняющихся неоднородностью выделения микроорганизмов из разных отделов испражнений, невозможностью воссоздания естественных условий обитания микроорганизмов при проведении исследования, трудностью культивирования анаэробных микроорганизмов и т.д.
Все это требует проведения многократных и длительных исследований для выявления повторяющихся, устойчивых изменений состава микроорганизмов кишечника. Кроме того, преимущественно определяется внутрипросветная (полостная) и наряду с ней транзитная (пассажная) флора, которые, как уже указывалось выше, доминируют в фекальной флоре. При этом основная ее часть, так называемая пристеночная флора, не оценивается.
Наиболее информативным является микробиологическое исследование микроорганизмов с применением анаэробного культивирования в биоптатах, полученных из различных отделов кишечника. Однако в силу технических сложностей на практике данный метод не может быть использован.
В последние годы широкое распространение получил способ определения видов микроорганизмов с помощью полимеразной цепной реакции (ПЦР-диагностика). В основе метода ПЦР лежит комплементарное достраивание участка геномной ДНК или РНК возбудителя, осуществляемое in vitro с помощью фермента термостабильной ДНК-полимеразы. С помощью ПЦР-диагностики определяются некоторые представители микрофлоры с внутриклеточной или мембранной локализацией. Метод отличается быстротой выполнения. Однако информативность исследования высока только в отношении ограниченного круга условно-патогенных и патогенных микроорганизмов и вирусов. Данный метод применяется в основном для верификации инфекционной патологии.
При диагностике родового состава сообщества микроорганизмов, получаемых методом хромато-масс-спектрометрии, внедренным в клиническую практику в конце 80-х годов ХХ столетия, определяется 35–40 показателей. К преимуществам метода можно отнести специфичность диагностики анаэробных инфекций, особенно рода клостридиум (метод позволяет оценить живые и мертвые микроорганизмы, возможно определение малых концентраций клеток микроорганизмов на преобладающем фоне биологической жидкости), быстроту получения результата (3 часа). Его универсальность доказывается сопоставлением результатов с методом ДНК-ДНК гибридизации и амплификации гена. К недостаткам можно отнести требование многократных исследований для анализа широкого диапазона микроорганизмов, особенности компьютерной обработки и др., большую стоимость исследования, зависящую от технического оборудования, и т.п.
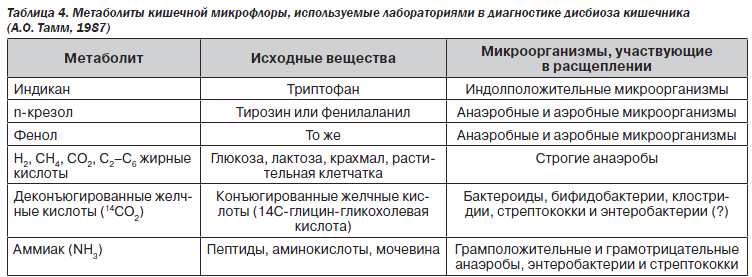
Существуют методы диагностики дисбактериоза кишечника по метаболитам (индикан, паракрезол, фенол, 14СО2, аммиак и др.) микрофлоры (табл. 4),
способные дать быстрый результат. Однако методы различаются специфичностью (от 50 до 90 %) и чувствительностью (от 25 до 100 %) исследования в отношении анаэробно-аэробных популяций микроорганизмов.
К способам диагностики синдрома избыточного бактериального роста, кроме перечисленных, можно отнести исследование выделяемого водорода (дыхательный тест) и тесты с меченым 14СО2, используемые для определения анаэробных микроорганизмов, участвующих в энтерогепатической циркуляции желчных кислот. Однако данные методы имеют также различную чувствительность и специфичность в отношении популяций микроорганизмов (от 25 до 70 %), техническую сложность и высокую стоимость, что ограничило их внедрение в широкую практику.
С 70-х годов прошлого столетия начали разрабатываться и в 90-е годы были внедрены в клиническую практику хроматографические (газожидкостная, ионнообменная, высокоэффективная жидкостная хроматография) методы определения метаболитов индигенной микрофлоры. Они отличались трудоемкостью и несовершенством методики пробоподготовки, приводящей к потере 15–20 % метаболитов, стоимостью оборудования и др.
Однако на основании полученных данных был создан метаболический паспорт при эубиозе кишечника (табл. 5).
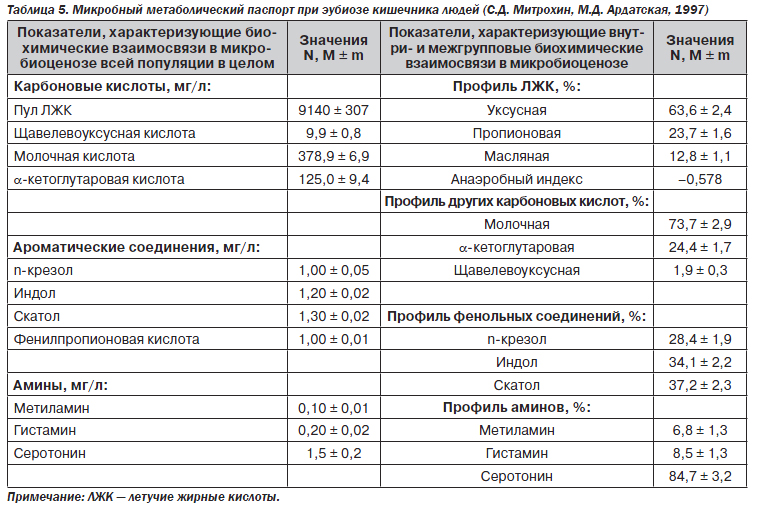
Были предприняты попытки по соотнесению выбранных параметров с клинической картиной заболеваний кишечника. Это стало началом нового качественного этапа в понимании взаимоотношений макроорганизма и микрофлоры при патологических состояниях.
В настоящее время нами разработан и внедрен в практику новый способ диагностики состояния микробиоценоза различных биотопов, в том числе кишечника (регистрационное удостоверение № ФС-2006/030-у от 17.03.2006 г. МЗ и соцразвития РФ), основанный на определении короткоцепочечных (монокарбоновых) жирных кислот методом газожидкостного хроматографического анализа1.
Данный способ позволяет быстро и точно оценить состояние индигенной микрофлоры, обладает большей чувствительностью и специфичностью исследования, воспроизводимостью результатов по сравнению с рутинным бактериологическим методом; обеспечивает высокую точность в оценке основных аэробных и, главное, анаэробных популяций микроорганизмов с указанием их родовой принадлежности (табл. 6), не требуя воспроизведения нативных условий обитания; предполагает сбор анализов в отсроченное (удобное для пациента) время, а также неограниченное время доставки в лабораторию, не оказывая при этом влияния на результаты исследования.

Кроме того, отличительной особенностью разработанного метода является то, что составлена клиническая база данных содержания КЖК (учитывая их физиологические эффекты) во многих биологических субстратах при различной патологии ЖКТ. Разработана адекватная система прогнозирования и мониторирования клинического течения, степени тяжести, стадии патологического процесса и развития осложнений при патологии ЖКТ, отработаны эффективные схемы лечения с учетом индивидуального метаболитного статуса пациента.
Показания к использованию и возможности метода широки:
5. Диагностика портальной гипертензии и портосистемного шунтирования (по исследованию КЖК в сыворотке крови).
6. Диагностика стадии и дифференциальная диагностика печеночной энцефалопатии (по исследованию КЖК в сыворотке крови).
7. Диагностика состояния энтерогепатической циркуляции желчных кислот и холестерина (по исследованию КЖК в кале и сыворотке крови).
8. Диагностика внешнесекреторной недостаточности поджелудочной железы у больных хроническим панкреатитом.
9. Диагностика спонтанного бактериального асцит-перитонита при циррозе печени (по исследованию КЖК в асцитической жидкости).
10. Выбор индивидуального лечения пациентов с вышеуказанными заболеваниями ЖКТ и их осложнениями и оценка его эффективности.
Противопоказаний для применения технологии нет.
Установлено место использования метода в сруктуре диагностических и лечебных мероприятий.
5. Лечебная коррекция и профилактика нарушений микробиоценоза кишечника
Переходя к вопросам лечения, необходимо остановиться на том, что на разных этапах развития учения о микробиоценозе претерпевали изменения и принципы коррекции микробиологических сдвигов — от широкого применения антибактериальных средств до полной замены их бактериальными препаратами и фагами.
Причем если первый тип лечения до настоящего времени широко применяется (что, по мнению многих авторов, глубоко ошибочно, так как приводит еще к большему дисбалансу микроорганизмов, за исключением случаев применения антибактериальных средств при верификации инфекционных агентов), то «увлечение» фагами прошло сравнительно быстро, когда выяснилось, что они несут «островки патогенности» и приводят к появлению у представителей индигенной микрофлоры свойств патогенности и вирулентности за счет обмена генетическим материалом.
По поводу применения препаратов пробиотиков одно время существовало мнение, что бактериальные препараты малоэффективны в связи с быстрой элиминацией вводимых в агрессивную среду штаммов. Однако с усовершенствованием биотехнологических процессов создания пробиотиков появились препараты, обладающие высокой клинической эффективностью. Кроме того, установлены показания к их применению и уточнено место пробиотиков в схеме лечебной коррекции микроэкологических нарушений.
Как указывалось выше, нарушения микробиоценоза, как правило, являются следствием функциональной или органической патологии ЖКТ.
Таким образом, современные принципы лечебной коррекции дисбиотических сдвигов и восстановления эубиоза включают широкий арсенал мероприятий.
Во-первых, это патогенетическое лечение основной патологии (при синдроме раздраженного кишечника это в первую очередь мероприятия, направленные на коррекцию моторно-эвакуаторной функции кишечника (например, с использованием миотропных спазмолитиков, блокаторов Na/Са-каналов — дюспаталина и т.п.); при воспалительных заболеваниях кишечника, в частности НЯК, — на купирование воспаления и др. (с использованием препаратов 5-АСК или глюкокортикоидных гормонов: салофалька, будесонида, гидрокортизона и т.д.), при хроническом панкреатите с внешнесекреторной недостаточностью поджелудочной железы обязательным является проведение ферментозаместительной терапии (креон и т.д.), при патологии билиарного тракта, сопровождающейся билиарной недостаточностью, необходимо использование препаратов, содержащих желчные кислоты и пр.).
В ряде случаев правильно назначенное лечение основного заболевания приводит к нормализации кишечного микробиоценоза или способствует его восстановлению. Например, при купировании моторно-эвакуаторных расстройств кишечника происходит восстановление окислительно-восстановительного потенциала внутриполостной среды, что, в свою очередь, способствует повышению активности и численности облигатных микроорганизмов и приводит к нормализации баланса аэробных и анаэробных популяций микроорганизмов.
Однако при необходимости проводят селективную деконтаминацию патогенной и условно-патогенной микрофлоры с помощью невсасывающихся антибактериальных средств (альфа нормикс (рифаксимин)) или кишечных антисептиков широкого спектра действия (интетрикс, энтерофурил и т.д.), препаратов-пробиотиков, содержащих культуру бактерий (средства из апатогенных представителей рода Bacillus — бактисубтил, споробактерин жидкий, бактиспорин сухой, биоспорин сухой), лиофилизированных дрожжей Saccharomyces boulardii (энтерол), препаратов, содержащих культуральную жидкость (активные метаболиты B.subtilis — бактистатин), обладающих антагонистической активностью и др., энтеросорбентов (смекта, полифепан, карболен и т.п.).
Кроме того, в ряде случаев используют комплексные иммунные препараты, рекомбинантные пробиотики (субалин, бифилиз, вигел) для усиления местного и системного иммунитета.
В дальнейшем (или параллельно) целесообразно проводить восстановление аутохтонной микрофлоры с использованием различных средств коррекции нарушений микробиоценоза.
Их включение в программы терапии различных заболеваний преследует следующие основные цели:
1. Улучшение клинического течения основного заболевания — снижение выраженности и длительности существования клинических симптомов, улучшение ближайших и отдаленных результатов лечения, профилактика осложнений, снижение частоты рецидивирования хронических заболеваний.
Средств коррекции нарушений микрофлоры кишечника достаточно много, постоянно появляются их новые разновидности и подвиды.
В современной отечественной и зарубежной литературе общеупотребимыми являются следующие определения препаратов из этой группы: эубиотики и пробиотики — содержат живые микроорганизмы, симбиотики — содержат комбинацию из нескольких видов живых микроорганизмов, пребиотики — содержат стимуляторы роста облигатных микроорганизмов, синбиотики — содержат живые микроорганизмы и пребиотики, пробиотические комплексы, представляющие собой рациональную комбинацию из перечисленных выше компонентов и средств из других групп (сорбентов, витаминов, микроэлементов).
Необходимо отметить, что термин «эубиотики» используется главным образом у нас в стране. Термин «пробиотики» является общепризнанным во всем мире.
Существует множество определений пробиотиков, однако большинство врачей России придерживаются определения отечественных авторов Б.А. Шендерова и М.А. Манвеловой (1997), которое предполагает, что одним из необходимых условий для отнесения препаратов к этой группе является их доказанное благотворное воздействие на организм человека в целом.
Таким образом, пробиотики в более широком определении — это живые микроорганизмы и вещества микробного и иного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию его микроэкологического статуса.
Однако в основном термин «пробиотики» характеризует препараты, состоящие из микроорганизмов и веществ микробного происхождения (В.М. Бондаренко и др., 2003).
Эффекты воздействия пробиотиков на организм человека можно условно разделить на три большие группы:
1. Эффекты общего характера:
2. Гуморальные эффекты:
3. Клеточные эффекты:
Можно выделить несколько групп микроорганизмов, которые используются в лечебных препаратах — пробиотиках и пищевых (пробиотических) продуктах: бифидобактерии (Bifidobacterium bifidum, B.infantis, B.longum, B.breve, B.adolescentis, B.lactis, B.animalis, B.thermophilum), лактобациллы (Lactobacillus acidophilus, L.plantarum, L.casei spp. ramnosus, L.brevis, L.delbrueckii spp. bulgaricus, L.helveticus, L.fermentum, L.reuteri, L.cellobiosus, L.curvatus), лактококки (Lactococcus spp. cremonis, L.lactis spp. lactis), кишечная палочка (Escherichia coli), энтерококки (Enterococcus faecium, E.faecalis), стрептококки (Streptococcus salivarius spp. thermophilus, S.cremoris, S.lactis, S.diacetylactis, S.intermedius), пропионибактерии (Propionibacterium acnes), бациллы (Bacillus subtilis, B.cereus, B.licheniformis), грибы-сахаромицеты (Saccharomyces boulardii, S.cerevisiae).
Пробиотики могут содержать как монокультуру, так и комбинацию из нескольких видов микроорганизмов (симбиотики).
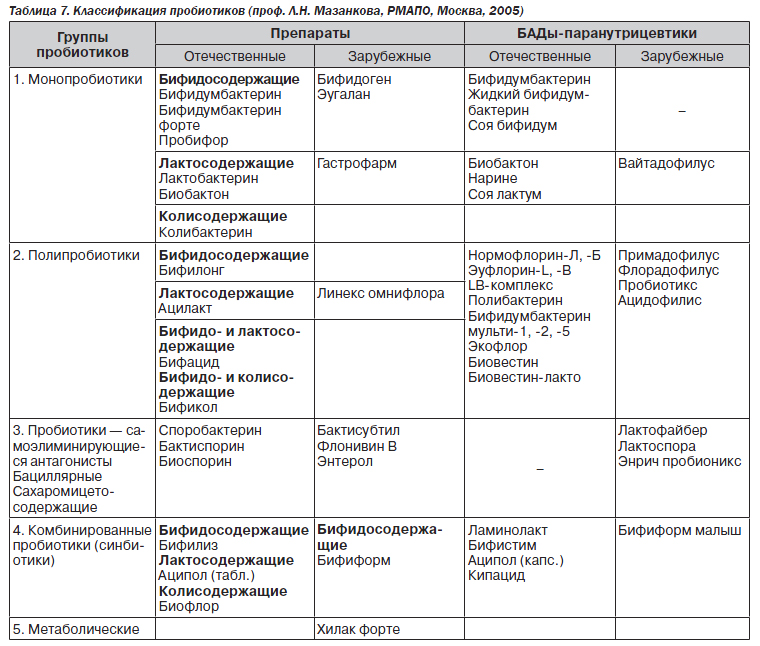
Выделяют 4 поколения пробиотиков. К 1-му поколению относят монокомпонентные препараты (колибактерин, бифидумбактерин, лактобактерин), содержащие 1 штамм бактерий.
Препараты 2-го поколения (бактисубтил, биоспорин, споробактерин и др.) основаны на использовании неспецифических для человека микроорганизмов и являются самоэлиминирующимися антагонистами.
Препараты 3-го поколения включают поликомпонентные пробиотики, содержащие несколько симбиотических штаммов бактерий одного вида (ацилакт, аципол и др.) или разных видов (линекс, бифиформ) с взаимоусиливающим действием. От препаратов 1-го поколения они отличаются более сбалансированным составом.
К 4-му поколению относят иммобилизованные на сорбенте бифидосодержащие препараты (бифидумбактерин форте, пробифор). Сорбированные бифидобактерии эффективно колонизируют слизистую оболочку кишечника, оказывая более выраженное протективное действие, чем несорбированные аналоги.
Классификация пробиотиков и представители разных групп препаратов представлены в табл. 7.
Долговременное применение пробиотиков и оценка их эффективности и безопасности позволили выработать строгие требования, которым должны соответствовать эти средства, а именно:
Принципиальные требования также предъявляются и к штаммам бактерий, на основе которых создаются пробиотики. Они должны:
В настоящее время в связи с более сбалансированным действием преимущество следует отдавать комбинированным пробиотикам 3-го поколения (например, линекс и т.п.).
Пребиотики (как указывалось выше) — это препараты или биологические активные добавки немикробного происхождения, неперевариваемые в кишечнике, способные оказывать позитивный эффект на организм через стимуляцию роста и/или метаболической активности нормальной микрофлоры кишечника.
Типичными представителями пребиотиков являются соединения, относящиеся к классу низкомолекулярных углеводов, — дисахариды, олигосахариды, которые широко распространены в природе.
К пребиотикам в чистом виде предъявляются достаточно строгие требования: они не должны подвергаться гидролизу пищеварительными ферментами человека, не должны абсорбироваться в верхних отделах пищеварительного тракта, должны селективно стимулировать один вид или определенную группу микроорганизмов, резидентных для толстой кишки.
Однако многочисленные исследования показали, что пребиотическим эффектом, т.е. способностью стимулировать рост и активность симбионтной микрофлоры, обладает большое число соединений, хотя они могут и не в полной мере отвечать всем требованиям, в частности перевариваемости, абсорбируемости, селективности:
Пребиотики относятся к одной из основных категорий функционального питания, и, таким образом, использование пищи с большим количеством балластных веществ (пищевые волокна, отруби, продукты, обогащенные живыми культурами бактерий (продукты «Данон», кисломолочные смеси «Гармония жизни», «Нарине», йогурты и др.)) является основной частью профилактических мероприятий для предупреждения развития нарушений микробиоценоза кишечника. Кроме того, существуют клинически апробированные БАДы, в частности стимбифид, содержащий в своем составе фруктополисахариды и фруктоолигосахариды, витамины и микроэлементы, которые в качестве стимуляторов роста собственной облигатной флоры, а именно бифидобактерий, могут быть использованы с этой же целью.
При этом использование в рационе питания фруктов и ягод, обладающих антибактериальным действием по отношению к определенным видам микроорганизмов (табл. 8), также приводит к профилактике «дисбактериоза».
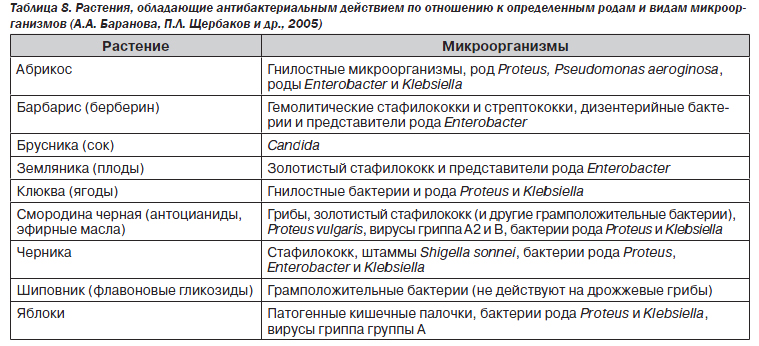
Особое место занимает профилактика нарушений микрофлоры кишечника при проведении антибактериальной, химио-, лучевой терапии и т.д.
Многочисленные данные и наши собственные исследования показали высокую эффективность препаратов как пробиотического ряда (бактисубтил, энтерол, линекс, биовестин-лакто, биокомплекс нормофлорин-Д, пробиотиков метаболитного типа (хилак форте) и др.), так и пребиотиков (лактулоза (дюфалак и т.п.)) в предупреждении развития микроэкологических нарушений, что доказывает необходимость их включения в комплексную терапию.
Подходя к заключению, необходимо отметить, что коррекция микробиоценоза не входит в обязательную программу лечения патологии ЖКТ, сопровождающуюся нарушением микробиоценоза (стандарты МЗ), но большинство врачей общей практики очень часто лечат «дисбактериоз», не учитывая (или просто не диагностируя) ни основную патологию, приведшую к его развитию, ни истинный характер изменения микробиоценоза. Подбор терапии осуществляется чисто эмпирическим путем, что приводит к низкой эффективности лечения и выводит на первый план фармако-экономический аспект проводимого лечения.
По нашим данным мы можем констатировать, что у 100 % больных как с патологией ЖКТ, так и при патологии других органов и систем диагностируются изменения со стороны микрофлоры и ее активности. Например, исследования КЖК в кале проведены более чем у 700 пациентов с функциональными и воспалительными заболеваниями кишечника (функциональный запор и диарея, различные варианты СРК, НЯК) на фоне проводимого лечения препаратами различных фармакологических групп: миотропные спазмолитики, прокинетики, слабительные средства, антидиарейные препараты, про- и пребиотики, кишечные антисептики и антибактериальные препараты, энтеросорбенты и др.
Результаты работы показали, что использование средств как непосредственно воздействующих на микрофлору, так и не оказывающих прямого влияния на нее приводило к восстановлению микробиоценоза кишечника. Причем в первом случае данный факт легко объясняется. Во втором случае, по нашему мнению, нормализация моторно-эвакуаторных расстройств кишечника приводит к естественной деконтаминации условно-патогенной микрофлоры за счет изменения внутриполостного окислительно-восстановительного потенциала кишечника. С нормализацией среды обитания активизируется метаболизм и увеличивается численность облигатной микрофлоры, что, в свою очередь, влияет на преэпителиальный и эпителиальный барьер защиты кишечной стенки и восстанавливает чувствительность рецепторного аппарата кишечника.
На основании полученных фактов изучения КЖК были разработаны критерии, позволяющие индивидуализировать подбор проводимого лечения, что привело к повышению эффективности терапии у данной категории больных. Были выделены типы изменения КЖК, являющиеся параметрами выбора фармпрепаратов различных групп.
При первом типе изменений спектра КЖК, характеризующем активность анаэробных микроорганизмов, в основном родов Propionibacterium, Bacteroides (отдельных штаммов), наиболее эффективной является терапия с использованием препарата из группы пребиотиков — энтеросана.
При втором типе изменений спектра КЖК, характеризующем активность анаэробных микроорганизмов, в основном родов Bacteroides, Clostridium, Eubacterium, Coprococcus, Fusobacterium, и штаммов анаэробных микроорганизмов, обладающих протеолитической активностью, наиболее эффективной является терапия с использованием антидиарейных препаратов биологического происхождения типа энтерол, бактисубтил или бактистатин.
При третьем типе изменений состава и спектра КЖК, характеризующем активность некоторых штаммов анаэробных микроорганизмов (в основном родов Bacteroides, Eubacterium, Coprococcus, Clostridium, Fusobacterium), принимающих участие во вторичном обмене желчных кислот и холестерина (в 7-альфа-дегидроксилировании), наиболее эффективной является терапия с использованием невсасывающегося и непереваривающегося в тонкой кишке синтетического дисахарида — лактулозы (в частности, препарата дюфалак) или препаратов метаболитного типа (хилак форте).
При четвертом типе изменений состава и спектра КЖК, характеризующем активность факультативных аэробных микроорганизмов, обладающих протеолитической активностью (Е.coli, энтеро-, стрепто-, стафилококки), наиболее эффективной является терапия с использованием препаратов лактулозы (в частности, дюфалака), обладающих осмотическим слабительным эффектом, бифидогенным и лактогенным свойствами.
При пятом типе изменений состава и спектра КЖК, характеризующем повышение активности факультативной микрофлоры и появление условно-патогенных аэробных микроорганизмов, обладающих протеолитической и гемолитической активностью (гемолитические штаммы Е.coli и др., клебсиелла, протей и пр.), наиболее эффективной является терапия с использованием препаратов — невсасывающихся кишечных антибиотиков типа альфа нормикс (рифаксимин) или антисептиков — интетрикса, энтерофурила и т.п.
При шестом типе изменений состава и спектра КЖК, характеризующем повышение активности факультативной микрофлоры и появление условно-патогенных анаэробных микроорганизмов, обладающих протеолитической и гемолитической активностью (условно-патогенных штаммов родов Bacteroides, Clostridium и др.), наиболее эффективной является терапия с использованием препаратов невсасывающихся кишечных антибиотиков типа альфа нормикс (рифаксимин) и т.п.
При седьмом типе изменений состава и спектра КЖК, характеризующем незначительное изменение активности облигатной и факультативной микрофлоры, не резко выраженном дисбалансе анаэробно-аэробных популяций микроорганизмов, наиболее эффективной является терапия с использованием препаратов про- и пребиотиков (нормофлорин-Л, -Б, биовестин-лакто, хилак форте, дюфалак (в минимальных терапевтических дозах в качестве бифидо- и лактогенного средства)).
Оценка эффективности проводится с учетом данных КЖК на фоне лечения, динамики клинического симптомокомплекса. При этом в случае эффективного лечения происходит нормализация количественного и качественного состава КЖК.
Таким образом, в результате исследования разработаны адекватные подходы к лечению пациентов с заболеваниями ЖКТ с учетом индивидуальных показаний, включающие подбор эффективной дозы препаратов, проведение комбинированного лечения для достижения максимальной эффективности терапии и предотвращение резистентности.
Кроме того, установленный факт изменения состава и активности микрофлоры на фоне лечения позволил сделать вывод, что ремиссия основной патологии приводит к стабилизации и нормализации микробиоценоза. С другой стороны, целенаправленное воздействие на микрофлору способствует повышению эффективности лечения основного заболевания.
Подводя итог вышеизложенному, хотелось бы отметить, что на настоящем этапе кишечную микрофлору следует рассматривать с позиции одной из функциональных систем макроорганизма, которая находится в тесной взаимосвязи с другими функциональными системами; при этом конечный результат их взаимодействия направлен на выравнивание нарушенного равновесия.
Кишечная микрофлора, неся большую функциональную нагрузку, не может не участвовать в возникновении и поддержании функциональных и патологических расстройств, поэтому выбор терапии должен быть корректным и направлен на то звено нарушенной регуляции, которое утратило возможность самовосстановления.
Необходимо подчеркнуть важность в первую очередь врача общей практики в ведении пациентов с нарушениями микробиоценоза кишечника, так как именно к нему обращаются пациенты со словами: «Доктор, у меня страшная болезнь — дисбактериоз».
Прежде всего, нельзя гиперболизировать данный синдром, а необходимо верифицировать патологию ЖКТ, приведшую к его нарушениям. Назначение адекватной диагностической программы с использованием в первую очередь исследования метаболитов микрофлоры (биохимический экспресс-анализ кала на «дисбактериоз») позволит избежать ряда трудоемких и инвазивных процедур, правильно оценить ситуацию и проводить как этиопатогенетическое лечение основной патологии, так и коррекцию микроэкологических нарушений.
Это приведет не только к повышению эффективности лечения, но и позволит снизить стоимость лечения и избежать полипрагмазии.
1. Алешкин В.А., Борисова И.В. Комплексные иммунобиологические препараты (КИП) для орального и ректального применения. — Н.-Новгород, 1991. — С. 212.
2. Ардатская М.Д. Диагностическое значение содержания короткоцепочечных жирных кислот при синдроме раздраженного кишечника // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2000. — Т. 10, № 3. — С. 36-41.
3. Ардатская М.Д. Клиническое значение короткоцепочечных жирных кислот при патологии желудочно-кишечного тракта: Дис... д-ра мед. наук. — М., 2003. — 300 с.
4. Ардатская М.Д. Метаболические эффекты пищевых волокон // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2001. — Т. 11, № 4 (прил. № 14). — С. 91-102.
5. Ардатская М.Д., Минушкин О.Н. Дисбактериоз кишечника: эволюция взглядов. Современные принципы диагностики и фармакологической коррекции // Consilium medicum. Приложение «Гастроэнтерология». — 2006. — № 2. — С. 4-18.
6. Ардатская М.Д., Арутюнян Э.Э., Прихно Н.И., Минушкин О.Н. Клинические аспекты изучения короткоцепочечных жирных кислот при патологии желудочно-кишечного тракта // Материалы 30-й межрегиональной конференции «Современные аспекты патогенеза, перспективы диагностики и лечения в гастроэнтерологии». — Смоленск, 2002. — С. 154-162.
7. Ардатская М.Д., Минушкин О.Н., Бабин В.Н. и др. Определение содержания и профиля низкомолекулярных метаболитов в кале у пульмонологических больных до и после проведения антибактериальной терапии Факты и размышления // Клинический вестник ПМЦ РФ. — 1995. — № 3. — С. 13-14.
8. Ардатская М.Д., Минушкин О.Н., Елизаветина Г.А., Зверков И.В. Клинические возможности использования метаболитов кишечной микрофлоры в диагностике и тактике лечения больных с синдромом раздраженного кишечника // Материалы 29-й конференции «Функциональные заболевания и расстройства функций. Гастроэнтерологическая онкология». — Смоленск, 2001. — С. 3-11.
9. Ардатская М.Д., Минушкин О.Н., Масловский Л.В., Сергеев А.В. Короткоцепочечные жирные кислоты и внешнесекреторная недостаточность поджелудочной железы у больных с хроническим панкреатитом // Материалы 31-й конференции «Негативные эффекты лечения. Сочетанные болезни органов пищеварения и отягощение их другой патологией; различные аспекты диагностики и лечения в гастроэнтерологии». — Смоленск, 2003. — С. 209-215.
10. Ардатская М.Д., Минушкин О.Н., Прихно Н.И., Дубинин А.В. Летучие жирные кислоты и их диагностическое и прогностическое значение в гастроэнтерологической клинике // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2000. — Т. 10, № 5. — С. 63-70.
11. Ардатская М.Д., Сундукова М.Б., Минушкин О.Н. Применение «Биовестина-Лакто» в лечении больных с синдромом раздраженного кишечника // Материалы IX Российского национального конгресса «Человек и лекарство». — 2002. — С. 26.
12. Арутюнян Э.Э., Ардатская М.Д., Минушкин О.Н. Изучение короткоцепочечных жирных кислот у больных неспецифическим язвенным колитом // Кремлевская медицина. — 2002. — № 1. — С. 21-25.
13. Бабин В.Н., Домарадский И.В., Дубинин А.В., Кондракова О.А. Новые подходы к разработке лекарственных средств // Рос. хим. журн. (ЖРХО им. Менделеева). — 1996. — Т. 40(2). — С. 125-130.
14. Бабин В.Н., Домарадский И.В., Дубинин А.В., Кондракова О.А. Биохимические и молекулярные аспекты симбиоза человека и его микрофлоры // Рос. хим. журн. (ЖРХО им. Менделеева). — 1994. — Т. 38(6). — С. 66-78.
15. Бабин В.Н., Минушкин О.Н., Дубинин А.В. и др. Молекулярные аспекты симбиоза в системе хозяин-микрофлора // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 1998. — № 6. — С. 76-82.
16. Бельмер С.В. Антибиотикоассоциированный дисбактериоз у детей // Русский медицинский журнал. — 2004. — №12.
17. Бондаренко В.М., Грачева Н.М., Мацулевич Т.В. Дисбактериозы кишечника у взрослых. — М.: KMK Scientific Press, 2003. — 224 с.
18. Борисова И.В., Алешкин В.А., Холчев Н.В. и др. Комплексные иммуноглобулиновые препараты для перорального и ректального применения // Иммунобиологические препараты. — М., 1989. — С. 5-10.
19. Василенко В.В. Дисбактериоз — синдром раздраженного кишечника: эссе-анализ проблемы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2000. — № 6. — С. 10-13.
20. Григорьев П.Я., Коровина В.И., Жуховицкий В.Г., Яковенко Э.П. и др. Изменения родового состава кишечной микрофлоры и степени обсемененности кишечника: бактериологическая характеристика, клиническое значение, вопросы терапии // Практикующий врач. — 1999. — № 16(3). — С. 14-19.
21. Дисбиоз кишечника. Руководство по диагностике и лечению / Под ред. проф. Е.И. Ткаченко, проф. А.Н. Суворова. — СПб.: Спецлит, 2007. — 238 с.
22. Дубинин А.В., Бабин В.Н., Раевский П.М. Трофические и регуляторные связи макроорганизма и микрофлоры // Клиническая медицина. — 1991. — № 7. — С. 24-28.
23. Дубинин А.В., Бабин В.Н., Раевский П.М., Шихман А.Р. Механизм патогенеза неспецифического язвенного колита // Клиническая медицина. — 1991. — 7. — С. 24-28.
24. Калмыкова А.И., Селятицкая В.Г., Пальчикова Н.А., Бгатова Н.П. Клеточные и системные механизмы действия пробиотиков. — Новосибирск, 2007. — 280 с.
25. Красноголовец В.Н. Дисбактериоз кишечника. — М.: Медицина, 1989. — 206 c.
26. Кристен М.О. Новый класс антагонистов кальция, обладающих селективным действием на желудочно-кишечный тракт // Материалы Международного симпозиума «Моторика толстой кишки. Патофизиологические и терапевтические аспекты». — М., 1997. — С. 25-38.
27. Куваева И.Б., Ладодо К.С. Микроэкологические и иммунные нарушения у детей. — М.: Медицина, 1991. — 240 c.
28. Лыкова Е.А. Характеристика и алгоритм применения пробиотиков. // Медик — 21 век. — 2005.
29. Мазанкова Л.Н., Лыкова Е.А. Пробиотики: характеристика препаратов и выбор в педиатрической практике // Детские инфекции. — 2004. — № 1. — С. 18-23.
30. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: Пер. с англ.: В 2 т. —М.: Мир, 1993.
31. Минушкин О.Н., Ардатская М.Д., Бабин В.Н., Дубинин А.В. Исследование низкомолекулярных метаболитов сахаролитической толстокишечной микрофлоры — метод диагностики заболеваний толстой кишки и оценки лечебной коррекции // «Основы и принципы лечения воспалительных заболеваний кишечника». Мат-лы Фальк-симпозиума. — СПб., 1996.
32. Минушкин О.Н., Ардатская М.Д., Бабин В.Н., Дубинин А.В. Исследование короткоцепочечных жирных кислот в кале при сочетанной патологии толстой кишки и легких// Материалы научно-практической конференции «Сочетанные гастроэнтерологические заболевания. Взаимосвязанные поражения органов ротовой полости и органов пищеварения». — Смоленск, 1999. — С. 226-231.
33. Минушкин О.Н., Ардатская М.Д., Дубинин А.В. Дисбактериоз кишечника: современные аспекты изучения проблемы, принципы диагностики и лечения (обзор) // Терапевтический архив. — 2001. — № 2. — С. 67-72.
34. Минушкин О.Н., Ардатская М.Д., Бабин В.Н., Домарадский И.В., Дубинин А.В. Дисбактериоз кишечника // Российский медицинский журнал. — 1999. — №3. — С. 40-45.
35. Минушкин О.Н., Ардатская М.Д., Елизаветина Г.А., Масловский Л.В. Роль «Энтерола» в лечении и профилактике дисбактериоза кишечника // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 1998. — Т. 8, № 5. — С. 292.
36. Минушкин О.Н., Ардатская М.Д., Елизаветина Г.А. и др. Оценка пробиотической эффективности препарата «Энтеросан» при хронической патологии ЖКТ по данным изучения маркеров метаболической активности кишечной микрофлоры // Кремлевская медицина. — 2000. — № 1. — С. 60-63.
37. Минушкин О.Н., Ардатская М.Д., Масловский Л.В. Роль кишечной микрофлоры в патогенезе желчнокаменной болезни (по результатам изучения короткоцепочечных жирных кислот в кале) // Материалы 29-й конференции «Функциональные заболевания и расстройства функций. Гастроэнтерологическая онкология». — Смоленск, 2001. — С. 77-83.
38. Минушкин О.Н., Арутюнян Э.Э., Ардатская М.Д. Позволяет ли изучение короткоцепочечных жирных кислот выбрать фармпрепарат для адекватного лечения больных неспецифическим язвенным колитом? // Российский медицинский журнал. — 2002. — № 5. — С. 15-19.
39. Минушкин О.Н., Елизаветина Г.А., Ардатская М.Д. Лечение функциональных расстройств кишечника и желчевыводящей системы, протекающих с абдоминальными болями и метеоризмом // Клиническая фармакология и терапия. — 2002. — № 11 (1). — С. 1-4.
40. Минушкин О.Н., Елизаветина Г.А., Ардатская М.Д. и др. Клиническая эффективность «Перистила» в терапии синдрома раздраженного кишечника // Материалы 28-й конференции «Перспективные направления в изучении патогенеза, новые технологии диагностики и лечения в гастроэнтерологии». — Смоленск, 2000. — С. 329-332.
41. Комплексная диагностика, лечение и профилактика дисбактериоза (дисбиоза) кишечника в клинике внутренних болезней МЦ УД ПРФ (методические рекомендации) / Сост. С.Д. Митрохин, М.Д. Ардатская и др.; под ред. О.Н. Минушкина, В.И. Минаева. — М., 1997. — 45 с.
42. Осипов Г.А. Хромато-масс-спектрометрическое исследование микроорганизмов и их сообществ: Автореф. дис... д-ра биол. наук. — М., 1995. — С. 62.
43. Парфенов А.И. Клинические проблемы дисбактериоза // Рос. гастроэнтерологический журнал. — 1999. — № 4. — С. 49-55.
44. Потапов А.С., Пахомовская Н.Л., Полякова С.И. Применение пробиотиков врачами общей практики // Consilium medicum. Гастроэнтерология. — 2007. — № 1. — С. 54-58.
45. Прихно Н.И., Минушкин О.Н., Ардатская М.Д. и др. Изучение состава короткоцепочечных жирных кислот в фекалиях и сыворотке периферической крови у пациентов, страдающих желчекаменной болезнью, и значения КЖК для изучаемого заболевания // Клиническая медицина. — 2001. — № 4. — С. 37-40.
46. Тамм А.О., Вия М.П., Микельсаар М.Э, Сийгур У.Х. Метаболиты кишечной микрофлоры в диагностике дисбиоза кишечника // Антибиотики и медицинская биотехнология. — 1987. — Т. 32, № 3. — С. 191-195.
47. Тец В.В. Справочник по клинической микробиологии. — СПб., 1994. — 211 с.
48. Ткаченко Е.И., Успенский Ю.П. Питание, микробиоценоз и интеллект человека. — СПб.: Спецлит, 2006. — 590 с.
49. Ушкалова Е. «Живое» лекарство: линекс // Врач. Спецвыпуск. — 2007. — С. 1-4.
50. Шендеров Б.А. Медицинская микробная экология и функциональное питание: В 3 т. — М., 1998.
51. Шендеров Б.А. Современное состояние и перспективы развития концепции «Пробиотики. Пребиотики, симбиотики».
52. Шептулин А.А. Синдром избыточного бактериального роста бактерий и «дисбактериоз кишечника»: их место в современной гастроэнтерологии // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 1999. — № 3. — С. 51-54.
53. Bai J.C. Malabsorption Syndromes // J. Digestion. — 1998. — 59. — 530-546.
54. Berg R.D. Bacterial translocation // Blum H.E., Bode J.C., Bode C., Sartor R.B. (eds). Gut and Liver: Proceeding of the Falk Symposium 100. — Kluwer Academic Publishers, 1998. — P.47-60.
55. Berg R.D. Bacterial translocation from the gastrointestinal tract // Trends Microbiol. — 1995. — Vol. 3. — 149-54.
56. Casafont F., Martin L., Pons-Romero F. Bacterial overgrowth in the small intestine in chronic liver disease // Proceeding of the Falk Symposium 100. Kluwer Academic Publishers, 1998. — P. 332-340.
57. Cherbut C., Aube A.C., Blottiere H.M., Galmiche J.P. Effects of short-chain fatty acids on gastrointestinal motility // Scand. J. Gastroenterology. — 1997. — Vol. 32, Suppl. 222. — P. 58-61.
58. Clausen M.R., Mortensen P.B. Kinetic studies on colonocyte metabolism of short chain fatty acids and glucose in ulcerative colitis // Gut. — 1995. — Vol. 37. — 684-689.
59. Gibson G.R., Macfarlane G.T. (eds) Human colonic bacteria: role in nutrition, physiology and pathology // CRC Press. — 1995. — 1-18.
60. Gut microflora. Digestive physiology and pathology / Ed. by J.-C. Rambaud, J.-P. Buts, G. Corthier, B. Flourie. — London: John Libbey, 2006. — 247 p.
61. Hentges D.J. Human intestinal microflora in health and disease. — New York: Academic Press, 1983.
62. Role of gut bacteria in human toxicology and pharmacology // Ed. by M.J. Hill. — Basingstoke: Burgess Science Press, 1995.
63. Husebye E., Hellstrom R., Midtvedt T. The role of normal microbial flora in control of small intestine motility //
Microbiol. Therapy. — 1990. — Vol. 20. — 389-394.
64. Kordecki H., Niedzielin K. Does modification of bacterial microflora constitute the progress in the therapy of functional and inflammatory bowel diseases // Abs. Word Congresses of Gastroenterology, September 6–11, 1998. — Vienna, 1998. — 59 (Suppl. 3). — 144.
65. Macfarlane G.T., Macfarlane S. Human colonic microbiota: ecology, physiology and metabolic potential of intestinal bacteria // Scand. J. Gastroenterol. — 1997. — 32 (Suppl. 222). — 3-9.
66. Ozcelic M.F., Pekmezci S., Altinli E. et al. Lactulose to prevent bacterial translocation in biliary obstruction // Dig. Surg. — 1997. — 14. — 267-271.
67. Parks R.W., Clements W.D., Pope C., Halliday M.I. et al. Bacterial translocation and gut microflora in obstructive jaundice // J. Anat. — 1996. — 189. — 561-5.
68. Salminen S., Isolauri E., Onela T. Gut flora in normal and disordered states // Chemotherapy. — 1995. — 41 (Suppl. 1). — 5-15.
69. Salminen S., Isolauri E., Salminen E. Clinical uses of probiotics for stabilization of gut mucosal barrier: successful strains and future challenges // Antonie van Leeuwenhoek. — 1996. — Vol. 70. — 347-58.
70. Salminen S., Salminen E. Lactulose, lactic acid bacteria, intestinal microecology and mucosal protection // Scand. J. Gastroenterol. — 1997. — 222. — 45-48.
71. Salyers A.A. Bacteroides of the human lower intestianal tract // Ann. Rev. Microbiol. — 1984. — Vol. 38. — 293-313.
72. Sandborn W.J. Are short-chain fatty acid enemas effective for left-sided ulcerative colitis? // Gastroenterology. — 1998 Jan. — 114(1). — 218-9.
73. Sartor R.B., Lichtman S.N. Hepatic injury and biliary tract diseases associated with small intestinal bacterial overgrowth / Proceeding of the Falk Symposium 100. — 1998. — 241-250.
74. Sedman P.C., Macfie J., Sagar P., Mitchell C.J. et al. The prevalence of gut translocation in humans // Gastroenterology. — 1994. — 107. — 643-9.
75. Short Chain Fatty Acids. Congress Short Report Falk Symposium / Comp. by W. Scheppach. — Strasbourg, 1993. — 50 p.
76. Siavoshian S. et al. Butyrate and trichostatin A effects on the proliferation/differentiation of human intestinal epithelial cells: induction of cyclin D3 and p21 expression // Gut. — 2000. — Vol. 46. — 507-514.
77. Simpson E.J., Chapman M.A.S., Dawson J., Berry D., Macdonald I.A., Cole A. In vivo measurement of colonic butyrate metabolism in patients with quiescent ulcerative colitis // Gut. — 2000. — Vol. 46. — 73-77.
78. Tannock G.W. Normal microflora. — London: Chapman & Hall, 1995.

