Газета «Новости медицины и фармации» Кардиология (314) 2010 (тематический номер)
Вернуться к номеру
Порівняльний аналіз режимів антикоагулянтної терапії в ранні строки після коронарного шунтування на працюючому серці
Авторы: О.А. Береговий. Національний інститут серцево-судинної хірургії ім. М.М. Амосова АМН України, м. Київ
Версия для печати
Актуальність
Незважаючи на досконалість сучасних методів хірургічного лікування ішемічної хвороби серця (ІХС) [1–3], тромбогеморагічні ускладнення при коронарному шунтуванні є однією з актуальних проблем кардіохірургії. Ці хворі вже до операції мають зміни в системі згортання крові, пов''язані з прийомом антикоагулянтів та антиагрегантів. У ранньому післяопераційному періоді вони потребують адекватної антикоагулянтної терапії, направленої на запобігання тромбоемболічним та геморагічним ускладненням [3–8].
Нами проведено дослідження з метою оцінки ефективності антикоагулянтної терапії та вдосконалення її у хворих у ранні строки після коронарного шунтування на працюючому серці (ПС).
Матеріали і методи
Клінічний матеріал охоплює 167 пацієнтів з ІХС, прооперованих без використання штучного кровообігу в 2009 році в Національному інституті серцево-судинної хірургії ім. М.М. Амосова АМН України. Усі хворі належали до групи високого ризику виникнення тромбогеморагічних ускладнень та мали певні відмінності в їх медикаментозній профілактиці.
За тиждень до операції всім хворим відміняли антиагреганти.
Під час аортокоронарного шунтування (АКШ) стандартно вводився нефракціонований гепарин (НФГ) 2 мг/кг та в кінці операції інактивувався протаміну сульфатом у дозі 2 мг/кг.
Безпосередньо після операції хворі були рандомізовані за показниками розгорнутої коагулограми, мали однакові зміни системи згортання крові, але вірогідного кореляційного взаємозв''язку цих змін з доопераційними не було виявлено.
Основні відмінності в антикоагулянтній терапії мали місце у післяопераційному періоді. У зв''язку з цим прооперовані хворі були розподілені на 2 групи. У 1-шу групу ввійшли 47 пацієнтів, яким профілактика тромбогеморагічних ускладнень проводилась за умови відсутності кровотеч через 6 годин від закінчення операції інфузією нефракціонованого гепарину за допомогою шприцевого дозатора зі швидкістю 10 ОД/кг/год під контролем коагулограми (активований частковий тромбопластиновий час (АЧТЧ), протромбіновий індекс (ПТІ), тромбіновий час).
Другу групу склали 120 хворих, яким профілактику тромбогеморагічних ускладнень у ранньому післяопераційному періоді проводили низькомолекулярними гепаринами (НМГ) так само через 6 годин після закінчення операції: у 32 хворих застосовували оригінальний препарат еноксапарину натрію 60 мг/добу, у 32 — вітчизняний препарат еноксапарину натрію — 60 мг/добу, у 49 — оригінальний препарат дальтепарину натрію 5000 МО/добу. Крім гепаринотерапії, усі хворі після ізольованого АКШ через 6 годин після закінчення операції рутинно отримували 100 мг ацетилсаліцилової кислоти і 75 мг клопідогрелю. Така терапія проводилась хворим весь час перебування їх у відділенні інтенсивної терапії, у середньому 3–5 днів. Доопераційні характеристики груп хворих наведені в табл. 1.
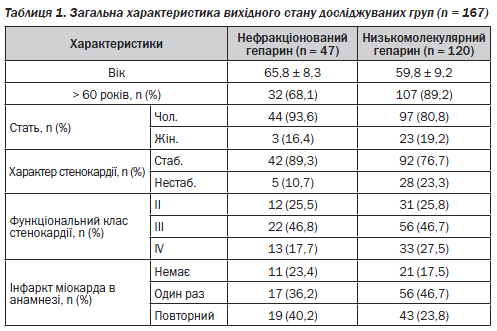
Як видно з даних табл. 1, у хворих другої групи стенокардія мала більш виражений характер.
Усім хворим проводились загальноклінічні та біохімічні дослідження крові, розгорнута коагулограма, моніторування показників центральної гемодинаміки, інструментальні дослідження. Математична обробка інформації виконувалась на комп''ютері з використанням статистичного пакету Statistica 8.0.
Результати і їх обговорення
Проведений порівняльний аналіз кількісних клінічних та біохімічних характеристик хворих після АКШ в умовах ШК та на ПС дозволив виявити такі вірогідні особливості порівнюваних груп (табл. 2).
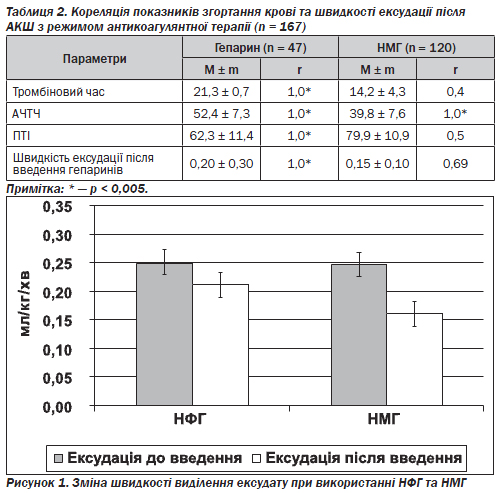
При застосуванні НМГ найбільшим інформативним показником ефективності антикоагулянтної терапії є АЧТЧ, який не потребує високої частоти контролю, може контролюватися з меншою періодичністю, ніж НФГ, враховуючи значну тривалість та стабільність дії НМГ. При застосуванні НФГ необхідний контроль широкого діапазону показників згортання крові (АЧТЧ, ПТІ, тромбіновий час) з регулярною частотою 1 раз на 6 годин, враховуючи короткотривалу дію НФГ.
Використання а.mamaria при коронарному шунтуванні, гіпертензія в періопераційному періоді також мають вірогідний (р < 0,005) позитивний кореляційний зв''язок з рівнями швидкості ексудації.
Швидкість виділення ексудату в групі хворих, де використовувався НФГ, мала тільки тенденцію до зниження після початку його інфузії в 1-шу добу під ретельним контролем АЧТЧ в межах 45–70 с, у групі з НМГ темп ексудації був вірогідно нижчим (р < 0,005) після введення препарату, не збільшувалася крововтрата, застосування НМГ не потребувало контролю за коагуляційною системою (рис. 1).
На відміну від нефракціонованих гепаринів серед низькомолекулярних наявний позитивний (р < 0,005) кореляційний зв''язок еноксапарину натрію (Фленокс™ та Клексан®) з АЧТЧ, що може свідчити про їх вплив на ІІА-фактор згортання (табл. 3). Регресійний аналіз дозволив виявити граничне значення АЧТЧ, що становило 45–70 с, при якому були відсутні тромбогеморагічні ускладнення.
Гепаринопрофілактика тромбогеморагічних ускладнень у ранньому післяопераційному періоді починалась через 8 годин від закінчення операції за відсутності кровотеч, темп ексудації зменшувався, та використання НФГ та НМГ в обох групах не приводило до збільшення геморагії. У групі пацієнтів, у яких застосовувався НФГ, швидкість ексудації була вищою, ніж у пацієнтів після введення НМГ (рис. 2).
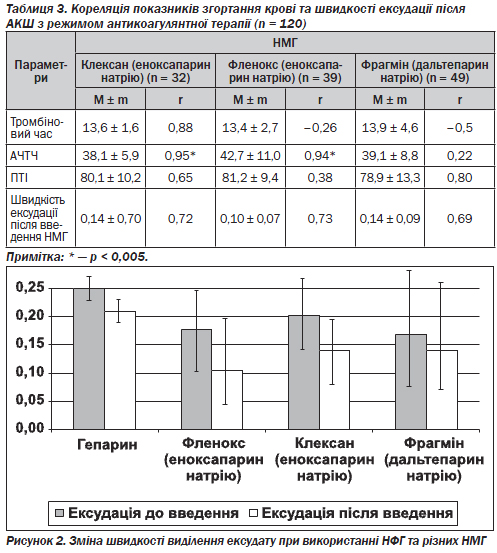
Не виявлено залежності досліджуваних показників згортання крові від виду застосованого препарату НМГ. При використанні НФГ виявлена кореляція між рівнями швидкості ексудації та тромбіновим часом, АЧТЧ, ПТІ. Статистичний аналіз дозволив виявити граничні значення тромбінового часу (15–20 с), АЧТЧ (45–70 с), ПТІ (50–60 %), при яких були відсутні тромбогеморагічні ускладнення. Застосування НМГ не потребує ретельного контролю за системою згортання крові; вони прості у використанні.
Таким чином, нами визначено гемостатичні критерії при коронарному шунтуванні. Під час застосування НФГ і НМГ виявлено кореляцію між рівнями швидкості ексудації та біохімічними показниками системи згортання крові. Проведено порівняльний аналіз ефективності профілактики тромбогеморагічних ускладнень після АКШ шляхом застосування НМГ і НФГ.
Висновки
1. Профілактика тромбоемболічних ускладнень в ранньому післяопераційному періоді повинна починатися через 6 годин одним із гепаринів у комбінації з антиагрегантами (100 мг аспірину та 75 мг клопідогрелю), якщо немає кровотечі по дренажній системі після АКШ. Ця тактика відповідає міжнародним рекомендаціям з профілактики тромбоемболічних ускладнень.
2. Проведені клініко-біохімічні дослідження свідчать про ефективність у профілактиці тромбоемболічних ускладнень препаратів еноксапарину натрію й дальтепарину натрію, які не призводять до геморагічних ускладнень після АКШ у ранньому післяопераційному періоді.
3. При застосуванні НФГ виявлено кореляцію між рівнями швидкості ексудації та тромбіновим часом, АЧТЧ, ПТІ, що свідчить про ефективність контролю системи згортання крові в динаміці кожні 6 годин протягом періопераційного періоду.
4. Застосування НМГ має очевидні переваги перед НФГ, а серед НМГ виявлено порівнянну ефективність вітчизняного препарату еноксапарину натрію й оригінальних препаратів еноксапарину та дальтепарину натрію.
1. Наумов В.Г., Лупанов В.П. Профилактика рестенозов после ангиопластики, стентирования и коронарного шунтирования // Сердце. — 2002. — 1 (5). — 138-143.
2. Чазов Е.И. Ишемическая болезнь сердца и возможности повышения эффективности ее лечения // Клинические исследования лекарственных средств в России. — 2001. — 1. — 2-4.
3. Петракова Л.Н. Дезагреганты и прямые антикоагулянты при имплантации коронарных стентов у больных со стабильной стенокардией: Автореф. дис… канд. мед. наук. — М., 2008.
4. Акчурин Р.С., Галяутдинов Д.М., Ширяев А.А. Показания к операции коронарного шунтирования у больных с различным течением ИБС // Кардиология. — 2002. — Т. 10, № 19.
5. Богопольская О.М. Вторичная профилактика сердечно-сосудистых осложнений после аортокоронарного шунтирования // Кардиология и сердечно-сосудистая хирургия. — 2007. — № 1.
6. Lee K.W. et al. // Blood. — 2005. — Vol. 105. — Р. 526-532.
7. Li N. et al. // J. of Thrombosis and Haemostasis. — 2003. — Vol. 1. — P. 470.
8. Lippi G. et al. // Thrombosis J. — 2006. — № 4. — Р. 2.
