Журнал «Медицина неотложных состояний» 3(34) 2011
Вернуться к номеру
Досвід використання Гепасолу НЕО 8% при лікуванні синдрому печінкової енцефалопатії, зумовленої отруєнням аманітальними грибами
Авторы: Шлапак І.П., Недашківський С.М., Галушко О.А. НМАПО імені П.Л. Шупика, кафедра анестезіології та інтенсивної терапії, м. Київ Струк В.Ф. Київська міська клінічна лікарня швидкої медичної допомоги, відділення інтенсивної терапії та екстракорпоральної детоксикації
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Виконано дослідження впливу препарату Гепасол НЕО 8% щодо зменшення клінічних проявів печінкової енцефалопатії, оцінки його дезінтоксикаційного, гепатопротекторного ефектів у хворих із токсичним гепатитом, зумовленим отруєнням аманітальними грибами. Проведено порівняльну оцінку клінічної ефективності лікування в основній групі хворих, які отримували терапію з включенням препарату Гепасол НЕО 8%, і в пацієнтів контрольної групи, які отримували базову терапію без включення до схеми лікування Гепасолу НЕО 8%. Отримані результати свідчать, що препарат Гепасол Нео 8% найбільш ефективний при лікуванні початкових стадій печінкової енцефалопатії та завдяки комбінованому механізму дії має дезінтоксикаційний, гепатопротекторний та метаболічний ефекти.
Отруєння аманітальними грибами, токсичний гепатит, печінкова енцефалопатія, Гепасол Нео 8%.
З року в рік у засобах масової інформації ми чуємо сумні повідомлення про фатальні наслідки отруєння грибами. Серед потерпілих опиняються цілі сім’ї, і результат цих прикрих випадків не завжди втішний. Сезон отруєнь припадає на весняно-осінній період, а пік, залежно від погодних умов, — на липень — вересень. Аналізуючи епідеміологію отруєнь грибами за період 1998–2008 рр. у Київському міському токсикологічному центрі, що працює на базі Київської міської клінічної лікарні швидкої медичної допомоги, ми отримали такі дані: щорічна кількість потерпілих від отруєння грибами коливалась від 55 до 136 осіб, із них клінічні прояви отруєння аманітальними грибами реєструвались у 2–22 випадках. Щорічна кількість смертельних отруєнь грибами цієї групи (гепатонефротоксичної дії) становила від 0 до 8 (23 %). Але кількість хворих цієї категорії щороку може істотно відрізнятися. Так, у 2009 році було зареєстровано всього 2 випадки отруєння грибами гастроентеротропної дії, натомість наступного року (2010) пролікувалося 40 осіб, із них 15 з отруєнням грибами гепатонефротоксичної дії (2 померлі). Кількість пацієнтів в Україні, яким установлений первинний діагноз «отруєння грибами», у різні роки коливається від 700–800 до 1500–2500 на рік. Проблема отруєнь грибами існує не тільки в Україні. Так, за даними інформаційних токсикологічних центрів США (2006 р., мережа ТOXNET), на 100 000 населення реєструється 5 випадків отруєнь, 64 % із них старші 6 років, у 88 % не проводилася верифікація грибних токсинів. Найбільш небезпечними справедливо вважаються отруєння грибами гепатонефротоксичної дії (аманітальні гриби, до яких належить бліда поганка та її різновиди). За даними К. Olson, 1999 [10], смертність, що зумовлена отруєннями грибами гепатонефротоксичної дії, становить від 10 до 65 % і залежить насамперед від своєчасності звернення по медичну допомогу та терміну початку спеціалізованої медичної допомоги.
Щодо причин, які обумовили велику кількість госпіталізованих із діагнозом «отруєння грибами», ми виділили такі:
— сприятливі погодні умови для вегетації грибів;
— необізнаність переважної частки населення про можливі фатальні наслідки, до яких веде вживання нерозпізнаних отруйних грибів;
— втрата потерпілими навичок розпізнавання та збирання їстівних грибів (серед осіб, госпіталізованих з отруєнням грибами, значно переважає міське населення);
— легковажне та зневажливе ставлення певної частки населення до застережень щодо збирання грибів, які здійснюються місцевими органами охорони здоров’я через засоби масової інформації;
— потрапляння до грибного кошика молодих екземплярів отруйних грибів, які навіть грибники з досвідом іноді плутають з печерицями та деякими іншими їстівними грибами;
— вживання у їжу грибної суміші, коли збираються декілька різновидів грибів, серед яких трапляються й отруйні екземпляри;
— вживання грибних страв у гостях, коли потерпілі ставляться з довірою до якості вжитого продукту (трапляються й отруйні гриби);
— неправильна або неповна кулінарна обробка грибів;
— погіршення соціально-економічної ситуації на місцях, яка спонукає населення розширювати свій харчовий раціон за рахунок дикорослих грибів, що поставило проблему отруєнь грибами на одне з перших місць у структурі отруєнь харчовими токсикантами.
Аналізуючи летальність серед потерпілих від грибних отруєнь, виявлено низку причин, що її зумовлюють:
— надзвичайно висока токсичність деяких грибних токсинів (a-аманітин, b-аманітин, g-аманітин, e-аманітин), які містяться у певних грибах роду Amanita (A.phalloides, A.virosa, A.verna, A.ocreata), Galerina (G.autumnalis, G.marginata), Lepiota, внаслідок чого практично всі летальні випадки були зумовлені проявами гострої печінково-ниркової недостатності, яка властива для ураження цими токсинами;
— особливість перебігу отруєння цими грибами: перші симптоми при отруєнні аманітальними грибами з’являються не раніше ніж через 6 годин (зазвичай через 8–12 годин, рідше до 48 годин) із моменту вживання їх у їжу, коли токсиканти потрапляють у кровотік, зв’язуються з тканинами, і надання ефективної медичної допомоги утруднюється;
— пізнє звернення потерпілих по медичну допомогу — через добу та пізніше (іноді на 3-тю — 4-ту добу) з моменту отруєння.
Відсутність можливості верифікації аманітинів у сечі постраждалих, як якісно, так і кількісно, зумовлює необхідність розуміння клінічного перебігу отруєння, яке може бути спричинене не лише блідою поганкою, але й низкою інших грибів, що містять подібні токсини. Висока токсичність блідої поганки (Amanita phalloides) обумовлена наявністю в ній двох основних груп грибних токсинів: 1) швидкодіючих — фалотоксинів (фалоїдин, фалоїн, профалін, фалідин тощо) та 2) повільнодіючих — аматоксинів (a-, b-, g-, e-аманітини, аманін та деякі інші). Ці токсини містяться також і в різновидах блідої поганки (у білій поганці, жовтій поганці та зеленій поганці). Аматоксини входять до складу деяких інших отруйних грибів: мухомора смердючого (Amanita virosa), поганкоподібного мухомора (Amanita verna), Amanita ocreata, деяких грибів з роду Galerina (Galerina autumnalis, G.marginata) та Lepiota (Lepiota subincarnata тощо). Аманітини належать до найбільш токсичних речовин у світі. Смертельною дозою аманітину вважається 0,1 мг/кг. Одна шапка блідої поганки в середньому містить 10– 15 мг аманітинів. На відміну від Amanita phalloides у грибах роду Galerina міститься набагато менше аматоксинів. Так, летальною дозою для дорослого може бути вживання 15–20 шапок грибів цього роду.
Фалотоксини починають діяти не раніше як за 6 годин після вживання грибів. Токсична дія фалотоксинів пов’язана з їхнім впливом на мембрану та органели гепатоцитів, епітелію та судин кишечника. Дія аматоксинів сповільнена, але спричинює набагато більші ушкодження в організмі. Аманітини перш за все порушують діяльність клітин із високим ступенем білковосинтезуючої активності: гепатоцитів, епітелію кишечника, судин ниркового епітелію тощо. В основі токсичної дії аматоксинів лежить порушення внутрішньоклітинного синтезу білка за рахунок блокади РНК-полімерази. Це призводить до повної дезінтеграції синтетичних процесів у клітині (насамперед у гепатоцитах) і зрештою до її загибелі. Токсини, що всмокталися, на 60 % депонуються в печінці. Виведення аманітинів відбувається через нирки, у сечі вони виявляються через 17–20 год, елімінація закінчується за 60–70 год [9].
Токсини блідої поганки є термостабільними і не розкладаються при кулінарній обробці. Тому навіть довготривала термічна обробка грибів, до яких потрапила бліда поганка, на вберігає від розвитку отруєння.
Клінічний перебіг отруєння грибами гепатонефротоксичної дії складається із латентного періоду, періоду токсичного гастроентериту/гастроентероколіту, періоду вдаваного благополуччя, який може бути відсутнім при фульмінантному перебігу отруєння, періоду токсичного гепатиту та періоду реконвалесценції.
Синдром печінкової енцефалопатії (ПЕ) є безпосередньою складовою клінічних ознак токсичного гепатиту і першою ланкою розвитку крайнього прояву печінкової енцефалопатії — печінкової коми.
Розвиток ПЕ є логічним підсумком гепатоцелюлярної недостатності внаслідок цитолізу гепатоцитів та значного зниження дезінтоксикаційних властивостей печінки. Причини печінкової енцефалопатії поліморфні. Однією з них вважається значне зниження спроможності синтетичної функції печінки до утворення сечовини з аміаку (орнітиновий цикл) та утворення глутаміну в печінці, головному мозку, м’язах. Надлишок аміаку зв’язується з a-кетоглутаровою кислотою, у результаті чого утворюється глутамінова кислота. Дефіцит a-кетоглутарової кислоти істотно знижує інтенсивність процесів окислення та фосфорилювання, призводячи до дефіциту АТФ. Вважається, що близько 80 % аміаку утворюється в кишечнику в результаті мікробного гідролізу білків. Рівень аміаку крові при печінковій недостатності може збільшуватися в 5 разів [4]. Проникаючи в неіонізованій формі шляхом здолання гематоенцефалічного бар’єра до головного мозку, аміак сприяє зниженню синтезу АТФ, збільшується проникність ароматичних амінокислот, підвищується афінність постсинаптичних 5-НТ1-серотонінових рецепторів. При наявності портокавальних анастомозів за рахунок портальної гіпертензії аміак минає печінку і шлях його до головного мозку полегшується. Але збільшення концентрації аміаку в крові хворих не є єдиною та провідною причиною ПЕ. У певної частки хворих з печінковою комою рівень аміаку крові не підвищений [4]. Тому існують й інші чинники, що спричиняють гальмівну дію на центральну нервову систему. Порушення білковосинтетичної функції печінки реалізується в дисбалансі амінокислот. У нормальних умовах співвідношення амінокислот з розгалуженим боковим ланцюжком (валін, лейцин, ізолейцин тощо) і ароматичних амінокислот (фенілаланін, тирозин) характеризується коефіцієнтом Фішера, який за нормальних умов становить 3,0–4,5 [1, 2, 8].
При печінковій недостатності характерні процеси катаболізму, внаслідок чого кількість карбонових амінокислот значно збільшується. Це призводить до того, що в ЦНС створюються умови для синтезу так званих псевдонейромедіаторів: октопаміну, b-фенілетаноламіну, які структурно подібні до таких нейротрансмітерів, як норадреналін та дофамін, але значно менш активні. Основним чинником їхнього впливу на ЦНС є витіснення з синапсів природних медіаторів, зумовлюючи при цьому гальмівні процеси у головному мозку. Частина цих хибних медіаторів утворюється при мікробному гідролізі білка у кишечнику і не знешкоджується в печінці, частина утворюється під час перетворення амінокислот з ароматичним кільцем, кількість яких суттєво збільшена.
Розвиток ПЕ пов’язаний також із порушенням обміну g-оксимасляної кислоти (ГАМК) в ЦНС. Синтез ГАМК як основного гальмівного медіатора відбувається з глутамату за допомогою дегідрогенази у пресинаптичних терміналях. При печінковій недостатності в результаті зміни нормальної бродильної флори кишечника на гнилісну створюються умови для посиленого синтезу ГАМК кишковими бактеріями. Підвищена концентрація цього гальмівного медіатора досягає ЦНС і бере участь у поглибленні печінкової енцефалопатії. Існують дані, що на тлі печінкової недостатності відбувається накопичення ендогенних бензодіазепінів, збільшена концентрація яких також сприяє гальмівним процесам у ЦНС. Чинниками, що сприяють розвиткові ПЕ, є також алкалоз і гіпокаліємія [7].
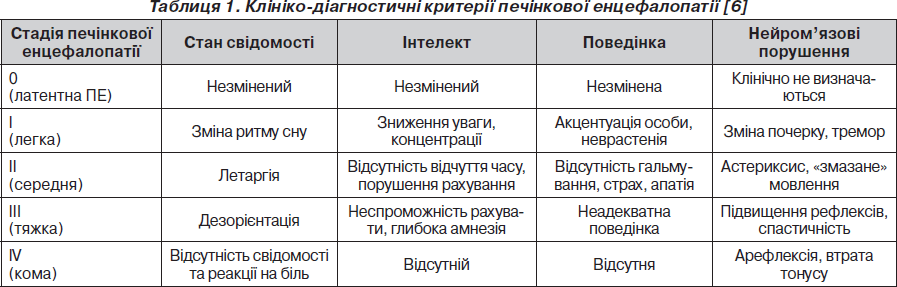
Клінічні прояви ПЕ умовно розподіляються на 5 стадій [1, 2, 8]. Нульова (латентна стадія ПЕ) клінічно не проявляється.
Перша стадія характеризується порушенням поведінки, сну, ейфорією, яка змінюється дратівливістю, некритичністю до тяжкості свого стану, внаслідок чого хворі часто можуть необґрунтовано наполягати на виписці зі стаціонару. Це пов’язане із залученням у процес лобних ділянок головного мозку. Підвищена активність хворих може змінюватися періодами апатії, фіксованим поглядом, зменшенням числа активних рухів. Порушення інтелекту характеризуються розладом оптико-просторової діяльності (порушення розпізнавання просторової фігури, неспроможність копіювання простих малюнків тощо).
Друга стадія характеризується переважанням гальмівних процесів: хворі увесь час сонливі, неадекватні, відповідають односкладно, відбувається інверсія циркадних ритмів. Як крайній прояв порушеної поведінки може бути справляння природних потреб у непередбачених місцях.
Третя стадія. Свідомість сплутана, ближче до сопору, дизартрія, виявляється комплекс загальномозкових, пірамідних та екстрапірамідних розладів, відмічається тризм, фібрилярні посмикування та судоми м’язів, нетримання сечі.
Четверта стадія (печінкова кома). Знепритомнення, обличчя маскоподібне, зникають реакції на больові подразники. Може реєструватися ригідність м’язів потилиці, кінцівок. У термінальній фазі зіниці розширюються, зникає реакція зіниць на світло, вгасають рефлекси.
Печінкова енцефалопатія залежно від перебігу токсичного гепатиту може розвиватися швидко або поступово. Прогноз при І і ІІ стадії ПЕ, як привило, сприятливий, при ІІІ та ІV — сумнівний.
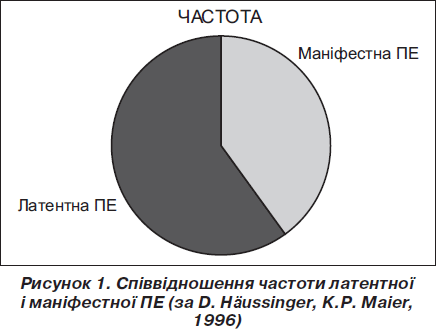
Діагностувати та лікувати ПЕ слід якомога раніше, тому не буде зайвим навести дані щодо співвідношення частоти латентної ПЕ і маніфестних стадій ПЕ. При латентній печінковій енцефалопатії можна досягти найбільшого ефекту лікування порівняно з терапією, розпочатою в пізніших стадіях.
Для зручності визначення стадій ПЕ наводимо узагальнені дані (табл. 1) [6].
Відомо, що ПЕ тісно пов’язана з іншими патофізіологічними змінами. Токсичному гепатиту при отруєнні аманітальними грибами передує токсичний гастроентерит/гастроентероколіт, при якому пацієнт зазнає серйозних розладів із боку волемічного та кислотно-основного стану, розвиток токсичного гепатиту відбувається на тлі порушень мікроциркуляції, гіпоксії, гемоконцентрації в паренхіматозних органах, насамперед у печінці та нирках, в кишечнику, міокарді тощо. Токсичне ураження печінки супроводжується цитолітичним синдромом, розладами вуглеводного, білкового та ліпідного обміну, значно знижується активність ферментів. Під час маніфестації отруєння значно підвищується катаболізм. Пацієнти з різних причин (токсичний гастроентерит/гастроентероколіт, ІІ–ІІІ стадії ПЕ тощо) не в змозі отримувати та засвоювати ентеральне харчування в необхідній кількості. Тому на тлі комплексного лікування токсичного гепатиту стає актуальним проведення парентерального харчування, зменшення амінокислотного дисбалансу, гіперамоніємії.
Зважаючи на те що препарат для парентерального харчування Гепасол НЕО 8% у хворих із патологією печінки, за даними літератури [3, 5], сприяє нормалізації амінокислотного складу, зменшує гіперамоніємію, ми вивчили його ефективність у хворих з отруєнням аманітальними грибами.
Препарат містить 15 амінокислот, із них: 8 незамінних, 2 умовно-замінні, 5 замінних. Амінокислоти (валін, ізолейцин, лейцин, лізин, метіонін, треонін, аланін, аргінін, гліцин, гістидин, пролін, серин, цистеїн, фенілаланін, триптофан) перебувають у L-формі, що забезпечує їхнє пряме включення до біосинтезу білка. Розчин не містить вуглеводів та електролітів. Аргінін виступає як субстрат у циклі синтезу сечовини та сприяє зменшенню гіперамоніємії. Аланін та пролін зменшують потреби організму в гліцині й опосередковано знижують кількість аміаку внаслідок того, що гліцин активно дезамінується з вивільненням іонів амонію. Наявність незамінних амінокислот з розгалуженим боковим ланцюжком (ізолейцин, лейцин, валін) не тільки сприяє усуненню енергетичного та пластичного дефіциту, але й перешкоджає утворенню та потраплянню до ЦНС ароматичних амінокислот, зменшуючи тим самим ступінь ПЕ. Енергетична цінність препарату Гепасол НЕО 8% становить 1344 кДж/л (320 ккал/л), теоретична осмолярність — 770 мОсм/л; pH 5,7–6,0. До переваг Гепасолу НЕО 8% слід віднести високий вміст аргініну (10,72 г/л), високу біологічну цінність (незамінні амінокислоти: 47,53 г/л, залишковий азот — 12,9 г/л, відповідно, коефіцієнт біологічної цінності дорівнює 3,68). Коефіцієнт Фішера становить 21,5. Внаслідок цього цей препарат містить залишковий азот у мінімальній кількості, не збільшує рівень аміаку в крові і показаний для лікування печінкової енцефалопатії.
Метою дослідження стало вивчення ефективності застосування препарату Гепасол НЕО 8% щодо частоти та ступеня тяжкості ПЕ у хворих з тяжким отруєнням аманітальними грибами.
Матеріали та методи
Нами проведено проспективне дослідження ефективності використання препарату Гепасол НЕО 8% у лікуванні хворих із синдромом печінкової енцефалопатії внаслідок токсичного гепатиту, зумовленого отруєнням аманітальними грибами. До дослідження були залучені 23 хворі з тяжким перебігом токсичного гепатиту внаслідок отруєння. 19 з них проходили лікування на базі Київського міського токсикологічного центру (Київська міська клінічна лікарня швидкої медичної допомоги), 4 — на базі ВІТ та екстракорпоральної детоксикації Київської обласної клінічної лікарні. Як критерії залучення до дослідження враховували наявність у пацієнтів токсичного гепатиту тяжкого ступеня з різними стадіями ПЕ, вік від 18 до 65 років, необтяженість супутніми декомпенсованими захворюваннями печінки, нирок, серцево-судинної системи. Контрольну групу склав 21 пацієнт, які відповідали таким же вимогам, як і хворі основної групи. Вони не отримували як препарат для парентерального харчування Гепасол НЕО 8%.
Базова терапія в обох групах включала інфузійну терапію від 40 до 80 мл/кг маси тіла за добу (кристалоїди, гідроксіетилкрохмалі, декстрани, свіжозаморожена одногрупна нативна плазма), засоби антидотної терапії: бензилпеніцилін, силібінін; гепатопротектори (a-тіоктова кислота), глюкокортикоїди (за потребою), препарати для нормалізації мікробного «пейзажу» кишечника (лактулоза), ситуаційна терапія (вітаміни, інгібітори фібринолізу тощо). Хворі контрольної групи отримували для забезпечення енергетичних потреб препарати парентерального харчування загального призначення, енергетична цінність яких була порівнянна з такою Гепасолу НЕО 8%. Хворі основної групи отримували Гепасол НЕО 8%. Препарат призначався залежно від стану хворих № 7–10 по 500 мл за добу зі швидкістю 1,0–1,25 мл/кг/г (30–35 крапель/хв = 0,08–0,1 г амінокислот/кг/год). Контроль стану пацієнтів проводився щоденно, відповідно до даних клінічного огляду, клінічних та біохімічних лабораторних показників. Оцінка наявності або відсутності латентної ПЕ не застосовувалася з причини необхідності використання психометричних тестів для її діагностики, що потребували активної участі хворих, стан яких внаслідок тяжкості не завжди дозволяв подібну співпрацю. Але була прийнята робоча гіпотеза, що передбачала наявність латентної ПЕ (при відсутності клінічних ознак ПЕ) у більшості пацієнтів із тяжким перебігом токсичного гепатиту, тому Гепасол НЕО 8% призначали відразу ж при виявленні токсичної гепатопатії, пов’язаної з отруєнням грибами (1-ша — 3-тя доба). Ступінь наявної ПЕ визначався згідно з вищенаведеними градаціями.
Отримані результати оцінювалися з використанням загальноприйнятих статистичних методів (застосовувалася програма Biostat).
Отримані результати та їх обговорення
Серед хворих основної (І група) та групи порівняння (ІІ) переважали чоловіки (61% в основній групі та 62% — у порівняльній). Вік хворих І та ІІ групи становив 33,26 ± 14,02 року й 33,22 ± 12,36 року відповідно; основний масив пацієнтів був працездатного віку.
Одна хвора основної групи та пацієнт контрольної групи померли до завершення дослідження. У першому випадку причиною смерті була велика доза отрути; у другому — пізнє звернення по медичну допомогу (4-та доба з моменту вживання грибів та 3-тя — з моменту початку клінічних проявів). Ще один хворий основної групи помер від пневмонії на 16-ту добу, коли результати дослідження вже були отримані.
Переважну кількість пацієнтів обох груп доставляли до стаціонару на 1-шу — 2-гу добу з моменту отруєння, і за часом госпіталізації потерпілих вірогідної різниці між групами не було.
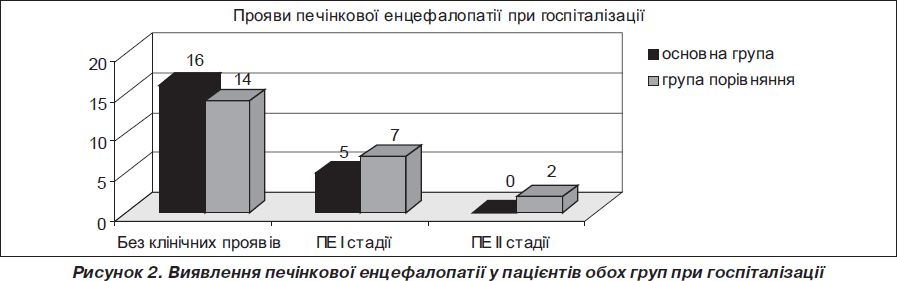
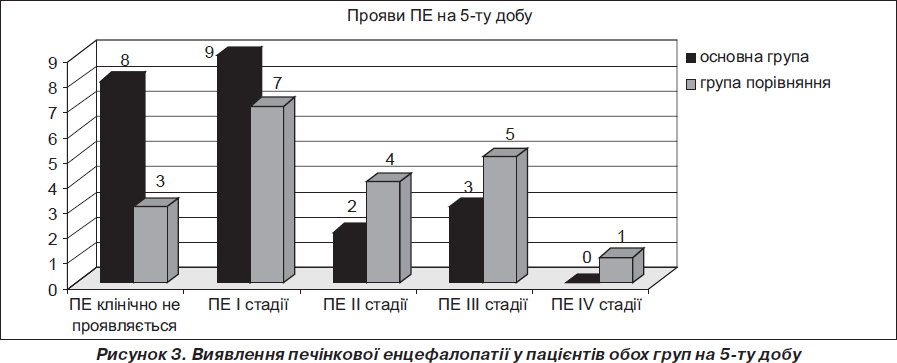
Отримані й наведені в графіках дані свідчать, що при приблизно однаковому початковому стані хворих в основній групі, пацієнтам якої призначався Гепасол НЕО 8%, глибина і тривалість ПЕ були помітно менші (рис. 2–4). Так, у 61 % хворих І (основної) групи і у 68,6 % хворих ІІ (контрольної) групи ПЕ клінічно не визначалася, хоча з великою ймовірністю в більшості з них мала місце латентна стадія печінкової енцефалопатії. Розбіжності за перебігом ПЕ у хворих, що досліджувалися, почали виявлятися при повторній оцінці їхнього стану на 5-ту добу. У першій групі кількість хворих без клінічних ознак ПЕ становила 36,4 % проти 15 % у другій групі; виявився більш тяжкий перебіг ПЕ у пацієнтів контрольної групи: ПЕ ІІ ст. реєструвалася у 20 % хворих (І група — 9,1%), ПЕ ІІІ ст. — у 25 % проти 13,6% в І групі. На 10-ту добу серед більшості хворих (77,3 %) І групи клінічно ПЕ не реєструвалася. У пацієнтів ІІ групи цей показник складав 55 %. Також на цей період в основній групі були відсутні хворі з найтяжчими (ІІІ–ІV) стадіями ПЕ. Таких пацієнтів у контрольній групі було 3.
Найбільша ефективність щодо попередження розвитку та лікування ПЕ при призначенні Гепасолу НЕО 8% відмічалася серед хворих з відсутністю клінічних ознак або з початковими стадіями печінкової енцефалопатії. Із 2 хворих основної групи, у яких при госпіталізації виявлялася ІІ ст. ПЕ, один помер під час дослідження, у іншого ПЕ поглибилася з поступовим подальшим регресом симптоматики. У той же час ті пацієнти, яким Гепасол НЕО 8% призначався з самого початку, у випадку відсутності клінічних проявів ПЕ були більш резистентні до цього ускладнення, у 36,6 % із них ПЕ, що клінічно проявляється, не виникала.
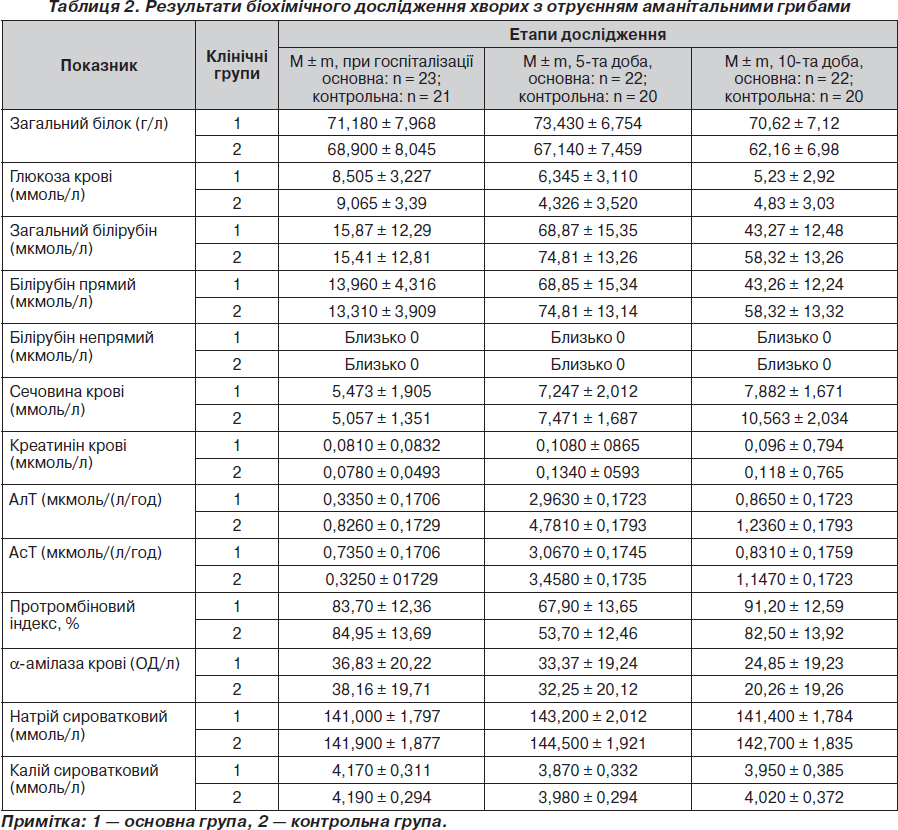
Досвід використання Гепасолу НЕО 8% показав його достатню дезінтоксикаційну дію. Аналіз біохімічних показників, що насамперед відображають функцію печінки, показав вірогідно кращі результати (р < 0,05) у контрольній групі на 5-ту добу і надалі. Динаміка загального білка, білірубіну, активності трансаміназ, протромбінового індексу була позитивною у хворих основної групи (табл. 2).
Окрім забезпечення описаного терапевтичного ефекту, Гепасол НЕО 8% виступає як компонент парентерального харчування, особливо в категорії хворих, які за певних обставин не в змозі приймати або засвоювати їжу природним шляхом.
Висновки
1. Отримані результати свідчать про ефективність Гепасолу НЕО 8%, особливо при ранньому використанні, щодо зменшення печінкової енцефалопатії у хворих із токсичним гепатитом унаслідок отруєння грибами.
2. Включення до комплексної терапії хворим на токсичний гепатит Гепасолу НЕО 8% сприяє реалізації дезінтоксикаційного, метаболічного та гепатопротекторного ефектів цього препарату.
1. Болезни печени и желчевыводящих путей: Руководство для врачей / Под ред. В.Т. Ивашкина. — 2-е изд. — М.: ООО «Изд. дом «М-Вести», 2005. — 536 с.
2. Губергриц Н.Б. Печеночная энцефалопатия: клиника, диагностика, лечение. Учебное пособие для врачей. — Донецк, 2008. — С. 29.
3. Звягинцева Т.Д., Глущенко С.В. Хронические заболевания печени: патогенетические подходы к лечению // Здоров’я України. — 2008. — № 17.
4. Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии. — М.: Медицина. 1984. — С. 356-357.
5. Кузьмінов В.Н., Юрченко М.П. Застосування препарату Гепасол НЕО в комплексному лікуванні та профілактиці гострого психоорганічного синдрому у хворих, які перенесли стан відміни алкоголю з делірієм // Здоров’я України. — 2009, жовтень. Тематичний номер.
6. Надинская М.Ю. Печеночная энцефалопатия // Болезни печени и желчевыводящих путей / Под ред. В.Т. Ивашкина. — М.: ООО «Изд. дом М-Вести», 2002. — С. 177-189.
7. Руководство по интенсивной терапии / Под ред. проф. А.И. Трещинского, проф. Ф.С. Глумчера, — К.: Вища шк., 2004. — 582 с.
8. Скрипник І.М., Мельник Т.В., Потяженко М.М. Клінічна гепатологія: Навчальний посібник. — Полтава: Дивосвіт, 2007. — 424 с.
9. Суворов А.В. Справочник по клинической токсикологии. — Нижний Новгород: Изд-во НМГА, 1996. — С. 137-139.
10. Olson K. Poisoning and drug overdose — New York: Applton and Lange, 1999. — P. 156-157.