Журнал «Медицина неотложных состояний» 4(35) 2011
Вернуться к номеру
Симпозиум: Тромбоэмболия легочной артерии и беременность
Авторы: Ребров Б.А. Луганский государственный медицинский университет
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького
Рекомендован: врачам скорой помощи, анестезиологам, реаниматологам, хирургам, терапевтам, семейным врачам, акушерам-гинекологам, кардиологам
Патофизиология ТЭЛА
Тромбоэмболия легочной артерии (ТЭЛА) — это острая закупорка ветвей легочной артерии (ЛА) эмболами, отделившимися от тромбов, образовавшихся в венах большого круга кровообращения.
ТЭЛА и глубокий венозный тромбоз (ГВТ) — два клинических проявления венозной тромбоэмболии (venous thromboembolism; ВТЭ). Большинство случаев ТЭЛА являются следствием ГВТ.
У 50 % больных с проксимальным ГВТ (выше колена) развивается ТЭЛА, часто бессимптомная и выявляемая при сканировании легких. С другой стороны, у 70 % больных с ТЭЛА обнаруживается ГВТ нижних конечностей.
Распространенность ТЭЛА у госпитализированных больных в США — 0,4 %. В год в США регистрируется от 600 тыс. до 2 млн случаев ТЭЛА. В целом, по данным американских и европейских наблюдений, число случаев прижизненного диагноза ТЭЛА колеблется от 6 до 53 на 100 000 населения в год. При этом повторные эпизоды ТЭЛА наблюдаются в 3 раза чаще после начальной ТЭЛА, чем после ГВТ (60 и 20 % соответственно). Острые случаи ТЭЛА оказываются фатальными в 7–11 % случаев. Однако об истинной распространенности ТЭЛА можно судить по данным патологоанатомических исследований. Так, по данным M. Nodstrom и B. Lindblant (Швеция, 1998), ВТЭ обнаруживалась в 25 % аутопсий, в том числе ТЭЛА — в 18 %. В 13,1 % случаев ТЭЛА была причиной смерти. В то же время диагноз ТЭЛА устанавливается при жизни всего лишь в 2 % случаев.
В Украине ТЭЛА является причиной 10 % летальных исходов в хирургических и ортопедических стационарах.
Риск ТЭЛА у беременных в 5 раз выше, чем в общей популяции. Летальная ТЭЛА встречается с частотой 0,3–1,2 на 1000 родов. Риск ТЭЛА выше в послеродовой период, частично после кесарева сечения. Очень часто ТЭЛА является следствием ГВТ, которые возникают во время беременности у 0,42 % женщин, а в послеродовом периоде — у 3,5 %. Частота случаев материнской смертности при этом осложнении составляет 0,1 на 10 000 родов при вагинальном родоразрешении и увеличивается соответственно до 1–1,6 при кесаревом сечении. ГВТ нижних конечностей и ТЭЛА нередко являются осложнениями гинекологических операций.
Патофизиология ТЭЛА включает в себя следующие эффекты:
1. Повышение легочной сосудистой резистентности вследствие обструкции сосудов или секреции тромбоцитами нейрогуморальных факторов, включая серотонин.
2. Нарушение газообмена вследствие увеличенного альвеолярного мертвого пространства из-за сосудистой обструкции, гипоксемии из-за альвеолярной гиповентиляции относительно перфузии в интактном легком, шунтирования крови справа налево и нарушения переноса окиси углерода из-за уменьшения дыхательной поверхности.
3. Альвеолярная гипервентиляция вследствие рефлекторной стимуляции ирритативных рецепторов.
4. Повышение резистентности дыхательных путей вследствие констрикции дыхательных путей дистальнее главных бронхов.
5. Уменьшение подвижности легких вследствие отека, кровоизлияний в легкие и потери сурфактанта.
Клинические проявления ТЭЛА появляются при окклюзии > 30–50 % артериального русла. Но даже небольшой тромб, касающийся сосудистой стенки в зоне малого круга кровообращения, рефлекторно вызывает спазм сосудов малого круга и резкое повышение давления в нем.
Нетромботический легочный эмболизм редок и имеет другие патофизиологические следствия и клиническую характеристику.
Основные следствия ТЭЛА гемодинамические. Большие и/или множественные эмболы могут внезапно повышать легочную сосудистую резистентность до уровня постнагрузки, которая не может быть шунтирована через правый желудочек (ПЖ). Случаи смерти обычно констатируются в виде электромеханической диссоциации.
У больных, выживших после острого эпизода эмболии, несмотря на ПЖ-недостаточность, системные сенсоры активируют симпатоадреналовую систему. Происходит инотропная и хронотропная стимуляция, включается механизм Франка — Старлинга и повышается давление в ЛА, что ведет к сохранению легочного тока покоя, левожелудочкового заполнения и выброса. Вместе с системной вазоконстрикцией это может стабилизировать и системное АД. Однако неподготовленный и тонкостенный ПЖ не может создавать среднее давление в ЛА более 40 мм рт.ст.
Вторичная гемодинамическая дестабилизация случается обычно в течение 24–48 часов как результат ухудшения функции ПЖ и/или повторной эмболии. Даже в отсутствие повторной эмболизации ПЖ не в состоянии длительно поддерживать повышенную функцию при симпатоадреналовой стимуляции. При этом наблюдается ухудшение коронарной перфузии кислорода ПЖ, что ведет к его ишемии.
Развитие дыхательной недостаточности в основном определяется степенью гемодинамических расстройств. Различные факторы могут приводить к гипоксии во время ТЭЛА. Низкий сердечный выброс ведет к десатурации смешанной венозной крови, попадающей в легочную циркуляцию. Зоны сниженного кровотока и повышенного кровотока в неповрежденных сосудах приводят к нарушению перфузии и гипоксемии.
Малые и дистальные эмболы часто не влияют на гемодинамику, однако приводят к локальным альвеолярным кровоизлияниям, кровохарканью, плевриту, обычно с небольшим плевральным выпотом, при этом эффект на газообмен, как правило, небольшой, за исключением случаев у больных с предшествующими сердечно-сосудистыми заболеваниями.
В 10–25 % случаев ТЭЛА развивается инфаркт легкого.
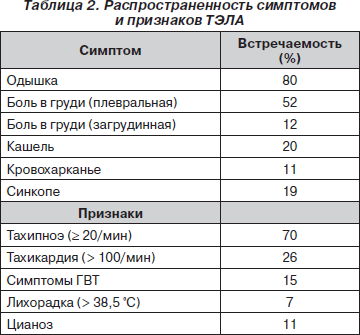
Тяжесть ТЭЛА. ТЭЛА стратифицируется по риску ранней смерти (внутригоспитальная или 30-дневная смертность) на основании маркеров риска, определяемых клинически, при помощи эхокардиографии (ЭхоКГ), компьютерной томографии (КТ) или лабораторно:
1. Клинические — шок, гипотензия (систолическое АД < 90 мм рт.ст. или снижение і 40 мм рт.ст. за 15 мин, если не возникла аритмия, гиповолемия или сепсис).
2. ПЖ-дисфункция:
— ПЖ-дилатация, гипокинезия или перегрузка давлением на ЭхоКГ и/или КТ;
— повышение BNP (brain natriuretic peptide; натрийуретический пептид) или NT-proBNP (N-terminal proBNP);
— повышение давления в ПЖ при катетеризации.
3. Повреждения миокарда — повышение уровней сердечных тропонинов Т и I.
Маркеры риска используют для стратификации ТЭЛА с целью подбора соответствующей тактики диагностики и лечения (табл. 1).
Риск ТЭЛА у беременных возрастает:
— при наличии антифосфолипидных антител (АФС-синдром);
— развитии преэклампсии/эклампсии;
— послеродовой супрессии лактации;
— послекесаревом тромбоцитозе;
— кровотечении/анемии;
— гемотрансфузиях;
— возрасте беременной старше 35 лет.
Клинические проявления ТЭЛА многообразны и не всегда четко очерчены. В 5–10 % клинической презентацией ТЭЛА является гипотензия, в половине из этих случаев развивается шок с признаками правожелудочковой недостаточности. Появление «клиники» приводит к смерти в течение первого часа в 10 % случаев. Без приема антикоагулянтов у 50 % больных развивается повторный тромбоз в течение 3 месяцев.
В 90 % случаев предположение о ТЭЛА основывается на клинических симптомах (табл. 2). Одышка обычно появляется внезапно, может быть изолированной, но случается, что прогрессирует в течение недели и более. Синкопе (обморок, потеря сознания) — не частый, но важный начальный признак ТЭЛА, показывающий тяжелое снижение гемодинамического резерва. Плевральная боль в груди в сочетании или без одышки является наиболее частым клиническим проявлением ТЭЛА. Боль чаще связана с дистальными эмболами и плевральной реакцией на инфаркт легкого, иногда сочетается с кровохарканьем. Возможно развитие цианоза верхней части туловища, появление акцента II тона на легочной артерии и разнокалиберных хрипов в легких при аускультации. При небольшой ТЭЛА больные отмечают появление дискомфорта в груди при кашле и глубоком дыхании, беспокойство, головокружение.
Изолированная, остро возникшая одышка в сочетании с острыми нарушениями гемодинамики характерна для центральной ТЭЛА. Однако при центральной ТЭЛА возможна и загрудинная боль, напоминающая инфаркт миокарда, она может быть также следствием ишемии ПЖ. В постановке диагноза помогает анализ предрасполагающих факторов.
Клинические проявления ТЭЛА у беременных существенно не отличаются от таковых у небеременных. Однако при беременности часто наблюдается одышка, и этот симптом должен рассматриваться с осторожностью, особенно если она изолированная, не тяжелая и не остро возникшая. РаО2 нормальное в течение беременности, однако артериальная кровь должна быть взята в вертикальной позиции, так как в горизонтальной может быть ниже в периоде III триместра.
Диагностика. Воздействие на плод ионизирующей радиации при диагностических исследованиях вызывает беспокойство при диагностике ТЭЛА у беременных и врачей. Однако это несущественно по сравнению с опасностью пропустить фатальный диагноз. Неправильный диагноз может привести и к назначению большого количества медикаментов, опасных для плода.
Расчетная доза радиации, поглощаемая плодом при выполнении диагностических процедур при ТЭЛА, представлена в табл. 3.
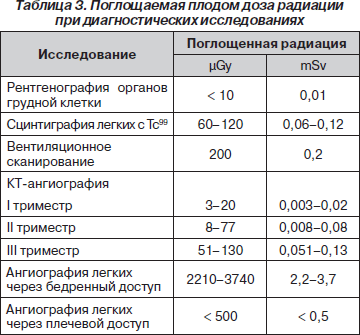
Верхняя граница, считающаяся опасной для плода, составляет 50 mSv (50 000 μGy). Все радиологические тесты, необходимые для диагностики ТЭЛА, находятся ниже этой границы, поэтому рекомендуемая для диагностики ТЭЛА у беременных КТ является возможным и удобным методом исследования в любом триместре.
В то же время замена на МРТ (при ее доступности) является адекватной и не имеет лучевой нагрузки.
Рентгенография — патологическая, но, как правило, неспецифическая:
а) высокое и малоподвижное стояние купола диафрагмы;
б) дископодобные ателектазы;
в) расширение тени верхней полой вены;
г) выбухание второй дуги по левому контуру сердечной тени;
д) инфильтраты легочной ткани (зоны инфарктов легкого).
Рентгенография часто позволяет исключить другие причины одышки или боли в груди.
Определение парциального давления газов в крови — ТЭЛА в 80 % случаев ассоциируется с гипооксигенацией крови (снижение РаО2).
ЭКГ — определяются признаки перегрузки ПЖ: инверсия Т в V1–V4, QR в V1, классический — углубление SI,QIII,TIII, а также неполная или полная блокада правой ножки пучка Гиса, особенно ценная для диагностики, как впервые возникшая. Характерна синусовая тахикардия, возможна впервые возникшая фибрилляция предсердий, часто угол a > 90°.
D-димер — продукт деградации фибрина, он повышается в плазме в присутствии острого тромба вследствие стимуляции свертывания и фибринолиза.
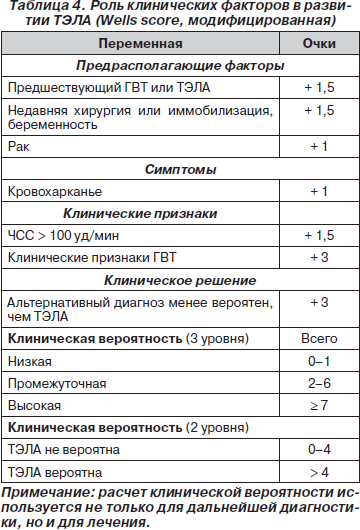
Нормальный уровень D-димера делает диагноз ТЭЛА или ГВТ маловероятным, а в сочетании с клиническими данными (шкала Wells, табл. 4) позволяет полностью исключить ВТЭ.
Однако повышенный уровень не подтверждает ТЭЛА, так как фибрин продуцируется при множестве других состояний (рак, воспаление, инфекции, некроз и т.д.). Специфичность теста снижается у пожилых и в сроки > 3 дней после тромбоза. В целом специфичность для ТЭЛА составляет 40–50 %.
Норма D-димера (верхняя граница) при определении иммуноферментным методом (ELISA) — 500 нг/мл, однако может различаться у разных производителей наборов (250, 300). При определении калориметрическим методом или латекс-тест — > 0,5 мг/л (500 мкг/л).
Определение уровня D-димера у беременных с подозрением на ТЭЛА является хорошим диагностическим подспорьем. Хотя его величина физиологически повышается при беременности, нормальный уровень исключает ТЭЛА.
Спиральная КТ-ангиография легочной артерии в сочетании с в/в введением контраста (обычно 100 мл в локтевую вену — 3–4 мл/с).
Диагностическая ценность во многом зависит от применяемой техники. При однодетекторном томографе составляет 53 % и специфичность 73 %, а при мультидетекторной технике (с контрастированием) чувствительность и специфичность повышаются до 100 % и позволяют видеть тромбы в ЛА на субсегментарном уровне.
На сегодня мультидетекторная КТ — стандарт диагностики ТЭЛА.
Магнитно-резонансная томография (с контрастным усилением) уступает по диагностической ценности мультидетекторной КТ и сопоставима с монодетекторной. Однако может быть использована при непереносимости йодосодержащих контрастов (используется гадолин) и почечной недостаточности. Может быть использована у беременных, так как не имеет лучевой нагрузки.
Легочная ангиография. Используется с 1960 года. Прямая легочная ангиография позволяет определять тромбы размером 1–2 мм в субсегментарных артериях, непрямые признаки ТЭЛА, такие, как замедление тока контраста, региональная гипоперфузия, прекращение венозного тока и др. В/в введение контраста представляет некоторую опасность, при этом смертность составляет 0,2 %. Ранее считалась золотым стандартом диагностики ТЭЛА, но в последнее время начинает отступать перед мульти-КТ, которая дает такую же информацию, но не вызывает осложнений. Этот надежный, но инвазивный, дорогой и иногда трудный для интерпретации тест может использоваться при сомнительных результатах КТ.
ЭхоКГ. Дилатация ПЖ определяется у > 25 % больных с ТЭЛА и используется для стратификации риска. Эхо-критерии, используемые для диагностики ТЭЛА: трикуспидальная недостаточность, скорость выброса и размеры ПЖ. Чувствительность 60–92 %, специфичность 78–92 %. Негативный тест не исключает ТЭЛА, так как эхо-критерии могут быть и при других заболеваниях сердца и легких. У больных с подозрением на ТЭЛА в критических состояниях помогает вести больных.
У больных с шоком или гипотензией отсутствие эхокардиографических признаков перегрузки ПЖ или его дисфункции исключает ТЭЛА.
Основные эхо-допплер-критерии:
А. Критерии перегрузки ПЖ:
1. Правосторонний сердечный тромбоз.
2. ПЖ диастолическое изменение (парастернальный вид) > 30 мм или ПЖ/ЛЖ > 1.
3. Систолический флаттеринг межжелудочковой перегородки.
4. Время ускорения < 90 мс или трикуспидальная недостаточность с градиентом давления Ј 60 мм рт.ст. при отсутствии ПЖ-гипертрофии.
В. Признак «60/60»: ускорение времени ПЖ-выброса < 60 мс при наличии трикуспидальной недостаточности и градиента давления Ј 60 мм рт.ст.
С. Признак McConnel: нормокинезия и/или гипокинезия апикального сегмента свободной стенки ПЖ, несмотря на гипокинезию и/или акинезию остальной свободной стенки ПЖ.
Сопутствующие ЭхоКГ-признаки перегрузки давлением требуют исключения ложного диагноза острой ТЭЛА у больных с гипокинезией и/или акинезией свободной стенки ПЖ, соответствующей инфаркту ПЖ.
Клиническая классификация ТЭЛА (МКБ-10 — I26.-)
А. По остроте развития патологического процесса:
— острая;
— подострая;
— хроническая (рецидивирующая).
Б. По объему поражения сосудов:
— массивная (сопровождается шоком/гипотензией);
— субмассивная (сопровождается дисфункцией правого желудочка без гипотензии);
— немассивная (нет гемодинамических нарушений или признаков правожелудочковой недостаточности).
В. По наличию осложнений:
— с развитием инфаркта легкого (I26.-);
— с развитием легочного сердца (I26.0);
— без упоминания об остром легочном сердце (I26.9).
Г. По этиологии:
— связанная с глубоким венозным тромбозом;
— амниотическая, связанная с абортом (O03-O07), внематочной или молярной беременностью (O00-O07, O08.2), беременностью и родами (O88.-);
— идиопатическая (без установленной причины).
Диагностическая стратегия
Современная диагностическая стратегия основана на разделении больных на две категории в зависимости от риска ранней смерти при ТЭЛА: с высоким риском и с невысоким риском (табл. 1). При установлении высокого риска ESC-2008 предлагает соответствующий диагностический алгоритм (рис. 1).

Диагностика ТЭЛА при наличии признаков, свидетельствующих о высокой вероятности, особенно в сочетании с шоком или гипотензией, основана на использовании мультидетекторной КТ. Следует отметить, что, несмотря на клиническую необходимость безотлагательного проведения КТ, это не всегда возможно обсуждать ввиду тяжести состояния больного (невозможность транспортировки). В таких случаях необходимо немедленное проведение ЭхоКГ у постели больного. При обнаружении признаков перегрузки ПЖ и невозможности проведения КТ больного следует вести как с диагностированной ТЭЛА. При отрицательных результатах КТ врачу следует искать другие причины, вызвавшие шоковое состояние.
Основным лечебным мероприятием у больных с высоким риском ранней смерти при ТЭЛА является тромболизис.
При установлении невысокого риска проводится оценка клинической вероятности ТЭЛА с использованием анализа симптомов и предрасполагающих факторов. Для этого существует несколько различных таблиц, наиболее распространенные — Geneva score и Wells score (табл. 4).
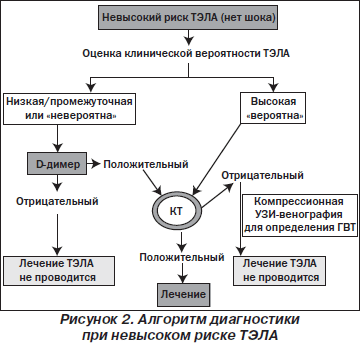
При установлении невысокого риска ESC-2008 предлагается диагностический алгоритм, учитывающий двух- и трехуровневую клиническую вероятность (рис. 2). При невысоком риске, но высокой клинической вероятности диагностическая стратегия основана на КТ. При отрицательном результате КТ проводится компрессионная ультрасонографическая венография для определения ГВТ. При низкой или промежуточной клинической вероятности наиболее целесообразным считается определение уровня D-димера, а при его повышенном уровне — КТ. При нормальном уровне D-димера и отрицательных результатах КТ лечение не проводится.
Дифференциальную диагностику ТЭЛА проводят:
— с острым коронарным синдромом (включая инфаркт миокарда и нестабильную стенокардию);
— пневмонией, бронхитом, обострением бронхиальной астмы или ХОЗЛ;
— сердечной недостаточностью;
— перикардитом;
— плевритом;
— заболеваниями костно-мышечного аппарата;
— первичной легочной гипертензией;
— психическими тревожными синдромами.
Лечение ТЭЛА у беременных
При предполагаемой или установленной ТЭЛА с наличием шока или гипотензии необходима немедленная гемодинамическая и дыхательная поддержка. Острая ПЖ-недостаточность с низким системным выбросом ведет к смерти больных.
Больные с массивной и субмассивной ТЭЛА должны быть госпитализированы в отделение (палату) интенсивной терапии.
У больных с ТЭЛА и сниженным сердечным выбросом, артериальной гипотонией или шоком используют в основном негликозидные средства с положительным инотропным действием, вазопрессоры (добутамин, допамин, норадреналин и др.) и введение плазмозаменителей.
1. Использование кровезаменителей является необходимым условием при шоке или гипотензии. Довольно быстрое (» 20 мл/мин) внутривенное введение, как правило, Ј 500 мл плазмозаменителя (реополиглюкин, изотонический раствор хлорида натрия и др.) может увеличить сердечный индекс с 1,6 до 2,0 л/мин/м2, преимущественно у больных с нормальным давлением. Однако агрессивная нагрузка объемом при ТЭЛА может ухудшить ПЖ-функцию вследствие увеличения преднагрузки и усугубить гемодинамические расстройства, поэтому введение жидкости больным с ТЭЛА необходимо под контролем сердечного индекса (СИ).
2. Инотропная поддержка также необходима при тяжелой ТЭЛА. При этом ESC (2008) считает возможным использование следующих препаратов:
— добутамин и допамин — основные препараты, использующиеся для инотропной поддержки при ТЭЛА. Повышают сердечный выброс и улучшают транспорт О2 и оксигенацию тканей при устойчивом артериальном РаО2. Показаны при ТЭЛА с низким сердечным выбросом и умеренной гипотонией. Могут быть использованы как самостоятельно, так и в сочетании 1 : 1 в/в капельно.
Использование добутамина/допамина может обсуждаться при низком СИ и нормальном АД. Однако повышение СИ выше физиологической нормы может усиливать вентиляционно-перфузионные несоответствия при дальнейшем перераспределении кровотока для подвергшихся обструкции (частично) и необструктированных сосудов.
Добутамин — в/в инфузия 5–20 мкг/кг/мин, допамин — в/в инфузия 5–30 мкг/кг/мин;
— норадреналин — используется ограниченно у гипотензивных больных. Улучшает функцию ПЖ через прямой положительный инотропный эффект, коронарную перфузию ПЖ через стимуляцию периферических сосудистых a-адренорецепторов и повышение системного АД. Введение норадреналина (2– 30 мкг/мин в/в капельно) показано только при массивной ТЭЛА со значительным снижением АД (систолическое АД < 70 мм рт.ст.);
— адреналин — соединяет положительные свойства норадреналина и добутамина при отсутствии системной вазодилатации. У больных с ТЭЛА может давать положительный эффект;
— изопротеринол — кроме инотропного действия индуцирует легочную вазодилатацию, но этот положительный эффект часто нивелируется периферической вазодилатацией.
3. Вазодилататоры — снижают давление в ЛА и легочную сосудистую резистентность. Однако при развитии острой правожелудочковой недостаточности (набухание шейных вен, увеличение печени, дилатация ПЖ по данным ЭхоКГ и др.) применение вазодилататоров (нитраты, нитропруссид натрия и т.д.) и диуретиков противопоказано, потому что они, уменьшая преднагрузку и сердечный выброс, могут привести к тяжелой системной гипотензии.
Преодолеть это ограничение позволяет ингаляционное введение. Есть некоторые данные об эффективности аэрозольного введения простациклина в лечении легочной гипертензии, вторичной по отношению к ТЭЛА. Ингаляции оксида азота улучшают гемодинамику и обмен газов у больных с ТЭЛА.
Использование левосимендана (симдакс) при беременности противопоказано.
Повышается интерес к использованию антагонистов эндотелина и ингибиторов фосфодиэстеразы-5 при ТЭЛА, ослабляющих выраженность легочной гипертензии при ТЭЛА. Использование силденафила уменьшает повышение давления в ЛА. Однако в Украине на сегодняшний день зарегистрирована только пероральная форма препарата, хорошо зарекомендовавшая себя при хронической легочной гипертензии, но не позволяющая эффективно использовать препарат при шоке.
4. Коррекция гипоксемии и гипокапнии часто требуется у больных с ТЭЛА, хотя в большинстве случаев эти изменения средней тяжести. Гипоксемия обычно устраняется назальным введением кислорода и редко ИВЛ. Потребление кислорода должно быть минимизировано мероприятиями, снижающими лихорадку и ажитацию, и ИВЛ при повышенной ЧДД. При проведении ИВЛ необходимо ограничивать ее побочный гемодинамический эффект. В частности, положительное интраторакальное давление, индуцированное ИВЛ, может уменьшать венозный возврат и ухудшать ПЖ-недостаточность у больных с массивной ТЭЛА. Поэтому может быть применено положительное давление на выдохе (end-expiratory). Низкий дыхательный объем (» 6 мл/кг веса) может быть использован для достижения на вдохе (end-inspiratory) плато давления ниже 30 см Н2О.
5. Обезболивание — адекватная анальгетическая терапия (с использованием фентанила, морфина, промедола) устраняет/предупреждает развитие рефлекторного болевого шока, уменьшает страх и возбуждение, улучшает адаптацию больного к гипоксии.
6. Антикоагулянтная терапия (АКТ) играет главную роль в ведении больных с ТЭЛА с 1960 г., когда D.W. Barrit и S.C. Jordan доказали необходимость использования АКТ в профилактике смерти и повторных случаев.
Лечение ТЭЛА при беременности основано на использовании нефракционированного гепарина, который может назначаться в течение всей беременности.
НМГ практически не проходит через плаценту и находится в грудном молоке в незначительных количествах, однако по нему так же, как и по фондапаринуксу, нет достаточных данных о безопасности применения при беременности, поэтому ESC (2008) их не рекомендует.
Режим назначения в/в гепарина основан на величине АЧТВ, которое должно быть определено через 4–6 ч после начального болюсного введения и затем через 3 ч после каждого изменения дозы или ежедневно после достижения целевой дозы. Как правило, в/в введение гепарина начинается с болюсного введения 80 Ед/кг, с дальнейшей инфузией 18 Ед/кг/ч, с изменением режима введения в зависимости от АЧТВ (табл. 5).
Парентеральная АКТ назначается на 10–14 дней. Целевым уровнем антикоагуляции является достижение уровня международного нормализационного отношения (МНО; INR) в диапазоне 2,0–3,0.
Эпидуральная анестезия при родах может быть использована после прекращения введения гепарина через 12 ч. Лечение гепарином возобновляется через 12–24 ч после удаления эпидурального катетера.
7. Тромболитическая терапия — быстро рассасывает тромболитическую обструкцию и оказывает положительный эффект на параметры гемодинамики. В 80 % увеличивается сердечный индекс и в 40 % снижается давление в ЛА через 72 часа после проведения лечения стрептокиназой.
Утвержденные ESC (2008) тромболитические режимы при ТЭЛА: стрептокиназа (стрептаза, эберкиназа) — 250 000 МЕ как нагрузочная доза в течение 30 мин, затем 100 000 МЕ/ч — 12–24 ч. Ускоренный режим — 1,5 млн МЕ за 2 ч.
Тромболитическая терапия у беременных назначается только при массивной ТЭЛА (высокий риск, табл. 1). Важным условием для проведения тромболизиса у беременных является КТ-подтверждение ТЭЛА.
Среди известных тромболитиков данные при беременности имеются пока только по стрептокиназе. Она не проходит через плаценту, и риск для плода минимален. Однако у 8 % беременных возникают кровотечения, обычно из генитального тракта.
В целом 92 % больных ТЭЛА классифицируются как нуждающиеся в тромболизисе в первые 36 ч. Большая польза отмечается до 48 часов, далее эффективность быстро снижается, но тромболизис может быть проведен у больных с ТЭЛА в течение 6–14 дней. Проведение тромболизиса через неделю после эпизода приводит к улучшению, но различия в эффективности с гепарином оказываются несущественными. При проведении тромболизиса необходимо учитывать противопоказания.
Противопоказания к фибринолитической терапии у беременных:
1. Геморрагический (или неизвестного происхождения) инсульт в анамнезе.
2. Ишемический инсульт в предшествующие 6 мес.
3. Недавняя большая травма/хирургия/повреждение головы (3 нед.).
4. ЖКТ-кровотечения в течение 1 мес.
5. Другие известные кровотечения.
При возникновении ТЭЛА во время родов предпочтительна хирургическая тромбэктомия, и только если она невозможна, то проводится тромболизис с использованием стрептокиназы.
8. Хирургическая легочная эмболэктомия полезна у больных с абсолютными противопоказаниями к тромболизису или в случае его неэффективности. Несмотря на высокую эффективность тромболитической терапии, важно отметить, что 30–40 % больных с ТЭЛА имеют относительные противопоказания, а у 20 % развиваются различные кровотечения, причем у 3 % внутримозговые.
9. Чрескожная катетерная эмболэктомия и фрагментация выполняются при наличии проксимальных тромбов ЛА как альтернатива хирургическому лечению. Операция проводится только на крупных сосудах (главный и долевые), а не на сегментарных легочных артериях.
10. Относительно компрессионных повязок нет достоверных данных при ТЭЛА, но при ГВТ ношение эластических чулок уменьшает число новых случаев ТЭЛА с достоверными различиями после 2 лет. При постановке диагноза ГВТ ношение эластических чулок в течение 1 года уменьшает число повторных случаев проксимального ГВТ.
Лечебная стратегия при массивной ТЭЛА (высокий риск)
АКТ гепарином должна быть начата без промедления.
Тромболитическая терапия должна быть использована немедленно у больных с кардиогенным шоком и/или артериальной гипотензией.
Системная гипотензия должна быть корригирована для предупреждения прогрессирования ПЖ-недостаточности и смерти.
У гипотензивных больных используются вазопрессорные агенты.
Хирургическая легочная эмболэктомия рекомендуется как лечебная альтернатива во время родов, у больных с абсолютными противопоказаниями к тромболизису либо при его неэффективности.
Кислород должен быть назначен больным с гипоксемией.
Добутамин и допамин могут использоваться у больных с ТЭЛА при нормальном АД и низком сердечном выброса.
Катетерная эмболэктомия или фрагментация тромбов проксимальной ЛА может проводиться как альтернатива хирургическому лечению у больных с абсолютными противопоказаниями к тромболизису либо при его неэффективности.
Агрессивная нагрузка жидкостью не рекомендуется.
Возникновение ТЭЛА в I триместре является показанием к прерыванию беременности.
При массивной ТЭЛА во II и III триместрах показано срочное родоразрешение. Выбор метода родоразрешения зависит от состояния родовых путей.
При промежуточном риске ТЭЛА возможно пролонгирование беременности с проведением длительной антикоагуляции и вторичной профилактики.
Длительная антикоагуляция и вторичная профилактика
Долговременная АКТ больных с ТЭЛА предназначена для предупреждения фатальных и нефатальных повторных случаев ВТЭ.
Длительность профилактики ТЭЛА зависит от ее риска (табл. 1). При умеренном (промежуточном) риске тромбопрофилактика продолжается 6–8 нед., при высоком риске (особенно при ТЭЛА в анамнезе) — 3 месяца.
Как средство долговременной АКТ у беременных используют гепарин. Дозирование гепарина в соответствии с рекомендациями МЗ Украины (приказ № 329 от 15.06.2007) для профилактики ВТЭ: умеренный риск — 5000 ЕД 2 р/сут п/к; высокий риск — 5000 ЕД 3 р/сут п/к.
Резкая отмена АКТ приводит к увеличению риска ВТЭ. При увеличении АЧТВ в 2 раза, появлении геморрагий и тромбоцитопении доза антикоагулянта уменьшается либо увеличивается интервал между введениями (на 2 ч).
Варфарин проходит через плаценту и ассоциируется с эмбриопатиями в I триместре. Является антикоагулянтом выбора при беременности у женщин с протезами клапанов во время II и III триместров беременности до 36 недель гестации в дозе менее 5 мг/сут. (EAC, 2007). Однако следует взвешенно подходить к его назначению, учитывая наличие некоторых работ, указывающих на развитие внутриутробных кровотечений и аномалий ЦНС у плода.
После родов, сопровождавшихся ТЭЛА, или при наличии ГВТ АКТ назначается не менее 3 мес. и гепарин может заменяться на антагонисты витамина К (варфарин). Варфарин в незначительных количествах проникает в грудное молоко и не вызывает кровотечений у грудных детей, однако рекомендуется воздержаться от кормления в первые 3 дня от начала лечения.
Целевым уровнем АКТ является достижение уровня международного нормализационного отношения (МНО; INR) » 2,5 (2,0–3,0). Статистически достоверное уменьшение числа рецидивов ТЭЛА отмечается через 4–6 недель лечения, поэтому длительность лечения не может быть менее 4–9 нед. Прекращение лечения ведет к возврату риска ТЭЛА. Отрицательное определение D-димера через 1 мес. после прекращения лечения варфарином свидетельствует о сохранении и положительном эффекте лечения.
Варфаринат натрия (варфарин) — табл. по 1,0; 2,5; 3,0; 5,0 мг внутрь 1 р/сут.
Следует помнить об усилении действия варфарина в сочетании с другими препаратами, и в частности с нестероидными противовоспалительными, антибактериальными, этиловым спиртом и др. Неудобство для больных составляет регулярное определение МНО. При проведении долговременной АКТ возрастает риск кровотечений.
В настоящее время идут исследования по перспективным антикоагулянтам, пероральным ингибиторам фактора Ха (ривароксабан и апиксабан).
Кроме назначения антикоагулянтов возможно использование механических методов профилактики ВТЭ, в частности компрессионных чулок. Важным методом профилактики ВТЭ является ранняя мобилизация больных после операций.
Венозные фильтры. Установка в нижнюю полую вену фильтра как метод профилактики ТЭЛА была впервые предложенна Trousseau в 1868 году. Но венозные фильтры стали доступны лишь после 1960 года, когда стала возможна чрескожная техника их установки. Обычно фильтры располагаются в инфраренальной части нижней полой вены (кава-фильтры).
Кава-фильтры подразделяются на временные (на период родов, операции, курса тромболитиков) и постоянные (при венозном тромбозе с опасностью отрыва тромбов). Оторвавшийся тромб в этом случае не попадает в сердце, а задерживается фильтром. В Украине наиболее часто используются кава-фильтры «Осот».
Венозные фильтры особенно рекомендуются:
— при абсолютных противопоказаниях к длительной АКТ и высоком риске повторной ВТЭ;
— установленном проксимальном ГВТ;
— планируемой операции с высоким риском кровотечения;
— повторных ВТЭ, несмотря на проводимую антикоагуляцию.
Венозные фильтры у беременных устанавливаются по общим показаниям.
Постоянные фильтры способствуют пожизненной профилактике ТЭЛА, однако они ассоциируются с осложнениями, включающими возвратный ГВТ и развитие посттромботического синдрома. Возможные осложнения:
— ранние — вставочный тромбоз — 10 % больных;
— поздние — возвратный ГВТ — 20 %, посттромботический синдром — 40 %.
В целом окклюзия нижней полой вены (полная или частичная) развивается у 22 % больных в течение 5 лет, у 33 % — в течение 9 лет, в зависимости от использования и длительности АКТ.
Рутинная установка фильтров больным с ТЭЛА не рекомендуется.
Заключение
Для предупреждения ТЭЛА (ВТЭ) у лиц с повышенным риском рекомендуется:
— повышение двигательной активности;
— борьба с ожирением;
— предупреждение ГВТ по время путешествий: пить дополнительную жидкость, периодически двигаться, использовать компрессионные чулки, исключить алкоголь;
— сократить/прекратить курение;
— строго контролировать АД;
— при отягощенном семейном анамнезе контролировать свертываемость и D-димер;
— проводить профилактическое лечение при травмах и операциях;
— при планируемой беременности рассмотреть факторы риска ВТЭ и при необходимости своевременно начать профилактику;
— обсудить целесообразность заместительной гормональной терапии.
Для лечения ТЭЛА (ВТЭ) рекомендуется:
1. Для инициирующего лечения беременных с ГВТ предпочтительно использовать нефракционированный гепарин.
2. Оптимальным препаратом для длительной антикоагулянтной терапии в послеродовом периоде является варфарин.
3. АКТ должна проводиться 3–6 мес. при наличии факторов риска ВТЭ.
4. После эпизодов ВТЭ антикоагулянтная терапия должна проводиться не менее 1 года для предупреждения повторных случаев.
5. Ношение эластических чулок в течение 1 года после установления проксимального ГВТ.
1. Компендиум 2008 — лекарственные препараты [Текст] / Под ред. В.Н. Коваленко, А.П. Викторова. — К.: МОРИОН, 2008. — 2270 с.
2. Мостовой Ю.М., Константинович Т.В. Тромбоэмболия легочной артерии: диагностическая и лечебная тактика. Взгляд терапевта / Ю.М. Мостовой, Т.В. Константинович [Электронный ресурс] // Здоровье Украины. — 2006. — № 2. — http://urgent.health-ua.com/article/27.html
3. Наказ МОЗ України № 329 від 15.06.2007 р. Про затвердження клінічних протоколів надання медичної допомоги з профі-
лактики тромботичних ускладнень в хірургії, ортопедії і травматології, акушерстві та гінекології. — К.: МОЗ, 2007. — 11 с.
4. Пархоменко А.Н. Тромбоэмболия легочной артерии и инертность мышления врача / А.Н. Пархоменко [Текст] // Здоровье Украины. — 2007. — № 7. — С. 14-15.
5. Сенчук А.Я., Иваненко С.В. Тромбоэмболия легочных артерий в акушерско-гинекологической практике [Текст] // Здоровье Украины. — 2007. — № 7. — С. 14-15.
6. Яцковська Н.М., Машкевич О.Г. Рекомендації європейського товариства кардіологів щодо гострої тромбоемболії легеневої артерії (2008) [Текст] / Внутрішня медицина. — 2008. — № 5–6. — С. 107-111.
7. Current Diagnosis of Venous Thromboembolism in Primary Care: A Clinical Practice Guideline from the American Academy of Family Physicians and the American College of Physicians [Текст] / A. Qaseem, V. Snow, P. Barry еt al. // Ann. Fam. Med. — 2007. — 5. — 57-62.
8. Goldhaber S.Z. Pulmonary Thromboembolism // Harrison’s principles of internal medicine. 16th Edition [Текст] / Ed. by T.R. Harrison. — 2005. — P. 1561-1565.
9. Guidelines on the diagnosis and management of acute pulmonary embolism European Society of Cardiology (ESC) [Текст] // European Heart Journal. — 2008. — 29. — P. 276-2315.
10. Is Bed Rest Recommendation In The Management Of Patients With Pulmonary Embolism And/or Deep Vein Thrombosis Evidenced-based Medicine: A Meta-analysis [Текст] / C. Meune, N. Aissaoui, E. Martins-Meune, S. Mouly, S. Weber // Circulation. — 2007. — 116. — II 698-II 699.
11. Kucher N., Goldhaber S.Z. Management of Massive Pulmonary Embolism [Текст] // Circulation. — 2005. — 112. — e28-e32.
12. Management of Venous Thromboembolism: A Clinical Practice Guideline from the American College of Physicians and the American Academy of Family Physicians [Текст] / V. Snow, A. Qaseem, P. Barry еt al. // Ann. Fam. Med. — 2007. — 5. — 74-80.
13. Preventing Deep Vein Thrombosis and Pulmonary Embolism A Practical Guide to Evaluation and Improvement [Электронный ресурс] / F.A. Anderson // http://www.outcomes-umassmed.org/dvt/best_practice/ Dec. 2008.