В течение последнего десятилетия интерес к проблемам экономической оценки эффективности лечения стали проявлять не только организаторы здравоохранения, но и врачи различных специальностей [1, 2]. Этот интерес обусловлен несколькими факторами, наиболее важными из которых являются повышение стоимости медицинской помощи и появление альтернативных методов лечения одного и того же заболевания, имеющих не только разную клиническую эффективность, но и разную стоимость [3]. Вместе с тем проблема относительной ограниченности средств, выделяемых на здравоохранение, остается актуальной в большинстве экономически развитых стран [4, 5].
Расходы на лечение сердечно-сосудистых заболеваний занимают важное место в структуре затрат на здравоохранение: в некоторых странах они составляют 12–13 % всех затрат на здравоохранение [6]. Из 1 триллиона долларов, расходуемых на медицинскую помощь в США, $178 млрд (16,8 % от всех расходов) приходится на лечение всех сердечно-сосудистых заболеваний и $102 млрд (9,6 % от всех расходов) — на лечение только заболеваний сердца [7]. В структуре затрат на лечение заболеваний сердца ведущее место занимают расходы, связанные со стационарным лечением, — 60 %, оставшиеся 40 % распределяются следующим образом: 13 % — на плату врачебным службам, 7 % — на оплату лекарственных препаратов на амбулаторном этапе лечения, 4 % — на организацию лечения на дому, 16 % — на организацию наблюдения за больными медицинскими сестрами на дому [81]. Оценка экономической эффективности лечения сердечно-сосудистых заболеваний — одна из актуальных проблем современной медицины.
Фармакоэкономика становится одной из часто обсуждаемых на страницах периодической медицинской литературы тем. Поиск в базе данных MEDLINE по ключевому слову pharmacoeconomics за период с 1966?го по 2000 г. выявил 879 статей. Впервые статья, содержащая ключевое слово pharmacoeconomics, появилась в 1989 г. [9].
Показатели экономической оценки эффективности лечения в настоящее время выступают в качестве критериев, которые позволяют в конкретной клинической ситуации выбрать наиболее приемлемый вид лечения с учетом его эффективности и стоимости [4], а для здравоохранения в целом — оптимальным образом распределить ограниченные ресурсы [5].
Современные подходы к оценке экономической эффективности лечения
Экономическая оценка эффективности определенной медицинской программы или метода лечения в общем виде состоит в сопоставлении затрат на их проведение. Поскольку эффективность лечения можно оценивать по различным критериям (например, по увеличению продолжительности жизни, улучшению ее качества, экономии денежных средств, а также по прямой экономической прибыли) [10], существует несколько методов анализа ее экономической оценки. Наиболее часто используют следующие четыре метода экономической оценки эффективности лечения — анализ минимизации стоимости (cost miniminization analysis), анализ эффективности затрат (cost effectiveness analysis), стоимостно-утилитарный анализ (cost utility analysis) и стоимостный анализ прибыли (cost benefit analysis) [11].
Применение анализа минимизации стоимости (cost miniminization analysis) ограничивается теми редкими случаями, когда сравниваемые методы лечения имеют одинаковую клиническую эффективность, при этом экономически более эффективным считается тот метод лечения, который и требует меньших затрат [11]. На практике же различные методы лечения, как правило, дают различные результаты.
Анализ эффективности затрат (cost effectiveness analysis) применяется в тех случаях, когда критерии эффективности лечения представляют собой естественные единицы (например, увеличение продолжительности жизни, уменьшение выраженности определенного симптома и т.д.) [11]. В результате данного анализа можно установить, какую сумму денег надо заплатить для получения определенных преимуществ в состоянии здоровья, достигнутых за счет оцениваемого метода лечения. Анализ эффективности затрат позволяет сравнивать экономическую эффективность двух методов лечения по так называемому анализу прироста (incremental analysis), в результате которого можно установить, какую дополнительную сумму денег надо заплатить для получения преимуществ, предоставляемых более дорогостоящим методом лечения [11].
Например, метод лечения А стоит 5 000 денежных единиц, а метод лечения В — 10 000 денежных единиц. В результате применения метода А ожидаемая продолжительность жизни составит 3 года, а в результате применения метода В она составит 5 лет. Анализ экономической эффективности дополнительных затрат на применение метода В будет включать в себя следующие вычисления:
Эффективность затрат = (10000 – 5000) / (5 – 3) =
= 5000 / 2 = 2500 денежных единиц за 1 год спасенной жизни.
Оценка экономической эффективности с помощью анализа эффективности затрат является одним из наиболее часто применяемых методов экономического анализа эффективности медицинских вмешательств [12], который не лишен определенных недостатков. В частности, анализ эффективности затрат неприемлем в тех случаях, когда есть необходимость использовать более одного критерия эффективности медицинского вмешательства, например увеличение продолжительности жизни и улучшение ее качества за счет уменьшения симптомов заболевания [11].
Для преодоления указанных ограничений был разработан метод экономической оценки медицинских вмешательств, совмещающий данные о затрачиваемых средствах с данными о продолжительности жизни и ее качестве. Этот метод был назван стоимостно-утилитарным анализом (cost utility analysis) [11]. Он позволяет в денежном эквиваленте оценить влияние вмешательства на показатель продолжительности жизни, соотнесенной с ее качеством. Ключевым моментом метода является выбор утилитарных показателей, которые в количественной форме отражают обусловленное состоянием здоровья качество жизни. Утилитарные показатели располагаются в порядке уменьшения качества жизни от полного здоровья (1,00) до смерти (0,00) [13, 14]. Некоторые утилитарные показатели представлены в табл. 1.
Следующим этапом стоимостно-утилитарного анализа является вычисление показателя продолжительности жизни, соотнесенного с ее качеством (quality adjusted life years — QALY) [15]. Один год жизни с абсолютным ее качеством имеет значение показателя QALY равное 1, а один год жизни с меньшим качеством имеет показатель QALY менее 1 [11].
Вычисление QALY производится следующим образом. Допустим, применение нового метода лечения стоимостью 60 000 денежных единиц позволяет увеличить продолжительность жизни больного на 4 года. Первые два года он проживет с утилитарным показателем 0,6, а оставшиеся 2 года — с утилитарным показателем 0,4. Тогда общий для всех 4 лет показатель QALY будет равен:
(0,6 – 2) + (0,4 – 2) = 2.
Разделив сумму в 60 000 денежных единиц, затраченную на данный метод лечения, на общий показатель QALY, равный 2, мы получим стоимость 1 года спасенной жизни с показателем QALY 1, то есть стоимость 1 года спасенной жизни с абсолютным ее качеством, которая составит 30 000 денежных единиц [11].
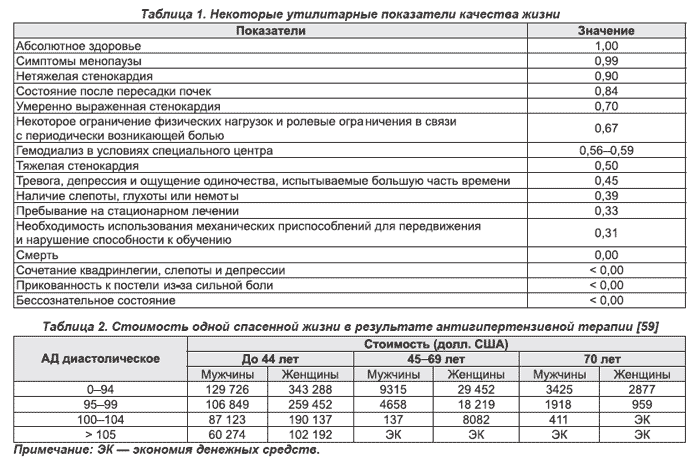
В настоящее время стоимость 1 года жизни с абсолютным ее качеством часто используется для экономической оценки эффективности лечения [16]. При этом в США и большинстве развитых стран считается, что стоимость лечения < $20 000 / QALY является экономически эффективной, стоимость от $20 000 / QALY до $40 000 / QALY считается приемлемой (именно такую стоимость имеет большинство методов лечения), от $40 000 / QALY до $60 000 / QALY — пограничным уровнем, а лечение стоимостью > $60 000 / QALY считается дорогим. Стоимость лечения > $100 000 / QALY считается неприемлемой [16, 17].
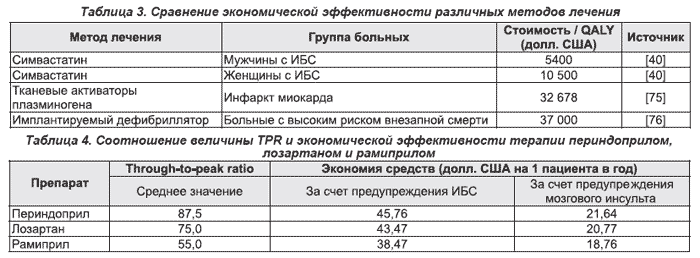
Стандартизированные критерии экономической оценки эффективности лечения позволяют сравнивать соотношение стоимости и эффективности различных методов лечения, а также одних и тех же методов лечения, но у различных групп больных [18]. Результаты такого анализа экономической эффективности различных методов лечения и профилактики сердечно-сосудистых заболеваний представлены в табл. 3 и 5.
Стоимостный анализ прибыли (cost benefit analysis), оценивающий эффективность медицинских вмешательств только в денежном выражении, в настоящее время считается неприемлемым анализом экономической эффективности медицинских вмешательств, так как не учитывает их клиническую эффективность. Поэтому останавливаться подробно на этом методе анализа мы не будем.
Сохраняющие средства (cost-saving) стратегии лечения
Использование методов экономической оценки эффективности лечения позволило выявить виды вмешательств, которые, несмотря на относительно высокую первоначальную стоимость, позволяют экономить денежные средства. В то же время дешевые, на первый взгляд, стратегии лечения далеко не всегда оказываются самыми экономичными.
До рассмотрения конкретных примеров экономических стратегий лечения попытаемся выделить некоторые общие подходы к терапии, позволяющие экономить средства, затрачиваемые на лечение определенных заболеваний. Одним из главных факторов, способствующих экономии денежных средств за счет определенной терапии, является отсутствие затрат на лечение тех осложнений заболевания, которые удается предотвратить за счет данной терапии. При анализе литературы складывается впечатление, что влияние терапии на потребность в госпитализации больных является достаточно универсальным фактором, способствующим сохранению денежных средств при лечении различных заболеваний [1, 19–21]. Улучшение качества и объема амбулаторной помощи больным различными заболеваниями также позволяет экономить денежные средства [22, 23].
Важным фактором, влияющим на экономичность стратегий лечения, является исходная выраженность заболевания: чем больше выраженность заболевания, тем более экономически эффективной и/или экономичной может быть одна и та же терапия. Например, экономическая эффективность антигипертензивной терапии, выраженная в утилитарных показателях, у больных артериальной гипертензией при исходном диастолическом артериальном давлении (АД) > 105 мм рт.ст. составляет около $20 600 / QALY, а при исходном диастолическом АД 95–104 мм рт.ст. в два раза выше — $41 900 / QALY [24].
Использование интегрированных программ лечения некоторых распространенных заболеваний также позволяет сократить расходы [21]. Под интегрированным подходом к лечению больного с определенным заболеванием понимают такой путь к решению определенной клинической проблемы, который построен на использовании подробного структурированного плана и мультидисциплинарного принципа, подразумевающего тесное взаимодействие врачей различных специальностей. Этот подход был предложен для того, чтобы обеспечить более эффективное внедрение в практическое здравоохранение национальных рекомендаций попечению определенных заболеваний [25].

Интегрированные подходы к лечению наиболее распространенных заболеваний особенно широко используются в США, а в последнее время и в Великобритании. В настоящее время разработаны интегрированные программы лечения более чем 45 различных патологических состояний, включая ХСН 1261, ИБС [27] и пороки сердца [28].
Экономичные стратегии лечения в кардиологии
Экономичные стратегии лечения ишемической болезни сердца
Актуальность поиска экономичных стратегий лечения ИБС определяется ее распространенностью и большой стоимостью лечения, особенно при использовании высокотехнологичных методов — аортокоронарного шунтирования (АКШ), чрескожной транслюминальной коронарной ангиопластики (ЧТКА) со стентированием. Острый инфаркт миокарда только среди лиц 65 лет и старше в США является причиной более 200 000 госпитализаций в год. Прямые затраты на лечение ИБС в США составляют около $22 млрд в год, а непрямые — около $32 млрд в год [29].
Стентирование коронарных артерий в настоящее время используется в большинстве случаев ЧТКА коронарных артерий. Хотя стентирование улучшает непосредственные результаты баллонной ангиопластики, остается не совсем ясным, окупаются ли расходы на имплантацию стентов за счет снижения риска коронарных событий. Экономический анализ эффективности баллонной ангиопластики и стентирования коронарных артерий у пациентов с однососудистым поражением в течение 12 мес. после процедуры был проведен D.J. Cohen и соавт. по результатам исследования Stent Restenosis Study (STRESS) [30]. Несмотря на то что частота повторных реваскуляризаций после имплантации стента достоверно снижалась, общая стоимость лечения через 1 год оставалась в среднем на $800 (7 %) выше на одного больного в группе стентирования по сравнению с группой баллонной ангиопластики.
Позднее в исследовании Belgian Netherlands Stent Study II (BENESTENT II) [31] были подтверждены данные о более высокой стоимости стентирования по сравнению с баллонной ангиопластикой через 1 год наблюдения. Несмотря на более благоприятные клинические исходы, через год наблюдения стоимость стентирования оказалась на 12 % выше ЧТКА.
В условиях реальной практики большинство пациентов, у которых проводятся ангиопластика и стентирование коронарных артерий, не имеют идеальной для этих процедур анатомии коронарных артерий. В нескольких рандомизированных исследованиях сравнивали отдаленные клинические результаты баллонной ангиопластики и АК.Н1 у больных с многососудистыми поражениями [32, 33].
Рандомизированное исследование The Bypass Angioplasty Revascularization Investigation (BARI), включавшее 1829 больных, которым выполнялась ЧТКА или АКШ, показало, что 5-летняя выживаемость была одинакова в обеих группах, но частота повторных реваскуляризаций оказалась достоверно выше в группе ЧТКА [34]. Исследования The BARI Study of Economics and Quality of Life (SEQOL) выявило, что начальная стоимость АКШ была выше стоимости ЧТКА ($32 347 и $21 113 соответственно), но при длительном наблюдении различия в стоимости лечения нивелировались [35]. Стоимость ЧТКА со временем возрастала за счет увеличения необходимости проведения повторных процедур реваскуляризации.
Однако все эти исследования были выполнены в период, когда баллонная ангиопластика не сопровождалась стентированием коронарных артерий. Для установления различий в стоимости ЧТКА со стентированием и АКШ был проведен анализ с использованием моделирования различных сценариев лечения [36]. На основании использованной модели в течение 4 лет общая стоимость лечения с применением ЧТКА составила $50 899, а с применением АКШ — $53 007. При многососудистом поражении экономическая эффективность ЧТКА со стентированием зависела от стратегии вмешательства. Анализировали стратегию неизбирательного стентирования всех стенозированных артерий, доступных ангиопластике и стентированию (primary stenting), и стратегию избирательного стентирования только тех артерий, в которых после ангиопластики определялся высокий риск рестеноза (provisional stent strategy). Общая стоимость лечения за 4-летний период оказалась на $1742 (3,4 %) меньше при избирательном стентировании артерий с высоким риском рестеноза по сравнению с неизбирательным стентированием всех пригодных для стентирования стенозированных артерий. За 4-летний период лечение с использованием избирательной стратегии оказалось на $832 (1,7 %) дешевле, чем лечение с использованием АКШ. Напротив, применение неизбирательной стратегии стентирования оказывалось дороже избирательной стратегии на $333 (0,7 %) и дороже АКШ на $1243 (2,5 %). Более высокая стоимость определялась в основном более высокой стоимостью самой процедуры стентирования.
Полученные с помощью моделирования результаты не подтвердились в проспективном рандомизированном исследовании 479 больных, у которых использовалась избирательная или неизбирательная стратегия стентирования [37]. Оказалось, что, несмотря на меньшую начальную стоимость избирательной стратегии по сравнению с неизбирательной ($389 и $339 соответственно, р < 0,001), через 6 мес. общая стоимость лечения в группе неизбирательного стентирования всех доступных для реваскуляризаций артерий оказалась несколько ниже ($10 206 и $10 490 соответственно). Различия результатов исследования, основанного на моделировании, и проспективного исследования указывают на необходимость подтверждения результатов фармакоэкономического анализа, основанного на моделировании, в проспективных фармакоэкономических исследованиях.
Экономичность гипохолестеринемической терапии
Экономические последствия осложнений атеросклероза велики. Ежегодные расходы на лечение этих осложнений только в США составляют $160 млрд [75]. Экономическая эффективность терапии ингибиторами 3-гидрокси-3-метилглутарил-коэнзим А (ГМГ-КоА) редуктазы (статинами) определялась в нескольких исследованиях с использованием как моделирования [38], основанного на результатах рандомизированных клинических исследований, так и проспективного анализа [39].
В исследовании Scandinavian Simvastatin Survival Study (4S), оценивающем эффективность вторичной профилактики ИБС, была показана высокая экономическая эффективность симвастатина даже при учете только прямых затрат [40]. Средняя стоимость 1 года спасенной жизни за счет терапии симвастатином составила $5500 у мужчин и $10 300 у женщин.
Экономическая эффективность терапии статинами в значительной степени зависит от стратегии лечения. Стратегия использования статинов для вторичной профилактики является высокоэффективной экономически, в то время как первичная профилактика экономически менее эффективна (табл. 5) [41].
В исследовании West of Scotland Coronary Prevention Study (WOSCOPS) оценивали эффективность первичной профилактики ИБС. Правастатин в суточной дозе 40 мг/сут. на 32 % снижал риск общей летальности, на 37 % — потребность в ЧТКА и АКШ и на 31 % — вероятность развития нефатального инфаркта миокарда [42]. Стоимость 1 года спасенной жизни за счет первичной профилактики в исследовании WOSCOPS составила от $16 000 до $32 000, то есть была в 3 раза выше, чем стоимость 1 спасенной жизни за счет вторичной профилактики в исследовании 4S.
Было установлено, что стоимость 1 спасенной жизни за счет терапии статинами у мужчин в возрасте 45–64 лет с доказанной ишемической болезнью сердца и уровнем холестерина плазмы > 5,4 ммоль/л оказалась почти в 4 раза дешевле по сравнению со стоимостью 1 спасенной жизни у мужчин того же возраста и с уровнем холестерина плазмы > 6,5 ммоль/л, но без четких признаков ишемической болезни сердца [43].
Экономичные стратегии лечения хронической сердечной недостаточности
За последние два десятилетия в развитых странах существенно снизилась летальность от мозгового инсульта и ишемической болезни сердца. Однако в этот же период происходил неуклонный рост распространенности хронической сердечной недостаточности [44]. В США ежегодно диагностируется более 400 000 новых случаев застойной сердечной недостаточности, 900 000 из 4,7 млн больных с застойной сердечной недостаточностью ежегодно требуют стационарного лечения [45]. Один из 20 больных, поступающих в стационар, — это больной с сердечной недостаточностью. Каждый третий пациент, госпитализированный по поводу сердечной недостаточности, в течение года поступает в стационар повторно.
Лечение ХСН требует больших финансовых затрат. Стоимость стационарного лечения одного больного с сердечной недостаточностью в США составляет от $8611 до $10 400 [46]. В индустриально развитых странах расходы на лечение ХСН составляют около 1–2 % всех расходов на здравоохранение [47]. Только в США ежегодные затраты, связанные с лечением сердечной недостаточности, превышают $20 млрд, причем из этих средств 75 % тратится на оплату стационарного лечения и около 20 % — на организацию амбулаторного лечения [48]. По сравнению со всеми сердечно-сосудистыми заболеваниями расходы, связанные с госпитализацией, занимают еще больше места в структуре общих расходов на лечение ХСН. Это и определяет в значительной степени современный интерес к проблемам фармакоэкономики ХСН.
Экономический анализ эффективности лечения ингибитором ангиотензинпревращающего фермента (ИАПФ) эналаприлом был проведен на основании данных исследования SOLVD (Studies of Left Ventricular Dysfunction) [49]. В это исследование было включено 2569 больных с клиническими проявлениями сердечной недостаточности и фракцией изгнания левого желудочка < 35 %. Период наблюдения за больными составил 48 мес. Стоимость эналаприла для лечения в течение этого периода составила для одного больного $777; в группе приема плацебо этих затрат, естественно, не было. Однако в конце периода наблюдения оказалось, что общая стоимость лечения одного больного в группе терапии эналаприлом в среднем составила $11 840, а в группе плацебо — $12 557, то есть лечение эналаприлом одного больного с выраженной систолической дисфункцией левого желудочка в течение 48 мес. позволяло сэкономить $718 [50]. Экономия денежных средств за счет терапии эналаприлом была обусловлена прежде всего уменьшением потребности в госпитализациях и соответственно снижением затрат на оплату стационарного лечения. Так, в группе лечения эналаприлом затраты на госпитализацию в среднем на одного больного составили $8760, а в группе плацебо — $10 249. Терапия эналаприлом оказалась экономически высокоэффективной и при оценке ее по стоимости / QALY, которая составила в среднем $5250 [50].
Несмотря на данные, доказывающие возможность сохранения денежных средств за счет терапии ИАПФ, даже в экономически развитых странах отчетливо прослеживается тенденция к недостаточному использованию этих препаратов для лечения больных с сердечной недостаточностью. Так, при бессимптомной дисфункции левого желудочка только 53 % врачей общей практики и 75 % кардиологов назначали ИАПФ в качестве терапии первого выбора. При небольших и умеренных проявлениях сердечной недостаточности ИАПФ в качестве препарата первого выбора использовали только 62 % врачей общей практики и 85 % кардиологов [51]. Увеличение частоты назначения ИАПФ больным ХСН и приверженности больных к терапии ИАПФ являются важными источниками повышения экономической эффективности лечения ХСН.
Результаты исследования Digitalis Investigator Group (DIG) показали, что терапия дигоксином по сравнению с плацебо уменьшает потребность в госпитализациях больных с сердечной недостаточностью [52]. Это снижение обусловливает экономию денежных средств за счет лечения дигоксином. Экономические расчеты, основанные на данных исследований Randomized Assessment of Digoxin on Inhibitors of the Angiotensin-Converting Enzyme (RADIANCE) и Prospective Randomized Study of Ventriclilar Failure and the Efficacy of Digoxin (PROVED), показали, что лечение дигоксином больных с сердечной недостаточностью только в США может сохранять ежегодно около $12 млн.
Использование новых организационных подходов к лечению больных с ХСН также позволяет уменьшить расходы на лечение. В нескольких рандомизированных клинических исследованиях [53, 54] было доказано, что применение мультидисциплинарного подхода к лечению, подразумевающего участие в лечении нескольких специалистов (кардиолог, клинический фармаколог, специально обученная медицинская сестра и др.) и терапевтическое обучение больных, позволяет снизить расходы на лечение больных с ХСН. Экономия средств происходит за счет снижения потребности в повторных госпитализациях, являющихся наиболее дорогостоящим компонентом лечения больных с ХСН в развитых странах [55].
Поиск экономичных стратегий лечения артериальной гипертензии
Применение экономических критериев оценки эффективности антигипертензивной терапии представляет особый интерес в связи с высокой распространенностью артериальной гипертензии (15–20 % среди взрослого населения и 30–40 % среди пожилых лиц) [56], а также в связи с тем, что сама по себе артериальная гипертензия не вызывает значимого ухудшения качества жизни и работоспособности, но является фактором риска заболеваний, терапия которых требует значительных затрат [4]. Около 10 % всех случаев госпитализации в США обусловлено артериальной гипертензией.
Экономическая эффективность антигипертензивной терапии определяется ее способностью уменьшать риск сердечно-сосудистых заболеваний, прежде всего инфаркта миокарда и мозгового инсульта, характеризующихся высокой стоимостью лечения. Возможность предотвращения этих осложнений в значительной степени зависит от продолжительности антигипертензивного действия препарата в течение суток. Сердечно-сосудистые катастрофы обычно происходят в утренние часы, поэтому сохранение эффекта препарата, принятого накануне, до утра следующих суток в значительной степени определяет его защитные эффекты. Интегральным показателем равномерности действия препарата является отношение эффекта препарата в конце его действия и в момент максимального действия (through-to-peak ratio — TPR). Возрастает ли экономичность антигипертензивной терапии с увеличением отношения конечного эффекта к наибольшему?
Расчет экономической эффективности лечения одним из трех антигипертензивных препаратов — периндоприлом (престариумом), лозартаном (козааром) и рамиприлом (тритаце) — с различной величиной TPR продемонстрировал, что этот показатель может влиять на экономическую эффективность лечения [57]. В табл. 4 представлены результаты этого расчета. У периндоприла отмечена более высокая величина TPR, составляющая около 90 %, и соответственно большая экономия средств за счет предупреждения осложнений артериальной гипертензии: ИБС — $46 на 1 человека в год и мозгового инсульта — около $22 на 1 человека в год. Экономия средств за счет терапии рамиприлом, обладающим наименьшим показателем TPR, была выражена в наименьшей степени. Лозартан занимал промежуточное положение между периндоприлом и рамиприлом как по показателю TPR, так и по степени экономии денежных средств. Такая закономерность может быть обусловлена тем, что препараты с высоким показателем TPR в большей степени сохраняют антигипертензивное действие через сутки после приема и, следовательно, обладают большей способностью предупреждать сердечно-сосудистые события в утренние часы — период, когда эти события развиваются наиболее часто [58].
Экономическая эффективность антигипертензивной терапии, как указывалось выше, возрастает (то есть уменьшается стоимость 1 года спасенной жизни) при исходно более высоком АД и в более старших возрастных группах (табл. 2). Это происходит на фоне снижения частоты развития мозгового инсульта на 38 % и коронарной болезни сердца на 16 %. Из табл. 2 видно, что у мужчин и женщин в возрасте старше 45 лет с исходным диастолическим АД > 105 мм рт.ст. и у женщин старше 70 лет при исходном диастолическом АД от 100 до 104 мм рт.ст. антигипертензивная терапия приводит к экономии денежных средств [59].
Данные об экономичности антигипертензивной терапии, проводимой под контролем 24 ч мониторирования АД по сравнению с обычным измерением АД противоречивы. Так, в исследовании G. Pozuelo et al. [60] амбулаторное мониторирование АД экономило денежные средства, расходуемые на лечение, за счет оптимизации терапии и снижения расходов на антигипертензивные препараты. В более крупном многоцентровом рандомизированном исследовании [61] у 419 больных с исходным диастолическим АД > 95 мм рт.ст. суточное мониторирование АД имело клинические преимущества перед обычным контролем АД, но не экономило денежных средств. В группе контроля эффективности терапии с помощью суточного мониторинга АД через 6 мес. наблюдения у большего числа больных удалось отменить антигипертензивные препараты по сравнению с группой обычного контроля АД (26,3 и 7,3 % соответственно; р < 0,001). У меньшего числа больных в группе суточного мониторирования по сравнению с обычным измерением АД требовалась комбинированная антигипертензивная терапия (27,2 и 42,7 % соответственно; р < 0,001). Тем не менее возможная экономия средств за счет снижения затрат на медикаментозные препараты и оплату дополнительных визитов к врачу не превосходила расходы на суточное мониторирование АД.
Важным фактором, влияющим на экономическую эффективность антигипертензивной терапии, является строгое выполнение больными предписанных врачом назначений. Применение комбинированных антигипертензивных препаратов, например содержащих в одной таблетке антагонист кальция амлодипин и ИАПФ беназеприл, увеличивает частоту выполнения больными предписанной схемы лечения по сравнению с терапией двумя препаратами и является более экономичным [62].
Фармакоэкономический анализ, предпринятый на основе исследования Hypertension Optimal Treatment (НОТ), показал, что экономическая эффективность антигипертензивной терапии зависит от ее интенсивности и степени гипотензивного эффекта. Наибольшая экономическая эффективность, определяемая с помощью анализа эффективности затрат и выраженная в стоимости 1 года спасенной жизни, отмечена при уровне целевого АД < 90 мм рт.ст. ($4262).
При более жестких критериях целевого уровня АД < 85 мм рт.ст. стоимость 1 года спасенной жизни возрастала более чем в 20 раз, до пограничного уровня экономической эффективности в $86 360, а при целевом АД < 80 мм рт.ст. — до $658 370, то есть оказывалась экономически неэффективной [63].
Экономичные стратегии лечения нарушений ритма сердца
Демонстративной иллюстрацией положения о том, что далеко не всегда самые дешевые методы лечения оказываются наиболее экономичными, являются данные метаанализа 132 исследований эффективности антиаритмической терапии одним из трех антиаритмических препаратов I класса — хинидином, прокаинамидом и мексилетином — у больных со злокачественными или клинически проявляющимися желудочковыми нарушениями ритма [64]. Стоимость антиаритмического препарата для лечения в течение 1 года составила для мексилетина $475, для хинидина — $225, а для прокаинамида — $268, то есть стоимость мексилетина была почти в два раза выше стоимости хинидина и прокаинамида. Хотя клиническая эффективность (оцениваемая по подавлению более 70 % аритмий) всех трех препаратов оказалась примерно одинаковой, соотношение частоты развития серьезных побочных эффектов мексилетина, хинидина и прокаинамида оказалось 1 : 2,1 : 2,8. Общая стоимость лечения в течение года с учетом затрат на лечение побочных эффектов составила $875 для мексилетина, $1239 — для хинидина и $1911 — для прокаинамида, а экономический показатель эффективности (все затраты / число больных с эффективной терапией) оказался равным $1716 для мексилетина, $2382 — для хинидина и $3901 — для прокаинамида. Таким образом, терапия наиболее дорогим препаратом оказалась и наиболее экономичной [64].
Несмотря на интенсивные поиски экономичных стратегий лечения, некоторые авторы указывают на то, что экономия денежных средств не должна происходить за счет снижения качества медицинской помощи. Парадоксальными, на первый взгляд, оказались данные сравнения стоимости лечения в больницах с различным уровнем оснащенности современной аппаратурой и качеством медицинской помощи. Было установлено, что в больницах с менее высоким уровнем оснащения стоимость лечения оказывалась более высокой [65].
Экономические стратегии антикоагулянтной терапии
Распространенность мерцательной аритмии среди лиц старше 65 лет составляет около 10 %, а ее развитие сопровождается повышением риска мозгового инсульта. В нескольких рандомизированных клинических исследованиях было показано, что у больных с мерцательной аритмией терапия варфарином позволяет предотвратить примерно 2/3 ишемических инсультов [66, 67].
Учитывая высокую стоимость лечения мозгового инсульта, которая в США составляет в среднем $25 000 на одного пациента в год [68], его профилактика с помощью антикоагулянтной терапии позволяет экономить денежные средства.
У больных с мерцательной аритмией, которая была единственным фактором риска мозгового инсульта, терапия варфарином в течение 10 лет позволяла улучшать показатель QALY на 0,05 и экономить $670 за счет уменьшения риска инсульта [69]. При наличии мерцательной аритмии и хотя бы еще одного фактора риска мозгового инсульта терапия варфарином в течение этого же периода улучшала показатель QALY на 0,02 и экономила $90 за счет снижения риска инсульта [69].
Метаанализ 15 исследований использования варфарина, нефракционированного гепарина и низкомолекулярного гепарина для предупреждения тромбоза глубоких вен голеней и тромбоэмболии легочной артерии выявил, что, несмотря на затраты, связанные с терапией, ее проведение является экономичным и уменьшает стоимость лечения больных с соответствующей патологией. При этом, по-видимому, использование низкомолекулярного гепарина, лечение которым не требует специального мониторинга, является более эффективным экономически по сравнению с терапией нефракционированным гепарином и варфарином [70].
Ограничения фармакоэкономических исследований
Таким образом, поиски экономичных стратегий лечения в различных областях медицины, включая кардиологию, становятся характерной чертой современной медицины. Однако широкий интерес к этой проблеме, отражающийся в возрастающем числе публикаций на эту тему, таит в себе определенные опасности искажения представляемой информации о стоимости и эффективности лечения. Именно поэтому актуальной становится проблема оценки качества исследований, отраженных в этих работах [71]. При анализе опубликованных статей, посвященных фармакоэкономическим аспектам лечения, было установлено, что среднее значение показателя качества статей, измеренное по специальной шкале, составило 57,5 ± 11,3 %, что указывало на низкое их качество [71].
Кроме того, оказалось, что в фармакоэкономических исследованиях, субсидированных фармацевтическими компаниями, в 89 % случаев были получены доказательства преимуществ испытываемого препарата по сравнению с контрольным, в то время как в исследованиях, финансированных из других источников, такие преимущества были получены только в 61 % случаев [72]. Таким образом, источник финансирования фармакоэкономических исследований заметно влияет на результаты исследований, зачастую порождая ошибочные выводы [73].
Преобладание среди фармакоэкономических исследований анализа, основанного на моделировании, а не проспективных данных, также может таить в себе источник ошибок, что было показано при рассмотрении экономической эффективности ИБС.
Заключение
В нашей стране проблемы экономической оценки эффективности лечения также начинают привлекать внимание врачей [74]. Хотя организация и проведение отечественных фармакоэкономических исследований в современных условиях является сложной проблемой, на наш взгляд, необходимо добиваться организации таких исследований, результаты которых могли бы стать важным фактором поиска оптимального решения конкретной клинической проблемы с учетом имеющихся финансовых средств.
Список литературы
inhibitors in chronic heart failure // Pharmacoeconomics. — 1996. — 9. — 188-197.
21. Stuck A.E. Multidimensionales geriatrisches Assessment im Akutspital und in der ambulanten Praxis // Schweiz Med. Wochenschr. — 1997. — 127. — 1781-1788.
22. Brazil К., Bolton С., Ulrichsen D., Knott C. Substituting home care for hospitalization: the role of a quick response service for the elderly // J. Community Health. — 1998. — 23. — 29-43.
23. Flood A.B., Fremont А.М., Jin К. et al. How do HMOs achieve savings? The effectiveness of one organization’s strategies // Health Serv. Res. — 1998. — 33. — 79-99.
24. Kupersmith J., Holmes-Rovner M., Hogan A. et al. Cost-effectiveness analysis in heart disease. Part II: Preventive therapies // Prog. Cardiovasc. Dis. — 1995. — 37. — 243-271.
25. Campbell H., Hotchkiss R., Bradshaw N., Porteous M. Integrated care pathways. — BMJ. — 1998. — 316. — 133‑137.
26. Urden L.D. Heart Failure Collaborative Care: An Integrated Partnership, to Manage Quality and Outcomes // Outcomes Management for Nursing Practice. — 1998. — 2 (2). — 64-70.
27. Gibbons R.J., Chatterjee К., Daley J. et al. ACC/AHA/ACP-ASIM Guidelines for the Management of Patients with Chronic Stable Angina: Executive Summary and Recommendations: A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients with Chronic Stable Angina) // Circulation. — 1999. — 99 (21). — 2829-2848.
28. Bonow R.O., Carabello В., de Leon A.C. et al. Guidelines for the Management of Patients with Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients with Valvular Heart Disease) // Circulation. — 1998. — 98. — 1949-1984.
29. Maron D.J. Nonlipid primary and secondary prevention strategies for coronary heart disease // Clin. Cardiol. — 1996. — 19. — 419-423.
30. Krumholz H.M., Cohen D.J., Williams С., Bairn D.S., Brinker J., Cabin H.S., Heuser R., Hirshfeld J., Leon M.B., Moses J., Savage M.P., Cleman M. Health after coronary stenting or balloon angioplasty: results from the Stent Restenosis Study // Am. Heart. J. — 1997. — Sep. — 134 (3). — 337-44.
31. Serruys P.W., van Hout B., Bonnier H. Randomised comparison of implantation of heparin-coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II) // Lancet. — 1998. — 352. — 673-81.
32. Bypass Angioplasty Revascularization Investigation (BARI) investigators. Comparison of coronary bypass surgery with angioplasty in patients with multivessel disease // N. Engl. J. Med. — 1996. — 335. — 217-25.
33. Pocock S.J., Henderson R.A., Seed P. et al. Quality of life, employment status and anginal symptoms after coronary angioplasty or bypass surgery, 3-year follow-up in the Randornized Intervention Treatment of Angina (RITA) trial // Circulation. — 1996. — 94. — 135-42.
34. Bypass Angioplasty Revascularization Investigation (BARI) investigators. Five-year clinical and functional outcome comparing bypass surgery and angioplasty in patients with multivessel coronary disease // JAMA. — 1997. — 277. — 715-21.
35. Hiatky M.A., Rogers W.J., Johnstone I. et al. Medical care costs and quality of life after randomization to coronary angioplasty or coronary bypass surgery // N. Engl. J. Med. — 1997. — 336. — 92-9.
36. Yock C.A., Boothroyd D.B., Owens D.K., Winston C., Hiatky M.A. Projected Long-Term Costs of Coronary Stenting in Multivessel Coronary Disease Based on the Experience of the Bypass Angioplasty Revascularization Investigation (BARI) // Am. Heart J. — 2000. — 14 (4). — 556-564.
37. Wfeaver W.D., Reisman M.A., Griffin J.J., Buller C.E., Leimgruber P.P., Henry T., D’Haern C., Dark V.L., Martin J.S., Cohen D.J., Neil N., Every N.R. for the OPUS-1 Investigators. Optimum percutaneous transluminal coronary angioplasty compared with routine stent strategy trial (OPUS‑1): a randomised trial // Lancet. — 2000. — 355 (9222). — 2199-2203.
38. Jacobson Т.А., Marchman К. Improving the cost-effectiveness of lipid-lowering therapy in coronary prevention / Gotto A.M., Lenfant C., Catapano A.L., Paoletti R. (еds.) // Multiple Risk Factors in Cardiovascular Disease: Strategies of Prevention of Coronary Heart Disease, Cardiac Failure and Stroke. — Dordrecht: Kluwer Academic Publishers, 1997.
39. Johanneson M., Jonsson B., Kjekshus J., Olsson A.G., Pedersen T.R., Wedel H. for the Scandinavian Simvastatin Survival Study Group, Cost-effectiveness of simvastatin treatment to lower cholesterol levels in patients with coronary heart disease // N. Engl. J. Med. — 1997. — 336. — 332-336.
40. Johannesson M., Jonsson B., Kjekshus J. et al. for the Scandinavian Simvastatin Survival Study Group. Cost effectiveness of simvastatin treatment to lower cholesterol levels in patients with coronary heart disease // N. Engl. J. Med. — 1997. — 336. — 332-336.
41. Farmer J.A. Economic implications of lipid-lowering trials: current considerations in selecting a statin // Am. J. Cardiol. — 1998. — 82 (6A). — 26M-31M.
42. Shepherd J. for the West of Scotland Coronary Prevention Study Economic Analysis Group. The cost-effectiveness of preventing initial coronary events with pravastatin. Results of the West of Scotland Coronary Prevention Study economic analysis (аbstr.) // J. Am. Coil. Cardiol. — 1997. — 29 (Suppl.) — 188A.
43. Pharoah P.D.P., Hollingworth W. Cost effectiveness of lowering cholesterol concentration with statins in patients with and without pre-existing coronary heart disease: Life table method applied to health authority population // Br. Med. J. — 1996. — 312. — 1443-1448.
44. Eriksson H. Heart failure: agrowing public health problem // J. Intern. Med. — 1995. — 237. — 135-141.
45. American Heart Association. 1997 Heart and Stroke Statistical Update. 1997.
46. Denton Т.А. The cost of heart failure: patient, provider and society (аbstr.) // Heart Failure. — 1996. — 3 (1). — 149.
47. Maiek M. Health economics of heart failure // Heart. — 1999. — 82 (Suppl. V). — IVII-IV13.
48. Parmley W.W. Cost-effective management of heart failure // Clin. Cardiol. — 1996. — 19. — 240-242.
49. Butler J.R.G. A cost-effectiveness analysis of enalapril maleate in the management of congestive heart failure in Australia // Aust. NZJ Med. — 1996. — 26. — 89-95.
50. Click H., Cook J., Kinosian B. et al. Costs and effects of enalapril therapy in patients with symptomatic heart failure: An economic analysis of the Studies of Left Ventricular Dysfunction (SOLVD) treatment trial // J. Cardiac. Failure. — 1995. — 1. — 371-380.
51. Philbin E., Rocco T. The utility of angiotensin-converting enzyme inhibitors in heart failure with preserved left ventricular systolic function. — 1997. — 134. — 188-195.
52. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure // N. Engl. J. Med. — 1997. — 336. — 525-533.
53. Cline C.M.J., Israelsson B.Y.A., Willenheimer R.B., Broms K., Erhardt L.R. Cost effective management programme for heart failure reduces hospitalisation // Heart. — 1998. — 80. — 442-446.
54. Stewart S., Marley J.E., Horowitz J.D. Effects of multidisciplinary, home-based intervention on planned readmissions and survival among patients with chronic congestive heart failure: a randomized controlled study // Lancet. — 1999. — 354 (9184). — 1077-1083.
55. The National Managed Health Care Congress, Management Strategies in Heart Failure. Optimiving Practice, Outcome and Cost. Boston, MA: The National Managed Health Care Congress, 1996.
56. Mancia G., Giannattasio C. Benefit and costs of anti-hypertensive treatment // Eur. Heart. J. — 1996. — 17 (Suppl. A). — 25-28.
57. Roth M.S., Davenport R.C., Simpson W. Assessing the economic value of antihypertensive medications // Am. J. Manag. Care. — 1998. — Sep. — 4 (9). — 1267-75.
58. Cohen M.C., Rohtia K.M., Lavery C.E., Muller J.E., Mittleman M.A. Meta-Analysis of the Morning Excess of Acute Myocardial Infarctionand Sudden Cardiac Death. — 1997. — 79 (11). — 1512-1516.
59. Junsson В. Cost-benefit of treating hypertension // J. Hypertens. — 1994. — 12 (Suppl. 10). — S65-S70.
60. Pozuelo G., Vergeles-Blanca J.M., Molina L. et al. Ahorro farmacologico у monitorizacion ambulatoria de la presion arterial en un grupo de pacientes hipertensos // Aten. Primaria. — 1997. — 20. — 329-332.
61. Staessen J.A., Byttebier G., Buntinx F., Celis H., O’Brien E.T., Fagard R. Antihypertensive treatment based on conventional or ambulatory blood pressure measurement. A randomized controlled trial. Ambulatory Blood Pressure Monitoring and Treatment of Hypertension Investigators // JAMA. — 1997. — Oct. 1. — 278 (13). — 1065-72.
62. Kountz D.S. Cost containment for treating hypertension in African Americans: impact of a combined ACE inhibitor-calcium channel blocker // J. Nail. Med. Assoc. — 1997. — 89. — 457-460.
63. Cost effectiveness of intensive treatment of hypertension / D.S. Shepard, D. Hodgkin // Am. J. Manag. Care. — 1998. — 4 (Suppl. 12). — S765-9; discussion S770.
64. Podrid P.J., Kowey P.R., Frishman W.H. et al. Comparative cost-effectiveness analysis of quinidine, procainamide and mexiletine // Am. J. Cardiol. — 1991. — 68. — 1662-1667.
65. Robertson R.H., Dowd S.B., Hassan M. Skill-specific staffing intensity and the cost of hospital care // Health Care Manage Rev. — 1997. — 22. — 61-71.
66. Ezekowitz M.D., Bridgers S.L., James K.E. et al. For the VA Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators. Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation // N. Engl. J. Med. — 1992. — 327. — 1406-1412.
67. Laupacis A., Boysen G., Connolly S. et al. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation: analysis of pooled data from five randomized controlled trials // Arch. Intern. Med. — 1994. — 154. — 1449-1457.
68. Claesson L., Gosman-Hedstrum G., Johannesson M. et al. Resource Utilization and Costs of Stroke Unit Care Integrated in a Care Continuum: A I-Year Controlled, Prospective, Randomized Study in Elderly Patients // Stroke. — 2000. — 31. — 2569.
69. Gage B.F., Cardinalli A.B., Owens D.K. Cost-effectiveness of preference-based antithrombotic therapy for patients with nonvalvular atrial fibrillation // Stroke. — 1998. — 29 (6). — 1083-91.
70. Raskob G.E. Low molecular weight heparin for the prevention and treatment of venous thromboembolism // Curr. Opin. Pulm. Med. — 1996. — 2. — 305-310.
71. Trakas К., Addis A., Kruk D. et al. Quality assessment of pharmacoeconomic abstracts of original research articles in selected journals // Ann. Pharmacotherapy. — 1997. — 31. — 423-428.
72. Sacristan J., Bolanos E., Hemandezi et al. Publication bias in health economic studies // Pharmacoeconomics. — 1997. — II. — 289-290.
73. Kernick D.P. Economic evaluation in health: a thumb nail sketch // Br. Med. J. — 1998. — 316. — 1663-1665.
74. Гиляревский С.P., Орлов В.А. Использование анализа экономической эффективности лечения для принятия клинического решения в кардиологии // Кардиология. — 1997. — 37 (9). — 70-80.
75. Mark D.В., Hlatky M.A., Califf R.M. et al. Cost effectiveness of thrombolitic therapy with tissue plasminogen activator as compared with streptokinase for acute acute myocardial infarction // N. Engl. J. Med. — 1995. — 332. — 1418-1424.
76. Owens D.K., Sanders G.D., Harris R.A. et al. Cost-effectiveness of implantable cardioverterdefibrillators relative to amiodarone for prevention of sudden cardiac death // Ann. Intern. Med. — 1997. — 126. — 1-12.



