Журнал «Медицина неотложных состояний» 5 (36) 2011
Вернуться к номеру
Клинико-фармакологические аспекты применения мультивитаминных комплексов для парентерального введения (обзор литературы)
Авторы: Шестопалов А.Е., Дмитриев А.В., Зингеренко В.Б. Главный военный клинический госпиталь им. акад. Н.Н. Бурденко, г. Москва, Россия
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Введение
Поливитаминные комплексы для приема внутрь в виде таблеток, драже, жидких лекарственных форм хорошо известны врачам и пациентам. Существует огромное количество энтеральных форм и видов поливитаминных препаратов, применяемых у детей и взрослых для лечения и профилактики гиповитаминозов, авитаминозов, недостатка макро- и микроэлементов, при состояниях, сопровождающихся повышенной потребностью в витаминах (в том числе неполноценное и несбалансированное питание, период после перенесенных заболеваний, астенические состояния, послеоперационный период).
В то же время существуют заболевания и состояния, когда прием поливитаминных препаратов внутрь невозможен, недостаточен либо не дает желаемого эффекта из-за плохого всасывания в желудочно-кишечном тракте (ЖКТ) или иных причин. К таким случаям относятся:
— полное парентеральное питание (ППП) (когда аминокислоты, жиры, глюкоза, витамины и микроэлементы вводятся внутривенно), поскольку прием пищи внутрь невозможен по тем или иным причинам (абдоминальные фистулы, тяжелые ожоги, тяжелые случаи болезни Крона и язвенного колита и др.);
— замедленный или усложненный энтеральный прием пищи: стенозы пищевода и желудочно-кишечного тракта, коматозные состояния, продолжительные рвоты;
— недостаточный энтеральный прием пищи: односторонняя диета, кахексия при онкологических заболеваниях;
— нейропатии различного генеза: диабетическая, алкогольная и другие;
— макроцитоз и пернициозная анемия;
— онкогематологические заболевания;
— инфекционные заболевания;
— замедленная регенерация тканей после травм и операций;
— недостаточность восполнения витаминного дефицита за счет энтерального приема препаратов при повышенной потребности в витаминах (относительный дефицит).
При этих состояниях и заболеваниях показано парентеральное (внутримышечное, внутривенное) введение витаминных препаратов. Оптимальным считается внутривенный путь введения, так как при этом обеспечивается наибольшая биодоступность витаминов, т.е. максимальное усвоение тканями организма. Попадая в клетки органов-мишеней, витамины выполняют свою роль коферментов в действии всех ферментов организма.
Парентеральное введение мультивитаминных комплексов имеет следующие преимущества:
— высокая биодоступность, что обеспечивает максимально возможное усвоение витаминов тканями органов и быстрое включение в биохимические процессы;
— возможность более точного дозирования;
— исключение побочных эффектов со стороны желудочно-кишечного тракта, связанных с воздействием на слизистую оболочку.
Проблема заключается в том, что большинство витаминов для парентерального введения, выпускаемых отечественной промышленностью, не являются поливитаминами, а содержат, как правило, один витамин в ампуле. Это связано не только с технологическими особенностями производства таких препаратов, но и с традиционными представлениями о несовместимости ряда витаминов в одном флаконе. Опубликовано множество пособий, в которые включены специальные таблицы о совместимости или несовместимости конкретных витаминов. Ключевым моментом этой идеологии является постулат о несовместимости жиро- (витамины А, Е и D) и водорастворимых витаминов (группа В, С и других). Соответственно полноценная витаминотерапия состояний и заболеваний, о которых говорилось выше, становится затруднительной или невозможной.
Современной химической и фармацевтической промышленностью созданы инъекционные формы поливитаминных препаратов, исключающие взаимодействие отдельных витаминов между собой в составе готовой лекарственной формы.
Поливитаминные комплексы для инъекций как необходимый компонент нутритивной поддержки у больных в критических состояниях
Витамины являются важнейшим компонентом нутритивной поддержки у пациентов, требующих какой-либо формы парентерального питания (ПП), включая краткосрочное, долгосрочное и транзиторное парентеральное питание. В процессе метаболического стресса, особенно в критических состояниях, потребность в витаминах может значительно возрастать. Для удовлетворения этих возрастающих потребностей рекомендуется ежедневная инфузия мультивитаминов (Zaloga G.P., Bortenschlager L., 1993; Fortin M.C. и соавт., 1999). Снижение концентрации большинства микроэлементов при заболеваниях является зеркальным отражением снижения содержания многих витаминов в крови. Это является частично результатом транскапиллярного выхода транспортных белков, а частично — результатом внутриклеточных процессов, катализирующих повышение метаболизма для увеличения антиоксидантной активности (Louw J.A. и соавт., 1992). Изменения концентрации наблюдаются не только в плазме, но и, по некоторым данным, отмечается значительное изменение внутриклеточных концентраций. Например, в процессе хирургии отмечается значительное снижение витамина С в лейкоцитах (Louw J.A. и соавт., 1992). Понятно, что изменения касаются витаминов во всем организме.
Наиболее интересное в настоящее время в клиническом питании — ситуация у больных в критических состояниях, особенно ожоговых больных или в палатах интенсивной терапии, у которых потребность в антиоксидантах очень большая из-за гиперметаболизма. Это суммарный результат возрастания потерь от аспирации, фистул, диализа и через повреждения кожи. Недавно опубликован метаанализ по результатам исследований антиоксидантов у больных в критических состояниях (Heyland D.K. и соавт., 2005). Результаты большинства исследований говорят о том, что антиоксиданты снижают смертность у этой категории больных.
В литературе имеются исследования, которые показывают другие клинические преимущества в снижении смертности. Так, в исследованиях у пациентов с септическим шоком, получавших смесь витаминов С, Е и N-ацетилцистеина, наблюдалось значительное улучшение гемодинамических параметров (Galley H.F. и соавт., 1997). В исследовании влияния витаминов Е и С на состояние молодых пациентов, получивших серьезные травмы, выявлено снижение числа инцидентов органной недостаточности и укорочение времени пребывания в ОИТ по сравнению со стандартным лечением (Nathens A.B. и соавт., 2002). Интересное исследование проведено у пациентов с неотложными хирургическими и ортопедическими вмешательствами. Рутинное ежедневное введение водорастворимых витаминов приводило к умеренному снижению продолжительности пребывания в стационаре (Vlaming S. и соавт., 2001).
Существенная роль витамина Е в лечении пациентов в критических состояниях находит свое отражение и при выборе макронутриентов для парентерального питания, в частности жировых эмульсий. Среди применяемых в настоящее время липидных эмульсий наибольшим преимуществом в плане коррекции дефицита витамина Е обладают препараты на основе оливкового масла, поскольку содержат наибольшее количество естественного (натурального) токоферола. В целом ряде исследований показана способность эмульсий на основе оливкового масла (КлинОлеик) стабилизировать уровень витамина Е у пациентов с травмой (Bernard и соавт., 2000), улучшать антиоксидантный статус у больных в послеоперационном периоде (Reimer и соавт., 2000, 2001), снижать перекисное окисление липидов при длительном парентеральном питании (Pironi и соавт., 2001), улучшать гематологический и нутриционный статус, увеличивать содержание жирорастворимых витаминов при проведении домашнего парентерального питания (Reimund и соавт., 2004, 2005). В результате жировые эмульсии на основе оливкового масла по сравнению с традиционными соевыми эмульсиями являются иммунонейтральными, не подавляют пролиферацию лимфоцитов, не увеличивают риск развития осложнений у пациентов на длительном парентеральном питании.
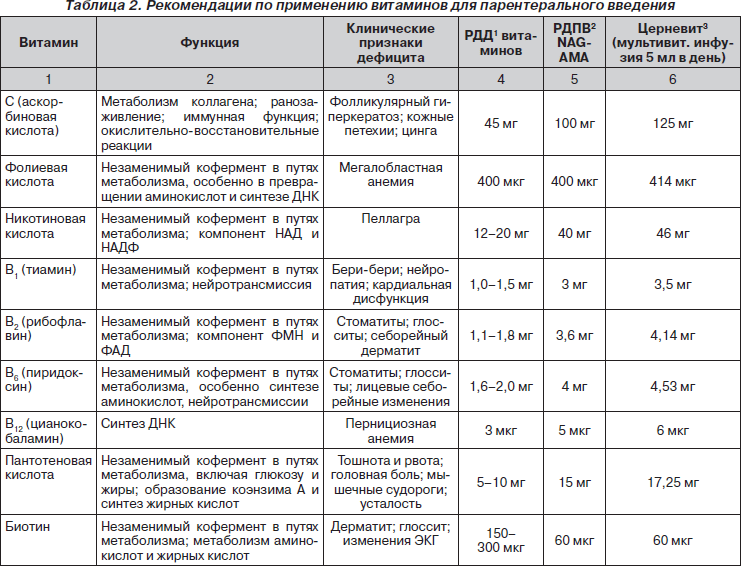
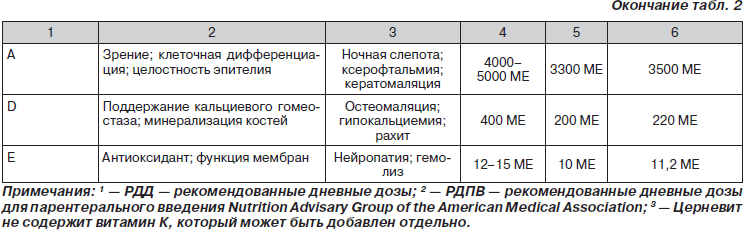
Анализ большинства исследований, посвященных использованию витаминных препаратов для инъекций, позволяет сделать заключение, что наиболее адекватный результирующий эффект достигается при совместном их введении в составе мультивитаминных комплексов в рекомендованных суточных и курсовых дозах, поскольку в подавляющем большинстве клинических ситуаций не бывает изолированного дефицита какого-либо витамина. Результатами такого подхода явились официальные рекомендации регулирующих органов Европы и мира по применению мультивитаминных комплексов (табл. 1–3). Важность и обязательность применения мультивитаминных комплексов у пациентов в критических состояниях, в том числе на парентеральном питании, подчеркивается практически во всех зарубежных и отечественных монографиях и рекомендациях по нутритивной поддержке (Попова Т.С. и соавт., 1996, 2002; Ефименко Н.А. и соавт., 2000; Щербакова Г.Н., Рагимов А.А., 2002; Луфт В.М. и соавт., 2003; Шестопалов А.Е., 2005; Jason Payne-James и соавт., 2001, 2003; Sobotka L., 2004).
Заболевания желудочно-кишечного тракта
При воспалительных заболеваниях кишечника может возникать дефицит ряда водо- и жирорастворимых витаминов. В случае болезни Крона нарушение всасывания является первичной причиной дефицита жирорастворимых витаминов (Rosenberg I.H. и соавт., 1985).
Субклинический дефицит витамина А превалирует при воспалительных заболеваниях кишечника (Main A.N.H. и соавт., 1983). Пациенты с концентрацией ретинола в плазме ниже 0,8 mмоль/л (22,9 mг%) имеют высокий риск нарушения сумеречного зрения и должны получать дополнение витаминами (Main A.N.H. и соавт., 1983). У 79 % пациентов с болезнью Крона регистрируется низкая концентрация 25-гидроксивитамина D (Driscoll R.H., Rosenberg I.H., 1978) как результат первичного нарушения всасывания. Отмечается также и эндогенная потеря (Harries A.D., Heatley R.V., 1983).
У пациентов с воспалительными заболеваниями кишечника может развиваться также дефицит водорастворимых витаминов, особенно фолата, витамина В12 и С. Дефицит фолиевой кислоты может приводить к мегалобластной анемии. Выраженность нарушения всасывания витамина В12 может нарастать по мере прогрессирования заболевания. Пациент с заболеванием окончания подвздошной кишки и/или резекцией имеет риск дефицита витамина В12 (Rosenberg I.H. и соавт., 1985; Afonso J.J., Rombeau J.L., 1993). Ухудшение всасывания витамина В12 также может возникать из-за чрезмерного роста бактериальной флоры (Harries A.D., Heatley R.V., 1983). Пациенты с болезнью Крона часто имеют сниженное поступление витамина С (Rosenberg I.H. и соавт., 1985). Концентрации витамина С в плазме и в белых кровяных клетках у пациентов с болезнью Крона значительно ниже, чем у здоровых субъектов (Afonso J.J., Rombeau J.L., 1993). Пациенты с фистулами ЖКТ могут иметь особенно низкую концентрацию витамина С в плазме (Rosenberg I.H. и соавт., 1985; Gerson C.D., Fabry E.M., 1974).
Многие пациенты, получающие ППП, имеют синдром короткой тонкой кишки. Нутриенты, которые в норме имеют энтеропанкреатическую или энтерогепатическую циркуляцию, могут теряться в больших количествах с того момента, как эндогенная интестинальная секреция не обеспечивает эффективной реабсорбции. Витамины энтерального цикла, которые могут быть разрушены у пациентов с короткой тонкой кишкой, включают жирорастворимые витамины, витамин В12 и фолат (Howard L. и соавт., 1993). Заместительная терапия данного синдрома обязательно включает парентеральное введение витаминов группы В, С, никотиновой кислоты, энтерально — фолиевой кислоты, рибофлавина, витаминов А, D, Е, К (Крумс Л.М., Сабельникова Е.А., 2002). Парентеральное введение полного комплекса витаминов при этой патологии рекомендуется большинством ведущих специалистов нашей страны и за рубежом (Попова Т.С. и соавт., 2002; Щербакова Г.Н., Рагимов А.А., 2002; Луфт и соавт., 2003; Шестопалов А.Е., 2005; Payne-James J. и соавт., 2001).
У пациентов с заболеваниями печени имеется высокий уровень нарушения всасывания (O’Keefe S.J.D., 1993). Нарушение баланса микронутриентов относятся к серьезной категории проявлений конечной стадии заболеваний печени, включая обострения хронического гепатита, первичный склерозирующий холангит, первичный билиарный цирроз и острые или подострые гепатиты (DiCecco S.R. и соавт., 1989).
Весьма существенная роль инъекциям мультивитаминов (M.V.I.) отводится в периоперативном ведении больных с патологическим ожирением (Holm R., Bakewell S., 2003). Поскольку патологическое ожирение стало носить в ряде стран характер эпидемии (в США более 60 % населения страдает избыточным весом), существует ряд оперативных вмешательств на кишечнике (гастропластика, проксимальное и дистальное желудочное шунтирование и др.), которые препятствуют нормальному прохождению пищи и, таким образом, ее усвоению. В подавляющем большинстве случаев в зависимости от характера хирургической операции во избежание развития серьезного витаминодефицита рекомендуется введение ежедневно M.V.I. от одной суточной дозы (вертикальная окаймляющая гастропластика и проксимальное желудочное шунтирование) до нескольких суточных доз (дистальное желудочное шунтирование).
Мультивитаминные комплексы в наркологии и лечении неврологических заболеваний
На сегодняшний день представляется совершенно доказанной роль витаминов группы В, в частности инъекционных форм, в лечении целого ряда неврологических заболеваний. Эффективность такого комплекса, как Мильгамма, при лечении нейропатий различного генеза доказана в зарубежных и российских клиниках целым рядом исследований (Садеков и соавт., 1998; Котов С.В. и соавт., 2000; Чернышова Т.Е., 2001) и не является предметом данного обзора. С другой стороны, как уже отмечалось, не существует изолированного дефицита только витаминов одной группы. Хотя витамины В1, В6 и В12 и рассматриваются в качестве «классических» неврологических витаминов с многолетней историей, как справедливо подчеркивается в работах российских ученых (Громова О.А., Намазова Л.С., 2003; Ребров В.Г., Громова О.А., 2003), в патогенезе неврологических заболеваний играет не последнюю роль сочетанный дефицит как водо-, так и жирорастворимых витаминов. В обзоре R.A. Sewell и L.D. Recht (2002), посвященном периферическим нейропатиям, рассматриваются две формы дефицита: определенный (обычно связанный с витаминами группы В) и сложный — как результат ряда конкурентных нарушений, связанных с мальабсорбцией. В проведенном авторами анализе большого числа клинических исследований сформулированы основные механизмы развития нейропатий: а) непосредственное влияние этиологических факторов (токсических, гормональных и т.п.), связанных с их проникновением в клетки, нарушением функции клеточных мембран и метаболических внутриклеточных процессов; б) дефицит витаминов группы В (тиамин, ниацин, пиридоксин, цианокобаламин, пантотеновая кислота), альфа-токоферола; в) мультифакторные (сочетанные) воздействия. В качестве основных витаминных препаратов для лечения периферических нейропатий рекомендованы: тиамин 50 мг в/м в течение 3 дней с последующим ежедневным энтеральным приемом поддерживающей дозы 5–10 мг; ниацинамид 100 мг в/в или в/м; цианокобаламин 1 мг в/м в течение одной недели; инъекционные поливитамины — Церневит 5 мл в/в в сутки в течение 10 дней или M.V.I.-12 по 10 мл в сутки в течение 10 дней.
Дефицит витаминов играет существенную роль в развитии нарушений функции органов и тканей при алкоголизме и наркоманиях (Сиволап Ю.Л., Савченко В.А., 2000). Наряду с прямым токсическим воздействием алкоголя на клетки организма хроническое его употребление ведет: к нарушению всасывания витаминов в кишечнике; угнетению синтеза витаминов бактериями кишечника; повышению потребности в витаминах (преимущественно группы В) в связи с необходимостью утилизации алкоголя (относительный дефицит). Существенная роль в патогенезе алкогольных поражений организма, прежде всего неврологических, в настоящее время отводится избыточному образованию свободных кислородных радикалов (СР) и последующему формированию оксидативного стресса. Наиболее часто с алкоголизмом ассоциируется дефицит тиамина. Это может быть результатом комбинации нарушенного всасывания и утилизации тиамина печенью, с возрастанием потребности и возможного апоферментного дефекта (Beers M.H., Berkow R., 1999). Пациенты с алкогольной зависимостью, находящиеся на полном парентеральном питании, склонны, в частности, к развитию синдрома Вернике и корсаковского синдрома (Beers M.H., Berkow R., 1999; Schuckit M.A., 1998). Периферические поражения нервной системы — алкогольные полинейропатии — встречаются наиболее часто (доля в общей структуре полинейропатий — 36 %, Vittadini G. и соавт., 2001), причем по современным представлениям это связано не только с дефицитом витаминов группы В, но и со снижением уровня антиоксидантных витаминов, являющихся частью естественного антиоксидантного механизма (АМ). При хроническом употреблении алкоголя продукция СР возрастает, а активность АМ снижается. Исходя из этого, приоритетным на протяжении последних 10 лет считается парентеральное введение тиамина, других витаминов группы В, витамина А, аскорбиновой, пантотеновой кислоты, биотина (Brust J., 1995), что наиболее успешно может быть достигнуто единым инъекционным поливитаминным комплексом.
Весьма схожие изменения, хотя и со своими особенностями, наблюдаются у больных различными видами наркоманий. Так, по данным исследований Nazrul Islan S.K. и соавт. (2001), уровень в крови витаминов Е, С и А у наркоманов был значительно и достоверно снижен по сравнению с контрольной группой. Существенное снижение концентрации витамина А было отмечено среди лиц с многократным использованием наркотиков. Продолжительность наркомании имела существенную линейную корреляционную связь с сокращением уровней витаминов А и Е. Причем большинство социально-экономических факторов (возраст, доход и т.д.) не влияли на уровни витаминов Е, С и А.
Анализ литературы по результатам широкомасштабных исследований на протяжении более чем 50 лет дает исчерпывающие доказательства, что витамины, минералы и аминокислоты в лечении лекарственной зависимости и реабилитации больных могут редуцировать абстинентные симптомы, увеличивать эффективность лечения, улучшать психологический статус и повышать качество жизни. Опубликованные данные по программам, включающим нутриентную терапию, свидетельствуют об уровне устойчивости долгосрочного результата в 55–81 %.
В то же время включение нутриентной терапии в стандартные схемы лечения наркотической зависимости распространено не столь широко.
Для обеспечения восстановления истощенных метаболических запасов и достижения необходимого терапевтического эффекта у наркозависимых пациентов требуются высокие дозы нутриентов.
В США начиная с 1970 года все полученные данные о лечении наркозависимости включались в большую национальную базу данных. В 1995 году большое исследование было опубликовано в Англии. Результаты лечения для программ, которые включали нутриентные компоненты, были существенно выше, чем в среднем по стране. В свете имеющихся общих знаний было бы недальновидно полагаться исключительно на дополнительные или замещающие препараты для уменьшения симптомов зависимости или влечения к наркотику, так как практика показывает, что такой симптоматический подход может создавать другой тип наркотической зависимости.
Успешные программы несут в себе тенденцию к расширению списка, рекомендованного RDA, и направлены на поддержание хорошего здоровья. Такие программы включают в себя много больше и соответствуют главным целям лечения:
а) адресная ликвидация дефицита, развивающегося от плохого питания, нарушения абсорбции, увеличения экскреции в результате использования наркотика;
б) восстановление нормальной нейротрансмиттерной функции, нарушенной (усиленной) наркотиком;
в) поддержание усиленных нутриентных режимов, направленных на метаболизм и элиминацию наркотиков при хронической интоксикации;
г) адресная индивидуализация нутриентных режимов, соответственно потребностям больного.
Наиболее часто употребляемыми нутриентами в таких программах являются: ниацин/ниацинамид; комплекс витаминов группы В, особенно В1, В5 и В6; антиоксиданты, такие как витамины С и Е; кальций и магний (Scher J. и соавт., 1976; Free V., Sanders P., 1979; Guenther R.M., 1983; Mathews-Larson J., Parker P.A., 1987; Replogle W.H., Elicke F.J., 1989; Beasley J.D. et al., 1991; Evangelou A. еt al., 2000). Каждый из них участвует в большом количестве метаболических процессов, и их дефицит может ассоциироваться с нарушениями высшей нервной деятельности (в первую очередь памяти). Ряд программ для поддержки функций ЦНС включает аминокислоты как прекурсоры нейротрансмиттеров (Blum K. еt al., 1988; Brown R.J. et al., 1990) и незаменимые жирные кислоты (Logan A.C., 2004; Peet M., 2004). Исследования по безопасности показывают, что побочные эффекты краткосрочного применения высоких доз витаминов, минералов и/или комбинаций аминокислот, используемых в процессе лечения наркозависимости, минимальны.
Коррекция витаминодефицита при заболеваниях почек
У пациентов с почечной недостаточностью имеется высокий риск нарушения всасывания из-за сочетанных катаболических изменений и снижения поступления нутритивных компонентов (Shuler C.L., Wolfson M., 1993). В двух недавних исследованиях показано, что пациенты в критическом состоянии, находящиеся на заместительной почечной терапии, имеют сниженные концентрации витаминов С, Е, фолиевой кислоты и пиридоксина фосфата (метаболизированная и фосфорилированная форма витамина В6) (Fortin M.C. и соавт., 1999; Story D.A. и соавт., 1999).
Следует подчеркнуть, что пероральное введение поливитаминов редко приводит к нормализации уровня общего гомоцистеина (важнейший показатель состояния и предиктор развития атеросклеротических поражений сердечно-сосудистой системы) у гемодиализных больных (Bostom A.G. и соавт., 2001). Гипергомоцистеинемия как предполагаемый фактор риска развития атеросклеротического тромбоза наблюдается по крайней мере у 85 % пациентов на поддерживающем гемодиализе и у 65–70 % больных с трансплантацией почек. Гипергомоцистеинемия, постоянно наблюдаемая у гемодиализных больных, проявляет повышенную устойчивость к энтеральному введению витаминов группы В даже в повышенных дозировках. В связи с этим чрезвычайно интересным является недавно опубликованное исследование, в котором подчеркивается существенное преимущество инъекционных форм введения витаминов у больных в конечной стадии почечной недостаточности по сравнению с пероральными (Poge U. и соавт., 2004). В выполненном авторами проспективном пилотном исследовании внутривенное комбинированное введение пациентам 10 мг фолиевой кислоты и 100 мг пиридоксина после каждого диализа и 1000 мкг витамина В12 один раз в неделю в значительной степени предотвращало развитие гипергомоцистеинемии. В другом исследовании (Obeid R. et al., 2005) показано, что внутривенное введение 5 мг фолиевой кислоты, 50 мг пиридоксина и 0,7 мг витамина В12 пациентам на гемодиализе с повышенным содержанием гомоцистеина (более 80 % от общего числа больных) нормализует его концентрацию в плазме у всех пациентов, что дает надежду на возможность замедления развития сердечно-сосудистых осложнений. В совсем новом исследовании А. Pastore и соавт. (2006) показана преимущественная роль ликвидации дефицита фолиевой кислоты по сравнению с витамином В12 в снижении уровня гомоцистеина.
В процессе гемодиализа наряду с потерями витаминов группы В отмечается и дефицит других водорастворимых витаминов, что связано с развитием оксидативного стресса. Оксидативный стресс, определяемый как дисбаланс между кислород-реактивными свободными радикалами (КРСР) и защитными антиоксидантными механизмами, хорошо известен у больных, находящихся на поддерживающем гемодиализе (Loughrey C.M. и соавт., 1994), и представляет важнейший фактор риска развития кардиоваскулярных заболеваний. Оксидативный стресс объясняется как увеличением продукции КРСР, так и снижением АМ. Периодический контакт крови с диализными системами вносит свой вклад в гиперпродукцию КРСР (Himmelfarb J. и соавт., 1991; Cristol J.P. и соавт., 1994). При этом существенно изменяются уровни гидрофильных и липофильных витаминов, обусловливающих антиоксидантную защиту: уровни витамина Е в эритроцитах и мононуклеарных клетках ниже нормальных уровней (Giardini O. и соавт., 1984; Pastor M. и соавт., 1993; Cristol J.P. и соавт., 1997), происходит драматическое снижение уровня витамина С (Taccone-Gallucci M. и соавт., 1986; Descombes E. и соавт., 1993; Morena M. и соавт., 2002). В исследованиях Bohm и соавт. (1997) показано снижение уровня витамина С в плазме крови приблизительно на 50 % в процессе гемодиализа. В недавних исследованиях R. Deicher и соавт. (2005) изучалась связь уровней общего витамина С в плазме крови с кардиоваскулярными изменениями у 138 пациентов, находящихся на поддерживающем гемодиализе (средний возраст — 61 год, 90 мужчин). В основном регистрировались рутинные лабораторные параметры, а преддиализный уровень витамина С в плазме измерялся с помощью жидкостной хроматографии. Пациенты последовательно наблюдались с целью выявления первичных признаков, указывающих на фатальные и нефатальные главные побочные кардиоваскулярные проявления и во всех случаях — кардиоваскулярную смертность. Это исследование подтвердило, что низкий общий уровень витамина С в плазме крови является предиктором нежелательных кардиоваскулярных событий у гемодиализных пациентов. Снижение уровня витамина С в плазме больных с хроническими заболеваниями почек связано и с диетой с пониженным содержанием калия (Kopple J.D., 1997) даже без проведения поддерживающего диализа. Пониженная концентрация в плазме аскорбиновой кислоты отмечается у большинства преддиализных больных. В то же время коррекцию гиповитаминоза С следует проводить с осторожностью, поскольку избыточное введение может повышать риск образования оксалатов и ассоциированного с ними нефролитиаза. С другой стороны, проведение поддерживающего диализа усиливает витаминодефицит, что требует повышения суточных доз витамина С (как и других витаминов).
У хронических почечных больных (особенно на поддерживающем диализе) наблюдаются изменения содержания в плазме и жирорастворимых витаминов.
У пациентов с хронической почечной недостаточностью без поддерживающего диализа и обычной или ограниченной в белке диетой уровень витамина Е может быть пониженным, нормальным или повышенным (Gilmour E.R. и соавт., 1998). В то же время у больных, находящихся на гемодиализе, концентрации токоферола в плазме существенно снижаются (Lim P.S. и соавт., 2000). Поскольку витамин Е, как и витамин С, является частью естественного антиоксидантного механизма, в условиях оксидативного стресса устойчивость организма к повышенному содержанию окисленных продуктов падает, что увеличивает риск развития сердечно-сосудистых поражений.
Внутривенное введение витамина D приводит к значительному улучшению выживаемости пациентов на диализе (Teng M. и соавт., 2005a, b), в соответствии с исследованием, которое было опубликовано в апрельском номере журнала Американского общества нефрологов. Инъекции витамина D в настоящее время рекомендованы только для диализных пациентов с повышенными уровнями паратиреоидного гормона, но сообщение из Massachusetts General Hospital по результатам работы научной группы наводит на мысль, что такое лечение может помочь большинству диализных пациентов продлить жизнь. Среди 300 000 пациентов в США, находящихся на диализе, годовая смертность составляет примерно 20 %, причем среди причин на первом месте — кардиоваскулярные осложнения. У здоровых людей в почках происходит превращение неактивной формы витамина D, получаемой с пищей, в активную, которая используется организмом в биохимических процессах. Больные почки не могут утилизировать витамин D и должны получать уже активированную форму во избежание дефицита. В настоящее время в США около 50 % пациентов с почечной недостаточностью получают активную форму витамина D, в то время как официальные рекомендации касаются только больных с повышенным уровнем паратиреоидного гормона. Были проведены двухгодичные исследования в Северной Америке (Fresenius Medical Care North America, Lexington) в период с 1996 по 1999 г. и продолженные вплоть до 2002 года, в которых из 50 000 пациентов более чем 37 000 получали инъекции ряда форм активного витамина D. По окончании двухгодичного исследовательского периода 76 % пациентов из тех, что получали инъекции витамина D, были живы, в то время как в группе, не получавшей витамина D, — только 59 %. Такое более чем 20% снижение летальности наблюдалось у всех категорий пациентов независимо от возраста и других факторов. Даже у больных с повышенным уровнем кальция или фосфатов, который часто служит основанием для прекращения терапии витамином D, продолжительность жизни была выше при условии получения ими инъекций витамина D. Эти результаты должны быть в дальнейшем подтверждены рандомизированными клиническими исследованиями для выработки точных рекомендаций, чтобы определить все группы пациентов, которым нужна такая терапия.
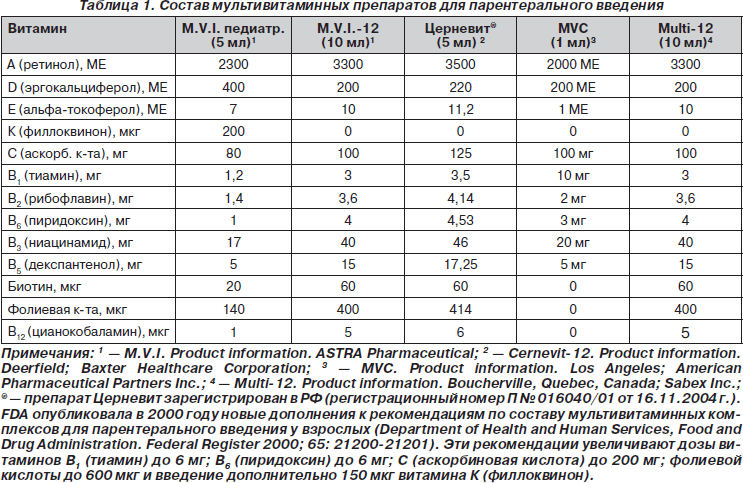
Дискуссионным на сегодняшний день остается вопрос о роли и метаболической функции витамина А при почечной недостаточности и в процессе диализа, поскольку имеются данные о традиционной кумуляции этого витамина и повышении его концентрации в плазме крови у диализных больных (De Bevere и соавт., 1981; Ono K., Waki Y., Takeda K., 1984; Fishbane S. и соавт., 1995; Chazot C., Kopple J.D., 1997). Исследование M.T. Vannucchi и соавт. (1992) у пациентов на перитонеальном диализе показало, что уровень витамина А и ретинолсвязывающего белка у пациентов на диализе выше, чем у нелеченых больных, независимо от возраста, длительности заболевания, продолжительности диализа, диеты и ряда других факторов. В то же время авторы не обнаружили каких-либо признаков передозировки (интоксикации) витамина А. Следует подчеркнуть, что содержание витамина А в современных мультивитаминных комплексах для инъекций в рекомендованных суточных дозах не может способствовать передозировке и развитию связанных с этим побочных эффектов (табл. 1 и 2), которые возникают при введении высоких доз витамина А.
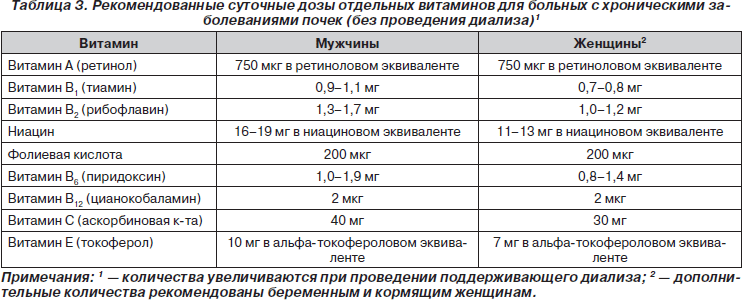
В целом рекомендованные дозы витаминов для больных с хроническими заболеваниями почек приведены в табл. 3 (The CARI Guidelines — Caring for Australians with Renal Impairment. Nutrition and Growth in Kidney Disease, October, 2004).
Инъекционные поливитаминные комплексы в лечении заболеваний крови
Применение инъекционных форм витаминов является общепринятым при лечении заболеваний крови различного генеза (Горбачев В.В., Горбачева В.Н., 2002; Гусева С.А., 2004). В то же время при назначении таких препаратов в реальной клинической практике предпочтение отдается тем витаминным комплексам или отдельным витаминам, которые играют ведущую роль в этиологии и/или патогенезе конкретного заболевания. Это положение нельзя признать абсолютно правильным, поскольку в большинстве состояний и заболеваний крови имеет место общий дефицит многих витаминов, выраженный в большей или меньшей степени.
К числу витаминодефицитных заболеваний крови относится пернициозная анемия (синонимы: В12-дефицитная анемия, кобаламин-дефицитная анемия, анемия Бирмера, анемия Хантера — Аддисона, анемия Ледерера, анемия Бирмера — Эрлиха, болезнь Аддисона — Бирмера, макроцитарная анемия, злокачественная анемия). Хорошо известно, что пернициозная анемия — это хроническое заболевание, вызванное нарушением абсорбции витамина В12 из-за недостатка внутреннего фактора (ВФ) в желудочной секреции. Классическая пернициозная анемия возникает в результате неспособности желудочных париетальных клеток продуцировать достаточное количество ВФ для абсорбции адекватного количества пищевого витамина В12. Другие расстройства, которые вмешиваются в абсорбцию и метаболизм витамина В12, могут продуцировать дефицит кобаламина с развитием макроцитарной анемии и неврологических осложнений. Пернициозная анемия возникает как соответствующая общая форма анемии у взрослых, связанная с атрофией желудочно-кишечного тракта и снижением продукции ВФ, и реже как конгенитальная аутосомальная форма, при которой ВФ-продукция снижается без наличия желудочной атрофии.
Патогенетическое медикаментозное лечение пернициозной анемии наряду с другими методами (Conrad M.E., 2002, Brick W., Burgess R., 2002) на современном этапе включает инъекционное введение витамина В12 (цианокобаламин, кристамин, циомин; активные формы в организме — деоксиаденозилкобаламин и гидроксокобаламин). Препарат витамина В12 вводят ежедневно внутримышечно в дозе 200–500 мкг 1 раз в день в течение 4–6 недель до наступления гематологической ремиссии. Критериями гематологической реакции являются резкое увеличение количества ретикулоцитов в периферической крови — ретикулоцитарный криз, трансформация мегалобластического кроветворения в нормобластическое. Появление ретикулоцитарного криза на 5–6-й день лечения является ранним критерием эффективности его. В процессе лечения цианокобаламином количество эритроцитов нарастает быстрее, чем содержание гемоглобина, в связи с этим цветовой показатель обычно снижается. После нормализации костномозгового кроветворения и состава крови (обычно через 1,5–2 месяца) витамин вводят 1 раз в неделю в течение 2–3 месяцев, затем в течение полугода 2 раза в месяц в тех же дозах, что и в начале курса.
Дополнительной терапией является парентеральное введение мультивитаминных комплексов, содержащих все водо- и жирорастворимые витамины в рекомендованных FDA суточных дозах: М.В.И. (M.V.I.-12 — multivitamins injection) 10 мл/день в/в или Церневит (Cernevit-12) 5 мл/день в/в. Педиатрические дозы составляют: М.В.И. для детей в возрасте менее 12 лет — 5 мл/день в/в, старше 12 лет — 10 мл/день; Церневит: менее 12 лет — 2,5 мл/день в/в, старше 12 лет — 5 мл/день в/в (Conrad M.E., 2002). Такое дополнение увеличивает эффективность основной терапии за счет устранения сопутствующего дефицита других витаминов.
Парентеральное введение мультивитаминных комплексов может оказывать положительное действие и при лечении тяжелых форм железодефицитных анемий при выраженных нарушениях всасывания в желудочно-кишечном тракте. Наибольшее значение имеют витамины А и С.
Острый респираторный дистресс-синдром (ОРДС)
В тканях, подвергшихся ОРДС, наблюдаются оксидативные повреждения реактивными окисляющими субстанциями (Metnitz P.G.H. и соавт., 1999). У пациентов с этим синдромом антиоксидантная система строго ориентирована на начало заболевания и продолжает оказывать влияние в течение всего болезненного состояния. Более того, прогрессивное увеличение конечных продуктов пероксидации липидов в плазме дает дополнительное доказательство увеличения оксидативного стресса. Тот факт, что уровни аскорбиновой кислоты, альфа-токоферола и бета-каротина в плазме снижаются у пациентов с ОРДС, подчеркивает необходимость пополнения этих нутритивных антиоксидантов (Metnitz P.G.H. и соавт., 1999).
Мультивитамины и ВИЧ-инфекция
Нарушение всасывания характерно для пациентов с синдромом приобретенного иммунодефицита (СПИД). Причинами могут быть как само заболевание, так и присоединившаяся инфекция, вызывающая диарею, нарушение всасывания и дефицит калорий (Harriman G.R. и соавт., 1989). Сообщалось о дефиците фолата и витамина В12 у ВИЧ-инфицированных (Herbert V. и соавт., 1988, 1989; Harriman G.R. и соавт., 1989). Пациенты со СПИД-ассоциированным истощением, которые получали ППП, нуждались в ежедневной инфузии мультивитаминов для удовлетворения возросших потребностях в них.
Вопрос применения мультивитаминов для лечения ВИЧ-инфекций в последние годы получил серьезное развитие в связи с полученными данными об их способности улучшать лабораторные показатели и клиническую картину у таких пациентов (Marston B., De Cock K.M., 2004). Микронутриенты играют важную роль в поддержании иммунной функции и нейтрализации оксиген-реактивных посредников, продуцируемых активацией макрофагов и нейтрофилов в ответ на микроорганизмы. Уровень витаминов и микроэлементов плазмы, который является индикатором их запасов в организме, указывает на их дефицит среди ВИЧ-инфицированных в целом, и особенно у тех, кто относится к беднейшим слоям населения (женщины в развивающихся странах и наркоманы). Порочный цикл представляется в таком аспекте: постоянно недоедающие ВИЧ-инфицированные имеют дефицит микронутриентов, ведущий к дальнейшей иммуносупрессии и оксидативному стрессу, последующему ускорению ВИЧ-репликации и подавлению CD4+ T-клеток (Semba R.D., Tang A.M., 1999).
В то же время трудно доказать причинную связь между специфическим дефицитом и побочными клиническими последствиями у ВИЧ-инфицированных и данными, связывающими замещение или дополнение специфическими микронутриентами с клиническим преимуществом. Fawzi и его коллеги сообщают о результатах контролируемого исследования добавления мультивитаминов среди ВИЧ-инфицированных беременных женщин в Танзании (Fawzi W.W. и соавт., 2004). Это сообщение вызывает не только ряд важных вопросов о достоверности данных, но также поднимает обширную тему относительно роли питания в поддержании здоровья у ВИЧ-инфицированных и больных СПИДом в Африке в эру увеличения доступности антивирусной терапии. Авторы сравнивают добавки, содержащие мультивитамины, только витамин А, а также то и другое с плацебо. Они обнаружили, что у женщин, которые получали мультивитаминные добавки, отмечается меньшее прогрессирование стадий ВИЧ-инфекции, лучшее сохранение количества CD4+ T-клеток, меньшее количество вирусных клеток, более низкий уровень связанных с ВИЧ-инфекцией уровень заболеваемости и смертности по сравнению с женщинами, получавшими плацебо. Витамин А снижал эффект мультивитаминов, а когда давался отдельно, оказывал негативный эффект.
Достоверность этих данных подтверждается качеством дизайна исследования и методами, соответствующим анализом и соответствием существующим на сегодня ограниченным данным, показывающим снижение смертности среди ВИЧ-инфицированных на Тайване, получавших мультивитамины (Jiamton S. и соавт., 2003). Fawzi и соавт. ранее показали, что мультивитамины могут применяться с целью улучшения последствий беременности, включая появление новорожденных с низким весом, преждевременные роды и внутриутробную смерть (Fawzi W.W. и соавт., 1998). Несмотря на то что некоторые данные указывают на связь дефицита витамина А с возрастанием риска перинатальной передачи инфекции и некоторых других побочных проявлений (Semba R.D. и соавт., 1994), добавление витамина А, по недавним данным (Fawzi W.W. и соавт., 2002), увеличивает частоту передачи инфекции от матери к ребенку. На основе этих данных, а также других представляется нецелесообразным применение витамина А для предупреждения ВИЧ-инфекции. Эти данные представляют собой небольшой первичный опыт экстенсивного применения мультивитаминов у населения Африки, но долгосрочное введение мультивитаминов пока требует дальнейшего осмысления. Более того, нет серьезных данных о количественной потребности в мультивитаминах у ВИЧ-инфицированных взрослых пациентов в цивилизованных странах, хотя рутинное добавление мультивитаминов практикуется довольно часто. Таким образом, перед вынесением окончательных рекомендаций по рутинному использованию мультивитаминов в лечении ВИЧ- инфекции и СПИДа необходимо получить новые доказательства об эффектах мультивитаминов на большей популяции, в частности, среди персон с более продвинутой формой ВИЧ-инфекции или более серьезным нутритивным дефицитом. Это также ни в коей мере не означает принижения роли специфической антивирусной терапии данного заболевания.
Витаминодефицит и его коррекция при лечении онкологических заболеваний
У пациентов с онкологическими заболеваниями существуют общие предпосылки для нарушения всасывания и развития дефицитов микронутриентов в связи с рядом факторов, служащих причиной нарушения абсорбции и повышения потребностей. Они включают хирургические интервенции, химиотерапию и лучевую терапию. Снижение в плазме концентрации таких витаминов, как В1, В2, В6 и РР, примерно на 40 % указывает на необходимость адекватного восполнения витаминов (Sclafani L.M., Brennan M.F., 1991). Использование селективной химиотерапии и лучевой терапии также приводит к образованию свободных радикалов (Conklin K.A., 2000; Lamson D.W., Brignall M.S., 1999, 2000). Эти воздействия являются оксидативным стрессом, назначение которого — редуцировать пролиферацию раковых клеток. Схемы селективной химиотерапии должны создавать клеточные повреждения за счет инициации свободных радикалов алкилирующими агентами, такими как циклофосфамид, ифосфамид и мелфан; опухолевыми антибиотиками, такими как доксорубицин, блеомицин и эпирубицин; препаратами платины — цисплатин (Conklin K.A., 2000; Labriola D., Livingston R., 1999; Lamson D.W., Brignall M.S., 1999, 2000). Радиационная терапия использует ионизирующую радиацию для уничтожения клеток через генерацию свободных радикалов (Lamson D.W., Brignall M.S., 1999, 2000). К сожалению, ряд физиологических побочных эффектов этих схем лечения (например, доксорубицин-вызванная кардиотоксичность, цисплатин-вызванная нефротоксичность, блеомицин-вызванный легочный фиброз) также обусловлен оксидативным повреждением (Conklin K.A., 2000). Хотя большинство клиницистов отмечает положительные эффекты антиоксидантов, главная концепция заключается в том, что использование антиоксидантов совместно с лечением онкологических заболеваний приводит к их взаимодействию с онкопрепаратами и методами и снижает эффективность последних. Как это взаимодействие происходит, в какой степени и в каком количестве давать антиоксиданты, чтобы сохранить эффект противоопухолевой терапии и при этом снизить ее побочные эффекты, остается недостаточно изученным. Врачу следует ориентироваться в конкретной клинической ситуации в зависимости от состояния больного, особенностей заболевания, интенсивности и характера медикаментозной и лучевой терапии. В количественном плане сопроводительное лечение онкологических больных мультивитаминными комплексами может содержать от 100 до 200 % суточной потребности обычного человека (Hamilton K.K., 2001).
Из литературы также известно, что добавление мультивитаминов помогает предотвратить синдром дефицита у онкологических больных, у которых прогрессивно развивается кахексия как результат нарушения всасывания. Витамин Е может оказывать защитное влияние при раке простаты (Plander P., Azzi D., 1998; Fairfield K., Fletcher R., 1998). Мультивитамины могут редуцировать риск развития рака ободочной и прямой кишки. Эта особенность может быть связана с наличием в мультивитаминном комплексе фолиевой кислоты, хотя и другие нутриенты могут также вносить свой вклад в положительный терапевтический эффект (Giovannucci E. и соавт., 1998).
Ряд интересных и очень важных исследований в плане профилактики онкологических заболеваний и их сопутствующего лечения, понимания механизмов, лежащих в основе клинической эффективности витаминных комплексов, проведен в последние годы отечественными учеными (Зиновьева В.Н., Спасов А.А., 2004). Несмотря на то что они касались в основном энтерально применяемых препаратов, а также в составе комплексной терапии, полученные результаты вполне могут быть экстраполированы и на инъекционные формы мультивитаминов, которые пока еще не всегда доступны в России. Обнаружено, что у больных предраковыми заболеваниями имеется не только дефицит основных антиоксидантных витаминов (А, Е и С), но и прямая зависимость степени поражений от выраженности этого дефицита. Применение комплекса указанных витаминов уже в течение 15 дней нормализует показатели иммунитета, усиливает заживление язвенных поражений. Это позволяет прогнозировать замедление и предотвращение процессов малигнизации при постоянном и длительном применении мультивитаминов.
Поливитамины для инъекций в гериатрии
В процессе старения организма снижается интенсивность всех основных этапов метаболизма витаминов и их влияние на биохимические процессы. За счет снижения всасывания в ЖКТ (нарушение абсорбции, синтеза ряда витаминов группы В, транспорта через стенку кишечника) развивается возрастной дефицит. Наличие нарушений питания подтверждено многочисленными исследованиями (Bistrian B.R. и соавт., 1974, 1976; Weinsier R.L. и соавт., 1979; Willard M.D. и соавт., 1980; Rein- hardt G.F. и соавт., 1980) различных групп пациентов. Хирургические пациенты и пожилые люди представляют группы с наибольшим риском (Bistrian B.R. и соавт., 1976; Sullivan D.H. и соавт., 1989). Соответственно дополнение витаминами является важной составной частью общей нутритивной поддержки пожилых пациентов, которые нуждаются в парентеральном питании. Витамины — незаменимые нутриенты. Они необходимы для поддержания клеточных функций через влияние на структурные белки и антиоксидантную защиту липидов мембран. Витамины также требуются для поддержания клеточного метаболизма; они являются необходимыми коферментами в широком круге метаболических процессов, при этом витаминный дефицит может приводить к повреждению клеточных и органных функций и рецидивированию заболеваний (Zaloga G.P., Bortenschlager L., 1993). Исследования у пожилых людей показывают, что дефицит микронутриентов может подрывать клеточную иммунную функцию и что введение витаминных добавок может восстанавливать иммунный ответ (Bogden J.D., Louria D.B., 1999).
К наиболее значимым факторам витаминной недостаточности у лиц пожилого возраста относят снижение поступления витамина В12, фолиевой кислоты и витамина С. В прошлом рекомендованное поступление витаминов для лиц пожилого возраста основывалось на тех уровнях, которые были адекватны для предотвращения клинического дефицита. В более поздних исследованиях были получены доказательства, что поступление и концентрация витаминов в плазме, таких как В12, фолиевая кислота и С, в более высоких дозах, чем те, которые необходимы для предотвращения клинического дефицита, могут оказывать важное влияние на состояние здоровья. Добавление витамина В12 и фолиевой кислоты снижает концентрацию гомоцистеина в плазме. Даже небольшое повышение плазменного гомоцистеина увеличивает риск сосудистых заболеваний (Boushey C.J. и соавт. 1995; Selhub J. и соавт. 1996.; Chasan-Taber L. и соавт. 1996; Naurath H.J. и соавт. 1996; Verhoef P. и соавт. 1996; Graham I.M и соавт., 1997; Konecky N. и соавт. 1997; Rimm E.B. и соавт. 1998). Несмотря на накопленные доказательства защитных сосудистых эффектов повышенного поступления В12 и фолиевой кислоты, эти доказательства рассматривались как предварительные для включения в официальные рекомендации (Institute of Medicine, Food and Nutrition Board, 1998). Сходным образом отмечена обратная взаимосвязь между поступлением витамина С и/или его концентрациями в крови и наличием атеросклеротических сосудистых заболеваний, особенно инсульта (Gale C.R. и соавт., 1995; Jha P. и соавт., 1995). В отношении фолиевой кислоты исследования отчетливо показывают, что в популяции людей с высоким риском сердечно-сосудистых заболеваний введение высоких доз фолатов ведет к снижению уровня гомоцистеина в плазме приблизительно на 30 % (с 11,1 до 7,2 mмоль/л) и это связано с уменьшением потребности в реваскуляризации, а в общеклиническом плане — к снижению смертности в конце 1-го года (Schnyder G. и соавт., 2002).
Имеются данные о снижении познавательных функций у лиц с низкой концентрацией В12 и/или фолиевой кислоты (и повышенной концентрацией гомоцистеина) (Van Goor L.P. и соавт., 1995; Riggs K.M. и соавт., 1996; Ortega R.M. и соавт., 1996; LaRue A. и соавт., 1997; Bernard M.A. и соавт., 1998) и витамина С (Perrig W.J. и соавт., 1997). Клинические данные свидетельствуют, что депрессия — наиболее частое нейропсихиатрическое проявление дефицита фолиевой кислоты (Herbert V., 1961; Abou-Saleh M.T., Coppen A., 1989; Alpert J.E., Fava M., 1997; Fava M. и соавт., 1997), и этот аспект необходимо тщательно продумывать при исследовании познавательной функции, так как хорошо известно, что депрессия может имитировать нарушение познавательной функции (псевдодеменция). В исследовании R.D. Lindeman и соавт. (2000) отчетливо показано, что введение мультивитаминного комплекса M.V.I. приводит к повышению уровня витаминов В12, фолиевой кислоты и С по сравнению с контрольной группой. Выявлена значительная связь между уровнем фолиевой кислоты в плазме крови и познавательной функцией в группах пожилых пациентов, но гораздо меньшее влияние этого показателя на аффективные функции исследуемых. Высокий уровень антиоксидантов ассоциируется с улучшением ментальной функции, в частности памяти (Posner B.M. и соавт., 1994). Дополнение терапии мультивитаминами, включающими витамины С, В6, Е, D и фолиевую кислоту, улучшает ментальные функции и может даже отсрочить начало развития болезни Альцгеймера (Berkeley Wellness Letter, 2002).
На основании приведенных данных можно сделать заключение об эффективности терапии мультивитаминными комплексами у лиц пожилого возраста в предотвращении в первую очередь психонейрофизиологических проявлений процесса старения и профилактике сердечно-сосудистых осложнений.
Мультивитаминные комплексы для инъекций в педиатрии
Витамины для парентерального введения — необходимый ежедневный компонент краткосрочного или долгосрочного (более 1 месяца) парентерального питания в педиатрии. Соответствующие витаминные добавки необходимы для поддержания нормальных клеточных и метаболических функций, регуляции иммунного ответа и обеспечения роста. Во время развития стресса и активной фазы болезни потребности в витаминах могут возрастать из-за их потери, увеличения утилизации или неадекватного поступления. Недостаточность лежащих в основе питания протеиновых калорий или дефицит специфических нутриентов могут ограничивать излечение и тканевые репаративные процессы. Также риск витаминного дефицита и повышение метаболизма витаминов увеличиваются у недоношенных детей из-за нарушения обмена в мочевыводящих путях, недоразвития органов и болезненного состояния, обусловленного преждевременными родами. Для детей старше 11 лет в США имеется ряд мультивитаминных препаратов для инъекций, но только один препарат M.V.I. педиатрический одобрен для применения у новорожденных и детей до 11 лет.
Абсолютные потребности в парентеральных витаминах для детей и частично для новорожденных не определены, а витаминный дефицит соотнесен с текущими рекомендациями для мультивитаминных добавок. Значение совместимости и стабильности осложняет выработку стратегии дозирования, особенно у детей в активной фазе заболевания, что диктует необходимость тщательного клинического мониторинга витаминного статуса.
Всеобъемлющие рекомендации для парентеральных витаминных добавок созданы Nutrition Advisory Group (American Medical Association — NAG-AMA) и отражены в рапорте Committee on Clinical Practice Issues (American Society for Clinical Nutrition — ASCN). Совсем недавно A.S.P.E.N. Safe Practices for Parenteral Nutrition Formulations повторно напомнила, что суточные дозы мультивитаминов должны добавляться к растворам для ПП непосредственно перед инфузией, поскольку возможно потенциальное взаимодействие между витаминами и пластификаторами или другими добавками к ПП, а также светодеградация.
В подавляющем большинстве случаев для покрытия витаминодефицита достаточно введение одной суточной дозы мультивитаминов для инъекций без дополнительного введения каких-либо доз отдельных витаминов. Как показало ретроспективное исследование A. Sitruk и соавт. (2001), эффективность препарата Церневит у детей, получавших полное парентеральное питание на протяжении более чем 2 лет по причине серьезных заболеваний желудочно-кишечного тракта, была не меньшей, чем его же внутривенное введение с дополнением болюсами жирорастворимых витаминов (витамин D в дозе 10 000 МЕ и витамин Е в дозе 100 мг). Более того, дополнительное введение витаминов D и Е в дозах, превышающих рекомендованные, увеличивает риск развития гипервитаминозов, особенно в условиях длительного парентерального питания.
Потребности в витаминах у детей исследованы недостаточно полно. Для недоношенных, новорожденных и детей моложе 11 лет в США доступен только препарат M.V.I. педиатрический для инфузий. После разведения лиофилизированного порошка в 5 мл стерильной воды для инъекций, или 5% глюкозе, или 0,9% растворе хлорида натрия данный продукт обеспечивает соответствующую комбинацию водо- и жирорастворимых витаминов, предназначенную для растворения в 100 мл или более внутривенного раствора.
M.V.I. педиатрический для инфузий показан в качестве парентерального мультивитаминного комплекса для ежедневного введения недоношенным, новорожденным и детям до 11 лет, получающим ПП, или же детям в особых ситуациях, таких как широкомасштабные хирургические вмешательства, обширные ожоги, травмы, серьезные инфекции. Хотя аллергические реакции на введение парентеральных мультивитаминов редки, они могут возникать вследствие внутривенного введения витамина К и тиамина. Противопоказания включают гиперчувствительность к какому-либо витамину или другим компонентам в составе или предшествующий гипервитаминоз.
Рекомендованные дозы производителя и Food and Drug Administration (FDA) для парентеральных мультивитаминных добавок у детей обоснованы, исходя из нормальной возрастной функции органов, и составляют: 30 % от растворенной дозы во флаконе 5 мл (1,5 мл) для новорожденных весом менее 1 кг, 65 % (3,5 мл) — для новорожденных весом от 1 до 3 кг и целый флакон (5 мл) — для новорожденных весом более 3 кг и детей до 11 лет. ASCN рапорт свидетельствует, что идеальной парентеральной мультивитаминной формулы для недоношенных не существует и что специфическая формула для недоношенных должна определяться, исходя из снижения дозы большинства водорастворимых витаминов и увеличения количества витамина А.
Для детей 11 лет и старше, получающих ПП, в США рекомендованы парентеральные мультивитаминные продукты для взрослых. Эти дети получают дозы, рекомендованные NAG-AMA для взрослых, в частности M.V.I.-12 в объеме 10 мл ежедневно. В случае какой-либо гиперчувствительности или проявлений гипервитаминоза эти формулы могут быть противопоказаны. В приведенной табл. 1 сравнивается количество отдельных витаминов в мультивитаминных препаратах, применяемых для парентерального введения.
Витаминопрофилактика и витаминотерапия в спорте
Следует подчеркнуть, что витаминные препараты относятся к группе недопинговых средств фармакологической коррекции метаболических процессов у спортсменов и включены во многие схемы подготовки и реабилитации (Макарова Г.А., 1999, 2002; Дидур М.Д., 2002). На основании разработок указанных авторов сформулированы следующие показания к применению поливитаминных комплексов при занятиях спортом.
— Профилактика гиповитаминозов. Клинические и субклинические признаки гиповитаминозов имеют от 20 до 60 % спортсменов.
— Возрастание потребности в витаминах. Периоды интенсивных ростовых сдвигов и полового созревания в детском и юношеском спорте требуют адекватного применения витаминов. Витаминной дотации требует значимое изменение любого компонента тренировочной программы: объема, интенсивности, частоты тренировок.
— Изменения пищевого рациона:
а) алиментарная недостаточность (встречается в детском и юношеском спорте);
б) несбалансированность питания. Сбалансированный и разнообразный рацион питания в соответствии с этапами подготовки по-прежнему остается лишь благим пожеланием. К тому же доказано, что даже идеальный пищевой рацион дефицитен на 20–30 % по жизненно необходимым витаминам;
в) снижение калорийности суточного пищевого рациона менее 2000 ккал в сутки при направленной регуляции массы тела;
г) резкое изменение пищевого статуса (сгонка веса, «чистое» вегетарианство, посты и пр.);
д) потребление большого количества белка (в том числе в виде пищевых добавок и аминокислот).
— Резкая смена климатических и часовых поясов. Применение витаминов позволяет нивелировать воздействие десинхронозов, патологических адаптационных реакций.
— Направленная коррекция анаболических, катаболических и восстановительных процессов. Витамины участвуют в большинстве процессов трансформации энергии, поэтому назначаются в зависимости от направленности тренировочных программ.
— Направленная коррекция физической и умственной работоспособности.
— Состояние перетренированности.
— Восстановление после заболеваний и травм.
— Нарушения углеводного, жирового или белкового обмена. Углеводное питание увеличивает потребность в витаминах B1, B6, C. Избыток в пище белка приводит к возрастанию потребности в витаминах B2, B6, B12, а недостаток белка снижает усвоение витаминов B2, C, A и никотиновой кислоты.
— Поддержание нормальной иммунологической реактивности организма.
Основным постулатом, определяющим необходимость дополнительного введения витаминных препаратов современным спортсменам, является недостаточное обеспечение поступления витаминов (как и многих других нутриентов) с обычным или даже повышенным приемом пищи (Williams M.H., 2004). Организм человека не создан для адекватной поддержки уровня физической активности спортсменов сегодняшнего дня. Высокоинтенсивное и быстрое использование энергетических запасов, которое происходит в теле и наносит урон тканям организма, происходит быстрее, чем процессы восстановления. В ответ на серьезные испытания физическими нагрузками на тело атлета возрастают потребности клеток в макро- и микронутриентах и жидкости, необходимых для восстановления и предотвращения повреждений мышц и связок. Всякий раз, когда тело увеличивает продукцию энергии, усиливаются биохимические процессы за счет клеточных запасов, а в случае существенного снижения этих запасов происходит повреждение клеток. Вдобавок к этому повышается уровень адреналина, что еще больше усиливает повреждение тканей. Эти два условия являются наиболее частой причиной повреждений и удлиняют восстановительный период, нанося спортсмену существенный вред. Ежедневное поступление менее 1/3 от рекомендованных количеств витаминов В1, В2, В6 и С, даже когда другие витамины добавлены в диету, ведет в течение менее чем 4 недель к нарушению транспорта кислорода и снижению анаэробного порога (Van der Beek E., 1991). В то же время большинство исследований четко показывает, что даже употребление спортсменами высококалорийной диеты, содержащей все рекомендованные дневные дозы витаминов, приводит, тем не менее, к дефициту ряда витаминов и минералов (Armstrong L., Maresh C., 1996). Основываясь на отечественных данных (Дидур М.Д., 2003), даже соответствующий средним энергозатратам современного человека рацион на 2500 ккал, сбалансированный и разнообразный, дефицитен по большинству витаминов на 20–30 %.
Серьезные зарубежные исследования указывают на то, что хотя большинство людей не получают с обычной диетой достаточного количества витаминов, их добавление должно быть ограничено разумными пределами — не более 100–150 % от суточных рекомендованных количеств (Fairfield K., Flet- cher R., 2002; Fletcher R., Fairfield K., 2002). Прием адекватного количества витаминов, включая применение добавок, является разумным шагом для целого ряда спортсменов. Мелинда Мэнор (Manore M., 2001, parts I and II) пишет, что спортсмены, вовлеченные в активный тренировочный процесс (школа высшего спортивного мастерства) с тяжелыми физическими нагрузками, испытывают дефицит по целому ряду витаминов, особенно участвующих в выработке энергии, но их количество не должно превышать рекомендованные суточные дозы более чем в два раза. С другой стороны, во время проведенного круглого стола (Benardot и соавт., 2001) ряд экспертов в области спортивного питания подчеркивал, что ряд спортсменов имеет существенный риск витаминного дефицита, особенно в тяжелой атлетике, а также те атлеты, которые по тем или иным причинам не имеют хорошо сбалансированной диеты.
Статистический анализ показывает, что витамины являются практически постоянным компонентом нутритивной поддержки у спортсменов различной специализации (Jacobson B. и соавт., 2001). С другой стороны, прием этих добавок и препаратов осуществляется зачастую самими спортсменами широко и бесконтрольно в нарушение основных принципов применения недопинговых фармакологических средств (Макарова Г.А., 1999, 2002; Сейфулла Р.Д., 1999). Учитывая, что основным путем введения является энтеральный прием, особенно длительный, в мегадозах, это сопровождается развитием гипервитаминозов (Дидур М.Д., 2002, 2003) и раздражением желудочно-кишечного тракта, нарушением процессов пищеварения. Гипервитаминозы — актуальнейшая проблема для спортивной медицины, где большие дозы витаминов применяются весьма широко и нерациональное введение избыточных доз может серьезно нарушить гомеостаз организма. Кроме того, энтеральный путь введения обеспечивает всасывание не более 10–15 % от введенной дозы витаминов, при этом контроль за уровнем витаминов в крови и тканях практически не осуществляется. Таким образом, дозирование препаратов представляет при энтеральном пути введения серьезную проблему. Кроме того, эффективность энтерального введения спортсменам (даже длительного) мультивитаминных комплексов во многих исследованиях не получила своего подтверждения (Singh A. и соавт., 1992; Telford R. и соавт., 1992; Weight L. и соавт., 1998).
В связи с этим парентеральное введение мультивитаминов, обеспечивающее высокую биодоступность при существенно более низких дозах, возможность дозирования, интактность желудочно-кишечного тракта, при условии тщательного врачебного контроля может быть разумной альтернативой энтеральному приему. В то же время этот аспект требует дальнейшего научного и клинического исследования.
Потенциально вредные эффекты микронутриентов
В целом добавки микронутриентов имеют положительное влияние, но в ряде случаев они не являются необходимыми и могут потенциально оказывать отрицательное воздействие. Иногда их называют «Янус-эффекты» (ассоциация с двуликим Янусом), так как, с одной стороны, они оказывают благоприятное влияние, а с другой (в зависимости от дозы и характера заболевания) — могут ухудшать течение процесса. Так, метаанализ применения витамина Е (Miller III E.R. и соавт., 2005) показал, что этот витамин имеет не только положительное действие, но и при превышении суточных доз свыше 150 МЕ может увеличивать смертность больных от различных причин. Такая потенциальная клиническая опасность высоких доз витамина Е ставит под вопрос целесообразность искусственного добавления токоферола в макронутриенты (в частности, в жировые эмульсии МСТ/ЛСТ с целью улучшения их свойств в условиях оксидативного стресса) для парентерального питания, особенно при его долгосрочном проведении.
Эти и другие факты отрицательного действия высоких доз витаминов требуют оптимизации их введения в клинической практике в зависимости от характера и стадии заболевания, индивидуальных особенностей метаболического статуса пациентов.
Состав мультивитаминных комплексов для инъекций и международные рекомендации по применению
Текущие рекомендации для состава мультивитаминных препаратов для внутривенного введения взрослым пациентам были подготовлены Nutrition Advisory Group of the Department of Foods and Nutrition of the American Medical Association (NAG-AMA). Эти рекомендации — важная основа для определения минимальных потребностей (AMADFN, 1979). Они базируются на рекомендованных пищевых прописях (RDAs) National Academy of Sciences/National Research Council (NAS/NRC). У пациентов в критических состояниях потребность в витаминах существенно выше, чем обычные рекомендованные дозы для энтерального применения, что и находит отражение в рекомендованных дозах в составе мультивитаминов для парентерального введения (табл. 2).
1. Горбачев В.В., Горбачева В.Н. Витамины, микро- и макроэлементы. Справочник. — Книжный Дом, Интерпрессервис, 2002. — 544 с.
2. Громова О.А., Намазова Л.С. Витамины и минералы в современной клинической медицине. Учебно-методическое пособие. — Москва, 2003.
3. Гусева С.А. Болезни системы крови. — 2-е изд. — Медпресс, 2004. — 488 с.
4. Дидур М.Д. Недопинговые фармакологические средства спортивной медицины. Пособие для врачей. — СПГМУ им. ак. И.П. Павлова, 2002. — 44 с.
5. Дидур М.Д. Современные подходы к применению витаминных и иммунологических препаратов в спортивной медицине и программах физической реабилитации. Пособие для врачей. — СПГМУ им. ак. И.П. Павлова, 2003. — 48 с.
6. Ефименко Н.А. и соавт. Искусственное лечебное питание в интенсивной медицине и реанимации. Методические рекомендации. — М.: ГВКГ им. Н.Н. Бурденко, 2000.
7. Луфт В.М. и соавт. Руководство по клиническому питанию больных в интенсивной медицине. — Санкт-Петербург: Фарм Инфо, 2003. — 325 с.
8. Котов С.В. и соавт. Диабетическая нейропатия. — М.: Медицина, 2000. — 232 с.
9. Крумс Л.М., Сабельникова Е.А. Синдром короткой тонкой кишки: актуальные проблемы патогенеза, клиники и лечения // Консилиум Медикум. — 2002. — Т. 4, № 6.
10. Макарова Г.А. Фармакологическое обеспечение в системе подготовки спортсменов. — Краснодар: Сов. Кубань, 1999. — 120 с.
11. Макарова Г.А. Практическое руководство для спортивных врачей. — Ростов-на-Дону: БАРО-ПРЕСС, 2002. — 800 с.
12. Попова Т.С. и соавт. Парентеральное и энтеральное питание в хирургии. — М., 1996.
13. Попова Т.С. и соавт. Нутритивная поддержка больных в критических состояниях. — Москва: М-Вести, 2002. — 319 с.
14. Ребров В.Г., Громова О.А. Витамины и микроэлементы. — Москва: Алев-В, 2003. — 648 с.
15. Садеков Р.А. и соавт. Лечение диабетической полиневропатии препаратом Мильгамма 100 // Журн. нврологии и психиатрии. — 1998. — № 9. — С. 30-32.
16. Сейфулла Р.Д. Спортивная фармакология. Справочник. — М.: ИПК «Московская правда», 1999. — 120 с.
17. Сиволап Ю.Л., Савченко В.А. Фармакотерапия в наркологии / Под ред. Н.М. Жарикова. — М.: Медицина, 2000. — 352 с.
18. Чернышова Т.Е. Витамины группы В в комплексной терапии диабетической нейропатии // Российские медицинские вести. — 2001. — № 4. — С. 48-51.
19. Шестопалов А.Е. Полное парентеральное питание с применением системы «все в одном» // Клиническое питание. — 2005. — № 3. — 15-18.
20. Щербакова Г.Н., Рагимов А.А. Парентеральное питание в клинике. — Москва: Медицинское информационное агентство, 2002. — 36 с.
21. Abou-Saleh M.T., Coppen A. Serum and red blood cell folate in depression // Acta Psychiatr. Scand. — 1989. — 80. — 78-82.
22. Afonso J.J., Rombeau J.L. Parenteral nutrition for patients with inflammatory bowel disease / Rombeau J.L., Caldwell M.D., eds. Clinical Nutrition: Parenteral Nutrition. 2nd ed. — Philadelphia, Pa: WB Saunders Co, 1993. — 676-695
23. Alpert J.E., Fava M. Nutrition and depression: the role of folate // Nutr. Rev. — 1997. — 55. — 145-149.
24. American Medical Association Department of Foods and Nutrition. Multivitamin preparations for parenteral use: statement by the Nutrition Advisory Group // J. Parenter. Enteral Nutr. — 1979. — 3. — 258-265.
25. Armstrong L., Maresh C. Vitamin and mineral supplements as nutritional aids to exercise performance and health // Nutrition Reviews. — 1996. — 54, Suppl. — S148-158.
26. Beasley J.D. et al. Follow-up of a cohort of alcoholic patients through 12 months of comprehensive biobehavioral treatment // J. Subst. Abuse Treat. — 1991. — 8. — 133-142.
27. Beers M.H., Berkow R. Vitamin deficiency, dependency, and toxicity // The Merck Manual of Diagnosis and Therapy / Beers M.H., Berkow R., eds. 17th ed. — Whitehouse Station, NJ: Merck Research Laboratories, 1999. — 33-51.
28. Benardot et al. Can vitamin supplements improve sport performance? // Sports Science Exchange Roundtable. — 2001. — 12 (3). — 1-4.
29. Berkeley Wellness Letter. Nutrition and Alzheimer’s: how strong is the link? // University of California. — 2002. — V. 18, issue 5.
30. Bernard M.A., Nakonezny P.A., Kashner T.M. The effect of vitamin B12 deficiency on older veterans and its relation to health // J. Am. Geriatr. Soc. — 1998. — 46. — 119-1206.
31. Bernard et al. Parenteral lipid emulsions: effects on vitamin E in intensive care unit patients (short infusion) // Clinical Nutrition. — 2000. — 19(1). — 21.
32. Bistrian B.R. et al. Protein status of general surgical patients // JAMA. — 1974. — 230. — 858-860.
33. Bistrian B.R. et al. Prevalence of malnutrition in general medical patients // JAMA. — 1976. — 235. — 1567-1570.
34. Bistrian B.R. The need for parenteral vitamin supplementation in critically ill patients. — Division of Clinical Nutrition, Beth Israel Deaconess Medical Center, 2001
35. Blum K. et al. Enkephalinase inhibition and precursor amino acid loading improves inpatient treatment of alcohol and polydrug abusers: double-blind placebo-controlled study of the nutritional adjunct SAAVE // Alcohol. — 1988. — 5. — 481-493.
36. Bogden J.D., Louria D.B. Aging and the immune system: the role of micronutrient nutrition // Nutrition. — 1999. — 15. — 593-595.
37. Bohm V., Tiroke K., Schneider S., Sperschneider H., Stein G., Bitsch R. Vitamin C status of patients with chronic renal failure, dialysis patients and patients after renal transplantation // Int. J. Vitam. Nutr. Res. — 1997. — 67. — 262-266.
38. Bostom A.G. et al. Treatment of hyperhomocysteinemia in hemodialysis patients and renal transplant recipients // Kidney Int. Suppl. — 2001. — 78. — S246-252.
39. Boushey C.J., Beresford S.A.A., Omen G.S., Motulsky A.G. A quantitative assessment of plasma homocysteine as a risk factor for vascular disease: probable benefits of increasing folic acid intakes // JAMA. — 1995. — 274. — 1049-1057.
40. Brick W., Burgess R. Macrocytosis. Brody School of Medicine, Division of Hematology // Oncology. — 2002. — September 4.
41. Brown R.J. et al. Neurodynamics of relapse prevention: a neuronutrient approach to outpatient DUI offenders // J. Psychoactive Drugs. — 1990. — 22. — 173-187.
42. Brust J. Alcoholism // Merrit’s textbook of neurology. 9th ed. / Еdt. Rowland L. — 1995. — 967-977.
43. Chasan-Taber L., Selhub J., Rosenberg I.H., Malinow R., Terry P., Tishler P.V., Willett W., Hennekens C.H., Stampfer M.J. A prospective study of folate and vitamin B6 and risk of myocardial infarction in US physicians // J. Am. Coll. Nutr. — 1996. — 15. — 136-143.
44. Chazot C., Kopple J.D. Vitamin metabolism and requirements in renal disease and renal failure // Kopple J.D., Massry S.G. Nutritional Management of Renal Disease. — New York: Williams & Wilkins, 1997. — 415-77.
45. Conklin K.A. Dietary antioxidants during cancer chemotherapy: Impact on chemotherapeutic effectiveness and development of side effects // Nutrition and Cancer. — 2000. — 37(1). — 1-18.
46. Conrad M.E. Pernicious Anemia. University of South Alabama. The Cancer Center. Mobile Infirmary Medical Center // Clinical Cancer Research Program. — 2002. — June 21.
47. Cristol J.P., Canaud B., Rabesandratana H., Gaillard I., Serre A., Mion C. Enhancement of reactive oxygen species production and cell surface markers expression during hemodialysis // Nephrol. Dial Transplant. — 1994. — 9. — 389-394.
48. Cristol J.P., Bosc J.Y., Badiou S., Leblanc M., Lorrho R., Descomps B., Canaud B. Erythropoietin and oxidative stress in haemodialysis: beneficial effects of vitamin E supplementation // Nephrol. Dial. Transplant. — 1997. — 12. — 2312-2317.
49. De Bevere V.O.R.C., De Paepe M., De Leenheer A.P. et al. Plasma vitamin A in haemodialysis patients // Clin. Chim. Acta. — 1981. — 114. — 249-56.
50. Deicher R. et al. Low Total Vitamin C Plasma Level Is a Risk Factor for Cardiovascular Morbidity and Mortalityin Hemodialysis Patients // J. Am. Soc. Nephrol. — 2005. — 16. — 1811-1818.
51. Descombes E., Hanck A., Fellay G. Water soluble vitamin in chronic hemodialysis patients and need for supplementation // Kidney Int. — 1993. — 43. — 19-28.
52. DiCecco S.R. et al. Assessment of nutritional status of patients with end-stage liver disease undergoing liver transplantation // Mayo Clin. Proc. — 1989. — 64. — 95-102.
53. Driscoll R.H., Rosenberg I.H. Total parenteral nutrition in inflammatory bowel disease // Med. Clin. North Am. — 1978. — 62. — 185-201.
54. Evangelou A. et al. Ascorbic acid (vitamin C) effects on withdrawal syndrome of heroin abusers // In Vivo. — 2000. — 14. — 363-366.
55. Fairfield K., Fletcher R. Vitamins for chronic disease prevention in adults. Scientific review // JAMA. — 2002. — 287. — 3116-26.
56. Fava M., Borus J.S., Alpert J.E. Folate, B12, and homocysteine in major depressive disorder // Am. J. Psychiatry. — 1997. — 154. — 426-428.
57. Fawzi W.W., Msamanga G.I., Spiegelman D. et al. Randomised trial of effects of vitamin supplements on pregnancy outcomes and T cell counts in HIV-1-infected women in Tanzania // Lancet. — 1998. — 351. — 1477-1482.
58. Fawzi W.W., Msamanga G.I., Hunter D. et al. Randomized trial of vitamin supplements in relation to transmission of HIV-1 through breastfeeding and early child mortality // AIDS. — 2002. — 16. — 1935-1944.
59. Fawzi W.W., Msamanga G.I., Spiegelman D. et al. A randomized trial of multivitamin supplements and HIV disease progression and mortality // N. Engl. J. Med. — 2004. — 351. — 23-32.
60. Fishbane S., Frei G.L., Finger M, Dressler R. Hypervitaminosis A in two hemodialysis patients // Am. J. Kidney Dis. — 1995. — 25. — 346-9.
61. Fletcher R., Fairfield K., Vitamins for chronic disease prevention in adults. Clinical applications // JAMA. — 2002. — 287. — 3127-9.
62. Fortin M.C. et al. Serum concentrations and clearances of folic acid and pyridoxal-5’-phosphate during venovenous continuous renal replacement therapy // Int. Care Med. — 1999. — 25. — 594-598.
63. Free V., Sanders P. The use of ascorbic acid and mineral supplements in the detoxification of narcotic addicts // J. Psychedelic Drugs. — 1979. — 11. — 217-222.
64. Gale C.R., Martyn C.N., Winter P.D., Casper C. Vitamin C and risk of death from stroke and coronary heart disease in a cohort of elderly people // Brit. Med. J. — 1995. — 310. — 1563-1566.
65. Galley H.F. et al. The effects of intravenous antioxidants in patients with septic shock // Free Radic. Biol. Med. — 1997. — 23. — 768-74.
66. Gerson C.D., Fabry E.M. Ascorbic acid deficiency and fistula formation in regional enteritis // Gastroenterology. — 1974. — 67. — 428-433.
67. Giardini O., Taccone-Gallucci M., Lubrano R. et al. Effects of alpha-tocopherol administration on red blood cell membrane lipid peroxidation in hemodialysis patients // Clin. Nephrol. — 1984. — 21. — 174-177.
68. Gilmour E.R. et al. “Trace Elements and Vitamins in Renal Disease” in Handbook of Nutrition and the Kidney. 3th edition / Ed. Mitch W.E., Klahr S. — Philadelphia: Lippincott-Raven Publishers, 1998.
69. Giovannucci E. еt al. Multivitamin use, folate and colon cancer in women in the Nurses Health Study // Ann. Int. Med. — 1998. — 129. — 517-524.
70. Graham I.M., Daly L.E., Refsum H.M., and 25 others. Plasma homocysteine as a risk factor for vascular disease. The European concerted action project // JAMA. — 1997. — 277. — 1775-1781.
71. Guenther R.M. The role of nutritional therapy in alcoholism treatment // Int. J. of Biosocial Research. — 1983. — 4. — 5-18.
72. Hamilton K.K. Antioxidant Supplements during cancer treatments: Where Do We Stand? // Clinical journal of oncology nursing. — 2001. — V. 5, № 4.
73. Harriman G.R. et al. Vitamin B12 malabsorption in patients with acquired immune deficiency syndrome // Arch. Intern. Med. — 1989. — 149. — 2039-2041.
74. Harries A.D., Heatley R.V. Nutritional disturbances in Crohn’s disease // Postgrad. Med. J. — 1983. — 59. — 690-697.
75. Herbert V. Experimental nutritional folate deficiency in man // Trans. Assoc. Am. Physicians. — 1961. — 75. — 307-320.
76. Herbert V. et al. Clinically unsuspected negative vitamin B12 balance in AIDS patients // Clin. Res. — 1988. — 36. — 796. Abstract.
77. Herbert V. et al. Vitamin B12, folate, and lithium in AIDS // Clin. Res. — 1989. — 37. — 594. Abstract.
78. Heyland D.K. et al. Antioxidant nutrients: a systematic review of trace elements and vitamins in the critically ill patient // Intensive Care Med. — 2005. — 31. — 327-37.
79. Himmelfarb J., Lazarus M., Hakim R. Reactive oxygen species production by monocytes and polymorphonuclear leukocytes during dialysis // Am. J. Kidney Dis. — 1991. — 17. — 271-276.
80. Holm R., Bakewell S. Perioperative care of the patient with morbid obesity. Home Study Program // AORN J. — 2003. — V. 77, № 4. — 801-821.
81. Howard L. et al. Home parenteral nutrition in adults // Rombeau J.L., Caldwell M.D., eds. Clinical Nutrition: Parenteral Nutrition. 2nd ed. — Philadelphia, Pa: WB Saunders Co; 1993. — 814-839.
82. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin and Choline. — Washington, DC: National Academy Press, 1998.
83. Jacobson B. et al. Nutrition practices and knowledge of college varsity athletes. A follow-up // J. of Strength and Conditioning Research. — 2001. — 15. — 63-8.
84. Jason Payne-James et al. Artificial Nutrition Support in Clinical Practice. — Greenwich Medical Media, 2001. — 816 pp.
85. Jason Payne-James. Key Facts in Clinical Nutrition. — Greenwich Medical Media, 2003. — 43 pp.
86. Jha P., Flather M., Lonn E., Farkauh M., Yusef S. The antioxidant vitamins and cardiovascular disease. A critical review of epidemiologic and clinical trial data // Ann. Int. Med. — 1995. — 123. — 860-872.
87. Jiamton S., Pepin J., Suttent R. et al. A randomized trial of the impact of multiple micronutrient supplementation on mortality among HIV-infected individuals living in Bangkok // AIDS. — 2003. — 17. — 2461-2469.
88. Kerr K., Cecchini M. Are we ignoring effective substance abuse treatment solutions? Vitamin therapy as an essential treatment component. Presentation Abstract. Third International Conference On Chemical Contamination and Human Detoxification. — New York, NY, September 22–23, 2005.
89. Konecky N., Malinow M.R., Tunick P.A., Freedberg R.S., Rosenzweig B.P., Katz E.S., Hess D.L., Upson B., Leung B., Perez J., Kronzon I. Correlation between plasma homocysteine and aortic atherosclerosis // Am. Heart J. — 1997. — 133. — 534-540.
90. Kopple J.D. Nutritional management of non-dialysed patients with chronic renal failure // Nutritional Management of Renal Disease / Kopple J.D., Klahr S.G. (eds.). — Baltimore: Williams and Wilkins, 1997. — 479-531.
91. Labriola D., Livingston R. Possible interactions between dietary antioxidants and chemotherapy // Oncology. — 1999. — 13. — 1003-1011.
92. Lamson D.W., Brignall M.S. Antioxidants in cancer therapy: Their actions and interactions with oncologic therapies // Alternative Medicine Review. — 1999. — 4. — 304-329.
93. Lamson D.W., Brignall M.S. Antioxidant and cancer therapy II: Quick reference guide // Alternative Medicine Review. — 2000. — 5. — 152-163.
94. LaRue A., Koehler K.M., Wayne S.J., Chiulli S.J., Haaland K.Y., Garry P.J. Nutritional status and cognitive functioning in a normally aging sample: a 6-y reassessment // Am. J. Clin. Nutr. — 1997. — 65. — 20-29.
95. Lim P.S. et al. Lipophilic Antioxidants and Iron Status in ESRD Patients on Hemodialysis // Nephron J. — 2000. — Vol. 86, № 4. — 428-435.
96. Lindeman R.D., Romero L.J., Koehler K.M., Liang Hwa Chi, LaRue A., Baumgartner R.N., Garry P.J. Serum Vitamin B12, C and Folate Concentrations in the New Mexico Elder Health Survey: Correlations with Cognitive and Affective Functions // Journal of the American College of Nutrition. — 2000. — Vol. 19, № 1. — 68-76.
97. Logan A.C. Omega-3 fatty acids and major depression: a primer for the mental health professional // Lipids Health Dis. — 2004. — 3.
98. Loughrey C.M., Young I.S., Lightbody J.H., McMaster D., McNamee P.T., Trimble E.R. Oxidative stress in haemodialysis // Q. J. Med. — 1994. — 87. — 679-683.
99. Louw J.A. et al. Blood vitamin concentrations during the acute-phase response // Crit. Cаre Med. — 1992. — 20. — 934-941.
100. Main A.N.H. et al. Vitamin A deficiency in Crohn’s disease // Gut. — 1983. — 24. — 1169-1175.
101. Manore M. Vinamins and minerals. Part I. How much do I need? // ACSM’s Health & Fitness Journal. — 2001. — 5(3). — 33-35.
102. Manore M. Vinamins and minerals. Part II. Who needs to supplement? // ACSM’s Health & Fitness Journal. — 2001. — 5(4). — 30-34.
103. Marston B., De Cock K.M. Multivitamins, Nutrition, and Antiretroviral Therapy for HIV Disease in Africa // The New England Journal of Medcine. — 2004 Jul 1. — Vol. 351, № 1. — 78-80.
104. Mathews-Larson J., Parker P.A. Alcoholism treatment with a biochemical restoration as a major component // Int. J. Biosoc. Res. — 1987. — 9. — 92-106.
105. Metnitz P.G.H. et al. Antioxidant status in patients with acute respiratory distress syndrome // Intensive Care Med. — 1999. — 25. — 180-185.
106. Miller III E.R. et al. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality // Ann. Intern. Med. — 2005. — 142. — 37-46.
107. Morena M. et al. Convective and diffusive losses of vitamin C during haemodiafiltration session: a contributive factor to oxidative stress in haemodialysis patients // Nephrol. Dial. Transplant. — 2002. — 17. — 422-427.
108. Mouser J.F. The clinical use of inthavenous multivitamins in pediatric parenteral nutrition // Newslines. — 2000. — V. 6, № 4. — 13 pp.
109. Nathens A.B. et al. Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients // Ann. Surg. — 2002. — 236. — 814-822.
110. National Advisory Group on Standards and Practice Guidelines for Parenteral Nutrition // J. Parent. Enteral Nutr. — 1998. — 22. — 49-66.
111. Naurath H.J., Joosten E., Riezler R., Stabler S.P., Allen R.H., Lindenbaum J. Effects of vitamin B12, folate, and vitamin B6 supplements in elderly people with normal serum vitamin concentrations // Lancet. — 346. — 1996. — 85-89.
112. Nazrul Islam S.K. et al. Serum E, C and A status of the drug addicts undergoing detoxication: influence of drug habit, sexual practice and lifestyle factors // Eur. J. Clin. Nutr. — 2001. — 55(11). — 1022-1027.
113. Obeid R. et al. Response of homocysteine, cystathionine, and methylmalonic acid to vitamin treatment in dialysis patients // Clin. Chem. — 2005. — 51(1). — 196-201.
114. O’Keefe S.J.D. Parenteral nutrition and liver disease // Clinical Nutrition: Parenteral Nutrition / Rombeau J.L., Caldwell M.D., eds. — 2nd ed. — Philadelphia, Pa: WB Saunders Co, 1993.
115. Ono K., Waki Y., Takeda K. Hypervitaminosis A: A contributing factor to anemia in regular dialysis patients // Nephron. — 1984. — 38. — 44-7.
116. Ortega R.M., Manas L.R., Andres P., Gaspar M.J., Agudo F.R., Jimenez A., Pascual T. Functional and psychic deterioration in elderly people may be aggravated by folate deficiency // J. Nutr. — 1996. — 126. — 1992-1999.
117. Pastor M., Sierra C., Bonal J., Teixido J. Serum and erythrocyte tocopherol in uremic patients: effect of hemodialysis versus peritoneal dialysis // Am. J. Nephrol. — 1993. — 13. — 238-243.
118. Pastore A. et al. Effects of folic acid before and after vitamin B12 on plasma homocysteine concentrations in hemodialysis patients with known MTHFR genotypes // Clin. Chem. — 2006. — 52(1). — 145-148.
119. Payne-James J. et al. Artificial Nutrition Support in Clinical Practice. — 2nd Edition. — London: Greenwich Medical Media Ltd., 2001.
120. Peet M. Nutrition and schizophrenia: beyond omega-3 fatty acids // Prostaglandins Leukot. Essent. Fatty Acids. — 2004. — 70. — 417-422.
121. Perrig W.J., Perrig P., Stдhelin H.B. The relation between antioxidants and memory performance in the old and very old // J. Am. Geriatr. Soc. — 1997. — 45. — 718-724.
122. Pironi et al. Impact of olive-oil based lipid emulsion on lipid peroxidation and vitamin E status in home parenteral nutrition (HPN) // Clinical Nutrition. — 2001. — 20(3). — 47.
123. Plander P., Azzi D. Lycopene in association with alpha-tocopheral inhibits at physiological concentrations proliferation of prostate carcinoma cells // Biochem. Biophys. Res. Commun. — 1998. — 250. — 582-585.
124. Poge U. et al. Intravenous treatment of hyperhomocysteinemia in patients on chronic hemodialysis a pilot study // Ren. Fail. — 2004. — 26(6). — 703-708.
125. Posner B.M. et al. Nutritional risk in New England Elders // J. of Gerontology. — 1994. — 49. — 123-132.
126. Reimer et al. Effects of short-term parenteral nutrition on antioxidant status of nonseptic postoperative patients // Clinical Nutrition. — 2000. — 19(1). — 16.
127. Reimer et al. Der Einfluss von parenteraler Ermahrung mit olivenolhaltiger Fettemulsion auf den postoperativen Antioxidantienstatus nichtseptischer Patienten // Anasthes. and Intensivmed. — 2001. — 42. — 493.
128. Reimund et al. Potential usefulness of olive oil-based lipid emulsions in selected situations of home parenteral nutrition-associated liver desease // Clinical Nutrition. — 2004. — 23. — 1418-1425.
129. Reimund et al. Efficacy and safety of an olive oil-based intravenous far emulsion in adult patients on home parenteral nutrition // Aliment. Pharmacol. — 2005. — 21. — 445-454.
130. Reinhardt G.F. et al. Incidence and mortality of hypoalbuminemic patients in hospitalized veterans // J. Parenter Enteral Nutr. — 1980. — 4. — 357-359.
131. Replogle W.H., Eicke F.J. Megavitamin Therapy in the Reduction of Anxiety and Depression Among Alcoholics // J. Orthomolec. Medicine. — 1989. — 4. — 221-224.
132. Rieg L.S. Metabolic alterations and nutritional management // Clin. Issues Crit. Care Nurse. — 1993. — 4. — 388-398.
133. Riggs K.M., Spiro A. III., Tucker K., Rush D. Relations of vitamin B12, vitamin B6, folate and homocysteine to cognitive performance in the Normative Aging Study // Am. J. Clin. Nutr. — 1996. — 63. — 306-314.
134. Rimm E.B., Willett W.C., Hu F.B., Sampson L., Colditz G.A., Manson J.E., Hennekens C., Stampfer M.J. Folate and vitamin B6 from diet and supplements in relation to risk of coronary heart disease in women // JAMA. — 1998. — 279. — 359-364.
135. Rosenberg I.H. et al. Nutritional aspects of inflammatory bowel disease // Ann. Rev. Nutr. — 1985. — 5. — 463-484.
136. Scher J. et al. Massive vitamin C as an adjunct in methadone maintenance and detoxification // J. Orthomolec. Psych. — 1976. — 5. — 191-198.
137. Schnyder G. et al. Effect of homocysteine-lowering therapy with folic acid, vitamin B12, and vitamin B6 on clinical outcome after percutaneous coronary intervention; the Swiss Heart study: a randomized controlled trial // JAMA. — 2002. — 288. — 973-979.
138. Schuckit M.A. Alcohol and alcoholism // Principles of Internal Medicine / Fauci A.S., Braunwald E., Isselbacher K.F., eds. — New York, NY; McGraw-Hill; 1998. — 2503-2508.
139. Sclafani L.M., Brennan M.F. Nutritional support in the cancer patient // Total Parenteral Nutrition / Fischer J.E., ed. — Boston, Ma; Little Brown and Co, 1991. — 323-345.
140. Selhub J., Jacques P.F., Bostom A.G., D’Agostino R.B., Wilson P.W.F., Belanger A.J., O’Leary D.H., Wolf P.A., Rush D., Schaefer E.J., Rosenberg I.H.: Relationship between plasma homocysteine, vitamin status and extracranial carotid artery stenosis in the Framingham study population // J. Nutr. — 1996. — 126. — 1258S-1265S.
141. Semba R.D., Miotti P.G., Chiphangwi J.D., et al. Maternal vitamin A deficiency and mother-to-child transmission of HIV-1 // Lancet. — 1994. — 343. — 1593-1597.
142. Semba R.D., Tang A.M. Micronutrients and the pathogenesis of human immunodeficiency virus infection // Br. J. Nutr. — 1999. — 81. — 181-189.
143. Sewell R.A., Recht L.D. Nutritional Neuropathy // EMedicine Journal. — 2002. — V. 3, № 2. — 19 pp.
144. Shenkin A. The key role of micronutrients (review) // Clin. Nutr. — 2005 Nov, Article in press.
145. Shuler C.L., Wolfson M. Nutrition in acute renal failure // Clinical Nutrition: Parenteral Nutrition / Rombeau J.L., Caldwell M.D., eds. — 2nd ed. — Philadelphia, Pa: WB Saunders Co, 1993. — 667-675.
146. Singh A. et al. Chronic multivitamin-mineral supplementation does not enhance physical performance // Medicine and Science in Sports and Exercise. — 1992. — 24. — 726-32.
147. Sitruk A. et al. Vitamins A, D and E supplementation in pediatric home parenteral nutrition patients: which needs? — Paris: Hospital-AP-HP, 2001.
148. Sobotka L. Basics in Clinical Nutrition. — Third Edition. — Prague: Galen, 2004. — 460 pp.
149. Story D.A. et al. Trace element and vitamin concentrations and losses in critically ill patients treated with continuous venovenous hemofiltration // Crit. Care Med. — 1999. — 27. — 220-223.
150. Sullivan D.H. et al. Patterns of care: An analysis of the quality of nutritional care routinely provided to elderly hospitalized veterans // J. Parenter Enteral Nutr. — 1989. — 13. — 249-254.
151. Taccone-Gallucci M., Giardini O., Ausiello C. et al. Vitamin E supplementation in hemodialysis patients: effects on peripheral blood mononuclear cells lipid peroxidation and immune response // Clin. Nephrol. — 1986. — 25. — 81-86.
152. Telford R. et al. The effect of 7 to 8 mounths of vitamin/mineral supplementation on athletic performance // Intern. J. of Sport Nutrition. — 1992. — 2. — 135-53.
153. Teng M. et al. Vitamin D Injections May Significantly Improve Survival In Dialysis Patients. — Massachusetts General Hospital Articles. — 2005a, March 11.
154. Teng M. et al.Activated Injectable Vitamin D and Hemodialysis Survival: A Historical Cohort Study // J. Am. Soc. Nephrol. — 2005b. — 16. — 1115-1125.
155. The CARI Guidelines — Caring for Australians with Renal Impairment. Nutrition and Growth in Kidney Disease, October, 2004.
156. Van der Beek E. Vitamin supplementation and physical exercise performance // J. Sport Sciences. — 1991. — 92. — 77-79.
157. Van Goor L.P., Woiski M.D., Lagaay A.M., Meinders A.E., Tak P.P. Review: Cobalamin deficiency and mental impairment in elderly people // Age and Aging. — 1995. — 24. — 536-542.
158. Vannucchi M.T., Vannucchi H., Humphreys M. Serum levels of vitamin A and retinol binding protein in chronic renal patients treated by continuous ambulatorial peritoneal dialysis // Int. J. Vitam. Nutr. Res. — 1992. — 62(2). — 107-12.
159. Van Way C.W. III. Vitamins and trace elements // Handbook of Surgical Nutrition / Van Way C.W. III, ed. — Philadelphia, Pa: JB Lippincott Co, 1992. — 56-69.
160. Verhoef P., Stampfer M.J., Buring J.E., Gaziano J.M., Allen R.H., Stabler S.P., Reynolds R.D., Kok F.J., Hennekens C.H., Willett W.C. Homocysteine metabolism and risk of myocardial infarction: Relation with vitamins B6, B12, and folate // Am. J. Epidemiol. — 1996. — 143. — 845-859.
161. Vittadini G. et al. Alcoholic polyneuropathy: a clinical and epidemiological study // Alcohol. — 2001. — 36(5). — 393-400.
162. Vlaming S. et al. Should the food intake of patients admitted to acute hospital services be routinely supplemented? A randomized placebo controlled trial // Clin. Nutr. — 2001. — 20. — 517-526.
163. Weight L. et al. Vitamin and mineral supplementation. Effect on the running performance of trained athletes // Am. J. of Clinical Nutrition. — 1998. — 47. — 192-95.
164. Weinsier R.L. et al. Hospital malnutrition: a prospective evaluation of general medical patients during the course of hospitalization // Am. J. Clin. Nutr. — 1979. — 418-426.
165. Williams M.H. Dietary Supplements and Sports Performance: Introduction and Vitamins // J. Intern. Soc of Sports Nutrition. — 2004. — 1(2). — 1-6.
166. Willard M.D. et al. Protein-calorie malnutrition in a community hospital // JAMA. — 1980. — 243. — 1720-1722.
167. Zaloga G.P., Bortenschlager L. Vitamins // Nutrition in Critical Care / Zaloga G.P., ed. — St. Louis, Mo: Mosby, 1993. — 217-242.