Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Роль биологических маркеров в неотложной кардиологии
Авторы: Пархоменко А.Н., Иркин О.И., Лутай Я.М. Отдел реанимации и интенсивной терапии, Национальный научно-исследовательский центр «Институт кардиологии им. акад. Н.Д. Стражеско», г. Киев
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Болезни системы кровообращения занимают ведущее место в структуре заболеваемости и общей смертности населения большинства стран мира и Украины в частности. Основной причиной кардиальной смерти являются острые коронарные синдромы, острая сердечная недостаточность, тромбоэмболии и жизнеугрожающие нарушения ритма сердца. Правильная и ранняя диагностика острых состояний позволяет своевременно назначить лечение, а определение вероятности развития осложнений — обеспечить индивидуальный подход к терапии. Большую помощь в реализации такого подхода оказывают биологические маркеры (биомаркеры). Под термином «биомаркеры» в медицине принято понимать белки крови, концентрация которых отражает наличие или выраженность того или иного патологического состояния.
Сфера применения биомаркеров при различных острых состояниях в кардиологии:
1. Острый коронарный синдром:
— диагностика острого инфаркта миокарда;
— стратификация риска;
— выбор оптимальной тактики лечения.
2. Острая сердечная недостаточность:
— идентификация пациентов с сердечной недостаточностью (скрининг);
— подтверждение степени выраженности сердечной недостаточности;
— направленный мониторинг пациентов с сердечной недостаточностью (СН);
— мониторинг терапии и ее оптимизация.
3. Тромбоэмболия легочной артерии (ТЭЛА):
— дифференциальная диагностика;
— стратификация риска.
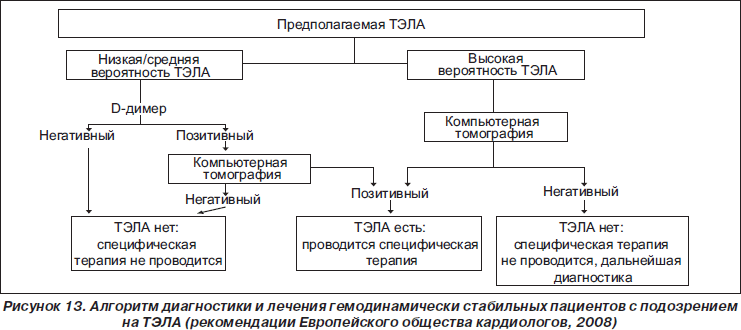
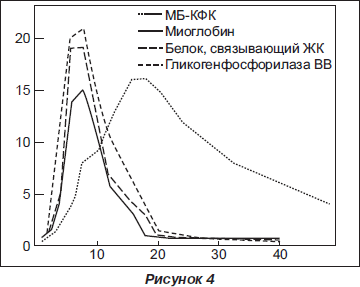
При остром коронарном синдроме (ОКС) биомаркеры в первую очередь применяют для диагностики повреждения миокарда. В настоящее время используется целый ряд маркеров, что обусловлено характерными для каждого из них уровнями кардиоспецифичности и особенностями попадания в кровь после повреждения кардиомиоцитов, определяющими различия во времени достижения диагностического и пикового значений, длительность циркуляции маркера (рис. 1).
Миоглобин. Сложный белок мышц, связывающий переносимый гемоглобином кислород с образованием оксимиоглобина и, таким образом, обеспечивающий работающую мышцу некоторым запасом кислорода, перенося его к цитохромоксидазе мышечных митохондрий (рис. 2).
Поскольку миоглобин является довольно низкомолекулярным протеином, он легко диффундирует через мембраны поврежденных мышечных клеток и быстро появляется в периферической крови при повреждении миокарда. Содержание миоглобина при инфаркте миокарда (ИМ) повышается в сыворотке крови в пределах 2 ч после возникновения симптомов. Он в неизмененном виде выводится с мочой и уже через 24 часа с момента начала заболевания исчезает из кровотока. Диагностическим уровнем для ИМ считается повышение концентрации миоглобина до 20 нг/мл/ч. Большое содержание миоглобина в скелетной мускулатуре и зависимость его концентрации от функции почек ограничивают его применение для диагностики ИМ.
Факторы, влияющие на изменение концентрации миоглобина в крови:
— острый ИМ;
— сердечно-сосудистая операция;
— повреждение скелетной мускулатуры (в том числе при приеме статинов);
— чрезмерная физическая нагрузка;
— прогрессирующие мышечные дистрофии;
— шок;
— почечная недостаточность.
Преимущества применения миоглобина: высокая чувствительность, эффективен при ранней диагностике ИМ, полезен при исключении инфаркта миокарда, может быть маркером реперфузии. Недостатки: низкая специфичность при повреждении скелетной мускулатуры, травмах, быстро возвращается к нормальным значениям, что ограничивает возможности поздней диагностики.
Клинические рекомендации: не должен использоваться как самостоятельный диагностический маркер ввиду низкой специфичности.
МБ-фракция креатинфосфокиназы (МБ-КФК) — это гетеродимер с молекулярной массой 86 кДа. Среди традиционных маркеров именно определение активности МБ-КФК до последнего времени рассматривалось в качестве золотого стандарта в биохимической диагностике ОИМ. Изоформа МБ-КФК при ОИМ появляется в сыворотке крови через 3–4 ч после начала симптомов и достигает диагностически значимого уровня к 4–6-му часу. Повышенный уровень может сохраняться до 48–72 часов. Доля МБ-КФК среди общей КФК, превышающая 5–6 %, является специфичным признаком некроза миокарда.
При использовании MБ-КФК для диагностики ИМ необходимо неоднократное, динамическое определение концентрации этого маркера в крови, так как МБ-КФК обладает низкой чувствительностью в раннем (до 6–8 ч) и позднем (после 48 ч) периодах ИМ. Эксперты Европейского кардиологического общества считают предпочтительным расчет индекса МБ-КФК: индекс МБ-КФК = (МБ-КФК х х 100)/общая КФК.
Индекс МБ-КФК выше 3–6 % на фоне подъема общей КФК подтверждает диагноз ИМ. В настоящее время МБ-КФК разделяют на две изоформы: МБ1-КФК и МБ2-КФК. В норме соотношение МБ1-КФК : МБ2-КФК = 1 : 1. Соотношение МБ1- КФК : МБ2-КФК = 1 : 1,5 — ранний маркер повреждения миокарда: пик — 2–4 ч; возвращается к норме — 18–30 ч; нормальное соотношение МБ1- КФК : МБ2-КФК через 6 ч после приступа исключает ИМ. МБ2-КФК — тканевая форма, которая, попадая в кровоток, превращается в МБ1-КФК, поэтому соотношение МБ2-КФК/МБ1-КФК больше 1,5 через 1– 2 ч после начала болевого синдрома может свидетельствовать о развитии некроза миокарда.
Преимущества исследования МБ-КФК: быстрое, дешевое, доступное и точное определение, возможность диагностики раннего реинфаркта.
Недостатки: низкая специфичность при повреждении скелетной мускулатуры, травмах, после хирургических вмешательств, низкая чувствительность в ранние (< 6 часов) или поздние (> 36 часов) сроки от развития симптомов острого ИМ; низкая чувствительность при минимальном повреждении миокарда (положительный тест тропонина).
Клинические рекомендации: является стандартом в прошлом и в настоящее время; приемлем для большинства клинических ситуаций. Наибольшее значение имеет для диагностики реинфарктов.
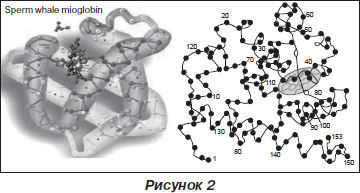
Тропонины Т и I. Основная структурная сократительная единица миоцита — саркомер, который образуют упорядоченно расположенные толстые и тонкие волокна. Тонкие содержат волокна актина и тропонин-тропомиозиновый комплекс. Тропониновый регуляторный комплекс в поперечнополосатых мышцах состоит из трех полипептидов; при диагностике инфаркта миокарда определяют в крови содержание только тропонина Т и тропонина I (рис. 3).
Для экстренной диагностики инфаркта миокарда на догоспитальном этапе наиболее подходит качественный иммунологический тест для определения содержания в крови специфического миокардиального белка тропонина Т. При инфаркте миокарда наблюдаются два пика повышения его концентрации в крови. Первый начинается через 2–3 ч, достигает максимума через 8–10 ч, второй начинается через трое суток. Нормализация концентрации тропонина Т в крови при ОИМ происходит через 10–14 суток. Чувствительность теста через 3 ч — примерно 60 %, через 10 ч приближается к 100 %, специфичность близка к 100 %. С помощью этого метода удается диагностировать инфаркты миокарда с зубцом Q, а также он используется для дифференциальной диагностики инфаркта миокарда без зубца Q и острого коронарного синдрома без повреждения миокарда — нестабильной стенокардии.
Новой проблемой в диагностике поражения миокарда при острых коронарных синдромах стали ультрачувствительные тропонины. Благодаря применению новых подходов (рекомбинантные белки, нанотехнологии) нижний уровень определения кардиальных тропонинов снижен в 10–100 раз. Разработчики таких тестов называют их или ультрачувствительными (ultra sensitive), или высокочувствительными (highly sensitive). Что «чувствуют» ультрачувствительные тесты? Молекулы тропонинов, «вытекающие» из нормального миокарда? Повреждения кардиомиоцитов, связанные только с ишемией? Или начало мионекроза?
Повышенный ультрачувствительный тропонин — показатель ишемии? Повышение уровня hs-cTnI > 1,3 пг/мл — это независимый предиктор ишемии.
У 195 лиц с подозрением на ИБС вызывали экспериментальную ишемию, которую контролировали с помощью однофотонной эмиссионной компьютерной томографии. Уровни hs-TnT определяли перед стрессом, затем через 18 мин, через 4 и 24 ч. Показано, что повышение hs-TnT — это скорее следствие необратимой смерти миоцитов, нежели результат обратимой миокардиальной ишемии, наступающей после физических упражнений или после фармакологического воздействия.
Среди 50 больных с установленным ИМ без подъема ST-сегмента и с отрицательными результатами стандартных cTnI-тестов 86 и 100 % лиц имели положительный us-cTnI-тест в 0 и 2 ч после начала болевого синдрома соответственно. У лиц без ОКС и без ИМ результаты обоих тестов были отрицательными. Таким образом, us-cTnI обнаруживает повреждения миокарда у большинства пациентов, у которых, согласно текущей классификации, диагностируется нефротический синдром (НС). Это, по мнению авторов, свидетельствует о том, что ишемическая загрудинная боль без повреждения миокарда — событие довольно редкое. Более чувствительный cTn-тест повысит количество положительных результатов и позволит раннюю диагностику кардиальных нарушений, хотя и будет выявлять патологии, не связанные с ОКС. Применение ультрачувствительных тестов на тропонины повышает количество как истинноположительных, так и ложноположительных результатов при диагностике ОИМ.
Повышенный ультрачувствительный тропонин — маркер мионекроза? Для подтверждения или исключения ОИМ следует проводить серийное определение ultra cTnI, при этом его повышение на 46 % или снижение на 32 % является основанием для интерпретации результатов.
Рекомендации для использования биохимических маркеров для диагностики инфаркта миокарда
Класс I
1. Биомаркеры некроза миокарда должны быть измерены всем больным, госпитализированным с симптомами острого коронарного синдрома (уровень обоснованности C).
2. Клинические признаки (история заболевания, данные осмотра) и ЭКГ должны быть использованы вместе с биомаркерами в диагностическом обследовании при подозрении на ИМ (уровень обоснованности C).
3. Сердечный тропонин является предпочтительным маркером в диагностике ИМ. Измерение массы МБ-КФК является приемлемой альтернативой, если тропонин недоступен (уровень обоснованности A).
4. Кровь для анализа должна браться при поступлении и серийно в последующее время в зависимости от клинической ситуации. Для большинства больных — при поступлении и 6–9 часов спустя (уровень обоснованности C).
5. При наличии клинической картины, свидетельствующей в пользу острого коронарного синдрома, полученные в дальнейшем результаты считаются диагностическими в отношении некроза, сопровождающего ИМ, если (уровень обоснованности C):
а) максимальная концентрация сердечного тропонина превышает 99-й перцентиль значения в эталонной контрольной группе хотя бы однократно в течение 24 часов после клинического события (наблюдение повышения и снижения уровня полезно при установлении времени возникновения повреждения);
б) максимальная концентрация MБ-КФК — 99-й перцентиль значения в эталонной контрольной группе, адаптированной по полу больных, в двух последовательно взятых образцах (значение MБ-КФК должно повышаться и снижаться).
Класс IIb
1. У больных, госпитализированных в первые 6 часов после начала симптомов, в добавление к сердечному тропонину может быть рассмотрено использование раннего маркера некроза миокарда. Миоглобин является наиболее изученным маркером из применяющихся с этой целью (уровень обоснованности B).
2. Раннее выявление инфаркта миокарда с помощью частого взятия крови для определения маркеров некроза может быть приемлемо, если связано с лечебной стратегией (уровень обоснованности C).
Класс III
1. Общая КФК, аспатратаминотрансфераза (АсАТ), дигидроксибутиратдегидрогеназа и/или лактатдегидрогеназа не должны применяться как биомаркеры при диагностике ИМ (уровень обоснованности C).
2. У больных с диагностическими изменениями ЭКГ (например, с подъемами сегмента ST) принятие решения о диагнозе и лечении не должно откладываться из-за ожидания результатов определения биомаркеров (уровень обоснованности C).
Однако уже в настоящее время существуют и даже активно используются новые биомаркеры поражения миокарда, для некоторых даже созданы экспресс-диагностические полоски. Новые маркеры в своем большинстве являются специфичными и быстро проявляющимися маркерами поражения кардиомиоцитов: MLC-I — легкая цепь миозина I (myosin light chain I), DNAse1 — дезоксирибонуклеаза-1, S100A1 — кардиальный сенсорный белок, зависимый от кальция (cardiac-specific Ca2+-sensor protein), H-FABP — кардиальный белок, связывающий свободные жирные кислоты (heart-type fatty-acid binding protein), GP-BB — гликогенфосфорилаза BB, карбоангидраза III.
Новые биомаркеры: диагностика повреждения миокарда
Кардиальная форма белка, связывающего жирные кислоты. В последнее время внимание исследователей обращено на кардиальную форму белка, связывающего жирные кислоты (БСЖК). Впервые предложение использовать БСЖК в качестве раннего маркера ИМ было высказано J. Glatz в 1988 г. БСЖК по последовательности аминокислот идентичен БСЖК, содержащемуся в поперечнополосатой мышечной ткани, однако представлен в скелетной мускулатуре в минимальном количестве. Максимальное количество БСЖК находится в миокарде — 0,5 мг/г ткани. Специфичность БСЖК не абсолютна, небольшое его количество имеется и вне миокарда, в частности в скелетной мускулатуре, а особенно в диафрагме. БСЖК содержится также в тканях аорты, и можно предположить, что при расслаивающей аневризме аорты содержание его в крови повышается. В крови здоровых людей циркулирует небольшое количество БСЖК; у женщин уровень БСЖК статистически значимо ниже, чем у мужчин (0,7 против 1,2 мкг/л), что, по-видимому, связано с различием в мышечной массе. Кинетика содержания БСЖК в крови больных ИМ сходна с кинетикой миоглобина. Его содержание при ИМ повышается в течение первых 3 ч после появления симптомов и возвращается к нормальному значению через 12–14 часов. Несмотря на то что уровень БСЖК в миокарде меньше, чем миоглобина (0,5 против 2,5 мг/кг), минимальная определяемая концентрация БСЖК в 15 раз ниже, чем миоглобина (2 против 32 мкг/л). Этим обусловлена большая чувствительность БСЖК по сравнению с миоглобином при выявлении некроза миокарда. По данным F. Ghani и соавт., чувствительность БСЖК в диагностике ИМ составила 39 %, специфичность — 95 %, при этом чувствительность миоглобина не превышала 28 %. Однако БСЖК еще недостаточно изучен в отдельных клинических ситуациях.
Ca2+-АТФаза саркоплазматического ретикулума. В 2009 г. L. Ciobanu создана тест-система ELISA для определения Ca2+-АТФазы саркоплазматического ретикулума (СР) в качестве маркера ОИМ. При исследовании с использованием новой диагностической системы 56 больных с ОИМ, подтвержденным повышением тропонина I и МБ-КФК, повышение уровня Ca2+-АТФазы СР было выявлено у всех пациентов. Увеличение концентрации этого маркера начиналось примерно через 4–6 ч после появления симптомов, а нормализация происходила в течение 6 суток. Титр Ca2+-АТФазы СР коррелировал с массой пораженного миокарда, степенью подъема сегмента ST и наличием у больного факторов риска сердечно-сосудистого осложнения.
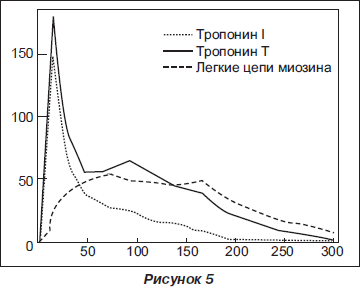
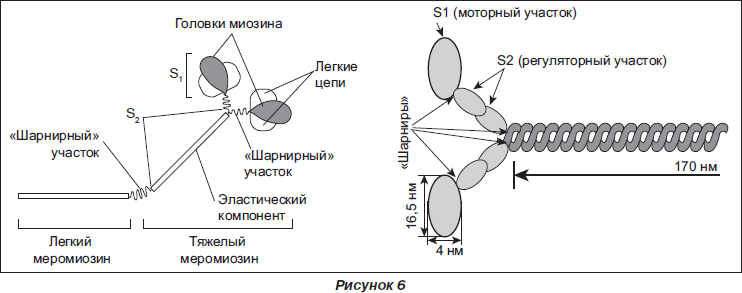
Легкие цепи миозина. Миозин является частью саркомера — основной составляющей контрактильного аппарата скелетной и сердечной мышцы. Молекула миозина гетерополимерна и состоит из 2 тяжелых и 2 легких цепей (рис. 6). Существуют 2 типа легких цепей миозина (ЛЦМ): ЛЦМ-1 (молекулярная масса 27 кДа) и ЛЦМ-2 (молекулярная масса 20 кДа).
Физиологическая роль ЛЦМ состоит в осуществлении взаимодействия между актином и миозином. ЛЦМ-1 появляется в крови через 3–6 ч после развития приступа болей, его высокие концентрации сохраняются в течение 4 дней, а повышенный уровень ЛЦМ-1 отмечается до 10–14 дней. Тяжесть клинических проявлений, прогноз заболевания и размер зоны инфаркта коррелируют с уровнем ЛЦМ-1 в крови. Изменение концентрации ЛЦМ-1 также коррелирует с тяжестью сердечной недостаточности и позволяет выделять группу риска среди больных с НС.
Карбоангидраза III. Растворимый белок в больших количествах определяется только в скелетной мускулатуре (мышечные волокна I типа), в небольшом количестве — в гладкой мускулатуре и миоэпителиальных клетках. Повышение уровня карбоангидразы III отмечается при нейромышечных заболеваниях и после значительной физической нагрузки. Уровень карбоангидразы III в плазме тесно коррелирует с выбросом миоглобина из скелетных мышц, а благодаря тому, что концентрация карбоангидразы III не отражает повреждения миокарда, отношение миоглобин/карбоангидраза III может использоваться для разграничения причин повышения уровня миоглобина в крови.
Гликогенфосфорилаза ВВ. Гликогенфосфорилаза катализирует расщепление гликогена в саркоплазматической сети. Она представляет собой димерный фермент с молекулярной массой 18,8 кДа (рис. 7).
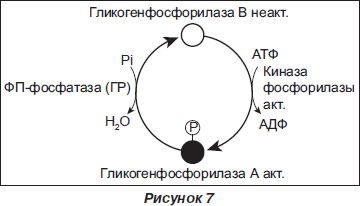
Существуют 3 изомера гликогенфосфорилазы: ВВ, содержащийся в мозге и сердце, ММ — в скелетной мускулатуре, LL — в печени. В результате метаболизма гликогена в ишемизированной ткани гликогенфосфорилаза ВВ переходит из саркоплазматической сети в цитоплазму, а затем в кровь через поврежденную клеточную мембрану. Повышение концентрации гликогенфосфорилазы ВВ наблюдается через 2–4 ч после повреждения миокарда, а возвращение к норме — спустя 36 ч. В исследовании J. Mair (1998 г.) продемонстрирована высокая информативность этого маркера в диагностике повреждений миокарда после операций реваскуляризации миокарда. Ограничением использования гликогенфосфорилазы ВВ в клинической практике является отсутствие коммерческих наборов для ее определения.
Стратификация риска и выбор оптимальной тактики лечения
При стратификации риска осложнений у больных с ОКС наиболее часто используются маркеры поражения миокарда — тропонины, сердечной недостаточности — proBNP и показатели системного воспалительного процесса, наиболее адекватным и чувствительным является С-реактивный белок (ЦРБ) и его высокочувствительный компонент.
Эффективность в стратификации риска больных с ОКС по маркеру поражения миокарда была доказана во множестве исследований. Наиболее доказанным и подтверждающим свою прогностическую значимость является тест тропонина (рис. 8).
Следующим биомаркером, также эффективно предсказывающим осложненное течение ОКС, является один из лучших показателей активности воспалительного процесса в организме — ЦРБ. С-реактивный белок (англ. C-reactive protein — CRP) — белок плазмы крови, относящийся к группе белков острой фазы, концентрация которых повышается при воспалении. Играет защитную роль, связывая бактериальный полисахарид Streptococcus pneumoniae. С-реактивный белок используется в клинической диагностике наряду со скоростью оседания эритроцитов (СОЭ) как индикатор воспаления.

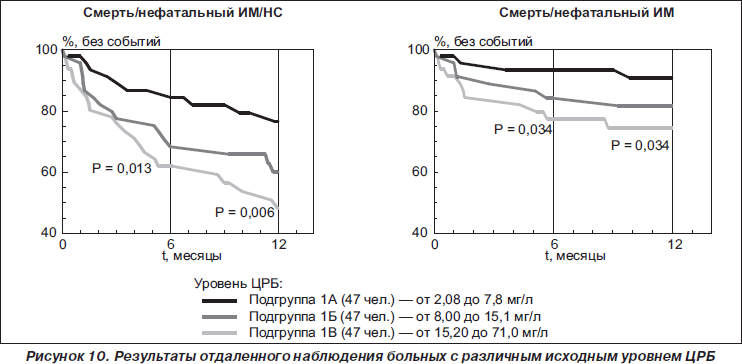
Предсказательную точность данного биомаркера показали во множестве исследований. Нашим исследованием была показана предсказательная точность в зависимости от выраженности повышения показателя ЦРБ. Разделяя уровни повышения ЦРБ на тертили, было показано достоверное влияние не только повышения ЦРБ на прогноз течения ОКС.
Многомаркерный подход к стратификации риска
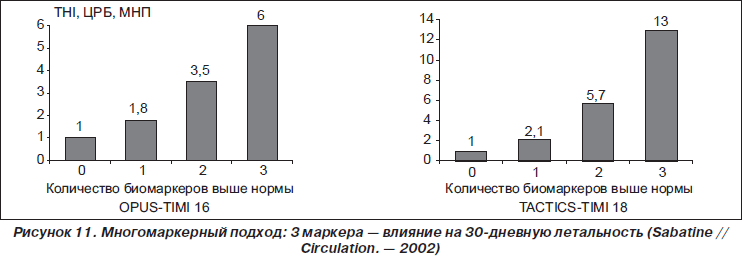
Наиболее качественным и точным в определении вероятности развития осложнений при ОКС был многомаркерный анализ. При сопоставлении нескольких маркеров, показывающих различные процессы в организме, был достигнут наиболее точный прогноз течения болезни и ее осложнений. Комбинация маркера поражения кардиомиоцитов — тропонина, показателя системного воспалительного процесса — ЦРБ и показателя наличия и выраженности сердечной недостаточности — мозгового натрийуретического пептида (МНП, или BNP) оказалась наиболее точным предсказателем осложнений течения ОКС. В исследованиях OPUS-TIMI 16 и TACTICS-TIMI 18 у больных с ОКС регистрировали повышение уровня трех диагностических биомаркеров: тропонина I, ЦРБ и МНП. По данным исследований, при повышении только одного биомаркера 30-дневная летальность повышалась в два раза, если же все три биомаркера были повышены, то риск развития смерти в течение месяца после развития ОКС вырастал в 6 или до 13 раз. Результат исследований показал высокую прогностическую ценность многомаркерного подхода в стратификации риска неблагоприятного течения при ОКС (рис. 11).
В других исследованиях оценивалось большое количество биомаркеров. У 664 пациентов, поступивших в отделения неотложной терапии с ОКС, была проведена оценка прогностической значимости следующих маркеров: cTnT, H-FABP (БСЖК), гликогенфосфорилазы ВВ, NT-proBNP, фибриногена и D-димера, hsCRP, МПО (миелопероксидаза), ММП-9 (матриксная металлопротеиназа-9), PAPP-A, или ПБАБ-А (плазменный белок А, ассоциированный с беременностью), sCD40L (растворимый фрагмент мембранного гликопротеина CD40L). По данным исследования, наилучшей прогностической способностью обладала панель cTnT, БСЖК и NT-proBNP.
NT-proBNP, ЛП-ФЛА2, холин в цельной крови. Еще в одном исследовании наблюдали 432 пациента, также поступивших в отделение неотложной терапии с ОКС. Оценивали прогностическую значимость cTnI, наилучшей прогностической способностью обладала панель cTnT, БСЖК и NT-proBNP, hsCRP, PlGF, или ПлФР (плацентарный фактор роста), ЛП-ФЛА2 (липопротеин-ассоциированная фосфолипаза А2).
D-димер, холин в цельной крови, холин в плазме. Наилучшая комбинация: NT-proBNP, холин в цельной крови и ЛП-ФЛА2.
Стратификация рисков при острой сердечной недостаточности
Цистатин С, сTnT, NT-proBNP. Эффективно предсказывают риск неблагоприятных исходов при острой сердечной недостаточности. 138 пациентов.
Стратификация рисков при острой декомпенсированной хронической сердечной недостаточности
BNP, cTnI, hs-CRP. 577 пациентов. Чем выше уровни указанных маркеров, тем выше риск 30-дневной летальности.
Плазменные уровни B-типа натрийуретического пептида для лечения пациентов с хронической сердечной недостаточностью использовались в ряде рандомизированных контролируемых исследований. Тем не менее преимущества этого лечения были неопределенными. Поэтому был проведен метаанализ, изучающий общий эффект влияния изменения BNP под действием лекарственной терапии на сердечно-сосудистые события у пациентов с хронической СН.
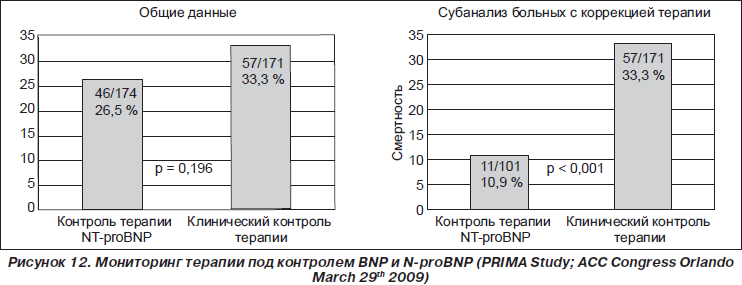
Результаты восьми рандомизированных контролируемых исследований с общим количеством 1726 пациентов и средней продолжительностью 16 месяцев были включены в метаанализ. Отмечен более низкий риск смертности от всех причин (относительный риск (ОР) 0,76; 95% доверительный интервал (ДИ) 0,63–0,91; P = 0,003) в группе терапии под контролем BNP по сравнению с основной группой. В подгруппе пациентов моложе 75 лет смертность от всех причин была также значительно ниже в группе BNP (ОР 0,52; 95% ДИ 0,33–0,82; P = 0,005). Однако не было сокращения смертности у пациентов 75 лет или старше (ОР 0,94; 95% ДИ 0,71–1,25; Р = 0,70). Риск госпитализации от всех причин и выживание без каких-либо госпитализаций незначительно отличаются между группами (ОР 0,82; 95% ДИ 0,64–1,05; Р = 0,12 и ОР 1,07; 95% ДИ 0,85–1,34; P = 0,58 соответственно). Дополнительный процент пациентов, достигших целевых доз ингибиторов ангиотензинпревращающего фермента и b-блокатора в ходе этих исследований, составил в среднем 21 и 22 % в группе BNP и 11,7 и 12,5 % в основной группе соответственно.
Выводы свидетельствуют, что терапия, осуществляемая под контролем В-типа натрийуретического пептида, снижает смертность от всех причин у пациентов с хронической СН по сравнению с обычным лечением, особенно у пациентов моложе 75 лет (рис. 12).
Тромбоэмболия легочной артерии
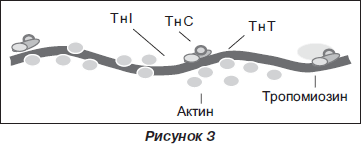
У большинства больных с венозным тромбозом наблюдается эндогенный фибринолиз, который вызывает разрушение определенного количества фибрина с образованием продукта распада перекрестно связанного фибрина — D-димера.
Увеличение концентрации D-димера более 500 мкг/л свидетельствует о спонтанной активации фибринолитической системы крови в ответ на массивное тромбообразование в бассейне венозной системы. Этот показатель характеризуется высокой чувствительностью (95–96 %) и отрицательной предсказательной ценностью (95–99 %), однако низкой специфичностью (около 40–50 %).
В настоящее время D-димер является основополагающим биомаркером и включен во все схемы дифференциальной диагностики тромбоэмболии легочной артерии (рис. 13). D-димер применяется при диагностике ТЭЛА мелких ветвей и реже — субмассивной эмболии. Однако там, где недоступно проведение компьютерной томографии, определение D-димера может использоваться для исключения ТЭЛА, так как отрицательный тест категорически исключает развитие ТЭЛА, а позитивный предполагает дальнейшее обследование пациента с подозрением на ТЭЛА, потому что повышение его уровня может наблюдаться и при других тромботических состояниях (сепсис, острый инфаркт миокарда, злокачественные новообразования, воспаление, после оперативных вмешательств и др.).
При обследовании больных ТЭЛА с целью выявления группы высокого риска необходимо определять уровни тропонина (Тn) или белка, связывающего жирные кислоты, и мозгового натрийуретического пептида (ВNP). Вследствие ишемии миокарда ПЖ в крови определяется повышение уровней ТnІ и TnТ, которые являются чувствительными маркерами необратимо поврежденных кардиомиоцитов. Повышение уровня Тn тесно коррелирует с выраженностью дисфункции ПЖ, увеличением летальности, осложнений и рецидивов ТЭЛА. Другим важным маркером неблагоприятного прогноза является мозговой натрийуретический пептид (ВNP). В ответ на перерастяжение кардиомиоцитов ПЖ, вследствие его перегрузки и дилатации, уже через несколько часов в миокарде ПЖ начинает вырабатываться прогормон ВNP (proВNP), который индуцирует появление биологически активного ВNP и конечной части proВNP (NТ-proВNP). Повышение в крови уровня этих биомаркеров является предиктором дисфункции ПЖ, развития правожелудочковой недостаточности и увеличения летальности.
Таким образом, достаточно ярко видны необходимость и распространенность применения биомаркеров различных патологических процессов, происходящих в организме при кардиологических заболеваниях. Мы видим, насколько велик вклад исследования биомаркеров в диагностику и стратификацию риска развития осложнений у наших пациентов, что ведет к коррекции терапии, применению более агрессивных методов лечения. Биомаркеры в кардиологии играют огромную роль в определении как тактики, так и стратегии лечения данного конкретного больного. Правильное использование биомаркеров в медицине не только спасает врача от ошибок в диагностике какого-либо заболевания, но и ведет к правильному отношению к отдельно взятому больному для правильного выбора групп препаратов, необходимых пациенту, предотвращения осложнений заболевания и достаточно агрессивного лечения, чтобы не навредить, а помочь больному.
1. Beuerle J.R., Azzazy H.M., Styba G. et al. Characteristics of myoglobin, carbonic anhydrase III and the myoglobin/carbonic anhydrase III ratio in trauma, exercise, and myocardial infarction patients // Clin. Chim. Acta. — 2000. — 294, 1. — 115-28.
2. Ciobanu L. Ca2+-ATPaza — un marker biologic in diagnosticul infarctului miocardic acut: Autoreferat al tezei de doctor in medicină // Chişnă. — 2009. — 22.
3. Ghani F., Wu A.H., Graff L. et al. Role of heart-type fatty acidbinding protein in early detection of acute myocardial infarction // Clin. Chem. — 2000. — 46, 5. — 718-19.
4. Glatz J.F., van Bilsen M., Paulussen R.J. et al. Release of fatty acidbinding protein from isolated rat heart subjected to ischemia and reperfusion or to the calcium paradox // Biochem. Biophys. Acta. — 1988. — 961. — 1. — 148-52.
5. Hillis G.S., Taggart P., Wardlaw D. et al. The relative utility of cardiac troponin I, creatine kinase-MBmass, and myosin light chain-1 in the long-term risk stratification of patients with chest pain // Clin. Cardiol. — 2003. — 26. — 3. — 147-52.
6. Ibanez J.I., Sobrado R., Rivero M. et al. Use of troponin-I, CPKMB and myoglobin in the diagnosis of myocardial infarct and processes of muscular necrosis of non-cardiac origin // An. Sist. Sanit. Navar. — 2001. — 24, 1. — 15-3.
7. Kaptein W., Cheng S., Glatt J. et al. Early detection of acute myocardial infarction with the new marker fatty acid-binding protein: kinetic release and diagnostic value // Eur. Heart. J. — 2000. — 21, Suppl. 524.
8. Katus H.A., Diederich K.W., Mehmel H.C. et al. Acute myocardial infarct: myosin-light-chain liberation and ventricular function // Klin. Wochenschr. — 1988. — 66, 17. — 784-89.
9. Krause E.G., Rabitzsch G., Noll F. et al. Glycogen phosphorylase isoenzyme BB in diagnosis of myocardial ischaemic injury and infarction // Mol. Cell. Biochem. — 1996. — 160-61. — 289-95.
10. Lassen D., Lucke C., Kveder M. et al. Three-dimensional structure of bovine heart fatty-acid-binding protein with bound palmitic acid, determined by multidimensional NMR spectroscopy // Eur. J. Biochem. — 1995. — 230. — 1. — 266-80.
11. Mair J. Glycogen phosphorylase isoenzyme BB to diagnose ischaemic myocardial damage // Clin. Chim. Acta. — 1998. — 272, 1. — 79-86.
12. Morrow D.A., Cannon C.P., Jessa R.L. et al. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: Clinical Characteristics and Utilization of Biochemical Markers in Acute Coronary Syndromes // Clin. Chem. — 2007. — 53, 4. — 552-74.
13. Pelsers M.M., Chapelle J.P., Knapen M. et al. Influence of age and sex and day-to-day and within-day biological variation on plasma concentrations of fatty acid-binding protein and myoglobin in healthy subjects // Clin. Chem. — 1999. — 45, 3. — 441-43.
14. Plebani M., Zaninotto M. Diagnostic strategies using myoglobin measurement in myocardial infarction // Clin. Chim. Acta. — 1998. — 272. — 69-77.
15. Rabitzsch G., Mair J., Lechleitner P. et al. Immunoenzymometric assay of human glycogen phosphorylase isoenzyme BB in diagnosis of ischemic myocardial injury // Clin. Chem. — 1995. — 41, 7. — 966-978.
16. Santos E.S., Pereira M.P., Minuzzo L. et al. Electrical cardioversion and myocardial injury: evaluation by new cardiac injury markers // Arq. Bras. Cardiol. — 2006. — 86, 3. — 191-97.
17. Tanasijevic J.M. Non-invasive assessment of coronary artery patency after thrombolysis using serum myoglobin measurements // Prilozi. — 2007. — 28, 1. — 5-1.
18. Van Nieuwenhoven F.A., Kleine A.H., Wodzig W.H. et al. Discrimination between myocardial and skeletal muscle injury by assessment of the plasma ratio of myoglobin over fatty acid-binding protein // Circulation. — 1995. — 92, 10. — 2848-854.
19. Van Nieuwenhoven F.A., Verstijnen C.P., Abumrad N.A. et al. Putative membrane fatty acid translocase and cytoplasmic fatty acidbinding protein are co-expressed in rat heart and skeletal muscles // Biochem. Biophys. Res. Commun. — 1995. — 207, 2. — 747-52.
20. Casals G., Filella X., Bedini J.L. et al. Evaluation of a new ultrasensitive assay for cardiac troponin I // Clin. Biochem. — 2007. — 40(18). — 1406-13.
21. Kavsak P.A., MacRae A.R., Yerna M.J. et al. Analytic and clinical utility of a next-generation, highly sensitive cardiac troponin I assay for early detection of myocardial injury // Clin. Chem. — 2009. — 55(3). — 573-7.
22. van de Kerkhof D., Peters B., Scharnhorst V. Performance of the Advia Centaur second-generation troponin assay TnI-Ultra compared with the first-generation cTnI assay // Ann. Clin. Biochem. — 2008. — 45(Pt 3). — 316-7.
23. Melanson S.E., Morrow D.A., Jarolim P. Earlier detection of myocardial injury in a preliminary evaluation using a new troponin I assay with improved sensitivity // Am. J. Clin. Pathol. — Aug 2007. — 128(2). — 282-6.
24. Kurz K., Giannitsis E., Zehelein J. et al. Highly sensitive cardiac troponin T values remain constant after brief exercise- or pharmacologic-induced reversible myocardial ischemia // Clin. Chem. — 2008. — 54(7). — 1234-8.
25. Wilson S.R., Sabatine M.S., Sloan S. et al. Novel Nanoparticle Cardiac Troponin I Assay Detects Myocardial Injury in Most Patients with Unstable Angina: Observations from the PROTECT-TIMI 30 Trial // Circulation. — 2008. — 118. — S 636-S637.
26. Melanson S.E., Conrad M.J., Mosammaparast N. et al. Implementation of a highly sensitive cardiac troponin I assay: test volumes, positivity rates and interpretation of results // Clin. Chim. Acta. — 2008. — 395(1–2). — 57-61.
27. Apple F.S., Smith S.W., Pearce L.A. et al. Use of the Centaur TnI-Ultra assay for detection of myocardial infarction and adverse events in patients presenting with symptoms suggestive of acute coronary syndrome // Clin. Chem. — 2008. — 54(4). — 723-8.
28. Apple F.S., Smith S.W., Pearce L.A. et al. Use of the bioMйrieux VIDAS troponin I ultra assay for the diagnosis of myocardial infarction and detection of adverse events in patients presenting with symptoms suggestive of acute coronary syndrome // Clin. Chim. Acta. — 2008. — 390(1–2). — 72-5.
29. Mingels A., Jacobs L., Michielsen E. et al. Reference population and marathon runner sera assessed by highly sensitive cardiac troponin T and commercial cardiac troponin T and I assays // Clin. Chem. — 2009. — 55(1). — 101-8.
30. McCann C.J., Glover B.M., Menown I.B. et al. Prognostic value of a multimarker approach for patients presenting to hospital with acute chest pain // Am. J. Cardiol. — 2009. — 103(1). — 22-8.
31. Mоеckel M., Danne O., Mиller R. et al. Development of an optimized multimarker strategy for early risk assessment of patients with acute coronary syndromes // Clin. Chim. Acta. — 2008. — 393(2). — 103-109.
32. Manzano-Fernбndez S., Boronat-Garcia M., Albaladejo-Otуn M.D. et al. Complementary prognostic value of cystatin C, N-terminal pro-B-type natriuretic Peptide and cardiac troponin T in patients with acute heart failure // Am. J. Cardiol. — 2009. — 103(12). — 1753-9.
33. Porapakkham P., MD; Porapakkham P., MD; Zimmet H., MD; Billah B., MD; Crum H., MD. B-Type Natriuretic Peptide-Guided Heart Failure // Arch. Intern. Med. — 2010. — 170(6). — 507-514.
34. Troughton R.W., Frampton C.M. and Nicholls M.G. Use of a single target level of BNP or NT-proBNP, perhaps adjusted for clinical covariates such as age, appears to offer the best opportunity for the biomarker-guided strategy to alter management // J. Am. Coll. Cardiol. — 2010. — 56. — 2090- 2100.
35. Zairis M.N., Tsiaousis G.Z., Georgilas A.T. et al. Multimarker strategy for the prediction of 31 days cardiac death in patients with acutely decompensated chronic heart failure // Int. J. Cardiol. — 2009.
36. Le Gal G., Righini M., Roy P.-M. et al. Value of D-Dimer Testing for the Exclusion of Pulmonary Embolism in Patients With Previous Venous Thromboembolism // Arch. Intern. Med. — Jan. 23, 2006. — 166. — 176-180.