Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Патогенетический подход к профилактике парезов кишечника в оперативной гинекологии
Авторы: Дубов А.М., Каминский В.В., Ткаченко Р.А., Коноплянко В.В. Кафедра акушерства, гинекологии и репродуктологии, Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Работа основана на анализе результатов профилактики и лечения парезов кишечника в оперативной гинекологии у 59 больных. Упреждающий характер предложенной и апробированной в клинике комплексной патогенетически обоснованной программы профилактики и лечения парезов кишечника способствует раннему восстановлению функций желудочно-кишечного тракта и предупреждает развитие осложнений в оперативной гинекологии.
Оперативная гинекология, парез кишечника, патогенетическое лечение, бензогексоний, Эспумизан, многоатомные спирты.
Одним из наиболее часто встречающихся функциональных расстройств в раннем послеоперационном периоде является парез кишечника, который клинически проявляется метеоризмом, вздутием живота и задержкой отхождения газов. Разной степени выраженности нарушения моторно-эвакуаторной функции кишечника встречаются не только после экстренных, но и после плановых и даже небольших по объему абдоминальных вмешательств, выполненных лапароскопическим доступом [1, 12, 14].
В литературе нет единого термина для обозначения состояния, возникающего в результате нарушения моторной деятельности кишечника в послеоперационном периоде. Это состояние называют послеоперационным метеоризмом, динамической кишечной непроходимостью, функциональным стазом кишечника, послеоперационной функциональной кишечной непроходимостью. Однако в настоящее время все чаще используется термин «послеоперационный парез кишечника» (ППК), который отражает, что ведущим является нарушение двигательной функции кишечника, появившееся в послеоперационном периоде. О послеоперационном парезе следует говорить, когда в результате угнетения двигательной активности желудочно-кишечного тракта (ЖКТ) возникают нарушения эвакуации его содержимого, что объективно проявляется ослаблением кишечных шумов, задержкой отхождения газов, более или менее выраженным вздутием живота в первые 48 ч после выполнения оперативного вмешательства [1–3, 6, 11, 15].
Неудовлетворительные результаты в профилактике и разрешении послеоперационных парезов клиницисты связывают с двумя основными причинами.
Во-первых, в широкой клинической практике доминирует традиционно стандартный подход врачей к выбору лечебных мероприятий без учета патогенеза заболевания [1, 6, 9].
Во-вторых, практический опыт лечения послеоперационных парезов свидетельствует о том, что борьба с ними начинается лишь тогда, когда они уже развиваются, в то время как мероприятия по лечению парезов должны проводиться в раннем послеоперационном периоде до появления клинических признаков [5, 6, 13].
Минимизировать влияние этих причин в клинической практике может лишь глубокое знание патофизиологии процессов развития парезов кишечника в послеоперационном периоде у больных после абдоминальных операций при наличии объективных методов контроля в процессе лечения этого осложнения [5, 7, 11, 16].
Нормальная моторика является результатом координированной контрактильной активности гладких мышц по всей длине ЖКТ. Эта активность регулируется местными факторами, моделирующими деятельность гладких мышц, рефлексами, пути которых замыкаются в пределах вегетативной нервной системы, гормонами и влиянием центральной нервной системы. По данным многих исследователей, каждая из этих систем играет, возможно, независимую патогенетическую роль в развитии послеоперационного пареза желудочно-кишечного тракта [2, 4, 8, 13].
Патогенез пареза желудочно-кишечного тракта весьма сложен и, видимо, имеет не одну, а несколько причин развития [1, 3, 6, 13]. Чаще всего парез желудочно-кишечного тракта встречается после обширных абдоминальных операций [3, 10, 15]. Многие авторы объясняют это тем, что при подобных оперативных вмешательствах травмируется богатая рецепторами брюшина, вследствие чего развиваются циркуляторные расстройства в стенке органов желудочно-кишечного тракта, повышается тонус симпатической нервной системы с выбросом в кровь большого количества катехоламинов [1–3, 9–11, 16]. В связи с этим многие авторы оценивают развитие послеоперационного пареза желудочно-кишечного тракта как защитную реакцию на операционную травму в ближайшие 2–3 дня после операции [6, 13, 15, 16].
Другие исследователи [7, 9, 11] считают, что одним из факторов развития послеоперационного пареза являются тяжелые водно-электролитные нарушения в дооперационном периоде, особенно калиевая недостаточность [6, 15].
Нередко причиной угнетения перистальтики оказываются нарушения микроциркуляции в кишечной стенке, обусловленные расстройствами гемодинамики [4, 5, 12]. Циркуляторная гипоксия, являющаяся главным звеном этих изменений, нарушает деятельность интрамурального нервного аппарата, в результате чего утрачивается способность передачи импульсов. Глубокие метаболические и внутриклеточные электролитные нарушения делают гладкомышечные клетки не способными к восприятию импульсов на сокращение. Дальнейшим этапом патогенеза становится эндогенная интоксикация, которая замыкает порочный круг, усиливая тканевую гипоксию [4, 6, 10, 13].
Программа профилактики и лечения послеоперационного пареза желудочно-кишечного тракта должна включать компоненты, воздействующие на основные звенья патогенеза.
Цель нашей работы — апробация патогенетически обоснованной программы лечебных мероприятий, направленных на профилактику и разрешение послеоперационного пареза и связанных с ним метаболических нарушений, каждый пункт которой выполняет задачи не одного, а нескольких патогенетически обоснованных лечебных направлений.
Материал и методы
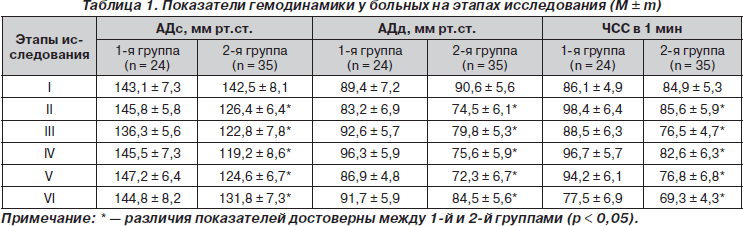
Исследования проведены у 59 женщин в возрасте от 28 до 78 лет, которых оперировали в клинике акушерства и гинекологии за последние 12 месяцев с октября 2010 года. Всем больным в условиях тотальной внутривенной анестезии с интубацией трахеи и искусственной вентиляцией легких кислородовоздушной смесью произведена экстирпация матки по поводу фибромиомы или рака. Исходя из методик профилактики пареза кишечника больные были разделены на 2 группы. Больным 1-й группы (24 чел.) проводилась традиционная анальгетическая, инфузионная и прокинетическая терапия во время операции и в ближайшем послеоперационном периоде. Больным 2-й группы (35 чел.) в качестве компонента нейровегетативной блокады на операционном столе (через 10–15 мин после вводной анестезии) применяли бензогексоний в дозе 0,12 мг/кг внутривенно методом тахифилаксии, а после операции по 0,12–0,15 мг/кг через 6 часов внутримышечно с наркотическими и ненаркотическими анальгетиками. У больных 2-й группы обязательно во время операции выполнялась декомпрессия желудка через зонд, который удаляли перед экстубацией, а после операции с целью декомпрессии желудка и кишечника назначали Эспумизан 120 мг каждые 8 часов внутрь (по 3 капсулы или по 75 капель). Инфузионная терапия у больных исследуемой группы проводилась раствором Рингера с добавлением через 6 часов после операции растворов, содержащих сорбит или ксилит (сорбилакт, реосорбилакт, глюксил, ксилат). Прокинетики (2 мл метоклопрамида или церукала) больным 1-й группы назначали сразу после операции с интервалом 6 часов, а больным 2-й группы — через 8 часов после операции 2–3 раза в суки в/м или в/в. Для оценки гемодинамического эффекта бензогексония на этапах анестезиологического обеспечения операции и в послеоперационном периоде у больных обеих групп оценивали систолическое и диастолическое артериальное давление (АДс и АДд), частоту сердечных сокращений (ЧСС) на следующих этапах: I — за 10 мин до вводной анестезии; II — через 30 мин после вводной анестезии (в это время у больных 2-й группы развивался ганглионарный блок); III — через час после операции; IV — в 18.00; V — в 24.00; VI — в 7.00.
Результаты и обсуждение
Достоверно значимых различий по возрасту, массе тела, сопутствующей патологии, длительности операции, величине кровопотери и объему инфузионной терапии между группами больных не было.
При анализе данных клинических результатов выявлено, что восстановление моторно-эвакуаторной функции желудочно-кишечного тракта во 2-й группе больных происходило в среднем через 12–18 часов после операции, а в 1-й — через 20–26 часов. У некоторых больных 2-й группы отчетливые волны перистальтики кишечника наблюдались даже в конце оперативного вмешательства. Изначальная декомпрессия желудка через зонд c последующим применением Эспумизана у больных исследуемой группы наряду с симпатолитическим эффектом бензогексония и отсроченным применением прокинетиков способствовали исключению эпизодов тошноты и рвоты в послеоперационном периоде. Если при введении бензогексония отмечалось снижение артериального давления, то проводилась коррекция темпа, объема и состава инфузионной терапии. Изменения показателей гемодинамики у больных обеих групп на этапах лечения подробно отражены в табл. 1. Отмечается статистически значимое различие в показателях АДс, АДд и ЧСС между группами больных (р < 0,05) на этапах исследования. Включение бензогексония в программу профилактики послеоперационных парезов имеет патогенетическое обоснование его многогранным механизмом действия, поскольку в современной отечественной анестезиологии недостаточно средств, обеспечивающих такой важный компонент анестезии, как нейровегетативная блокада, а наркотические анальгетики в чистом виде угнетают моторику кишечника. Кроме того, бензогексоний пролонгирует действие мышечных релаксантов, понижает тонус симпатической нервной системы и выброс в кровь большого количества катехоламинов, уменьшает секрецию желез желудочно-кишечного тракта, блокирует образование антидиуретического гормона, улучшает микроциркуляцию и функционирование энтероцитов.
Важная роль в нашей программе профилактики парезов кишечника отводится инфузионной терапии поскольку использование полиионных растворов (Рингера, Рингера лактат) не нарушает водно-электролитный баланс организма. Полиионные среды на основе многоатомных спиртов (реосорбилакт, сорбилакт, глюксил, ксилат) включены в программу на основании полипатогенетического действия: донаторы электролитов и энергии; поддерживают объем циркулирующей крови и улучшают микроциркуляцию, особенно в спланхнической зоне; уменьшают отек стенки кишечника; в дозе 0,5–1 мг/кг обладают прокинетическим действием на кишечник. Поскольку ксилат, реосорбилакт и сорбилакт усваиваются без участия инсулина, то их применение патогенетически обосновано и у больных с сопутствующим сахарным диабетом.
При анализе полученных результатов нами выявлено еще одно существенное различие в группах. При идентичных объемах кровопотери и инфузионной терапии темп мочеотделения в пересчете на 1 кг массы тела у больных 2-й группы был выше на 0,27 ± 0,08 мл/кг•час (р < 0,05), или 518 ± 153 мл в сутки, что, по нашему мнению, составляет суточный потенциально секретируемый объем в «третье пространство» при прогрессировании клиники пареза кишечника. Бензогексоний и инфузия в послеоперационном периоде реосорбилакта, сорбилакта, ксилата или глюксила блокируют патогенетический механизм секвестрации жидкости при парезе кишечника. Все больные, как правило, при неосложненном течении на вторые сутки переводились в профильное отделение, и там продолжалась профилактика парезов кишечника назначением ректальных свечей (бисакодил 10 мг, 2–3 раза в сутки), обладающих b-адренолитическим действием, стимулирующим моторику толстого кишечника, что позволило нам отказаться от традиционного назначения прозерина и клизм в различных модификациях.
Выводы
1. Программа профилактики и лечения парезов желудочно-кишечного тракта включает компоненты, каждый из которых выполняет задачи нескольких лечебных направлений: снижение тонуса симпатической нервной системы бензогексонием; декомпрессия желудка и кишечника с помощью зонда и Эспумизана; инфузия полиионных растворов на основе многоатомных спиртов (сорбилакт, реосорбилакт, глюксил, ксилат); рациональное применение прокинетиков и b-адренолитиков.
2. Упреждающий характер предложенной патогенетически обоснованной программы профилактики и лечения парезов кишечника способствует раннему восстановлению функций желудочно-кишечного тракта и предупреждает развитие осложнений в оперативной гинекологии.
1. Грибков Ю.И. Ранняя диагностика и лечение послеоперационного пареза желудочно-кишечного тракта / Ю.И. Грибков, А.С. Урбанович // Хирургия. — 1992. — № 2. — С. 120-123.
2. Евдокименко В.В. Особенности моторно-эвакуаторной функции двенадцатиперстной кишки при панкреатите: Автореф. дис… канд. мед. наук. — Красноярск, 2006. — 25 с.
3. Ермолов А.С. Синдром кишечной недостаточности в абдоминальной хирургии / А.С. Ермолов, Т.С. Попова, Г.В. Пахомова и др. — М.: МедЭкспертПресс, 2005. — 460 с.
4. Калинин А.В. Физиология и клинические аспекты нарушений моторики тонкой кишки / А.В. Калинин, Л.И. Буторова // Клин. перспективы гастроэнтерол., гепатол. — 2001. — № 4. — С. 25-32.
5. Каминский В.В. Методы профилактики парезов кишечника в оперативной гинекологии / В.В. Каминский, А.М. Дубов, Р.А. Ткаченко // Таврический медико-биологический вестник. — 2011. — Т. 14, № 3. — Ч. 2(55). — С. 264-266.
6. Костюченко А.Л. Интенсивная терапия послеоперационных осложнений / А.Л. Костюченко, К.Я. Гуревич, М.И. Лыткин. — СПб.: Спец.лит., 2000. — 543 с.
7. Минушкин О.Н. Лечение функциональных расстройств кишечника и желчевыводящей системы, протекающих с абдоминальными болями и метеоризмом / О.Н. Минушкин, Г.А. Елизаветина, М.Д. Ардатская // Клиническая фармакология и терапия. — 2002. — Т. 11, № 1. — С. 1-4.
8. Ткач С.М. Сравнительная эффективность различных препаратов первой и второй линии в лечении функциональной диспепсии / С.М. Ткач, Б.Н. Марусанич // Мистецтво лікування. — 2006. — № 7. — С. 78-80.
9. Chen S.C. Specific oral medications decrease the for srgery in adhesive partial small-bowel obstruction / S.C. Chen, C.C. Lee, Z.C. Yen et al. // Surgery. — 2006. — Vol. 139. — P. 312-316.
10. Gan T.J. Goal-directed intraoperative fluid administration reduces length of hospital stay after major surgery / T.J. Gan, A. Soppitt, M. Maroof et al. // Anesthesiology. — 2002. — Vol. 97, № 4. — P. 820-826.
11. Holte K. Postoperative ileus: a preventable event / K. Holte, H. Kehlet // Br. J. Surg. — 2000. — Vol. 87. — P. 1480-1493.
12. Kreiss Ch. Alpha 2-Adrenergic regulation of NO production alters postoperative intestinal smooth muscle dysfunction in rodents / Ch. Kreiss, S. Toegel, A.J. Bauer // Am. J. Physiol. Gastrointest. Liver Physiol. — 2004. — Vol. 287, № 3. — P. G658-G666.
13. Luckey A. Mechanisms and Treatment of Postoperative Ileus / A. Luckey, E. Livingston, Y. Tache // Arch. Surg. — 2003. — Vol. 138, № 2. — P. 206-214.
14. Meier R. Review of the Therapeutic Use of Simethicone in Gastroenterology / R. Meier, M. Steuerwald // Schweiz. Zschr. GanzheitsMedizin J. — 2003. — Vol. 19, Heft 7/8. — P. 380-387.
15. Mythen M.G. Postoperative Gastrointestinal Tract Dysfunction / M.G. Mythen // Anesth. Analg. — 2005. — Vol. 100, № 1. — P. 196-204.
16. Walker J. Pathophysiology and management of abdominal compartment syndrome / J. Walker, L.M. Criddle // Amer. J. Crit. Care. — 2003. — № 12. — P. 367-371.