Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Бемипарин и ультранизкомолекулярный гепарин RO-14 снижают неоангиогенные свойства эндотелия, вызванные лейкозом, раком легких или молочной железы
Авторы: Alfonso Vignoli, Marina Marchetti, Laura Russo, Elena Cantalino, Erika Diani, Gaia Bonacina, Anna Falanga Division of Immunohematology and Transfusion Medicine, Department of Oncology-Hematology, Ospedali Riuniti di Bergamo, Bergamo, Italy
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Низкомолекулярные гепарины — это антикоагулянты, обладающие также противоопухолевыми свойствами. Мы исследовали способность низкомолекулярного гепарина второй генерации бемипарина и ультранизкомолекулярного гепарина RO-14 ингибировать in vitro ангиогенный ответ эндотелиоцитов человека на стимуляцию средой, содержащей лейкозные клетки, клетки рака легких и молочной железы. Бемипарин и RO-14 проявили дозозависимые ингибирующие свойства в подавлении неоангиогенеза, индуцированного средой, кондиционированной раковыми клетками, в частности подавление процесса формирования тубулярных структур микроваскулярными эндотелиоцитами (по результатам теста с применением матригеля) и миграции эндотелиоцитов (по результатам теста на «заживление раны»). Оба препарата также подавляли неоангиогенез, стимулированный очищенными факторами роста эндотелия сосудов VEGF и фактором роста фибробластов FGF-2. Полученные данные подтверждают возможность применения данных препаратов в составе адъювантной терапии у онкологических больных.
Гепарины, низкомолекулярные гепарины, ангиогенез, эндотелиальные клетки, раковые клетки.
Введение
Зависимость между развитием рака и тромбообразованием установлена еще 100 лет назад [1]. Эта связь двухсторонняя: наличие опухоли индуцирует гиперкоагуляцию, что является предрасполагающим фактором для развития тромбов, в то же время активация коагуляционных процессов способствует прогрессированию опухоли. Существует гипотеза, согласно которой разрыв этой связи повлечет за собой увеличение выживаемости онкологических пациентов. В связи с этим проводится интенсивное исследование гепаринов — наиболее часто используемых парентеральных антикоагулянтов для профилактики и лечения тромбозов. Гепарины по химической структуре являются гликозаминогликанами. Механизм их действия заключается в том, что они усиливают степень ингибирования факторов Xа и IIа антитромбином III. Низкомолекулярные гепарины широко применяются для тромбопрофилактики у онкологических больных, составляющих группу высокого риска развития как венозных, так и артериальных тромбозов [2]. Следует отметить, что результаты различных рандомизированных клинических исследований указывают на благоприятное влияние низкомолекулярных гепаринов на выживаемость пациентов с определенными видами опухолей [3]. Этот эффект не может быть объяснен исключительно предотвращением тромбозов, и поэтому его относят к «неантикоагуляционным» эффектам гепарина [4].
Противоопухолевый эффект этой группы лекарственных средств впервые был отмечен в 1930 году [5]. С тех пор в ходе возрастающего количества исследований была показана эффективность гепарина в ингибировании роста первичной опухоли и развития метастазов, блокирование адгезии и миграции раковых клеток, влияние на индуцированный опухолью неоангиогенез [4, 6, 7]. Влияние гепаринов на ангиогенез активно исследуется как in vivo, так и in vitro [8]. По результатам других исследований известно, что от размера молекул гепарина зависят антиангиогенные свойства препарата [9]. В проведенном нами предыдущем исследовании мы продемонстрировали, что два низкомолекулярных гепарина первого поколения (дальтепарин и эноксапарин) со средней молекулярной массой 5,7 и 4,5 кДа соответственно обладают свойством предотвращать формирование капилляроподобных структур в культуре клеток микроваскулярного эндотелия под влиянием среды, кондиционированной клетками рака молочной железы и лейкоза [10].
В последнее время стали доступны низкомолекулярные гепарины второго поколения, характеризующиеся более низкой средней молекулярной массой, более точно определенным составом полисахаридных цепей, улучшенным отношением anti-FXa/anti-FIIa и, возможно, более благоприятным профилем безопасности (т.е. с пониженным риском развития геморрагий). Бемипарин — один из представителей этой группы препаратов, недавно прошедший фазу клинических испытаний, в которых проводилось изучение его эффективности при тромбопрофилактике и в составе адъювантной терапии у онкологических больных [11, 12]. RO-14 (средняя молекулярная масса 2,2 кДа) является гепарином с ультранизкой молекулярной массой, полученным в результате фракционирования гепарина. В настоящее время находится в фазе клинических исследований [13, 14].
Цель данного исследования — изучить, обладают ли бемипарин [11, 12] и RO-14 антиангиогенными свойствами, отмеченными у низкомолекулярных гепаринов первого поколения. Для этого в ходе исследования мы изучили взаимодействие раковых клеток с микрососудистыми эндотелиальными клетками человека (HMEG-1) in vitro. Таким образом, мы исследовали способность гепаринов ингибировать неоангиогенез, индуцированный как опухолевыми клетками различного вида (лейкоза, рака молочной железы и мелкоклеточного рака легких), так и стандартными проангиогенными факторами (VEGF и FGF-2). Фактически мы оценивали способность бемипарина и/или RO-14 предотвращать формирование тубулярных структур в культуре микроваскулярных эндотелиоцитов человека (HMEC‑1), пролиферацию и миграцию.
Материалы и методы
Лекарственные препараты
В данном исследовании проводилось изучение низкомолекулярных гепаринов — бемипарина натрия и ультранизкомолекулярного гепарина RO-14 (оба препарата были предоставлены фармацевтической компанией Laboratorios Farmaceuticos ROVI, Мадрид, Испания). Бемипарин и RO-14 были получены из слизистой кишечника свиньи с применением процесса деполимеризации — бета-элиминации. Средняя молекулярная масса олигосахаридных цепей, входящих в состав бемипарина, — 3,6 кДа (разброс от 3,0 до 4,2 кДА). Как правило, менее 35 % олигосахаридов имеют молекулярную массу менее 2,0 кДа, 50–80 %— от 2,0 до 6,0 кДа, молекулярная масса менее 15 % цепей — больше 6,0 кДа. Средняя молекулярная масса олигосахаридных цепей в составе RO-14 — 2,2 кДа (разброс от 1,8 до 3,0 кДа), молекулярная масса 25–45 % входящих в его состав олигосахаридов составляет 2,2 кДа, 40–75 % — от 2,0 до 6,0 кДа и менее 15 % олигосахаридов — более 6,0 кДа. Бемипарин был выпущен в форме коммерчески доступного препарата (25 (anti-FХa) МЕ/мл), а RO-14 нам предоставили в форме порошка, растворенного в стерильной воде, в концентрации 25 МЕ/мл, профильтрованного через фильтр с порами 0,22 мкм. Оба препарата прошли предварительные исследования производителем в соответствии с монографией о низкомолекулярных гепаринах, изданной Европейской Фармакопеей [15], а именно были проведены тесты на бактериальных эндотоксинах для подтверждения соответствия критерию об уровне анти-Ха-активности меньше чем 0,01 МЕ на каждую международную единицу.
Оценка пролиферации эндотелиоцитов и формирования капилляроподобных структур проводилась с применением бемипарина в концентрациях 0,01; 0,1 и 1 МЕ/мл, что покрывает терапевтический диапазон доз, используемый в клинической практике и выбранный по результатам наших предыдущих работ [10]. Для проведения теста на «заживление раны» бемипарин применялся в тех же концентрациях плюс в концентрации 10 МЕ/мл. Так как для RO-14 терапевтический уровень концентрации в плазме крови еще не установлен, то мы использовали его в тех же концентрациях, что и бемипарин.
Иммортализованные микроваскулярные эндотелиальные клетки человека
Клетки HMEC-1 (предоставлены доктором Ф.Дж. Кандал, Центр по контролю и профилактике заболеваний, Atlanta, GA, USA) были выращены на среде RPMI 1640 (Cibco, Gaithersburg, MD, USA) с добавкой 5% эмбриональной сыворотки теленка (FBS, Gibco), 2 ммоль L-глютамина (Gibco), 10 нг/мл эпидермального фактора роста (ICN, Costa Mesa, CA, USA) и 1 мкг/мл гидрокортизона (ICN). Клетки находились при 5% содержании CO2/95% воздушная среда во влажном инкубаторе (Heraeus, Milan, Italy) при температуре 37 °C. Пассажирование клеток было произведено сливными монослоями с использованием трипсина/EDTA (0,25% раствор трипсина-EDTA, Life Technologies, Inc., Rockville, MD, USA), в разведении 1 : 3.
Культуры раковых клеток и приготовление среды, кондиционированной раковыми клетками*
Клетки рака молочной железы человека линии МDA.MB.231. Культура этих клеток (American Type Culture Collection — ATCC, Manassas, VA, USA, cat. № HTB-26) была получена из плеврального выпота 51-летней женщины с аденокарциномой [16]. Характеристика: фибробластический фенотип, эстроген-рецептор отрицательный, высокая степень метастазирования invivo (это было установлено на мышах [17]). Клетки линии MDA.MB.231 были выращены в модифицированной Дулбеко среде Игла (DMEM, Gibco) с добавлением 10% эмбриональной сыворотки теленка, 2 ммоль L-глютамина, 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина и 1% заменимых аминокислот (Gibco) в колбах Т-75 (Becton Dickinson, Mountain View, USA), где произошла их адгезия к пластиковому дну в форме монослоя. При 100% слиянии монослоя среда была убрана, клетки промыты 3 раза в RPMI 1640. Дальнейшую инкубацию клеток провели с применением 10 мл RPMI 1640 без сыворотки плюс 2 ммоль L-глютамина в течение 24 часов. Затем среду, кондиционированную раковыми клетками данной линии, собрали, профильтровали через фильтр с отверстиями 0,22 мкм и хранили при температуре –40 °С до проведения анализа.
Клетки мелкоклеточного рака легких человека линии Н69. Клетки мелкоклеточного рака легких человека линии Н69 (ATCC, cat. № HTB-119) были выращены на среде RPMI 1640 с добавлением 10% эмбриональной сыворотки теленка в колбах Т-75 в виде суспензии клеток [18]. Для подготовки кондиционированной среды раковые клетки собрали из колб, центрифугировали и ресуспендировали в концентрации 500 000 клеток/мл в среде RPMI 1640 без сыворотки. Через 24 часа инкубации провели центрифугирование суспензии клеток при 1500 G в течение 5 минут, собрали надосадочную жидкость (т.е. среду, кондиционированную раковыми клетками) и снова процентрифугировали при 16 000 G в течение 10 минут для удаления остаточных элементов клеток. Затем профильтровали через фильтр с отверстиями 0,22 мкм. Среду, кондиционированную данным видом раковых клеток, хранили в замороженном состоянии до проведения собственно эксперимента.
Клетки промиелоцитарного лейкоза человека линии NB4. Линия клеток NB4 была получена invitro от пациента с острым промиелоцитарным лейкозом. Это подарок от д-ра М. Ланотте (INSERM Unit 301, St. Louis Hospital, Paris, France). Данная линия клеток была выращена в виде суспензии в среде RPMI 1640 с содержанием 10% эмбриональной сыворотки теленка, 2 ммоль L-глютамина, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина [19]. Кондиционированная среда для линии клеток NB4 была приготовлена так же, как для линии клеток Н69.
Для определения HMEC-1 и жизнеспособности раковых клеток применялся трипановый синий. Для проведения эксперимента были отобраны только те клеточные культуры, в которых обнаруживалось более 95 % живых клеток.
Оценка формирования капилляроподобных структур в матригеле
Для оценки способности этих клеток формировать организованную тубулярную структуру был проведен тест с применением матригеля [10]. Слитые НМЕС-1, оставленные на ночь при температуре 37 °C в среде RPMI 1640 с 1% эмбриональной сывороткой теленка, были собраны путем ферментативного отщепления с использованием трипсина-EDTA, подсчитаны и ресуспендированы в среде RPMI 1640 с 0,5% эмбриональной сывороткой теленка. После этого 10 000 клеток/лунку были посеяны на растворе матригеля (Becton Dickinson) с пониженным содержанием фактора роста и инкубированы при температуре 37 °C и 5% содержании СО2 в увлажненной атмосфере либо со средами, кондиционированными раковыми клетками, либо с добавлением очищенных рекомбинантных человеческих проангиогенных факторов: VEGF165 в дозе 50 нг/мл или 100 нг/мл FGF-2 при наличии или в отсутствие бемипарина или RO-14 в возрастающих концентрациях (0,01–0,1–1 МЕ/мл). Каждый эксперимент мы повторяли 3 раза. Формирование трубочкоподобных структур оценивалось при помощи инвертированного оптического микроскопа (ZEISS, Oberkochen, Germany) через 24 часа при температуре 37 °С. С помощью видеокамеры, установленной в микроскопе, были получены цифровые снимки и проведен их анализ с применением программного обеспечения Image J (National Institutes of Health, Bethesda, MD, USA). В ходе анализа мы измерили общую длину соединенных клеток, формирующих тубулярные структуры на поверхности матригеля (единица измерения — мм (длины трубки)/см2 (площади)). Предварительные эксперименты проводились для оценки оптимальной концентрации среды, кондиционированной раковыми клетками. Для этого мы провели инкубацию микрососудистых эндотелиоцитов человека с кондиционированными раковыми клетками средами с возрастающей концентрацией от 1,25 до 75 %. Наиболее выраженное формирование тубулярных структур наблюдалось при концентрации 12,5 % во всех кондиционированных средах (данные не предоставлены в статье), именно они применялись для проведения последующих экспериментов. До начала некоторых экспериментов кондиционированную среду инкубировали в течение 2 часов при температуре 37 °C с поликлональными нейтрализующими антителами против человеческого VEGF165 в концентрации 2,5 мкг/мл (R&D Systems, Minneapolis, MN, USA) [10].
Пролиферация эндотелиоцитов
Пролиферацию эндотелиоцитов оценивали с помощью колориметрического метода согласно инструкции [10]. Микроваскулярные эндотелиальные клетки человека были посеяны в концентрации 10 000 клеток/лунку в планшете с 96 лунками. Калибровочная кривая была подготовлена для посева человеческих микрососудистых эндотелиоцитов с клетками в лунке в возрастающей концентрации. Мы подождали, пока человеческие микрососудистые эндотелиоциты прикрепились, и затем выдерживали их в течение 24 часов в среде RPMI 1640 с добавлением 1% эмбриональной сыворотки теленка. Затем среду убрали, а микроваскулярные эндотелиальные клетки инкубировали со средой RPMI 1640 (лунки с контрольными клетками и лунки калибровочных кривых), со средами, кондиционированными раковыми клетками (концентрация среды 12,5 % в RPMI 1640 с добавлением 0,5% эмбриональной сыворотки теленка), или с добавлением проангиогенного фактора VEGF165 (в концентрации 50 нг/мл) в присутствии или в отсутствие бемипарина или RO-14 в концентрации 0,01–0,1–1 МЕ/мл. Через 24 часа инкубации человеческие микрососудистые эндотелиоциты промыли 3 раза фосфатным буферным физиологическим раствором и провели фиксацию 3% параформальдегидом (Sigma-Aldrich, Milan, Italy) в течение 10 минут. Затем планшеты промыли 3 раза с применением фосфатного буферного физиологического раствора, опорожнили и высушили на сухом воздухе. После этого 75 мкл красителя кристаллический фиолетовый добавили в каждую лунку (0,5% водный раствор). Через 5 минут его растворили с помощью раствора цитрата натрия с этанолом и оценили спектральную поглощательную способность при длине волны 540 нм с помощью Multiscan Ascent reader (Titertek, Huntsville, AL, USA). Калибровочная кривая была построена путем сопоставления количества клеток после теста исключения с применением красителя трипановый синий и соответствующих оптических плотностей, полученных при окраске кристаллическим фиолетовым.
Тест на «заживление раны»
Данный анализ позволяет исследовать способность эндотелиоцитов к пролиферации и миграции в условиях искусственной раны. Человеческие микрососудистые эндотелиоциты были выращены для слияния при температуре 37 °C и 5% содержании СО2 в инкубаторе. В монослое путем аспирации кончиком пипетки объемом 10 мкл было создано отверстие в центре каждой лунки. После 3 смывов с RPMI 1640, до проведения последующей обработки, были сделаны фото под инвертированным микроскопом LEICA DM IRB (Leica Microsystems GmbH, Wetzlar, Germany) при 5-кратном увеличении камерой OPTIKAM PRO3 (M.A.D. Apparecchiature Scientifiche, Ponteranica, Italy). Затем мы убрали среду и инкубировали микроваскулярные эндотелиоциты человека в присутствии либо среды, кондиционированной раковыми клетками, либо 50 нг/мл VEGF165 с добавлением или без бемипарина или RO-14 в концентрациях 0,01–0,1–1–10 МЕ/мл для обоих препаратов. Это была исследуемая группа. Контрольную группу эндотелиоцитов мы инкубировали в среде RPMI 1640. Через 20 часов инкубации при температуре 37 °C были сделаны фотографии после соответствующей обработки. Мы провели сравнение фотографий каждой лунки до и после обработки. Площадь, занятая мигрирующими/пролиферирующими клетками (так называемая площадь возобновленного роста), была рассчитана при помощи программного обеспечения Image J 1.42q (National Institute of Health, Bethesda, MD, USA). Результаты выражены в процентах площади возобновленного роста при условии, что площадь возобновленного роста в контрольной группе составила 100 %.
Количественное определение цитокинов в кондиционированных средах с применением иммуноферментного анализа
Кондиционированная среда была исследована на наличие проангиогенных факторов VEGF165, FGF-2 и IL-1b с применением коммерческих наборов для иммуноферментного анализа (VEGF-A и IL-1beta ELISA, Bender MedSystems, Vienna, Austria; FGF-2 ELISA, Chemicon International, Temecula, CA, USA). Анализ проводился в соответствии с инструкцией производителя. Результаты выражены в виде отношения цитокинов (в пикограммах) к кондиционированной среде (в миллилитрах) и представляют собой среднее значение ± величина стандартной ошибки из 30 различных проб кондиционированной среды (то есть собранных в разное время) для каждой линии раковых клеток.
Статистический анализ данных
Для определения уровней достоверности между различными методиками лечения мы рассчитывали парный и непарный критерий Стьюдента. Различия являлись статистически достоверными при p < 0,05.
Результаты
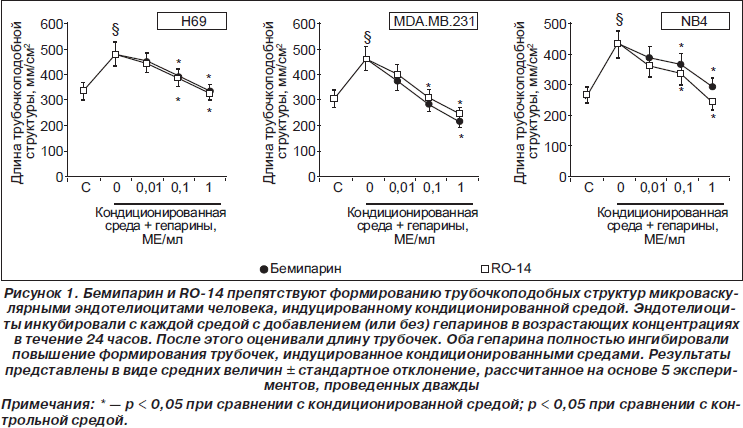
Бемипарин и RO-14 препятствуют формированию тубулярных структур эндотелиоцитами, индуцированному кондиционированными онкоклетками средами
Три различные кондиционированные среды индуцировали значительное повышение формирования трубочкоподобных структур эндотелиоцитами в растворе матригеля по сравнению с контрольной средой. Среда, кондиционированная клетками NB4, наиболее эффективно индуцировала неоангиогенез (повышение в среднем составило 61,2 ± ± 6,9 % по сравнению с контрольной средой при уровне значимости р < 0,01), на втором месте — среда, кондиционированная клетками MDA.MB.231 (повышение в среднем составило 50,6 ± 5,9 % по сравнению с контрольной средой при уровне значимости р < 0,01), наименее эффективной оказалась среда, кондиционированная клетками Н69 (повышение в среднем составило 43,5 ± 4,8 % по сравнению с контрольной средой при уровне значимости р < 0,01).
Формирование трубочкоподобных структур эндотелиоцитами под действием всех кондиционированных сред ингибировалось при введении бемипарина и RO-14. Причем этот эффект имел дозозависимый характер. Максимальная доза гепарина (1 МЕ/мл), как бемипарина, так и RO-14, полностью ингибировала формирование капилляров в средах, кондиционированных клетками Н69 или MDA.MB.231. Однако в среде, кондиционированной клетками NB4, при введении бемипарина происходило ингибирование на 86,5 ± 9,4 %, а при введении RO-14 — на 100 % (рис. 1). Статистически достоверных различий в действии бемипарина или RO-14 на кондиционированные среды с различной концентраций отмечено не было.
VGEF — наиболее распространенный проангиогенный фактор во всех кондиционированных средах
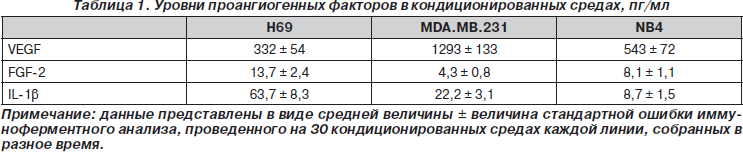
Уровень проангиогенных факторов в кондиционированных средах определяли при помощи иммуноферментного анализа, который показал, что VEGF — основной проангиогенный цитокин во всех трех кондиционированных средах, его наибольшее количество содержится в среде, кондиционированной клетками MDA.MB.231 (табл. 1). FGF-2 и IL-1b были обнаружены в меньшем количестве.
Так как VEGF содержится в наибольшем количестве, то мы решили исследовать роль этого цитокина в формировании тубулярных структур в кондиционированных средах. С этой целью мы провели преинкубацию всех типов кондиционированных сред с добавлением нейтрализующих VEGF антител и затем провели исследование с матригелем. В результате выяснилось, что после преинкубации кондиционированных сред с анти-VEGF-антителами формирование капилляроподобных трубочек в средах, кондиционированных клетками MDA.MB.231, NB4 и Н69, уменьшилось до 96,6 ± ± 10,4 %; 94,7 ± 8,7 % и 53,4 ± 6,1 % соответственно (для всех р < 0,05 по сравнению с контролем).
Бемипарин и RO-14 препятствуют формированию тубулярных структур эндотелиоцитами, индуцированному действием VEGF и FGF-2
Мы оценили способность бемипарина и RO-14 ингибировать очищенные проангиогенные цитокины. По результатам установлено, что и бемипарин, и RO-14 предотвращали формирование тубулярных структур, рост которых был индуцирован добавлением как VEGF (левая панель), так и FGF-2 (правая панель). В дозе 1 МЕ/мл и бемипарин, и RO-14 проявили значительное ингибирующее действие (р < 0,05) на процесс формирования тубулярных структур под действием VEGF: 78, 0 ± 8,5 % и 74,7 ± 6,6 % соответственно. Подобные результаты были получены при стимуляции неоангиогенеза фактором роста эндотелия FGF-2 — количество новообразованных сосудов уменьшилось до 86,8 ± ± 9,7 % под действием бемипарина и до 79,2 ± 8,8 % под действием RO-14 (р < 0,05 для обоих препаратов по сравнению с FGF-2). Статистически значимой разницы между действием бемипарина и RO-14 обнаружено не было.
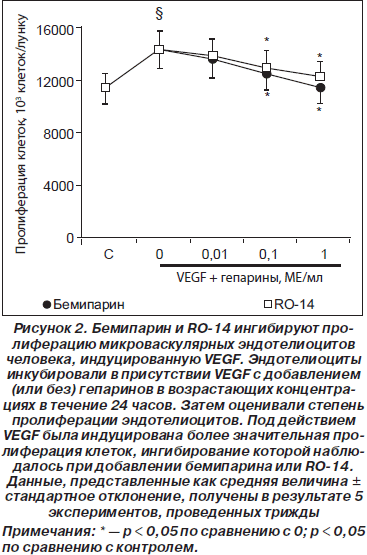
Бемипарин и RO-14 препятствуют пролиферации эндотелиоцитов, индуцированной фактором роста эндотелия VEGF
Инкубация микроваскулярных эндотелиоцитов человека со средой, кондиционированной клетками H69, MDA.MB.231 и NB4, в течение 24 часов значительно не повлияла на пролиферацию клеток (данные не представлены). В то же время их инкубация с добавлением стандартного VEGF индуцировала повышение уровня пролиферации эндотелиоцитов на 25,2 ± 4,2 % по сравнению с контрольной средой (p < 0,01). Ингибирующее действие бемипарина на VEGF-индуцированную пролиферацию эндотелиоцитов имеет дозозависимый характер и достигает 100% подавления в дозе 1 МЕ/мл (рис. 2). Действие RO-14 также носит дозозависимый характер, однако в меньшей степени, чем бемипарина: в дозе 1 МЕ/мл пролиферация эндотелиоцитов была подавлена до 72,8 ± 8,1 % (p < 0,05 по сравнению с VEGF) (рис. 2). Однако разница в эффектах между бемипарином и RO-14 не обладала достаточным уровнем статистической достоверности.
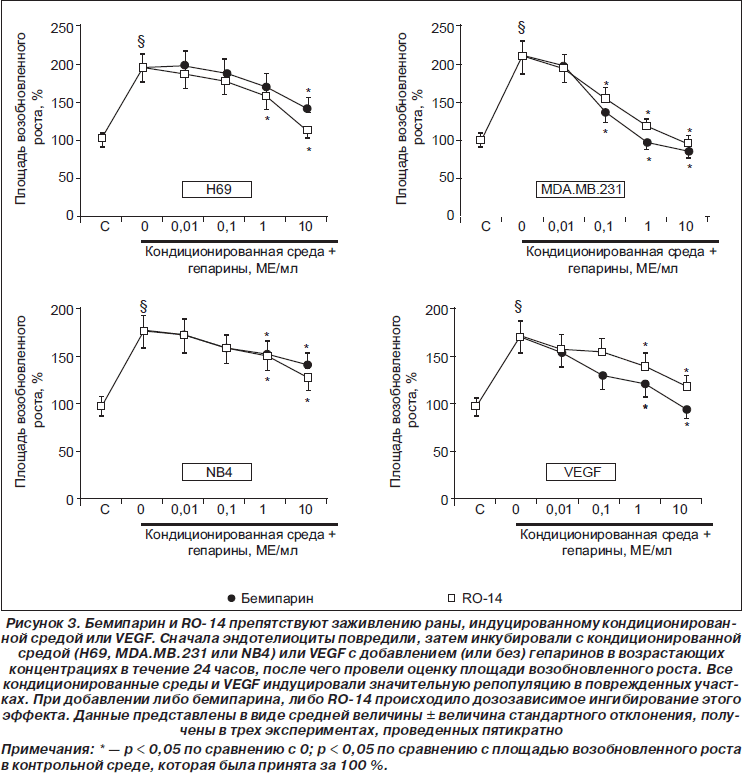
Бемипарин и RO-14 препятствуют заживлению раны, индуцированному кондиционированной средой или VEGF
Все кондиционированные среды (Н69, MDA.MB.231 и NB4) индуцировали значительное повышение пролиферации эндотелиоцитов в области раны. В частности, по сравнению с контрольной средой (принятой за 100 %) площадь возобновленного роста, индуцированного кондиционированной средой, составила 195 ± 10 % под действием среды, кондиционированной Н69, 210 ± 13 % — среды, кондиционированной MDA.MB.231, и 180 ± 8 % под действием среды, кондиционированной NB4 (p < 0,05 для всех сред по сравнению с контрольной) (рис. 4). При добавлении обоих низкомолекулярных гепаринов отмечалось достоверное дозозависимое ухудшение заживления раны, индуцированное кондиционированными средами (рис. 3). При концентрации 10 МЕ/мл бемипарин и RO-14 значительно ингибировали миграцию, индуцированную средой, кондиционированной клетками Н69 (то есть было отмечено снижение миграции до 55 ± 7 % под действием бемипарина и до 85 ± 8 % под действием RO-14). В то же время оба гепарина полностью, на 100 %, ингибировали миграцию, индуцированную средой, кондиционированной клетками MDA.MB.231 (рис.3). Стандартный фактор роста эндотелия VEGF повысил репопуляцию клеток до 76,3 ± 6,5 % по сравнению с контрольной средой (p < 0,05). Как бемипарин, так и RO-14 дозозависимо препятствовали миграции, индуцированной VEGF (рис. 3), достигая 100 % и 68,7 ± 7,4 % соответственно в дозе 10 МЕ/мл (p < 0,01). Статистически достоверной разницы между влиянием бемипарина и RO-14 в одинаковых концентрациях на кондиционированную среду или стандартный фактор роста эндотелия VEGF отмечено не было.
Обсуждение
Низкомолекулярные гепарины широко применяются для профилактики и лечения венозных тромбозов у онкологических пациентов. По результатам некоторых недавно проведенных метаанализов, низкомолекулярные гепарины также благоприятно влияют на выживаемость раковых пациентов [20, 21]. Эта информация побудила исследователей провести рандомизированные клинические исследования с целью оценить влияние низкомолекулярных гепаринов на уровень онкологической смертности. Некоторые из этих исследований уже завершены, результаты их опубликованы, в то время как другие — еще продолжаются [22].
Имеющиеся результаты в целом многообещающие, однако точные механизмы возможной противоопухолевой активности низкомолекулярных гепаринов неизвестны. Существует гипотеза, согласно которой данная группа препаратов влияет не только на коагуляционные процессы в организме пациента [4]. Предполагается, что один из таких возможных «побочных» эффектов — это влияние низкомолекулярных гепаринов на неоангиогенез, индуцированный опухолью, что было показано в ходе нескольких исследований invivo и invitro [8]. Однако в большинстве этих исследований изучался нефракционированный гепарин или низкомолекулярные гепарины первого поколения [8–10, 23]. Недавно стали доступными низкомолекулярные гепарины второго поколения, характеризующиеся более низкой молекулярной массой и более точно определенным составом полисахаридных цепей, что повышает эффективность и профиль безопасности этих препаратов.
В настоящем исследовании мы изучаем антиангиогенную активность гепаринов второго поколения (бемипарина и ультранизкомолекулярного гепарина RO-14) на модели неоангиогенеза, индуцированного опухолевыми клетками invitro.
Для получения проангиогенного фенотипа микроваскулярные эндотелиоциты человека инкубировали со средами, кондиционированными раковыми клетками от трех различных опухолей (лейкоз, рак молочной железы, мелкоклеточный рак легкого). Данный подход был выбран с учетом нашей предыдущей работы, в которой применялась экспериментальная модель взаимодействия опухолевых клеток с эндотелиоцитами [10]. В исследование были также включены факторы роста эндотелия сосудов VEGF и FGF-2. Включение очищенных проангиогенных факторов позволило нам изучить антиангиогенную активность обоих гепаринов в более стандартизованных условиях и сравнить ее с влиянием кондиционированных сред на процесс неоангиогенеза.
По результатам нашего исследования, все три типа кондиционированных сред обладают значительным влиянием на неоангиогенез в культуре микроваскулярных эндотелиоцитов человека (HMEC-1) за счет усиления формирования тубулярных структур, не влияя на их пролиферацию. Мощность индукции неоангиогенеза всех трех кондиционированных сред оказалась практически одинаковой и сравнимой с мощностью очищенных проангиогенных факторов VEGF и FGF-2. Добавление как бемипарина, так и RO-14 значительно ингибировало проангиогенный потенциал кондиционированных сред и факторов роста эндотелия: в частности, наблюдалось очень сильное ингибирование капиллярообразующей способности эндотелиоцитов (более чем на 90 % во всех кондиционированных средах) одновременно со значительным снижением их миграционной способности (более 60 % во всех кондиционированных средах). Настоящие результаты важны, так как по данным предыдущих исследований эффекты гепаринов, не связанные с их влиянием на гемокоагуляцию, различаются в зависимости от типа препарата [24]. В ходе нашего предыдущего исследования с использованием той же модели было отмечено, что низкомолекулярные гепарины первого поколения (эноксапарин и дальтепарин) по сравнению с нефрационированными гепаринами более эффективно ингибировали неоангиогенез, индуцированный очищенными проангиогенными факторами VEGF, FGF-2, TNF-a, в то же время все гепарины одинаково эффективно ингибировали неоангиогенез, индуцированный опухолевыми клетками.
По результатам настоящей работы видно, что оба гепарина второго поколения (бемипарин и RO-14) обладают сравнительно одинаковой активностью в ингибировании этапов неоангиогенеза, индуцированного как раковыми клетками, так и очищенными проангиогенными факторами; однако для достижения достоверных результатов требовались различные концентрации препаратов. В частности, для полного ингибирования формирования тубулярных структур под действием кондиционированных сред необходимая концентрация и бемипарина, и RO-14 составила 1 МЕ/мл. В то же время в тесте на «заживление раны» максимальный ингибирующий эффект гепаринов на индуцированную раковыми клетками миграцию эндотелиоцитов проявился при концентрации 10 МЕ/мл. При этом 100% ингибирование этого этапа неоангиогенеза было достигнуто только в среде, кондиционированной клетками линии MDA.MB.231. В исследовании пролиферации кондиционированные среды не оказали значительного влияния на пролиферацию эндотелиоцитов (что было также показано в ходе наших предыдущих исследований) [10]. В то же время очищенный VEGF индуцировал значительное усиление пролиферации клеток, а добавление 1 МЕ/мл бемипарина или RO-14 привело к ее ингибированию более чем на 70 %. Мы предположили, в согласии с другими исследователями, что антиангиогенный эффект гепаринов связан с их способностью влиять на связывание растворимых молекул проангиогенных факторов с высокоаффинными преобразующими сигнал рецепторами, экспрессированными на поверхности эндотелиальных клеток [8]. Также было показано, что ингибирование факторов роста эндотелиоцитов зависит от размера цепей в препарате гепарина [9]. Есть доказательства того, что очищенные октасахариды и декасахариды способны значительно ингибировать ангиогенез как invitro, так и invivo [8, 25, 26]. Бемипарин и RO-14 содержат большое количество олигосахаридов — от гексасахаридов до додекасахаридов.
В ходе данного исследования мы обнаружили, что все кондиционированные среды содержат проангиогенные факторы в различных пропорциях. В частности, в среде, кондиционированной клетками рака молочной железы, содержится больше VEGF, чем двух других факторов роста эндотелия, в то время как в среде, кондиционированной клетками мелкоклеточного рака легкого, содержится больше FGF-2 и IL-1b, чем в средах, кондиционированных клетками рака молочной железы и лейкоза. Для оценки роли VEGF в формировании тубулярных структур эндотелиоцитами в кондиционированных средах мы провели нейтрализацию VEGF в данных средах. Таким образом было выявлено, что наиболее значительное влияние фактора VEGF наблюдается в средах, кондиционированных клетками MDA.MB.231 и NB4, в отличие от среды Н69, где индукция неоангиогенеза, скорее всего, обусловлена действиями других цитокинов.
Мы предположили, что низкомолекулярные гепарины (бемипарин и RO-14) конкурируют с проангиогенными цитокинами за содержащиеся в кондиционированных средах участки связывания с соответствующими рецепторами и/или прямо связывают цитокины, инактивируя их.
Вероятно, в этот процесс вовлечены другие антиангиогенные механизмы [27]. Mousa et al. показали, что низкомолекулярный гепарин тинзапарин ингибирует формирование тубулярных структур макроваскулярными эндотелиоцитами, индуцированное влиянием FGF-2, посредством высвобождения ингибитора пути тканевого фактора (TFPI) — основного ингибитора тканевого фактора, который является наиболее важным активатором гемокоагуляции [23]. Так как известно, что бемипарин также индуцирует высвобождение TFPI из эндотелия, как было показано на линии клеток HUVEC [28] и EA.hy926 [29], а из микроваскулярных эндотелиоцитов человека TFPI также высвобождается под действием низкомолекулярных гепаринов первого поколения (дальтепарин и эноксапарин) [30], то мы не можем исключить вероятность ингибирования неоангиогенеза бемипарином и RO-14 посредством данного механизма.
Заключение
Настоящее исследование показывает, что низкомолекулярные гепарины второго поколения и новый ультранизкомолекулярный гепарин (так же, как и низкомолекулярные гепарины первого поколения и нефракционированные гепарины) проявляют антиангиогенную активность в условиях неоангиогенеза, индуцированного опухолевыми клетками. Эти данные свидетельствуют в пользу применения данной группы препаратов в составе адъювантной терапии в лечении онкологических заболеваний.
Перевод Ольги СУШИНСКИ
Оригинал статьи опубликован в Cancer Invest. — 2011 Feb. — 29(2). — 153-61
Список литературы находится в редакции