Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Вернуться к номеру
Раптова зупинка кровообігу при субарахноїдальній блокаді
Авторы: ХИТРИЙ Г.П., ЧЕРНИШОВ В.І Українська військово-медична академія, м. Київ МЕЛЬНИК В.М., БУГАЙ О.О., САМОЙЛЕНКО А.П. Головний військово-медичний клінічний центр «ГВКГ» МО України, м. Київ
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
У роботі наведено клінічний випадок раптової зупинки кровообігу при проведенні спинномозкової анестезії, виконано аналіз інформаційних джерел за тематикою, презентовано розроблені авторами алгоритми дій при рефлекторній брадикардії та зупинці кровообігу в умовах субарахноїдальної блокади та запропоновано авторську стратегію профілактики даного ускладнення.
Рефлекторна зупинка кровообігу, спинномозкова анестезія, ваготонія, преінфузія.
Частота зупинки кровообігу при субарахноїдальній блокаді, за даними різних джерел, становить від 1,5 до 15 на 10 000 блокад [3, 19]. Це частіше в 2–5 рази, ніж при некардіальних оперативних втручаннях у цілому (3 на 10 000), а також у 6–15 разів частіше, ніж при епідуральній блокаді (1 на 10 000) [20]. За 7 неповних років на клінічній базі УВМА ГВМКЦ МО України (2005–2011 роки) було зафіксовано 2 нелетальних випадки раптової зупинки кровообігу при проведенні спинномозкової анестезії (СА) (6 на 10 000). Наводимо один із цих випадків.
Клінічний випадок
Пацієнт П. чоловічої статі, 50 років, у минулому працював у середовищі з підвищеним радіоактивним фоном. В анамнезі: 2 оперативних втручання під СА, раптова втрата свідомості (синкопе) у післяопераційному періоді, знижений поріг нудоти та блювання, ASA II, АТ — 150/90 мм рт.ст., ЧСС — 74 уд/хв. Діагноз: консолідований перелом великогомілкової кістки. Операція: видалення металоконструкції. Премедикація: діазепам per os 10 мг на ніч, промедол 10 мг + димедрол 10 мг в/м за 30 хв до операції. Відзначався підвищений рівень ажитації у зв’язку із затримкою операційної черги. Преінфузія: 800 мл 0,9 % NaCl. Анестезія: інтратекально 13 мг гіпербаричного бупівакаїну в положенні на боці без технічних труднощів, ефективний блок на 7 хв із верхньою межею блоку на рівні пупка. Моніторинг: пульсоксиметрія, сфігмографія, неінвазивне вимірювання артеріального тиску.
Суть проблеми: на 15-й хв (у порядку виявлення): нудота, через 2–3 с втрата свідомості, відсутність пульсу на променевій артерії, при цьому монітор «не встигає» за клінікою і все ще демонструє нормальні значення АТ і навіть ЧСС. Далі: мідріаз (розцінено нами як ознака зупинки кровообігу), зупинка дихання, ціаноз, генералізовані судоми.
Наші дії: 1) ШВЛ маскою з FiO2 1,0; 2) в/в атропін 0,5 мг; 3) в/в мезатон болюсно 100 мкг; 4) струминна інфузія кристалоїду (розчин Хартмана). Розпочати компресії грудної клітки не встигли, бо завадили генералізовані судоми.
Подальший розвиток подій: через 45 с після зупинки кровообігу відновлення серцевої діяльності. Через 90 с — відновлення спонтанного дихання, свідомості, стабілізація АТ, нормальна ЕКГ. Операція продовжена. Пацієнт на 3-тю добу виписаний додому без ускладнень.
Дискусія
Враховуючи раптовий початок, «вагусну» ауру (нудота), швидкий регрес симптоматики у відповідь на терапію та відсутність системної дисфункції у подальшому, на наш погляд, найвірогіднішою причиною зупинки кровообігу стала рефлекторна реакція. У схожих випадках асистолії часто передує тяжка брадикардія (< 40 уд/хв), яка, імовірно, теж мала місце і в ситуації, що презентується, але не була зареєстрована через швидкоплинність процесу.
Механізм рефлекторної зупинки кровообігу при субарахноїдальній блокаді наведений на рис. 1 [13, 20]. Ключовими моментами цього патофізіологічного процесу є десимпатизація (внаслідок блокуючої дії місцевого анестетика на симпатичний стовбур) і зменшення венозного повернення до правого передсердя. Гіповолемія та неадекватна медикаментозна седація (недостатня або надмірна) є факторами, що посилюють рефлекторну реакцію при СА [13].
Наскільки несприятливим може бути прогноз після рефлекторної зупинки кровообігу під час СА?
Смертність при даному ускладненні може сягати 30 % [1]. У літературі, присвяченій цій проблемі, найчастіше згадується ретроспективний аналіз Caplan et al. [7], у якому автори проаналізували 14 випадків раптової зупинки серця при СА у здорових пацієнтів з невеликими за обсягами оперативними втручаннями, більше ніж 40 % з яких виявилися летальними, а решта призвели до тяжкого ушкодження головного мозку. Зазначається, що в цих випадках середній інтервал між останньою задовільною оцінкою вентиляції/циркуляції та першим проявом ускладнення становив менше 2 хв. Першим проявом, у порядку зниження частоти, були: брадикардія, артеріальна гіпотензія, ціаноз, втрата свідомості. Зупинка кровообігу проявлялася асистолією або брадикардією зі значним зниженням серцевого викиду. Основними причинами негативних наслідків автори вважають: а) надмірну седацію опіоїдами; б) високий симпатичний блок з наступною вазовагальною реакцією; в) пізнє призначення адреналіну (6 хв з моменту початку реанімації та 8 хв від першого прояву проблеми).
Публікація дослідження Caplan et al. спровокувала низку повідомлень, у яких автори наводили випадки брадикардії та короткочасної зупинки кровообігу при СА вже зі сприятливими наслідками [6, 11, 17]. У літературі зупинку серця при СА почали характеризувати як «неочікувану», «вкрай рідку» та ін. Проте через спорадичність менш гострою від того ця проблема не стає, оскільки до групи ризику потрапляють практично здорові молоді особи [21]. Крім того, розвиток тяжкої брадикардії/асистолії при СА можливий як відразу після введення анестетика, так і в післяопераційному періоді [11], отже постає нове запитання: як довго пацієнти після СА мають знаходитися під спостереженням?
Як раціонально має діяти анестезіологічна бригада, щоб упередити фатальні наслідки при раптовій брадикардії/асистолії під час СА?
Ключовими моментами [2, 7, 11, 16] є такі: 1) адекватний моніторинг; 2) швидка корекція брадикардії атропіном; 3) корекція гіпотензії вазопресором; 4) у випадку зупинки кровообігу — раннє застосування адреналіну; 5) додаткове волемічне навантаження.
Украй важливим видається раннє застосування адреналіну. Так, в одному з досліджень [2] повідомляється, що в тих випадках зупинки кровообігу при СА, де адреналін не застосовувався, летальність сягала 25 %. У нашому випадку застосування фенілефрину (мезатону), а не адреналіну, було скоріше «рефлекторним», і його не слід вважати оптимальним, хоча комбінація «атропін + мезатон» у результаті виявилася ефективною.
Додаткове волемічне навантаження, зважаючи на патогенез ускладнення (рис. 1), видається цілком логічним. Зокрема, Caplan [7], коментуючи вже згадуваний нами аналіз летальних випадків та ускладнень, зазначає, що «негайне посилення центрального венозного наповнення могло б зменшити ступінь пошкодження», а дані кількох досліджень продемонстрували, що некоригована гіповолемія в умовах нейроаксіальної блокади може викликати не тільки класичні вагусні симптоми, але й зупинку серця у здорових індивідів [5].
Алгоритми дій при рефлекторній брадикардії та зупинці кровообігу при СА
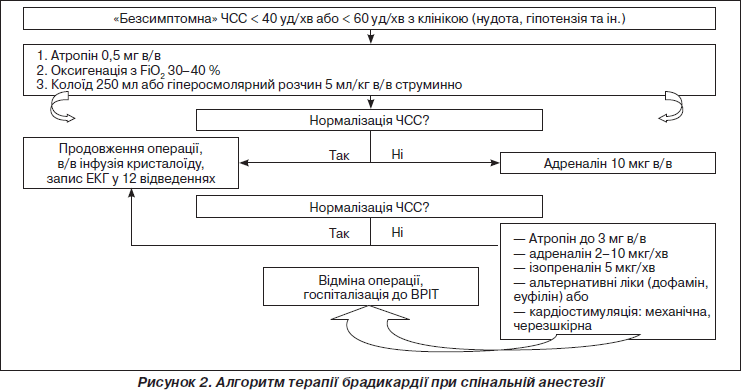
Враховуючи власний та міжнародний досвід, ми розробили алгоритми дій при рефлекторній брадикардії та зупинці кровообігу під час проведення СА у дорослих (рис. 2 та 3). Запропонований алгоритм дій при брадикардії (рис. 2) є специфікацією універсального алгоритму, опублікованого в ERS Guidelines 2010 [23], та його адаптацією до умов операційної. Ми акцентуємо увагу на ранньому застосуванні адреналіну, додатковому волемічному навантаженні і, крім того, на відміну від алгоритму ERS ми не розглядаємо глікопіролат як альтернативу атропіну, оскільки є повідомлення щодо його неефективності у випадку рефлекторної природи брадикардії [8].
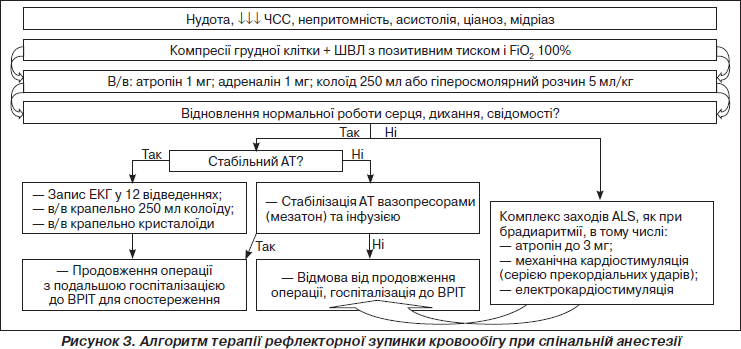
Особливостями запропонованого нами алгоритму терапії рефлекторної зупинки кровообігу при СА (рис. 3) на відміну від стандартної схеми заходів серцево-легеневої реанімації є агресивна ваголітична терапія на старті, раннє застосування адреналіну (< 3 хв) та, як і в попередньому алгоритмі, додаткове волемічне навантаження. Наш досвід свідчить, що відновлення кровообігу може бути досягнуте тільки за рахунок медикаментозних заходів, але це не означає, що слід затримуватися з початком компресій грудної клітки і вентиляційною підтримкою, які треба розпочинати за першої ж можливості.
Авторам також відомі випадки відновлення спонтанного кровообігу при рефлекторній зупинці серця під час проведення СА після виконання однократного прекордіального поштовху. Відсутність повідомлень у літературі про ефективність цього методу не дозволяє нам пропагувати його рутинне використання в подібній ситуації, що, однак, не виключає можливість застосування серії прекордіальних поштовхів для механічної стимуляції.
Опрацьовуючи клінічний матеріал, ми поставили собі запитання: яким чином передбачити та за можливості уникнути розвитку тяжких рефлекторних реакцій при проведенні нейроаксіальних блокад, зокрема СА? На наш погляд, стратегія профілактики полягає: 1) у виявленні пацієнтів групи ризику; 2) стратифікації ризику; 3) модифікації анестезіологічної тактики залежно від ступеня ризику.
Виявлення пацієнтів групи ризику
Орієнтовно 7 % людей у світі є ваготоніками [22] і саме ця частина популяції становить «кістяк» групи ризику розвитку тяжких рефлекторних реакцій під час СА [20]. Можливими шляхами ідентифікації таких пацієнтів є: 1) з’ясування наявності факторів ризику; 2) застосування провокаційних тестів. Тести на ваготонію, на зразок різкого опускання головного кінця стола (tilt-table testing), інфузії орципреналіну та інші, демонструють низьку чутливість та відтворюваність в одних і тих самих тестованих [4], через що виявлення факторів ризику є чи не єдиним шляхом вирішення проблеми.
Слід зазначити, що підвищений ризик виникнення тяжких вагусних реакцій при СА (зокрема, брадикардії) асоціюється з підвищеним ризиком зупинки кровообігу [11, 16, 17]. Фактори ризику ми умовно розділили на анамнестичні (виявлені під час опитування) та клінічні (встановлені під час передопераційного огляду та інструментального обстеження). В інформаційних джерелах згадуються такі анамнестичні фактори ризику вагусних реакцій під час СА [9, 20]: 1) епізоди синкопе, особливо на медичні маніпуляції (акупунктура, венепункція) — syncope history; 2) регулярний прийом b-адреноблокаторів; 3) вік < 50 років; 4) чоловіча стать; 5) регулярні спортивні тренування. Ми вважаємо, що до цього списку слід додати: а) знижений поріг нудоти та блювання як один із маркерів ваготонії; б) хронічне радіоактивне опромінення як фактор, що часто призводить до вегетативного дисбалансу. Клінічними факторами ризику є [9, 10, 15]: 1) ЧСС < 60 уд/хв у спокої; 2) ризик анестезії ASA І; 3) атріовентрикулярна блокада І ступеня (інтервал P-Q > 0,2 с); 4) змінена варіативність серцевого ритму (HRV) зі зростанням значень високочастотної спектральної компоненти. Метод доопераційної оцінки HRV у даний час є експериментальним, але в плані прогнозування тяжкої брадикардії при СА демонструє відносно високу специфічність та чутливість (65 та 74 % відповідно) [10]. Виражена еозинофілія (23 % еозинофілів) як маркер безсимптомної ендокардіальної патології також може бути фактором ризику зупинки кровообігу при СА [12].
Стратифікація ризику та модифікація анестезіологічної тактики
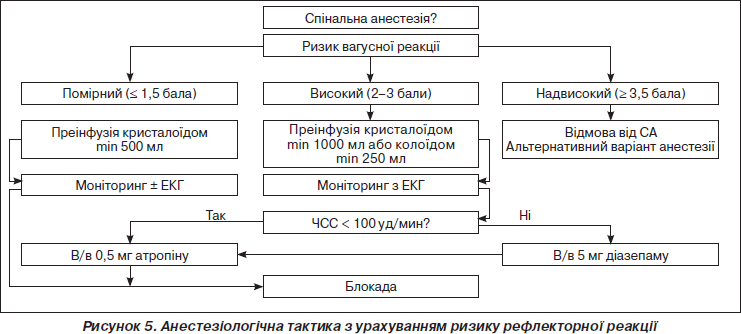
На рис. 4 наведена розроблена нами система стратифікації ризику тяжких рефлекторних реакцій при СА шляхом сумації бальної цінності наявних у пацієнта факторів ризику. Рекомендована анестезіологічна тактика з урахуванням ступеня ризику, наведена на рис. 5. Пацієнт з описаного нами клінічного випадку мав надвисокий ризик розвитку тяжкої рефлекторної реакції (4 бали) при СА, отже, оптимальним варіантом було б відмовитися від проведення СА на користь загального знеболювання.

«Інтраопераційні» фактори ризику
Надмірна ажитація перед процедурою, а також рівень блоку вище за Т5 [14] можуть посилити ризик виникнення рефлекторної зупинки кровообігу безпосередньо в операційній. Логічно припустити, що незаміщена крововтрата (> 10 мл/кг) при СА теж посилює цей ризик, зокрема при епідуральній блокаді такі випадки були описані [5].
Профілактичне волемічне навантаження (преінфузія)
«Якщо для знеболювання пацієнта обрано СА, підтримка адекватного переднавантаження є ключовим моментом для зниження ризику брадикардії та зупинки кровообігу», — цим висловлюванням J.B. Pollard [20], опираючись на фізіологічні дослідження [18] та повідомлення про клінічні випадки [11], акцентує увагу на важливості об’ємного навантаження та негайного заміщення втраченого об’єму. Важливою складовою інфузійної програми у пацієнта із СА є преінфузія. Досі не існує єдиної думки стосовно оптимального інфузійного середовища для преінфузії, але відмова від профілактичного рідинного навантаження, або його об’єм менше 300 мл, збільшують інцидентність брадикардії та раптової зупинки кровообігу [11]. Повідомляється також, що преінфузія в об’ємі < 500 мл асоціюється з більшою частотою гіпотензії при СА [14], що теоретично може посилити рефлекторну реакцію та спровокувати зупинку кровообігу.
Висновки
1. Рефлекторна зупинка кровообігу відносно часте та потенційно небезпечне ускладнення спинномозкової анестезії.
2. Терапія рефлекторної брадикардії та зупинки кровообігу при СА вже на старті має включати агресивну ваголітичну терапію, раннє застосування адреналіну та інтенсивну волемічну корекцію.
3. Запропонована профілактична стратегія теоретично може зменшити частоту тяжких рефлекторних реакцій при СА.
1. Auroy Y. Major complications of regional anesthesia in France: the SOS regional anesthesia hotline service / Y. Auroy, D. Benhamou et al. // Anesthesiology. — 2002. — Vol. 97. — P. 1274-80.
2. Auroy Y. Serious complications related to regional anesthesia / Y. Auroy, P. Narchi, A. Messiah et al. // Anesthesiology. — 1997. — Vol. 87. — P. 479-86.
3. Barreiro G. Unexpected cardiac arrest in spinal anaesthesia / G. Barreiro et al. // Acta Anaesth. Belg. — 2006. — Vol. 57. — P. 365-370.
4. Benditt D.G. A synopsis: neurocardiogenic syncope, an international symposium / D.G. Benditt, M. Erickson et al. // Pacing. Clin. Electrophysiol. — 1997. — Vol. 20. — P. 851-60.
5. Bonica J.J. Circylatory effects of peridural block: effects of acute blood loss / J.J. Bonica, W.F. Kennedy et al. // Anesthesiology. — 1972. — Vol. 36. — P. 219-27.
6. Brown D.L. Cardiac arrest during spinal anesthesia / D.L. Brown, R.L. Carpenter, D.C. Moore et al. // Anesthesiology. — 1988. — Vol. 68. — P. 971-2.
7. Caplan R.A. Unexpected cardiac arrest during spinal anesthesia: a closed claims analysis of predisposing factors / R.A. Caplan, R.J. Ward, K. Posner, F.W. Cheney // Anesthesiology. — 1988. — Vol. 68. — P. 5-11.
8. Carpenter R.L. Glycopyrrolate does not prevent bradycardia during spinal anesthesia / R.L. Carpenter, D.C. Mackey // Anesthesia & Analgesia. — 1990. — Vol. 70. — S51.
9. Carpenter R.L. Incidence and risk factors for side effects of spinal anesthesia / R.L. Carpenter, R.A. Caplan et al. // Anesthesiology. — 1992. — Vol. 76. — P. 906-16.
10. Chatzimichali A. Heart rate variable may identify patients who will develop severe bradycardia during spinal anaesthesia / A. Chatzimichali, A. Zoumprouli et al. // Acta Anaesthesiol Scand. — 2011. — Vol. 55(2). — P. 234-41.
11. Geffin B. Sinus bradycardia and asystole during spinal and epidural anesthesia: a report of 13 cases / B. Geffin, L. Shapiro // J. Clin. Anesth. — 1998. — Vol. 10. — P. 278-85.
12. Kamath Sh. Cardiac arrest following spinal anaesthesia / Sh. Kamath, M. Ambareesha et al. // Indian J. Anaesth. — 2006. — Vol. 50(6). — P. 279-80.
13. Kinsella S.M. Perioperative bradycardia and asystole: relationship to vasovagal syncope and the Bezold-Jarisch reflex / S.M. Kinsella, J.P. Tuckey // BJA. — 2001. — Vol. 86 (6). — P. 859-68.
14. Kyokonq O. The incidence and risk factors of hypotension and bradycardia associated with spinal anesthesia / O. Kyokonq, S. Charuluxananan et al. // J. Med. Assoc. Thai. — 2006. — Vol. 89. — Suppl. 3. — S58-64.
15. Liu S. Prolonged PR interval is a risk factor for bradycardia during spinal anesthesia / S. Liu, G.E. Paul et al. // Req. Anesth. — 1995. — Vol. 20(1). — P. 41-4.
16. Lovstad R.Z. Bradycardia and asystolic arrest during spinal anaesthesia: a report of five cases / R.Z. Lovstad, G. Granhus, S. Hetland // ACTA Anaesthesiol Scand. — 2000. — Vol. 44. — P. 48-52.
17. Mackey D.C. Bradycardia and asystole during spinal anesthesia: a report of three cases without morbidity / D.C. Mackey, R.L. Carpenter, G.E. Thompson, D.L. Brown, M.N. Bodily // Anesthesiology. — 1989. — Vol. 70. — P. 866-8.
18. Murray R. Hemodynamic effects of graded hypovolemia and vasodepressor syncope induced by lower body negative pressure / R.H. Murray, L.J. Thompson et al. // Am. Heart J. — 1968. — Vol. 76. — P. 799-809.
19. Picard J. Complications of regional anaesthesia / J. Picard, T. Meek // Anaesthesia. — 2010. — Vol. 65 (Suppl. 1). — P. 105-15.
20. Pollard J.B. Cardiac arrest during spinal anesthesia: common mechanisms and strategies for prevention / J.B. Pollard // Anesthesia & Analgesia. — 2001. — Vol. 92. — P. 252-6.
21. Sandove M.S. Neurological complications of spinal anesthesia / M.S. Sandove, M.J. Levin, I. Rant-Sejdinaj // Can. Anaes. Soc. — 1961. — Vol. 8. — P. 405-16.
22. Sapire D. Vagotonia in infants, children, adolescents and young adults / D. Sapire, A. Casta // Int. J. Cardiol. — 1985. — № 9. — P. 211-22.
23. Summary of the main changes in the Resuscitation Guidelines: ERS Guidelines 2010. — Edegem: European Resuscitation Council Secretariat vzw, 2010. — 23 p.