Журнал «» 6(20) 2011
Вернуться к номеру
Клиническая эффективность торасемида пролонгированного высвобождения не уступает таковой обычной формы торасемида при лечении легких и умеренных форм артериальной гипертензии
Авторы: Roca-Cusachs A., Aracil-Vilar J., Calvo-Gоmez C., Vaquer-Pеrez J.V., Laporta-Crespo F., Rojas-Serrano M.J., Guglietta A., Gropper S. от имени группы исследователей «Пролонгированная форма торасемида при артериальной гипертензии»
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Настоящее рандомизированное двойное слепое исследование было спланировано таким образом, чтобы оценить, будет ли эффективность нового торасемида пролонгированного высвобождения (торасемид-ПВ) эквивалентна таковой торасемида немедленного высвобождения (торасемид-НВ). В ходе исследования пациенты с вновь диагностированными легкими и умеренными формами артериальной гипертензии или не отвечавшие на ранее назначенную антигипертензивную монотерапию либо плохо переносившие ее получали 5 мг/день торасемида-ПВ (n = 219) или торасемида-НВ (n = 223) в течение 12 недель (если назначенное лечение не давало эффекта к 4-й или 8-й неделе терапии, дозу увеличивали до 10 мг/день). В результате обнаружили, что среднее снижение диастолического артериального давления (ДАД) в группе с торасемидом-ПВ (11,6 ± 7,1 мм рт.ст., 95% доверительный интервал (ДИ) 10,6–12,5) было эквивалентным таковому в группе с торасемидом-НВ (11,3 ± 7,5 мм рт.ст., 95% ДИ 10,2–12,3), поскольку разница средних изменений ДАД между группами была меньше установленного дельта-значения (минимальная клинически значимая разница, или предел эквивалентности) на уровне 2 мм рт.ст. В группе с торасемидом-ПВ у достоверно большего количества пациентов наблюдалось достижение адекватного контроля артериального давления спустя 8 и 12 недель терапии. При амбулаторном 24-часовом мониторировании артериального давления в подгруппе из 100 пациентов было выявлено большее снижение дневных значений систолического артериального давления в группе с торасемидом-ПВ по сравнению с торасемидом-НВ (128,4 ± 9,9 мм рт.ст. против 133,5 ± 10,4 мм рт.ст., p < 0,05). Безопасность и переносимость обоих препаратов была одинаковой.
Диуретик, гипертензия, торасемид, торасемид пролонгированной формы высвобождения.
Основная цель лечения артериальной гипертензии сводится к достаточному снижению артериального давления (АД), причем известные точны цифры, к которым нужно стремиться (McVeigh и соавт., 1995). Однако, несмотря на наличие четких руководств, обоснованных с позиции доказательной медицины (Chobanian и соавт., 2003; Mancia, 2007; Whitworth, 2003), ни для кого не секрет, что гипертензия все еще остается неадекватно контролируемым заболеванием — лишь у небольшого количества пациентов удается достичь целевых уровней АД (Turbull, 2005). Более 15 лет пероральные формы диуретиков были наиболее популярными препаратами, «шагом № 1» при инициировании лечения артериальной гипертензии. Для диуретиков характерны многие атрибуты идеального препарата первого выбора: они недорого стоят, их дозу легко подобрать, они эффективны у большинства пациентов с легкими и умеренными формами артериальной гипертензии, хорошо переносятся и повышают эффективность других антигипертензивных средств (Gifford, 1984).
И хотя до сегодняшнего дня назначали в основном тиазидные диуретики, дальнейшее их использование было поставлено под сомнение вследствие обнаружения предположительной связи с развитием ряда нежелательных побочных эффектов (Fukuda и Kimura, 2006). Торасемид является высокоэффективным петлевым диуретиком и обладает серьезным преимуществом перед более старыми соединениями — он эффективен в лечении эссенциальной гипертензии при приеме один раз в день (Dunn и соавт., 1995; Friedel и Buckley, 1991). Высокоэффективные (петлевые) диуретики реализуют свое действие путем ингибирования реабсорбции натрия в толстой части восходящего колена петли Генле, приводя таким образом к выделению большого количества мочи. Торасемид обладает мощным диуретическим и натрийуретическим действием и приводит к меньшей потере калия по сравнению с эквивалентными дозами других петлевых диуретиков наподобие фуросемида, что может быть объяснено возможным ингибирующим действием торасемида на активность альдостерона (Dunn et al., 1995). Доза торасемида 5 мг 1 раз в день является достаточной для проведения антигипертензивной терапии. Эта низкая доза торасемида приводит к развитию антигипертензивного эффекта, сравнимого с таковым при назначении явных натрийуретических доз тиазидов (например, гидрохлортиазида 25 мг) (Baumgart, 1993). В отличие от тиазидов торасемид в дозах, рекомендуемых для лечения артериальной гипертензии, не вызывает выраженной потери калия с мочой (Luft, 1993). Длительная антигипертензивная терапия торасемидом не сопровождалась развитием нежелательных метаболических побочных эффектов, таких как гипомагниемия, нарушение обмена глюкозы и липидов, гиперурикемия (Baumgart, 1993). Недавно была разработана новая форма торасемида пролонгированного высвобождения (торасемид-ПВ). В двух фармакокинетических исследованиях, в ходе которых сравнивали торасемид-ПВ и обычную форму торасемида немедленного высвобождения (торасемид-НВ) (Gropper и соавт., 2006a, 2006b), было показано, что обе лекарственные формы обладают сходной системной биодоступностью, о чем свидетельствует площадь под кривой «концентрация — время» (AUC), в рамках 90% доверительного (ДИ) интервала биоэквивалентности (90% ДИ 0,80–1,25) (хотя торасемид-ПВ имеет пропорционально большую AUC по сравнению с торасемидом-НВ). Максимальная концентрация в плазме крови (Cmax) была достоверно ниже у торасемида-ПВ по сравнению с торасемидом-НВ, и время достижения Cmax (tmax) было достоверно большим у торасемида-ПВ по сравнению с торасемидом-НВ.
В соответствии с рекомендациями Европейского медицинского агентства (ЕМА) касательно лекарственных форм с модифицированным высвобождением (Европейское агентство по оценке медицинских продуктов, 1999) было предпринято настоящее рандомизированное исследование, призванное ответить на вопрос, будет ли эффективность торасемида пролонгированного высвобождения (торасемид-ПВ) эквивалентна таковой торасемида немедленного высвобождения (торасемид-НВ) при лечении легких и умеренных форм артериальной гипертензии. Одновременно оценивалась безопасность и переносимость торасемида-ПВ.
Пациенты и методы исследования
Дизайн исследования
Настоящее рандомизированное двойное слепое, с двумя группами, параллельно-групповое многоцентровое исследование было спланировано таким образом, чтобы показать, что антигипертензивная эффективность торасемида-ПВ не уступает таковой торасемида-НВ у пациентов с легкими и умеренными формами артериальной гипертензии. Длительность исследования составила 3 месяца. Пациентов включали в исследование с апреля 2005 г. по февраль 2006 г. на территории двух стран Европы (Испания и Россия); в общей сложности в исследовании принял участие 41 клинический центр.
Протокол исследования был одобрен комиссией по биоэтике каждого из участвующих клинических центров. Само исследование было выполнено в соответствии с принципами Хельсинкской декларации (с учетом внесенных в нее поправок). Все пациенты до включения в исследование дали письменное информированное согласие на участие в нем.
Критерии включения/не включения пациентов в исследование
В исследование включали пациентов мужского и женского пола, любой расы, в возрасте 18–75 лет, с вновь диагностированной легкой или умеренной артериальной гипертензией, определяемой как систолическое артериальное давление (САД) 140–179 мм рт.ст. и диастолическое артериальное давление (ДАД) 90–109 мм рт.ст. (в соответствии с Рекомендациями Европейского общества по артериальной гипертензии и Европейского кардиологического общества 2003 г.), либо пациентов, уже получающих монотерапию по поводу артериальной гипертензии, если лечение не дало ожидаемого эффекта или плохо переносилось. Пациентов не включали в исследование, если в анамнезе были указания на отсутствие эффекта при назначении диуретика в виде монотерапии, либо при необходимости использования комбинированной терапии для достижения эффективного контроля над артериальным давлением; при наличии вторичной гипертензии или тяжелой гипертензии; если больной перенес инфаркт миокарда или инсульт в течение предшествующих 6 месяцев; при наличии нестабильной стенокардии, сердечной недостаточности, выраженной аритмии или нарушения проводимости; сахарного диабета 1-го или 2-го типа; выраженной почечной или печеночной дисфункции; ожирения (индекс массы тела (ИМТ) ≥ 40 кг/м2); при сопутствующем использовании аспирина, нестероидных противовоспалительных средств, антиаритмических средств Ia, Ib и II классов, лития, этакриновой кислоты или аминогликозидных антибиотиков; при наличии сведений о гиперчувствительности к исследуемому препарату или непереносимости лактозы, равно как и обнаружении врачом любого другого противопоказания к назначению торасемид. В исследование также не включали беременных женщин, кормящих матерей и женщин детородного возраста, не использующих адекватные методы контрацепции.
Схема терапии и регистрируемые показатели
Пациентов включали в исследование последовательно (т.е. по мере обращения к врачу). Перед включением в подготовительный период исследования от них требовали резко или постепенно прекратить прием тех антигипертензивных средств, которые они получали ранее. Подготовительный период длился 2 недели — в это время все пациенты получали плацебо. Затем те из них, которые полностью соответствовали критериям включения в исследование, были распределены к приему одного из двух тестируемых препаратов. При этом использовалась схема рандомизации, сгенерированная компьютером. Пациентов рандомизировали (1 : 1) к приему торасемида-ПВ или торасемида-НВ в дозе 5 мг. Препараты принимали утром натощак до приема любой пищи или питья. Тестируемые препараты давали пациентам во время каждого визита в таком количестве, чтобы их хватило до следующего визита.
Регистрацию САД и ДАД у пациентов осуществляли с помощью монитора артериального давления OMRON M7 в положении сидя после 5 мин отдыха. Пациентов инструктировали, чтобы в день визита к врачу они не принимали тестируемые препараты. Пациентов также просили не принимать алкоголь, кофе/чай, не курить и не выполнять физические нагрузки по крайней мере за 30 мин до измерения артериального давления. В дополнение к этому в специально выделенной подгруппе пациентов выполнили амбулаторное 24-часовое мониторирование артериального давления (АМАД) в конце подготовительного периода (до приема первой дозы тестируемого препарата) и в последний день лечения. С этой целью использовали ранее апробированное неинвазивное автоматическое устройство Spacelabs 90217 (Spacelabs Inc., г. Редмонд, штат Вашингтон, США), настроенное на проведение регистрации с интервалом 20 мин. Измерение проводили на недоминантной руке. При этом пациентов просили заниматься своей обычной повседневной деятельностью и ложиться спать в обычное время. Дневными показаниями считали те, которые были зарегистрированы с 10:00 до 22:00, ночными — с 24:00 до 06:00. Среди измеренных переменных были средние значения САД, ДАД, среднего артериального давления (СрАД), частоты сердечных сокращений (ЧСС) и пульсового давления за 24 ч, дневной и ночной интервалы времени. Помимо этого перед проведением АМАД оценивали снижение САД и ДАД спустя 4 ч после приема тестируемых препаратов по сравнению с его первоначальным (как мы помним, пациенты приходили на прием, не принимая таблеток) уровнем. Данные АМАД с более чем 20 % неправильных записей, а также случаи, когда в течение 1 ч не была зарегистрирована по крайней мере одна валидная запись, исключали из анализа.
Регистрацию у пациентов необходимых показателей (см. ниже) выполняли до подготовительного периода, в исходных условиях (визит 1), на 4-й (визит 2), 8-й (визит 3) и 12-й неделе (визит 4) после начала лечения торасемидом. Во время визита 2 или визита 3 доза торасемида пролонгированного высвобождения или обычной формы могла быть повышена до 10 мг, если ДАД снижалось менее чем на 10 % по сравнению с исходным уровнем. Пациенты, у которых снижение ДАД составляло по крайней мере 10 % по сравнению с исходным уровнем или у которых значение ДАД было < 90 мм рт.ст., получали ту же дозу торасемида (5 или 10 мг) в течение всего времени исследования. Пациенты, у которых не удалось добиться адекватного контроля артериального давления к визиту 3, т.е. спустя 4 недели лечения торасемидом в дозе 5 мг и 4 недели лечения торасемидом в дозе 10 мг, выбывали из исследования. Однако этих пациентов включали в анализ эффективности.
Во время каждого визита измеряли артериальное давление и ЧСС, регистрировали прием сопутствующей терапии, контролировали комплайенс к проводимому лечению, опрашивали пациентов о наличии симптомов со стороны мочевыводящих путей (см. ниже) и побочных эффектов. Об отсутствии комплайенса судили в том случае, если пациент принимал менее 75 % назначенного курса лечения. Все регистрируемые побочные эффекты оценивались врачами как связанные или не связанные с тестируемыми препаратами. Пациентов расспрашивали о времени начала, длительности и интенсивности побочных эффектов. Интенсивность определяли исходя из субъективной оценки пациентов и классифицировали как легкую, среднюю и тяжелую. По окончании подготовительного периода и в конце периода лечения пациентов подвергали полному медицинскому обследованию, включавшему в том числе запись электрокардиограммы (ЭКГ) в 12 отведениях и всестороннее лабораторное обследование.
Оценка эффективности и безопасности лечения
Первичной конечной точкой исследования, отражающей эффективность проводимой терапии, было снижение ДАД, достигаемое к концу периода лечения, по сравнению с его исходным уровнем. Вторичными конечными точками исследования, отражающими эффективность проводимой терапии, были снижение САД, достигаемое к концу периода лечения, по сравнению с его исходным уровнем и процент пациентов, у которых удалось достичь адекватного контроля артериального давления к концу периода исследования (САД < 140 мм рт.ст. и/или ДАД < 90 мм рт.ст.). В подгруппе пациентов с АМАД антигипертензивную эффективность тестируемых препаратов оценивали по разнице в среднем 24-часовом САД и ДАД, среднем дневном и ночном САД и ДАД и циркадианной вариабельности в конце периода лечения по сравнению с исходным уровнем. О переносимости и безопасности лечения судили по частоте и тяжести побочных эффектов, регистрируемых в ходе исследования, а также по изменениям жизненно важных показателей, лабораторных показателей, ЭКГ в 12 отведениях, наличию симптомов со стороны мочевыводящих путей (включая экстренные позывы к мочеиспусканию (частота и тяжесть), никтурию (частота)) и проценту пациентов с такими симптомами. Также оценивали комплайенс к лечению.
Статистический анализ
В статистический анализ были включены: 1) популяция пациентов, придерживавшихся протокола исследования (ПП), — все рандомизированные пациенты, которые полностью завершили исследование; 2) популяция пациентов, придерживавшихся протокола исследования, у которых отсутствующие значения для конечных точек исследования во время визита 4 подставляли с помощью «метода переноса вперед данных последнего из имеющихся наблюдений» (LOCF) (ПП-LOCF); 3) все пациенты, включенные в исследование (ВП), независимо от того, принимали они тестируемый препарат или нет; 4) все пациенты, включенные в исследование, у которых отсутствующие значения для конечных точек исследования во время визита 4 подставляли с помощью метода LOCF (ВП- LOCF); 5) все пациенты, которым выполняли АМАД в конце подготовительного периода и в последний день лечения; 6) все рандомизированные пациенты, которые получили по крайней мере одну дозу тестируемого препарата — эта популяция была выделена для анализа безопасности проводимой терапии.
В анализ эффективности проводимой терапии включали всех рандомизированных пациентов, которые не нарушали протокол исследования, получали лечение в течение 3 месяцев, делали запланированные визиты в клинические центры в течение 3 месяцев и у которых комплайенс к лечению был ≥ 75 %. Пациентов, которые выбывали из исследования спустя 2 месяца терапии вследствие неэффективности препаратов в дозе 10 мг, также включали в анализ эффективности. Первичный анализ эффективности был выполнен в популяции ПП-LOCF.
Расчет размера групп производили исходя из характера настоящего исследования, цель которого состояла в том, чтобы проверить, действительно ли торасемид-ПВ не уступает по эффективности торасемиду-НВ. Принимая обобщенное стандартное отклонение (СО) на уровне 7 мм рт.ст. и 97,5% доверительный интервал для одностороннего критерия с дельта-значением (минимальная клинически значимая разница, или предел эквивалентности) для ДАД между двумя группами на уровне 2 мм рт.ст., было рассчитано, что в каждую группу должно быть включено по 194 пациента (всего 388) при мощности сравнения 80 %.
Средние изменения артериального давления от исходного уровня к концу лечения сравнивали с помощью ковариационного анализа (ANCOVA), при этом начальное значение использовали в качестве ковариаты. Дисперсионный анализ (ANOVA) повторных измерений использовали для того, чтобы оценить различия в средних значениях показателей АМАД между двумя группами терапии. Категориальные переменные сравнивали с помощью критерия хи-квадрат (c2) или точного критерия Фишера; непрерывные переменные сравнивали с помощью U-критерия Манна — Уитни. Все гипотезы были протестированы с вероятностью ошибки 1-го рода на уровне 0,05. Для того чтобы обеспечить качество и сопоставимость данных, применяли метод двойного ввода данных (когда одни и те же данные вводятся в базу данных двумя различными операторами с последующей проверкой на расхождения; это позволяет существенно уменьшить число ошибок. — Прим. перев.) с последующей их валидизацией. Для проведения статистического анализа использовали программу SAS 8.2 (SAS Institute, Inc., Кэри, Северная Каролина, США).
Результаты
Пациенты
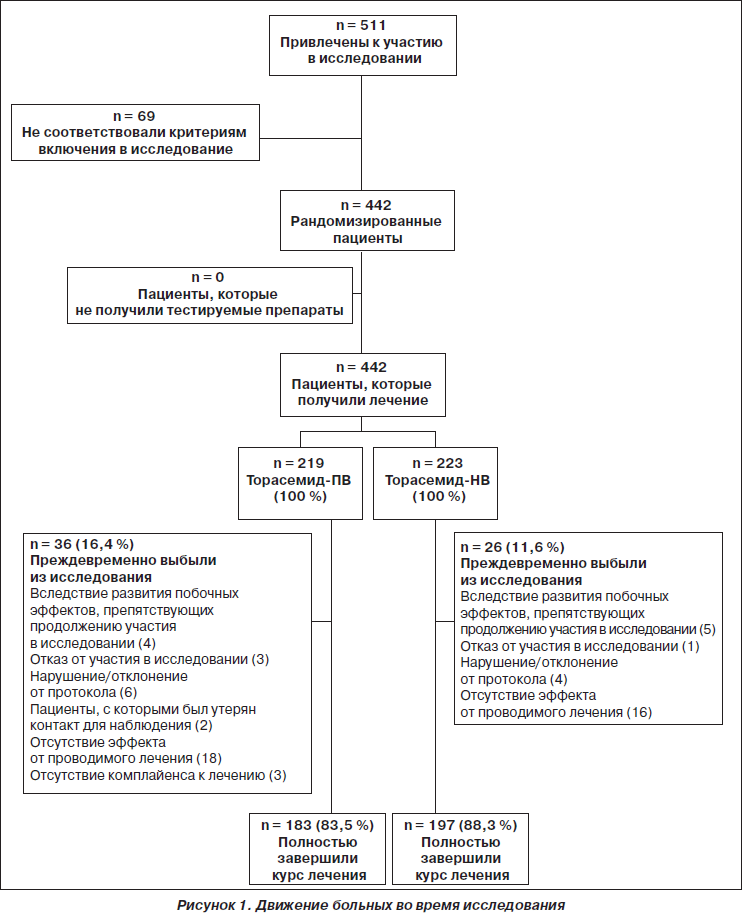
Из 511 пациентов, которые были привлечены 41 исследователем, 442 соответствовали критериям включения в исследование и были рандомизированы к лечению торасемидом-ПВ (n = 219) или торасемидом-НВ (n = 223). Движение пациентов в ходе исследования представлено на рис. 1. Популяция ВП-LOCF включала 201 пациента из группы с торасемидом-ПВ и 213 пациентов — с торасемидом-НВ, популяция ПП — 183 пациента из группы с торасемидом-ПВ и 197 пациентов — с торасемидом-НВ. Из 130 пациентов, которым было выполнено АМАД, 65 принимало торасемид-ПВ и 65 — торасемид-НВ; из них 14 пациентов, принимавших торасемид-ПВ, и 16 пациентов, принимавших торасемид-НВ, были исключены из анализа вследствие наличия неверных записей в конце подготовительного периода и/или в последний день лечения.
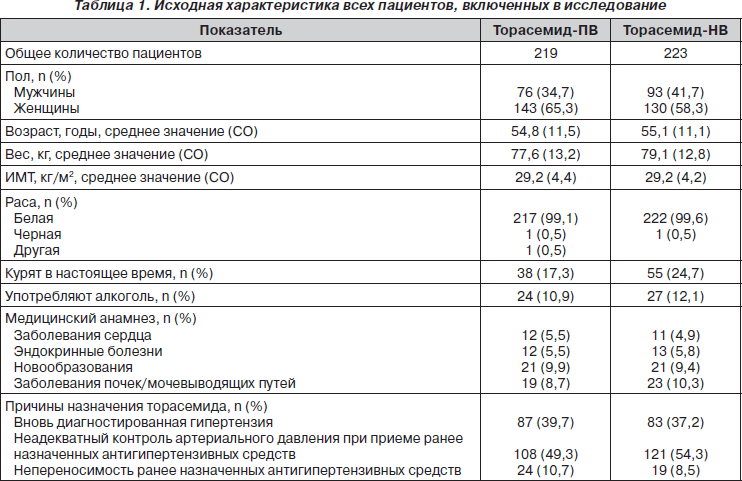
Среди пациентов, включенных в исследование, было 169 мужчин и 273 женщины, средний (± СО) возраст которых составил 54,9 ± 11,3 года, средний вес — 78,4 ± 13,1 кг, средний ИМТ — 29,2 ± 4,3 кг/м2. Девяносто девять процентов пациентов принадлежало к белой расе. Лечение торасемидом было назначено:
— вследствие неадекватного контроля артериального давления при приеме ранее назначенных антигипертензивных средств — 52 % пациентов;
— вследствие плохой переносимости ранее назначенных антигипертензивных средств — 9,7 % пациентов;
— в связи с вновь диагностированной артериальной гипертензией — 39 % пациентов. Исходная характеристика пациентов, распределенных в группу с торасемидом-ПВ и торасемидом-НВ, была одинаковой, что представлено в табл. 1.
Эффективность
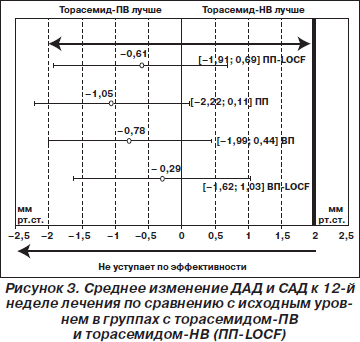
Спустя 12 недель лечения у пациентов, распределенных к лечению торасемидом-ПВ, наблюдалось среднее снижение ДАД на 11,6 ± 7,1 мм рт.ст. (95% ДИ 10,6–12,5) по сравнению с 11,3 ± 7,5 мм рт.ст. (95% ДИ 10,2–12,3) у тех пациентов, которые были распределены к приему торасемида-НВ (ANCOVA, p = 0,435) (рис. 2). В группе пациентов, получавших торасемид-ПВ, ДАД снижалось со среднего значения 97,1 ± 4,5 мм рт.ст. (95% ДИ 96,4–97,7) во время визита 1 до 85,5 ± 7,1 мм рт.ст. (95% ДИ 84,5–86,4) во время визита 4, что было аналогичным снижению ДАД со среднего значения 97,5 ± 4,8 мм рт.ст. (95% ДИ 96,9 ± 98,2) во время визита 1 до 86,3 ± 6,8 мм рт.ст. (95% ДИ 85,4–87,2) во время визита 4 в группе с торасемидом-НВ (ANCOVA, p = 0,354). Антигипертензивная эффективность обоих препаратов была одинаковой, поскольку разница средних изменений ДАД между группами с торасемидом-ПВ и торасемидом-НВ была меньше установленного дельта-значения (минимальная клинически значимая разница, или предел эквивалентности) на уровне 2 мм рт.ст. Эти результаты, полученные для популяции ПП-LOCF, были подтверждены также в анализе чувствительности, выполненном для популяций ПП, ВП и ВП-LOCF (рис. 3).
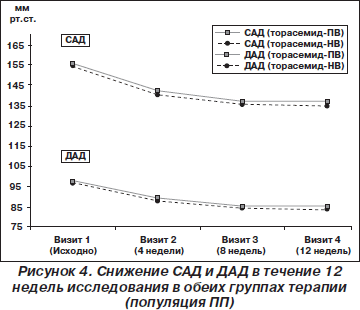
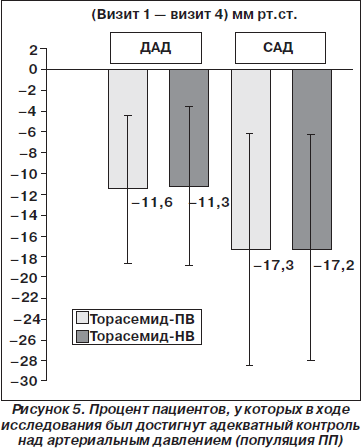
Изменения САД спустя 12 недель терапии также были одинаковы в двух исследуемых группах: среднее снижение в группе с торасемидом-ПВ составило 17,3 ± 11,2 мм рт.ст. (95% ДИ 15,7–18,2) по сравнению с 17,2 ± 10,8 мм рт.ст. (95% ДИ 15,7–18,6) в группе с торасемидом-НВ (ANCOVA, p = 0,713) (рис. 3). В группе с торасемидом-ПВ САД снижалось со среднего значения 154,5 ± 9,8 мм рт.ст. (95% ДИ 153,1–155,8) во время визита 1 до 137,2 ± 11,5 мм рт.ст. (95% ДИ 135,6–138,8) во время визита 4, что было аналогично снижению САД со среднего значения 155,2 ± 9,7 мм рт.ст. (95% ДИ 163,9–156,5) во время визита 1 до 138,1 ± 9,9 мм рт.ст. (95% ДИ 136,7–139,4) во время визита 4 в группе с торасемидом-НВ (ANCOVA, p = 0,579). И хотя при лечении торасемидом-ПВ и торасемидом-НВ не было достоверных различий в снижении ДАД и САД спустя 12 недель терапии, в обеих группах пациентов наблюдалось статистически достоверное снижение ДАД и САД к концу исследования по сравнению с исходным уровнем (рис. 4).
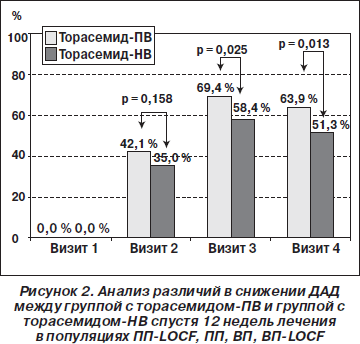
Процент пациентов с адекватным контролем артериального давления (САД < 140 мм рт.ст. и/или ДАД < 90 мм рт.ст.) был достоверно выше среди пациентов, получавших торасемид-ПВ, по сравнению с пациентами, получавшими торасемид-НВ, спустя 8 недель (69,4 % против 58,4 %, точный критерий Фишера, р = 0,025) и 12 недель (63,9 % против 51,3 %, точный критерий Фишера, р = 0,031) терапии (рис. 5). В популяции ПП относительная величина эффекта была на 25 % выше у пациентов с адекватным контролем артериального давления, получавших торасемид-ПВ (63,9 % [117/183]), по сравнению с теми, которые получали торасемид-НВ (51,3 % [101/197]) (относительный риск 1,25; 95% ДИ 1,0476–1,4845).
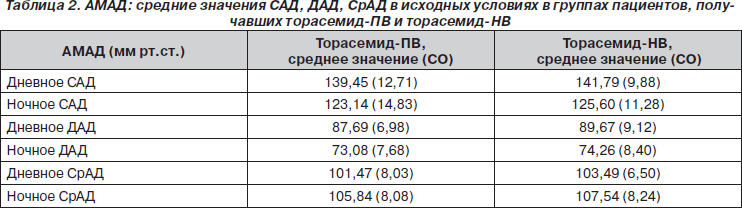
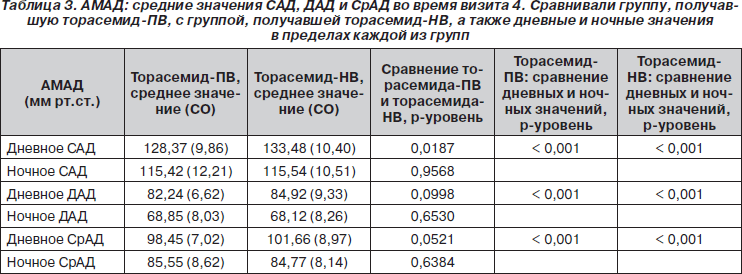
Исходные значения, полученные в подгруппе из 100 пациентов, у которых были валидные записи АМАД (торасемид-ПВ — n = 51; торасемид-НВ — n = 49), представлены в табл. 2. Спустя 12 недель лечения не было обнаружено статистически достоверных различий между группами с торасемидом-ПВ и торасемидом-НВ ни в средних суточных значениях САД (125,2 ± 10,1 мм рт.ст. и 128,9 ± 8,9 мм рт.ст. соответственно) (ANOVA, p = 0,051), ни в средних суточных значениях ДАД (78,1 ± 6,6 и 80,5 ± 7,6 мм рт.ст. соответственно) (ANOVA, p = 0,1). В обеих исследуемых группах ночные значения САД, ДАД и СрАД были достоверно ниже, чем дневные (p < 0,001). Дневные значения САД были достоверно ниже в группе с торасемидом-НВ (128,4 ± 9,9 мм рт.ст.) по сравнению с торасемидом-БВ (133,5 ± 10,4 мм рт.ст.) (ANOVA, p = 0,01) (табл. 3).
Симптомы со стороны мочевыводящих путей
Пациентов с экстренными позывами к мочеиспусканию в конце исследования в группе с торасемидом-ПВ и торасемидом-НВ было 47,0 и 51,2 соответственно. В группе с торасемидом-ПВ у 37,7 % пациентов наблюдалось более пяти эпизодов экстренных позывов к мочеиспусканию по сравнению с 43 % пациентов в группе с торасемидом-НВ. В общей сложности у 24,1 % пациентов в группе с торасемидом-ПВ наблюдалось более двух эпизодов экстренных позывов к мочеиспусканию по сравнению с 39,3 % пациентов в группе с торасемидом-НВ.
Безопасность и переносимость
Восемьдесят пять процентов пациентов, получавших торасемид-ПВ, и 88 % пациентов, получавших торасемид-НВ, полностью закончили 12-недельный период исследования. Доза препаратов была повышена с 5 до 10 мг у 49,5 % пациентов в группе с торасемидом-ПВ и у 55,3 % пациентов в группе с торасемидом-НВ.
Побочные эффекты были документированы у 29,7 % (65/219) пациентов, получавших торасемид-ПВ, при этом общее количество побочных эффектов составило 120, и у 29,1 % (65/223) пациентов, получавших торасемид-НВ, с общим количеством побочных эффектов, равным 114. В более чем 95 % случаев побочные эффекты имели легкую или умеренную интенсивность. Наиболее частыми побочными эффектами были головная боль, сердцебиение, головокружение, утомляемость и носовое кровотечение. Каких-либо серьезных побочных эффектов, связанных с приемом препаратов, обнаружено не было. Частота прерывания терапии в связи с развитием побочных эффектов составила 1,8 % (4/219) в группе пациентов, получавших торасемид-ПВ, и 2,2 % (5/223) в группе пациентов, получавших торасемид-НВ. Жизненно важные показатели, данные объективного обследования и ЭКГ значимо не менялись в ходе исследования. У всех пациентов лабораторные гематологические показатели (включая концентрацию ионов, глюкозы и профиль липидов) находились в пределах нормы или имели небольшие отклонения, которые, по мнению исследователей, не были клинически значимыми. В ходе исследования не были обнаружены новые случаи развития сахарного диабета, а также случаи клинически значимого повышения фракций холестерина или снижения содержания калия.
Обсуждение
Цель настоящего исследования сводилась к тому, чтобы сравнить эффективность торасемида пролонгированного высвобождения (торасемид-ПВ) и стандартной формы торасемида немедленного высвобождения (торасемид-НВ) при легких и умеренных формах эссенциальной гипертензии. Для этого был применен параллельно-групповой дизайн исследования с такой мощностью и уровнем значимости, чтобы продемонстрировать, что торасемид-ПВ не уступает по эффективности торасемиду-НВ при заданном дельта-значении (минимальная клинически значимая разница, или предел эквивалентности) для ДАД на уровне 2 мм рт.ст. в положении сидя. Выбранная длительность исследования (12 недель) была достаточной, чтобы оценить эффективность и безопасность антигипертензивной монотерапии торасемидом-ПВ. Оба вида проводимого лечения приводили к достоверному и сопоставимому снижению САД и ДАД, подтверждая внешнюю валидность исследования. Доверительные интервалы для разницы между группами терапии не достигали дельта-значения (2 мм рт.ст.), что указывает на то, что эффективность торасемида-ПВ не уступает таковой торасемида-НВ.
Группы лечения, сформированные с помощью случайного распределения пациентов, были гомогенны в отношении демографической характеристики и исходного морбидного статуса. Пациентов с вновь диагностированной гипертензией было больше в группе с торасемидом-ПВ по сравнению с группой с торасемидом-НВ (39,7 и 37,2 % соответственно), в то время как доля пациентов, ранее получавших лечение по поводу артериальной гипертензии, была несколько выше в группе с торасемидом-НВ по сравнению с группой с торасемидом-ПВ (54,3 и 49,3 % соответственно). Назначение плацебо во время подготовительного периода позволило исключить из рандомизации пациентов, которые отвечали на терапию плацебо.
К концу 12-недельного периода терапии было обнаружено значимое и достоверное снижение САД и ДАД у пациентов, получавших как торасемид-ПВ, так и торасемид-НВ. И хотя это снижение было одинаковым в обеих группах, процент пациентов с адекватным контролем артериального давления спустя 8 и 12 недель лечения был достоверно выше в группе, получавшей торасемид-ПВ. Какие-либо другие статистически достоверные различия параметров эффективности между группами не наблюдались, за исключением достоверно более низких дневных значений САД в группе с торасемидом-ПВ по сравнению с группой с торасемидом-НВ среди тех пациентов, которым выполняли АМАД. Оба вида лечения хорошо переносились. Профиль переносимости, касающийся симптомов со стороны мочевыводящих путей, согласовывался с тем профилем, который был ожидаем от этих лекарственных средств.
Приблизительно половине пациентов требовалось увеличивать дозу тестируемых препаратов для улучшения контроля артериального давления (49,5 % для торасемида пролонгированного высвобождения и 55,3 % — немедленного высвобождения). Многим пациентам с артериальной гипертензией потребуется назначение более чем одного препарата для достижения адекватного контроля артериального давления. Руководства по артериальной гипертензии в качестве второго шага при фармакотерапии данного заболевания рекомендуют увеличивать дозу назначенного препарата или назначать дополнительные антигипертензивные средства. Диуретики являются эффективными, хорошо переносимыми, с легко подбираемой дозой, относительно недорогими лекарственными средствами (Krakoff, 2005; Salvetti и Ghiadoni, 2006). Результаты, полученные в нашем исследовании, снова подтверждают тот факт, что торасемид является препаратом первого выбора при лечении легких и умеренных форм артериальной гипертензии и что возможность увеличения дозы диуретика является хорошим терапевтическим подходом до назначения других антигипертензивных средств.
Полученные нами данные свидетельствуют о том, что торасемид-ПВ и торасемид-НВ оказывают хорошее антигипертензивное действие при легких и умеренных формах артериальной гипертензии. Одновременно было показано, что при назначении торасемида-ПВ у большего количества пациентов удается достичь адекватного контроля артериального давления, измеренного обычным способом, а также лучшего контроля САД по данным АМАД. Хорошо известно, что АМАД обладает большей ценностью для прогнозирования сердечно-сосудистого риска и возможных повреждений органов-мишеней (Clement и соавт., 2003; Staessen и соавт., 2001).
Таким образом, в ходе исследования было показано, что антигипертензивная эффективность торасемида-ПВ, принимаемого один раз в день в дозе до 10 мг в течение 12 недель, не уступает таковой при приеме торасемида-НВ у пациентов с легкими и умеренными формами артериальной гипертензии. У большего количества пациентов, принимавших торасемид пролонгированного высвобождения, был достигнут адекватный контроль артериального давления спустя 8 и 12 недель лечения, а также получены лучшие результаты по данным 24-часового АМАД. Обе лекарственные формы — торасемид-ПВ и торасемид-НВ — хорошо переносились и имели одинаковый профиль безопасности.
Перевод А.В. САВУСТЬЯНЕНКО
Оригинал статьи опубликован в Cardiovascular Therapeutics, 2008, 26, 91-100
Список литературы находится в редакции