Журнал «Внутренняя медицина» 4(4) 2007
Вернуться к номеру
Нарушения иммунитета при критических состояниях: особенности диагностики. Продолжение. Начало в № 2, 2007
Авторы: В.И. Черний, член-корреспондент АМН Украины, д.м.н., профессор; А.Н. Нестеренко, к.м.н. Кафедра анестезиологии, интенсивной терапии и медицины неотложных состояний факультета последипломного образования Донецкого государственного медицинского университета им. М. Горького
Рубрики: Медицина неотложных состояний, Иммунология
Разделы: Справочник специалиста
Версия для печати
Тесты, характеризующие лимфоцитарный комплекс
Абсолютное и относительное содержание Т-лимфоцитов (СD3). Главную роль в иммунных реакциях играют Т-лимфоциты, которые посредством клеточных рецепторов распознают антигены. Поэтому их называют антигенреактивными, или иммунокомпетентными клетками. Снижение этого показателя может свидетельствовать о нарушении в клеточном звене иммунитета. Однако многообразие функций, которые выполняют Т-лимфоциты в рамках реализации иммунного ответа, связано с существованием различных их субпопуляций.
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): абсолютное количество T-лимфоцитов (CD3) — 1,42 ± 0,13 х 109/л, референтные величины — 0,59–2,88 х 109/л; относительное количество T-лимфоцитов (CD3) — 73,10 ± 1,46 %, референтные величины — 56–83 %.
Диагностическое значение. Повышение относительного числа СD3 отмечается при резко поляризованном Th1-типе иммунного ответа на вирусный антиген. Снижение относительного числа СD3 бывает как при иммунодефицитном состоянии, так и при резком увеличении доли В-лимфоцитов при Th2-типе ответа. Увеличение абсолютного числа СD3 может быть связано с лимфоцитозом при нормальном относительном числе СD3, с увеличением относительного числа СD3 при резко поляризованном Th1-ответе. Снижение абсолютного числа СD3 может быть вызвано лимфопенией, а также Т-клеточным дефицитом (Н.М. Калинина, 2002).
Абсолютное и относительное содержание Т-хелперов (СD4). Т-хелперы привлекают популяцию В-лимфоцитов к процессу выработки антител. Т-хелперы составляют примерно 55–60 % от числа циркулирующих Т-лимфоцитов. Недостаточность хелперной функции Т-лимфоцитов приводит к «неотвечаемости» организма на антигенную стимуляцию, что способствует развитию тяжелых инфекционных осложнений, развитию злокачественных новообразований.
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): абсолютное количество Т-хелперов (CD4) — 0,65 ± 0,07 х 109/л, референтные величины — 0,312–1,349 х 109/л; относительное количество T-хелперов (CD4) — 33,4 ± 0,60 %, референтные величины — 23–42 %.
Диагностическое значение. При критическом состоянии снижение содержания CD4 значительно меньше контрольных значений является неблагоприятным прогностическим признаком.
Увеличение относительного числа CD4 может отмечаться при Th2-типе иммунного ответа, причем в этом случае повышение соотношения CD4/CD8 связано только с увеличением CD4 при неизменном относительном количестве CD8. Такие нарушения отмечаются также при обострении аллергических заболеваний, при аутоиммунном варианте ответа, сопровождающемся преимущественным образованием аутоантител.
Снижение относительного числа CD4 может быть одним из проявлений Т-клеточного иммунодефицита, в том числе и при ВИЧ-инфекции.
Абсолютное и относительное содержание Т-супрессоров (СD8). Т-киллеры / супрессоры — это тормозящие регуляторные клетки. Они составляют приблизительно 20–30 % циркулирующих лимфоцитов. Специфические Т-супрессоры подавляют иммунный ответ на определенный антиген, а неспецифические Т-супрессоры подавляют иммунный ответ вне зависимости от антигена, регулируя клеточную пролиферацию.
От функционального состояния Т-супрессоров и их содержания в периферической крови зависят развитие аутоиммунных, иммунодефицитных, аллергических, бластоматозных процессов, выраженность реакций трансплантационного иммунитета.
При дефиците Т-супрессоров эффекторные клетки иммунной системы получают неограниченную возможность реагирования против собственных клеток и тканей; если количественные и функциональные показатели Т-супрессоров выше Т-хелперов, создаются реальные условия для развития иммунодефицитного состояния.
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): абсолютное количество Т-супрессоров (CD8) — 0,43 ± 0,05 х 109/л, референтные величины — 0,21–0,85 х 109/л; относительное количество T-супрессоров (CD8) — 21,57 ± 0,72 %, референтные величины — 16–32 %.
Диагностическое значение. Повышение относительного числа CD8 может происходить при инфекции, в момент, когда идет увеличение специфических цитотоксических клеток. Аналогичные изменения отмечены при онкологических заболеваниях, в поствакцинальном периоде, при аллотрансплантации. Повышение абсолютного числа CD8 может быть связано с лимфоцитозом, увеличением абсолютного числа Т-клеток, может происходить в ходе иммунного ответа на инфекционный, вакцинальный, опухолевый, аллогенный трансплантационный антигены, при прерывании беременности.
Снижение относительного числа CD8 может наблюдаться при аутоиммунных и аллергических заболеваниях. При этом коэффициент CD4/CD8 становится выше нормы. В связи с миграцией при инфекционной и опухолевой патологии CD8-лимфоцитов в патологический очаг в периферической крови отмечается снижение как относительного, так и абсолютного числа Т-киллеров.
Иммунорегуляторный индекс: соотношение Т-хелперов и Т-супрессоров (СD4/СD8). Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): 1,59 ± 0,08 (безразмерная величина), референтные величины — 0,75–2,39 (безразмерная величина).
Диагностическое значение. Для нормального иммунного ответа на 2–3 клетки Т-хелперов должна приходиться 1 клетка Т-супрессоров. При оценке конкретной иммунограммы могут встретиться следующие варианты:
1. Сдвиг соотношения влево — ниже 1,5. Такой иммунорегуляторный индекс характерен для иммунодефицитных состояний, онкологических заболеваний, СПИДа. Так, патогномоничным лабораторным симптомом СПИДа является практически полное или прогрессирующее до полного отсутствия Т-хелперов снижение иммунорегуляторного индекса до 0,5–0,4–0,3 и менее. Снижение иммунорегуляторного индекса может произойти:
— за счет снижения количества Т-хелперов и повышения количества Т-супрессоров;
— за счет только снижения количества Т-хелперов;
— за счет только повышения количества Т-супрессоров.
2. Сдвиг соотношения вправо — выше 3,5. Такой иммунорегулирующий индекс характерен для аутоиммунных и аллергических состояний.
Повышение индекса СD4/СD8 может произойти:
— за счет повышения количества Т-хелперов и снижения количества Т-супрессоров;
— за счет только повышения количества Т-хелперов;
— за счет только снижения количества Т-супрессоров.
3. Соотношение субпопуляций может оставаться в пределах нормальных значений, но при этом абсолютное количество клеток снижено.
Такая ситуация характерна для интоксикаций, эндокринопатий, стрессовых ситуаций.
4. Соотношение иммунорегуляторных субпопуляций остается нормальным, но абсолютное количество клеток повышено. Это характерно для начала острых вирусных инфекций.
Оценка способности лимфоцитов (мононуклеаров) к активации
В 1997 г. сотрудники отдела и кафедры иммунологии Российского государственного медицинского университета (Москва) А.Н. Чередеев и Л.В. Ковальчук предложили новый, патогенетический подход к оценке иммунной системы человека.
Помимо традиционных, известных как тесты I уровня (определение количества основных субпопуляций лимфоцитов в периферической крови, концентрации иммуноглобулинов основных классов в сыворотке и функциональной активности фагоцитов) в основу патогенетического принципа положены рекомендации по оценке наиболее важных свойств жизнеобеспечения иммунокомпетентных клеток с ориентацией на основные этапы их функционирования. Для упорядочения основных процессов предложено оценивать способность клеток иммунной системы к активации, пролиферации, дифференциации (эффекторная функция) и регуляции.
Для оценки способности клеток иммунной системы (мононуклеаров) к активации проводится фенотипирование маркеров активации CD25, CD95, HLA и других.
В зависимости от ряда внешних и внутренних факторов при активации иммунокомпетентных клеток могут иметь место по крайней мере два исключающих друг друга исхода. В связи с этим А.Н. Чередеев и Л.В. Ковальчук (1997) выдвинули концепцию позитивных и негативных последствий активации.
После активации иммунокомпетентные клетки проходят типичный путь своего развития — начинают пролиферировать и после этого дифференцируются в зрелые клетки, обеспечивающие эффекторные функции иммунной системы (позитивный процесс).
На конечном этапе активации Т-клеток реализуются эффекторные функции: секреция цитокинов, цитотоксичность и др. Но прежде клеточные элементы проходят этап пролиферации, необходимый для накопления пула соответствующих клеток.
Фазы позитивной активации с последующей пролиферацией и дифференцировкой В-лимфоцитов имеют свои некоторые особенности и могут быть оценены по таким параметрам, как повышение экспрессии CD23 и молекул HLA класса II.
Содержание CD25-мононуклеаров (лимфоцитов), несущих на своей поверхности рецепторы к интерлейкину-2 (ИЛ-2-Р). CD25-рецепторы к ИЛ-2 образуются (экспрессируются) преимущественно на активированных Т-хелперах. Увеличение числа клеток с достаточной для выявления моноклональными антителами плотностью CD25-рецептора возникает при пролиферации Т-клеток под воздействием Т-клеточного ростового фактора ИЛ-2. Вместе с тем CD25-рецептор — общий для всех ростовых Т-клеточных факторов (ИЛ-4, ИЛ-7, ИЛ-9) и его отсутствие ведет к первичному Т-клеточному иммунодефициту.
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): относительное содержание — 13,90 ± 0,52 %; абсолютное содержание — 0,271 ± 0,027 х 109/л.
Диагностическое значение. Увеличение числа Т-клеток с ИЛ-2-рецептором может быть связано с активацией иммунной системы во время ответа на антиген. Увеличение содержания CD25 — ИЛ-2-Р-позитивных клеток до 15 % свидетельствует об активации Т-хелперов. Снижение этого показателя ниже 4 % отражает уменьшение хелперной активности тимоцитов. При ВИЧ-инфекции число клеток, экспрессирующих CD25, резко снижается. Таким образом, значение определения числа Т-клеток с ИЛ-2-рецептором весьма актуально.
Тот же самый стимул, направленный на ту же популяцию клеток, но осуществленный в несколько отличающихся условиях воздействия внешних и внутренних факторов микроокружения клеток, дефицита факторов, обеспечивающих пролиферацию, может привести к противоположному эффекту — запрограммированной гибели (апоптозу) активируемой клетки (негативному процессу). Эти процессы, по всей вероятности, наиболее существенны для Т-лимфоцитов. Именно поэтому при оценке состояния иммунокомпетентных клеток следует определять тип активации — позитивный или негативный.
При негативном типе активации зрелых Т-клеток решающую роль играет взаимодействие пары «рецептор — лиганд»: Fas / FasL. Активированные Т-клетки экспрессируют как Fas, так и его лиганд (FasL) и становятся чувствительными к клеточной гибели, являющейся следствием связывания Fas-рецептором Fas-лиганда.
В качестве одного из апоптотических маркеров, позволяющих судить о степени негативной активации иммунокомпетентных клеток, используют CD95-маркер — Fas (CD95, APO-1)-рецептор, экспрессируемый мембранами активируемых мононуклеаров.
Абсолютное и относительное содержание мононуклеаров, экспрессирующих CD95-рецептор индукции апоптоза. CD95 (Fas, APO-1) относится к семейству рецепторов фактора некроза опухоли / фактору роста нервов. Fas проводит апоптотический сигнал внутрь клетки, антитела к Fas работают как антагонисты Fas-белков.
CD95 может быть рецептором для пока неизвестного цитокина. Процесс апоптоза реализуется после соединения Fas-антигена с его лигандом, экспрессию которого можно выявить на клеточной поверхности.
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): абсолютное количество CD95-клеток — 0,0492 ± 0,0113 х 109/л, референтные величины — 0,75–2,39 х 109/л; относительное количество CD95-клеток — 2,57 ± 0,46 %, референтные величины — 1–7 %.
Диагностическое значение. По данным Н.М. Калининой (2002), увеличение числа клеток с СD95-рецепторами, воспринимающими сигнал к индукции апоптоза, может как отражать активацию иммунной системы (СD95 — маркер «поздней» активации наряду с HLA-DR), так и быть маркером готовности к апоптозу, который происходит при взаимодействии СD95 / СD95L. СD95-рецептор представлен преимущественно на Т-клетках, в частности, на Т-хелперах. На Т-киллерах представлен в большей мере СD95L. Увеличение маркера апоптоза характерно для острой вирусной инфекции, для некоторых стадий ВИЧ-инфекции и вирусного гепатита.
Уменьшение количества лимфоцитов с СD95-рецепторами, которые опосредуют апоптоз, может привести к накоплению пула аутоагрессивных лимфоцитов, что может содействовать развитию аутоиммунных реакций. Уменьшение числа клеток с СD95-маркером характерно как для аутоиммунных, так и для злокачественных опухолевых заболеваний. Это снижение является одной из причин сохранения и накопления аутореактивных и трансформированных опухолевых клеток в организме пациента.
О.В. Тихомировой с соавт. (2003) для оценки соотношения позитивной и негативной активации лимфоцитов (Л.В. Ковальчук и А.Н. Чередеев, 1998) введен коэффициент СD25 / СD95.
Тесты, характеризующие гуморальный иммунитет
К гуморальным факторам иммунитета, которые имеют лимфоцитарное происхождение, относят иммуноглобулины (антитела) и систему цитокинов, посредством которых лимфоциты работают как между собой, так и в межклеточных взаимодействиях (изложено выше). К гуморальным факторам иммунитета относят также систему белков комплемента сыворотки крови, которую лимфоциты и их продукты привлекают для своих деструктивных (цитотоксических, протеолитических) функций в ходе реализации эффекторных стадий иммунного ответа [7].
Иммуноглобулины (Ig) — белки плазмы — выполняют функцию антител: осуществляют высокоспециализированную иммунологическую (специфическую гуморальную) защиту организма. Они синтезируются плазматическими клетками — клетками конечного этапа дифференцировки В-лимфоцитов под влиянием антигенного стимула и хелперного сигнала. При электрофорезе Ig мигрируют как γ-глобулины, образуя диффузную полосу в γ-области электрофореграммы. Это доказывает их гетерогенность.
Иммуноглобулины — полифункциональные белки, которые обеспечивают специфическое распознавание и связывание разнообразных антигенов и неполных антигенов (гаптенов); оказывают важный опсонизирующий эффект и активируют систему комплемента; взаимодействуют с другими иммунокомпетентными клетками, которые имеют к иммуноглобулинам специфические рецепторы.
Иммуноглобулины реализуют основной этап защиты организма от микробов, чужеродных белков, аутоантигенов и гаптенов. Естественно, что дефицит иммуноглобулинов приводит к тяжелым последствиям и быстрой гибели организма.
Основная функция антител — связывание антигена, однако антитела могут действовать и самостоятельно, обеспечивая нейтрализацию бактериальных токсинов, вирусов, предупреждая проникновение вирусов внутрь клеток. Помимо этого антитела усиливают фагоцитоз лейкоцитами как микробов, так и патологически измененных и разрушенных вирусами клеток.
В настоящее время выделяют пять основных классов иммуноглобулинов человека: IgA, IgM, IgG, IgE, IgD. По степени специфичности различных классов иммуноглобулинов к антигенам лидируют IgG, менее специфичны IgA и еще меньше — IgM.
Иммуноглобулин М составляет 5–10 % от всех сывороточных иммуноглобулинов и относится к наиболее раннему классу антител, а по своей структуре — к наиболее крупномолекулярным. Именно с синтеза IgM начинается иммунный ответ на внедрение многих антигенов. Так, у новорожденных при инфицировании и вакцинации антитела класса IgM представляют основную массу продуцируемых антител. IgM активируют комплемент по классическому пути, защищают организм от вирусов и бактерий, однако не проходят через плаценту. Одно из наиболее важных свойств иммуноглобулинов класса M — привлечение ими фагоцитов в места расположения антигена или в очаг инфекции с активацией фагоцитоза. При этом IgМ, опсонизируя антиген (микроб), повышает продуктивность фагоцитоза и снижает антигенную нагрузку.
Поскольку в синтезе IgM не участвуют Т-лимфоциты, этот процесс устойчив к действию иммунодепрессантов и ионизирующего излучения.
Длительный синтез преимущественно иммуноглобулинов M — симптом нарушения регуляторной функции Т-лимфоцитов-хелперов. Поэтому гипериммуноглобулинемия М — признак первичного иммунодефицита, связанного с нарушением передачи Т-хелперами костимуляционного сигнала В-лимфоцитов для переключения синтеза IgM на синтез Ig другого класса.
Следует отметить, что грамотрицательные микробы (в том числе все возбудители кишечных инфекций) вызывают выработку только IgM без последующего образования клеток иммунологической памяти. Поэтому вакцинация препаратами, полученными из грамотрицательных микробов, не дает длительного иммунитета.
Слабоспецифичные иммуноглобулины М могут связывать сразу 5 молекул антигена, что ведет к образованию крупных иммунных комплексов и способствует более быстрому выведению антигенов из циркулирующей крови, предотвращает возможность их фиксации в тканях и инициации патологических процессов. Доказано, что агглютинирующая и комплементсвязывающая способности IgM в сотни раз активнее, чем у IgG. Часть IgM относят к секреторным, поскольку они продуцируются локально.
Концентрация IgM в сыворотке крови у здоровых лиц, принятая в качестве региональной нормы (по данным авторов): 1,19 ± 0,04 г/л, референтные величины — 0,45–1,5 г/л.
Иммуноглобулин G составляет до 70 % от всех сывороточных иммуноглобулинов и является основным антителом вторичного иммунного ответа, поскольку наличие клеток памяти антител этого типа позволяет обеспечить иммунный ответ на повторное введение антигена, то есть обеспечить высокую напряженность иммунитета на протяжении длительного времени. Основная биологическая функция IgG — защита организма от инфекции и продуктов жизнедеятельности микробов-возбудителей (в том числе полисахаридных антигенов бактерий) за счет активации комплемента, опсонизации и активации фагоцитоза. Иммуноглобулин G — тимусзависимый, он вырабатывается при обязательном участии Т-лимфоцитов. Именно поэтому как ионизирующее излучение, так и иммунодепрессанты не только нарушают синтез IgG, но и полностью могут его подавить.
IgG обладает уникальными свойствами не только проникать в ткани, изолированные полости тела, через плаценту, но и регулировать продукцию специфических антител по типу обратной связи. Нейтрализующая способность IgG по отношению к различным токсинам в сотни раз выше, чем у IgM.
Концентрация IgG в сыворотке крови у здоровых лиц, принятая в качестве региональной нормы (по данным авторов): 12,15 ± 0,462 г/л, референтные величины — 8,0–15,0 г/л.
Иммуноглобулин А составляет до 15 % от всех сывороточных иммуноглобулинов и существует в двух формах — сывороточной и секреторной.
Сывороточный IgA способен обезвреживать микробы и токсины, циркулирующие в крови, однако его действие слабее, чем действие секреторного IgA. Сывороточный IgA может активировать комплемент по альтернативному пути. Инактивация сывороточного IgA может наступить под влиянием IgA-протеаз, которые продуцируются некоторыми микроорганизмами.
Секреторный IgA действует на слизистых оболочках, где нейтрализует бактериальные токсины и локализует вирусы, стимулирует фагоцитоз, обеспечивая местную резистентность к инфекции.
Концентрация IgA в сыворотке крови у здоровых лиц, принятая в качестве региональной нормы (по данным авторов): 1,833 ± 0,114 г/л, референтные величины — 0,9–3,2 г/л.
Циркулирующие иммунные комплексы (ЦИК) — высокомолекулярные белковые соединения, которые образуются в результате специфического взаимодействия антигена с антителом, то есть представляют собой иммунный комплекс «антиген — антитело». Этот перманентно протекающий в организме физиологический процесс направлен на поддержание постоянства внутренней среды организма. В крови постоянно циркулирует определенное количество ЦИК. Образование ИК — один из компонентов нормального иммунного ответа, который заканчивается нейтрализацией или элиминацией антигена. Однако при увеличении антигенной нагрузки количество комплексов растет. При некоторых патологических состояниях часть ЦИК фиксируется в сосудах, откладывается в тканях с повреждением их вследствие развития воспалительной реакции. Это так называемые иммунокомплексные повреждения — ключевое звено патогенеза ряда аутоиммунных заболеваний и полиорганных нарушений в медицине критических состояний. Поэтому содержание ЦИК можно интерпретировать только с учетом других лабораторных показателей и клинических проявлений заболевания.
Степень патогенности ЦИК зависит от их величины. ЦИК больших размеров нерастворимы, быстро фагоцитируются и обладают ограниченной патогенностью, в то время как растворимые ЦИК средних размеров, образовавшиеся при избытке антигена, способны активировать комплемент и обладают наибольшим патологическим потенциалом.
При непродолжительной антигенемии, даже в условиях образования ЦИК, поражение ими тканей и клинические проявления будут преходящими. При хронической инфекции, длительном и упорном персистировании антигена (инфекта) создаются условия для продолжительного формирования ЦИК и повреждения ими тканей органов-мишеней (инфекционный эндокардит, васкулит, гепатит, нефрит).
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным авторов): 57,70 ± 2,32 (в единицах оптической плотности), референтные величины — 41–85 (в единицах оптической плотности).
Диагностическое значение. Повышение уровня ЦИК выше значений у здоровых лиц возможно при: а) преобладании скорости образования ЦИК над скоростью их элиминации; б) увеличении антигенной нагрузки; в) образовании ЦИК, которые не могут быть удалены путем комплементопосредованных механизмов, при снижении активности системы комплемента; г) недостаточности фагоцитарной системы — блокаде моноцитарно-макрофагальной системы; д) после проведения лечебных мероприятий, приводящих к «вымыванию» иммунных комплексов из тканей.
Понижение уровня ЦИК ниже значений у здоровых лиц возможно при: а) сниженной антигенной нагрузке и значениях иммунорегуляторного индекса СD4/СD8, близких к значениям у здоровых лиц; б) увеличении антигенной нагрузки и значениях индекса СD4/СD8 выше 4,5.
Молекулярно-клеточные механизмы генетической предопределенности нарушений иммунитета у больных в критических состояниях
Главный комплекс гистосовместимости в диагностике нарушений иммунитета у больных в критических состояниях
Главный комплекс гистосовместимости (MHC — Major Histocompatibility Complex) — большая группа генов, кодирующих продукцию мембранных белковых молекул, экспрессирующихся на поверхности всех ядросодержащих клеток организма. Гены МНС были открыты знаменитым иммуногенетиком George Snell в 40-е годы ХХ в. Им же и был введен термин МНС. Тогда было выяснено, что у млекопитающих (мышей) существуют гены, предопределяющие выраженность реакции отторжения трансплантата.
Гомологичный комплекс локусов у человека идентифицировали J. Dausset с соавт. (1974) при исследовании реактивности антител из крови людей, перенесших трансплантации, а также у многорожавших женщин. У человека МНС назван HLA (Human leucocyte antigens). МНС и HLA — синонимы.
Первоначально изучение системы HLA было продиктовано потребностями трансплантационной иммунологии, когда возникла необходимость подбора тканесовместимых пар «донор — реципиент». Сегодня же мы знаем, что роль системы HLA в отторжении трансплантата является лишь одной из частных физиологических функций этой системы, а основная ее функция — это регуляция иммунного ответа на различных его этапах.
По современным представлениям, система HLA, обеспечивая регуляцию иммунного ответа, осуществляет такие важнейшие физиологические функции, как взаимодействие всех иммунокомпетентных клеток организма, распознавание своих и чужеродных, в том числе измененных собственных, клеток, запуск и реализация иммунного ответа, и в целом обеспечивает выживание человека как вида в условиях экзогенной и эндогенной агрессии (Р.М. Хаитов, Л.П. Алексеев, 1998; P.A. Bresnahan с соавт., 1997).
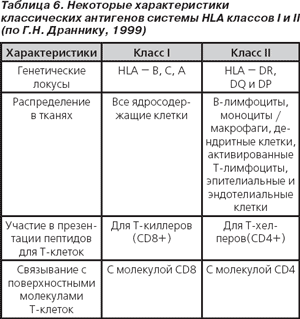
Обозначение HLA-специфичностей включает три компонента: 1) аббревиатуру всей системы (HLA); 2) локус, содержащий данную специфичность (А, В, С, DR, DQ и др.); 3) номер антигена (например, HLA-DR3).
В настоящее время гены системы HLA класса I включают локусы В, С, А (классические, кодирующие традиционные трансплантационные антигены) и недавно открытые локусы Е, G, F, биологическая функция которых уточняется. Описано более 40 специфичностей в локусе А, более 60 специфичностей в локусе В и около 20 — в локусе С (R. Lechler, 1994; цит. по Г.Н. Драннику, 1999).
Физиологическая функция аллелей и кодируемых ими HLA-антигенов, относящихся к различным классам HLA, в значительной степени различается. Так, антигены HLA класса I и II принимают участие во взаимодействии между иммунокомпетентными клетками в процессе иммунного ответа. Но антигенам класса I принадлежит также физиологическая функция обеспечения взаимодействия между всеми другими ядросодержащими клетками организма, вплоть до взаимодействия «нейрон — синапс». Тем самым с помощью системы HLA обеспечивается целостное функционирование не только иммунной системы человека, но и организма в целом (Ch.A. Janeway, 1997).
Гены системы HLA класса II включают основные локусы DR, DQ и DP, а также открытые позднее — DM, LMP и TAP. Три последних локуса обеспечивают такую важнейшую функцию, как процессинг и экспрессия HLA-антигенов на поверхности клеток [59].
Антигены, кодируемые генами системы HLA класса II локусов DR, DQ и DP, экспрессируются в норме лишь В-лимфоцитами, макрофагами и дендритными клетками (то есть на клетках, способных презентировать антиген). Под воздействием IFN-γ молекулы HLA класса II могут экспрессироваться и на других клетках, например Т-лимфоцитах, эндотелиальных и эпителиальных клетках.
Гены системы HLA класса III включают гены, кодирующие факторы компонентов комплемента, TNF, контроль активности ферментов цитохрома Р450 и некоторые другие (Р.М. Хаитов, Л.П. Алексеев, 1998).
Антигены гистосовместимости, выявляемые на клетках конкретного человека, составляют HLA-фенотип. Для его определения необходимо произвести фенотипирование клеток индивида. Как правило, «типируются» лимфоциты периферической крови.
На практике HLA-фенотип записывают, соблюдая числовой порядок HLA-антигенов согласно номенклатуре, например: HLA-фенотип субъекта — А1, 2; В5, 12; DR2, 5, DQ3, 4 (Г.Н. Дранник, 1999).
Для выявления классических антигенов системы HLA локусов А, В, С и DR используется серологическая реакция микролимфотоксичности, в которой применяются специальные антисыворотки, содержащие антитела к указанным антигенам.
Изучение связей HLA-системы с некоторыми заболеваниями, состояниями имеет важное значение для эпидемиологии, диагностики, прогноза и лечения.
Проведенные И.А. Криворучко с соавт. (2002) предварительные исследования показали, что у тяжелой категории больных с жизнеугрожающей осложненной абдоминальной инфекцией интенсивный антибактериальный ответ сочетался с экспрессией антигенов гистосовместимости HLA А33, HLA В5, HLA В15, а слабый — с HLA А28 и HLA В17 и снижением экспрессии HLA-DR-антигенов на моноцитах. Известно, что экспрессия антигенов II класса необходима для эффективной презентации и процессинга клетками антигенов — важнейшего компонента иммунного ответа на инфекцию. Выявленное уменьшение экспрессии HLA-DR-антигенов на моноцитах, по сути, было патогномоничным для прогноза последующего развития сепсиса и коррелировало с секрецией провоспалительных (в частности, IL-8) цитокинов.
Согласно данным W.D. Doecke с соавт. (1994, 1999) из Института медицинской иммунологии, медицинской школы Шарите и Гумбольдского университета, уменьшение экспрессии HLA-DR на моноцитах следует считать индикатором иммунопаралича — состояния иммуносупрессии, приобретенного иммунодефицита у больных с развившимся жизнеугрожающим сепсисом вследствие ожогов, политравмы или обширных хирургических вмешательств (K. Wolk с соавт., 1999).
В норме экспрессия HLA-DR на моноцитах составляет 70–100 %. При снижении до 30 % и менее экспрессии HLA-DR на моноцитах у больных с сепсисом авторы отмечали фатальный исход в более чем 85 % случаев. При значениях экспрессии HLA-DR на моноцитах 40 % или более летальность составила 12 % (K. Wolk с соавт., 1999).
Теперь благодаря развитию молекулярной генетики и иммунохимии появилась возможность не только проводить тонкий анализ HLA-антигенов, но и изучить сами гены HLA. Особенный прогресс в этом направлении произошел после открытия и внедрения в исследования в области изучения системы HLA метода полимеразной цепной реакции (ПЦР), позволяющего анализировать необходимые для исследований участки ДНК. Это открыло широкие возможности для быстрого и точного анализа молекулярного полиморфизма HLA, который затруднен или невозможен при применении серологического типирования (D. Middleton, F.A. Williams, 1997).
Молекулярно-генетический уровень генотипирования позволяет сегодня вплотную приблизиться к пониманию генетически обусловленной физиологической резистентности человека к определенным заболеваниям на популяционном уровне.
Система HLA осуществляет регуляцию иммунного ответа на его начальных и продуктивных этапах, она также обеспечивает и такой «терминальный» этап регуляции, как апоптоз различных типов антигенпрезентирующих клеток (АПК). Этот эффект касается как «профессиональных» АПК (макрофаги, CD34+ клетки, дифференцировавшиеся из моноцитов в культуре клеток, и дендритные клетки), так и В-лимфоцитов.
Еще одной важнейшей физиологической функцией HLA DR-генов и кодируемых ими белковых молекул является регуляция иммунного ответа за счет участия в механизме HLA-DR-опосредованного апоптоза различных типов АПК (N. Bertho с соавт., 2000). Роль HLA-DR-антигенов не ограничивается регуляцией апоптоза «профессиональных» АПК, но они также принимают непосредственное участие в апоптозе В-лимфоцитов.
Все эти данные в целом свидетельствуют в пользу ключевой физиологической роли HLA-DR-молекул в регуляции апоптоза всех типов АПК. При современном уровне знаний о физиологической роли HLA-DR-генов можно считать, что именно они в действительности являются генами иммунного ответа человека.
Генам главного комплекса гистосовместимости помимо вышеописанной физиологической функции генетического контроля специфического иммунного ответа принадлежит еще ряд важнейших физиологических функций. Одной из них является генетический контроль качества иммунного ответа.
Механизмы генной регуляции синтеза цитокинов
У больных в критических состояниях цитокиновый профиль в значительной степени характеризует иммунный статус пациентов, степень выраженности и темпы формирования полиорганных нарушений. При этом клиническая симптоматика отражает молекулярные, клеточные, биохимические процессы, возникающие в ответ на экстремальную агрессию, в том числе и на инфекцию. Эти процессы многоплановы, тесно взаимосвязаны и порой настолько избыточны, хаотичны, неуправляемы, что превышают биологическую целесообразность (SIRS). Характер их развития предопределен генетически (R. Bone, 1996).
Клинические публикации по этой проблеме довольно малочисленны и посвящены генетическому полиморфизму локуса генов, кодирующих ключевой цитокин системного воспалительного ответа — TNF-α. Так, Frank Stuber с соавт. (1996) выявили у пациентов, гомозиготных по аллели TNFB2, значительно более низкую выживаемость при тяжелом сепсисе (+СПОН) в сравнении с гетерозиготными больными. Авторы связали это с более высокой концентрацией TNF-α у гомозиготных по аллели TNFВ2 больных и заключили, что количество TNF-α, выделяющегося при тяжелой инфекции и сепсисе, генетически детерминировано. Это позволяет в предоперационном периоде выявлять пациентов с высоким риском септических осложнений для интенсивного мониторинга и профилактических мероприятий, в том числе использования так называемой анти-TNF стратегии (Frank Stuber с соавт., 1996).
Ядерный фактор транскрипции — каппа Б (NF-κB — nuclear factor kappa B)
Механизмы контроля, регуляции синтеза и секреции цитокинов при критических состояниях — сложный, многоплановый процесс. Характер реализации воспалительного ответа при экстремальной агрессии на уровне клетки во многом зависит от функции ядерного фактора транскрипции — каппа Б (NF-κB — nuclear factor kappa B) [50]. Так, рост активности NF-κB, исследуемого в ядерных экстрактах из мононуклеаров периферической крови, тесно коррелировал с ростом летальности при сепсисе (H.R. Wong, 1998) и тяжелом сепсисе (+СПОН) (H. Bohrer с соавт., 1997).
NF-κB — семейство белковых макромолекул, связывающихся со специфическими сайтами на молекуле ДНК и изменяющих интенсивность транскрипции различных генов. NF-κB регулирует экспрессию большого числа генов, ответственных за разнообразные функции, такие как иммунный ответ, воспаление, пролиферация, а также программируемая гибель клетки — апоптоз.
Гены, активируемые под воздействием NF-κB (по Г.Н. Драннику, 1999):
1. Гены медиаторов воспаления:
— IL-1, -2, -4, -6, -8, -10;
— антагониста рецепторов IL-1;
— IL-2 рецептора α;
— TNF-α, TNF-β;
— колониестимулирующего фактора;
— молекул адгезии: VCAM-1; ICAM-1; Е-селектина.
2. Гены острофазовых реактантов:
— плазменного белка амилоида А;
— некоторых компонентов системы комплемента.
3. Гены вирусов:
— вируса иммунодефицита человека 1;
— цитомегаловируса;
— аденовируса;
— SV40.
4. Гены компонентов NFκB/I kB.
5. Прочие гены, в том числе ангиотензиногена и индуцибельной формы синтазы оксида азота.
Оказать влияние на транскрипцию определенных генов ядерный фактор NF?B способен лишь после его активации в цитоплазме клетки и проникновения в ядро клетки. Активировать NFκB способны медиаторы воспаления.
Факторы, способные активировать NF-κB (по Г.Н. Драннику, 1999):
1. Бактериальные продукты:
— липополисахарид;
— экзотоксины;
— токсин синдрома токсического шока 1.
2. Цитокины:
— TNF-α;
— IL-1, -2;
— лейкотриен В4;
— фактор ингибиции лимфоцитов.
3. Вирусы и их продукты:
— аденовирус Е1А;
— цитомегаловирус;
— вирус Эпштейна — Барр и ядерный антиген вируса;
— вирус гепатита В;
— вирус Т-клеточной лейкемии человека;
— вирус простого герпеса;
— вирус герпеса человека 6;
— вирус иммунодефицита человека 1;
— вирус обезьян SV40.
4. Двуцепочечная РНК.
5. Активные кислородные радикалы.
6. Сфингомиелин, церамид.
7. Митогены Т- и В-лимфоцитов.
8. Ультрафиолетовое и рентгеновское облучение.
Неоднородность семейства белковых субъединиц, входящих в NF-κB, обусловливает при его активации реализацию клеточного ответа на сходные антигенные стимулы в виде либо воспаления, либо пролиферации, либо в виде апоптоза, а также определяет специфичность цитокинового ответа клетки (Г.Н.Дранник,1999).
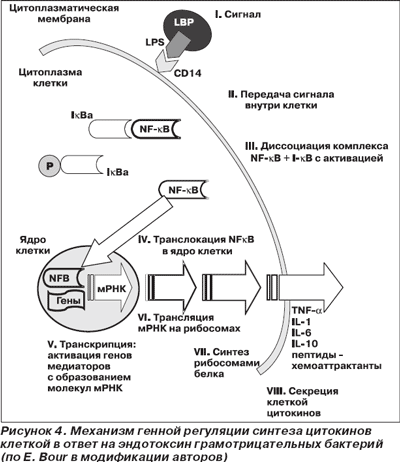
I. Сигнал. Для индукции синтеза цитокинов требуется определенный стимул — сигнал. Этот сигнал должен попасть на специфический участок (рецептор) плазматической мембраны клетки-мишени и быть строго проверен и подтвержден. При тяжелой инфекции (сепсисе) этим сигналом может быть генетически чужеродная субстанция различных микробов. Наиболее изучен процесс взаимодействия эндотоксина грамотрицательных бактерий — липополисахарида, LPS (lipopolysaccharide). Биологическая активность эндотоксина во многом зависит от его липидного компонента (липида А) и концентрации одного из белков сыворотки (липополисахаридсвязывающего белка — LBP — lipopolysaccharide binding protein). LBP синтезируется гепатоцитами и взаимодействует с липидом А, нейтрализуя его биологическую активность. Комплекс LPS + LBP способен реагировать со специфическими рецепторами (CD14) мембран нейтрофилов, макрофагов, связываться растворимыми рецепторами (SCD14) с последующей нейтрализацией этого комплекса липидами высокой плотности плазмы крови (K. Murphy с соавт., 1998). При грамположительной инфекции отмечаются как CD14-зависимые, так и CD14–независимые механизмы передачи клеточных сигналов (A. Cauwels с соавт., 1997).
II. Передача сигнала внутри клетки. Стимуляция клеток развивается посредством активации путей передачи сигнала внутри клетки, что связано с деятельностью протеинкиназ, фосфорилирующих определенные белки (ингибиторы IκB). Этот процесс приводит к (III) диссоциации в цитоплазме комплекса NF-κB + I-κB (ядерный фактор транскрипции + белок-ингибитор) с активацией NF-κB.
Далее происходят (IV) транслокация в ядро клетки свободных димеров NF-κB и (V) транскрипция: активация генов медиаторов с образованием молекул матричной РНК (мРНК). Затем молекулы мРНК транспортируются в цитоплазму клетки, где происходит их (VI) трансляция на рибосомах с последующим (VII) синтезом рибосомами белка / цитокинов и (VIII) секрецией цитокинов клеткой (рис. 4).
Тесты, характеризующие степень влияния эндогенной интоксикации на иммунный ответ
Содержание в крови молекул средней массы (МСМ) определяют путем ультрафиолетовой спектрофотометрии биологических жидкостей (кровь, моча) — вещества с молекулярной массой от 1500 до 5000 Д являются универсальными маркерами эндотоксикоза. Природа МСМ неоднородна. Установлено, что большая часть идентифицированных по химическому составу МСМ представляет собой фрагменты эндогенных белков. Косвенным доказательством того, что именно эндогенный протеолиз является важным источником МСМ, может служить то, что внутривенное введение антипротеаз значительно замедляло, но не исключало нарастание концентрации МСМ в крови. Нельзя исключить, что первичным продуктом для образования МСМ служат ацилгидроперекиси и фрагменты поврежденных клеточных мембран (А.Л. Костюченко с соавт., 2000).
Являясь в нормальных условиях естественными биогенными регуляторами, МСМ в повышенных концентрациях обладают широким спектром патологического действия. МСМ ингибируют митохондриальное дыхание, синтез ДНК в альвеолярных макрофагах и лимфоцитах. Некоторые фракции пула МСМ связываются с инсулином. Из-за невозможности инсулина образовывать связь с клеточными рецепторами это приводит к нарушению процессов внутриклеточной утилизации глюкозы. МСМ угнетают синтез гемоглобина, снижают активность лактатдегидрогеназы. МСМ, свободно проникая через ГЭБ, нарушают регуляцию функций головного мозга, оказывая психо- и нейротропный эффект. Высокие концентрации МСМ угнетают сократительную способность миокарда и выделительную функцию первично не скомпрометированных почек (А.Л. Костюченко с соавт., 2000).
При спектрофотометрии максимум поглощения в ультрафиолетовой зоне имеют многие вещества, не относящиеся по молекулярной массе к МСМ: мочевина, креатинин, мочевая кислота, глюкоза, молочная, пировиноградная и другие метаболические кислоты, нуклеотиды, аминокислоты, жирные кислоты, холестерин, фосфолипиды и их дериваты, продукты ПОЛ и т.д., накапливающиеся при КС в нефизиологических концентрациях.
Согласно данным А.И. Демченко (1981), М.Я. Малаховой (1995–2005), диапазон длины волн 220–255 нм — спектр максимального поглощения неароматических (254 нм) серосодержащих аминокислот (цистина, цистеина, метионина). 250–256 нм — максимум экстинций для пуриновых оснований (аденин, гуанин).
В диапазоне длины волн 238–242 нм регистрируются вещества катаболического происхождения, ксенобиотики, продукты распада клеток, тканей, вещества микробной природы. Диапазон длины волн 238–244 нм — спектр максимального поглощения мочевины, мочевой кислоты, креатинина. Близки к этому максимуму спектры поглощения продуктов деградации альбумина, фибриногена, неэстерифицированных жирных кислот и других веществ.
Появление высоких значений экстинций при длине волн 238, 242, 246 нм всегда свидетельствует о патологических процессах в организме.
Длина волны 258 нм — спектр максимального поглощения АДФ, АМФ, аденина, L-валина, L-фенилаланина. А длина волны 280 нм — спектр максимального поглощения света ароматическими хромофорами — фенолами, тирозином, триптофаном, фенилаланином.
Диагностически более целесообразным следует считать одномоментное определение концентраций МСМ в сыворотке крови, на эритроцитарных мембранах и в моче путем прямой ультрафиолетовой спектрофотометрии при длинах волн 238, 254, 260 и 280 нм с последующим расчетом коэффициента ароматичности, коэффициента распределения и пептидно-нуклеотидного коэффициента, клиренса МСМ [2, 24, 26].
Показатели у здоровых лиц, принятые в качестве региональной нормы (по данным А.Н. Нестеренко, Е.Д. Якубенко): МСМ-238 нм — 0,806 ± 0,077 Е/мл, референтные величины — 0,56–0,76 Е/мл; МСМ-254 нм — 0,268 ± 0,040 Е/мл, референтные величины — 0,18–0,24 Е/мл; МСМ-260 нм — 0,241 ± 0,039 Е/мл, референтные величины — 0,16–0,28 Е/мл; МСМ-280 нм — 0,348 ± 0,074 Е/мл, референтные величины — 0,18–0,30 Е/мл; коэффициент ароматичности (МСМ-238 нм / МСМ-280 нм) — 2,401 ± 0,454; коэффициент распределения (МСМ-280 нм / МСМ-254 нм) — 1,317 ± 0,307; пептидно-нуклеотидный коэффициент (МСМ-238 нм / МСМ-260 нм) — 3,395 ± 0,399.
Диагностическое значение. По данным А.Л. Костюченко с соавт. (1997–2000), ухудшение состояния пациентов в критических состояниях, связанное со снижением транспорта кислорода в организме, клинические проявления гипоксии, как правило, сочетаются со значительным повышением уровня МСМ в крови. Наибольшие изменения их содержания наблюдаются при СПОН, сочетающей нарушение жизненно важных функций, обеспечивающих транспорт кислорода, биотрансформацию и элиминацию токсинов.
Высокое содержание МСМ в плазме крови более характерно для резорбционно-тканевой, ретенционной и микробной интоксикации на различных этапах развития острого панкреатита, нежели для чисто энзимной интоксикации в самом начале его развития. При деструктивном панкреатите (энзимной интоксикации) уровень МСМ может быть практически нормальным за счет высокой активности панкреатических протеиназ. При шунтовой печеночной коме уровень МСМ всегда низок.
Эффективность проводимой активной детоксикации четко отражается на концентрации МСМ в крови, в то время как динамика обычных маркеров эндотоксикоза (мочевины, креатинина и др.) не всегда соответствует динамике уровня МСМ.
Согласно данным В.В. Чаленко (1991), при патологии в случае прямой стимуляции плазменных систем ограниченного протеолиза преобладает прирост МСМ-280 (спектр поглощения ароматических аминокислот), а при стимуляции ПОЛ и иммуногенеза преобладает прирост МСМ-254 (спектр поглощения неароматических аминокислот).
Согласно Н.А. Пятаеву с соавт. (2002), изменения так называемого коэффициента распределения (МСМ-280 / МСМ-254) являются косвенным признаком динамики соотношения бактериального и продукционного компонента эндотоксикоза.
И.П. Гордеева с соавт. (1986) при хирургическом сепсисе отметили тенденцию к снижению коэффициента распределения до величины 0,1 и ниже. При этом авторы приводят в качестве нормальных референтные величины индекса — 1,3–1,6.
Изучая дисбаланс протеиназно-ингибиторной системы при акушерском сепсисе и септическом шоке, Л.А. Белова с соавт. (2003) отметили:
— повышение пептидно-нуклеотидного коэффициента (МСМ-238 / МСМ-260) в 2 раза у больных акушерским сепсисом (0,902 ± 0,092) против доноров (нормы) — 0,384 ± 0,028;
— повышение коэффициента ароматичности (МСМ-238 / МСМ-280) у больных акушерским сепсисом, септическим шоком до 0,770 ± 0,083 против 0,233 ± 0,029 у родильниц без патологии.
Индекс соотношения содержания абсолютного количества лимфоцитов и молекул средней массы (лимф. абс. / МСМ254) предложен В.П. Шано, А.Н. Нестеренко в 1991 г. (АС SU 1666954 A1, G 01 N 33/53). Значение показателя у здоровых лиц, принятое в качестве региональной нормы, — 4,8 ± 0,6.
Диагностическое значение. По этому показателю можно судить о наличии или отсутствии иммунотоксикоза, то есть о степени влияния нарушений метаболизма на главные клетки иммунной системы — лимфоциты. При увеличении этого показателя в сравнении с данными контроля можно предполагать наличие иммунотоксикоза.
Парамецийный индекс токсичности (ПИТ). Значение показателя у здоровых лиц, принятое в качестве региональной нормы, — 1,20 ± 0,07 (по данным авторов).
Диагностическое значение. Парамецийный индекс токсичности — это интегральный показатель токсических свойств биологических жидкостей (цельной крови, ее сыворотки, плазмы, а также лимфы, мочи). Определяется по парамецийному тесту путем расчета соотношения времени жизни Paramecium Caudatum в контрольном растворе (физиологический раствор) и в исследуемом материале (сыворотка, плазма крови, моча, лимфа). Увеличение индекса токсичности выше 3 свидетельствует о наличии интоксикации. При сепсисе в критическом состоянии индекс токсичности иногда достигает 11.
Лейкоцитарный индекс интоксикации (ЛИИ) был предложен Я.Я. Кальф-Калифом и впервые опубликован в журнале «Врачебное дело» еще до второй мировой войны. Он представляет собой эмпирический интегральный показатель, который отражает соотношение положительных и отрицательных факторов. ЛИИ увеличивается при интоксикациях, сопровождающих инфекционные заболевания, сепсис, химические, термические, механические, радиационные травмы, шоки и т.п.
![]()
где С — сегментоядерные нейтрофилы, П — палочкоядерные, Ю — юные, М — миелоциты, Пл — плазматические клетки, Мо — моноциты, Л — лимфоциты, Э – эозинофилы. Безразмерная величина.
Значение показателя у здоровых лиц, принятое в качестве региональной нормы (по данным авторов), — 0,83 ± 0,067.
Диагностическое значение. Нормальное значение ЛИИ близко к единице, повышение до 4–9 свидетельствует о значительном бактериальном компоненте эндотоксикоза, умеренное повышение ЛИИ до 2–3 говорит либо о стабилизации инфекционного процесса, либо о преимущественном тканевом распаде. Низкий уровень лейкоцитов и высокий ЛИИ — тревожный прогностический признак [12, 19, 22].
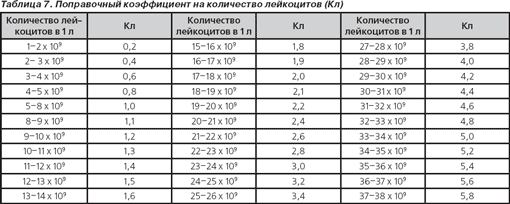
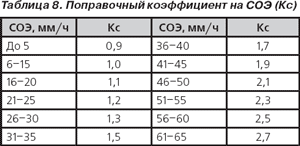
Гематологический показатель интоксикации (ГПИ). Несмотря на то что ЛИИ используется и в практической медицине, и при проведении научных исследований уже более 60 лет, он не лишен недостатков: гипертрофировано влияние эозинофилов на величину ЛИИ, не учитывается количество лейкоцитов и др. Неоднократно многими авторами предпринимались попытки оптимизации ЛИИ (В.К. Островский с соавт., 1983–2006; С.Ф. Химич в модификации А.Л. Костюченко, 1997, 2000) [22]. Сотрудниками кафедры инфекционных болезней Гродненского медицинского института С.В. Васильевым и В.И. Комар (1983) разработана модификация ЛИИ — гематологический показатель интоксикации с учетом изменения количества лейкоцитов и скорости оседания эритроцитов:
ГПИ = ЛИИ х Кл х Кс,
где Кл — поправочный коэффициент на количество лейкоцитов (табл. 7), Кс — поправочный коэффициент на СОЭ (табл. 8).
Значение показателя у здоровых лиц, принятое в качестве региональной нормы (по данным авторов), — 0,23 ± 0,14.
Интерпретация полученных результатов у пациентов в критических состояниях проводится с учетом сроков и кратности обследования, поэтапно.
Вначале оценивают изменения иммунного статуса путем сопоставления иммунологических и биохимических показателей пациента с аналогичными параметрами клинически здоровых лиц. Анализируют связь между изменениями иммунологических, биохимических показателей, маркерами эндотоксикоза и формулируют заключение о наличии лабораторных признаков следующих клинико-иммунологических состояний:
— неспецифического синдрома нарушения иммунной защиты с формированием неадекватного иммунного ответа в условиях эндогенной интоксикации;
— иммунодефицита — состояния недостаточности того или иного звена иммунной защиты с развитием аутоиммунного, инфекционного, аллергического, иммунопролиферативного синдромов;
— иммунодефекта — «срыва» иммунорегуляции, который затрагивает все или несколько звеньев иммунного реагирования и проявляется нарушением сопряженности в деятельности иммунной и монооксигеназной систем;
— иммунопаралича — функциональной несостоятельности моноцитов;
— синдрома системного воспалительного ответа — системной воспалительной реакции на экстремальное воздействие, обусловленной мощной активацией клеток иммунного реагирования, эндотелиоцитов и гуморальных факторов иммунитета [1, 18–20, 37, 38, 40].
Следует учитывать, что сравнение данных обследования пациентов в критических состояниях с показателями клинически здоровых лиц позволяет сделать лишь предварительное (ориентировочное) заключение о характере и степени выраженности иммунных нарушений, так как не учитывает индивидуальные, возрастные особенности иммунного реагирования, сезонные и суточные колебания показателей иммунитета у конкретного пациента.
Именно поэтому необходимо проведение следующего этапа обследования для оценки эффективности / неэффективности терапии путем анализа динамики показателей иммунного статуса пациента — данных предыдущего обследования и полученных данных в сравнении друг с другом и с показателями у клинически здоровых лиц. Сроки выполнения и кратность исследований индивидуальны. Все зависит от тяжести состояния больного, характера лечения.
Использование иммунотропных средств, глюкокортикостероидов, антибиотиков при критических состояниях требует тщательного лабораторного иммунологического контроля. Обязательным является иммунологическое обследование после выхода из критического состояния с целью выработки тактики иммунореабилитации.
Таким образом, оперативно полученная объективная информация о характере нарушений иммунитета у пациентов в критических состояниях позволяет своевременно избрать оптимальную тактику интенсивной терапии, в том числе целенаправленной иммунокоррекции, контролировать эффективность и адекватность проводимого лечения.
1. Бахтеева Т.Д., Шано В.П., Нестеренко А.Н. и др. Концепция иммунного дистресса в интенсивной терапии критических состояний // Біль, знеболюв. і інтенс. тер. — 2002. — № 2 (д). — С. 56-59.
2. Белова Л.А., Оглоблина О.Г., Саталкин А.А. и др. Дисбаланс протеиназно-ингибиторной системы при акушерском сепсисе и септическом шоке // Клин. лаб. диагностика. — 2003. — № 7. — С. 13-16.
3. Белушкина Н.Н., Северин С.Е. Молекулярные основы патологии апоптоза // Арх. патологии. — 2001. — № 1. — С. 51-60.
4. Бунятян А.А., Инвияева Е.В., Никода В.В., Винницкий Л.И. Иммунокорректоры в комплексном лечении послеоперационных гнойно-воспалительных осложнений у хирургических больных и мониторинг иммунологических показателей // Анестезиол. и реаниматол. — 2004. — № 5. — С. 79-83.
5. Винокуров М.Г., Прохоренко И.Р., Юринская М.М. и др. Действие липополисахаридов и УФ-облучения диапазона С на регуляцию апоптоза нейтрофилов человека // Иммунология. — 2001. — № 2. — С. 25-27.
6. Голиков П.П., Пахомова Г.В., Утьешев Н.С. и др. Динамика содержания конечного продукта оксида азота нитрита в различных биологических жидкостях при перитоните // Вестн. интенсивн. тер. — 2000. — № 4. — С. 31-33.
7. Дранник Г.Н. Клиническая иммунология и аллергология: Учебное пособие. — Одесса: Астропринт, 1999. — 604 с.
8. Еськов А.П., Каюмов Р.И., Соколов А.Е. Оценка и прогноз состояния больных в послеоперационном периоде // Вестн. хирургии. — 2003. — Т. 162, № 4. — С. 76-70.
9. Звягина Т.В. Метаболиты оксида азота в крови и моче здоровых людей: их связь с цитокинами и гормонами // Вестн. неотложн. и восстановит. медицины. — 2002. — Т. 3, № 2. — С. 302-304.
10. Иммуноферментный анализ. Наборы и оборудование // Каталог группы компаний «БиоХимМак». — М., 2002. — 165 с.
11. Киров М.Ю., Евгенов О.В., Егорина Е.М. и др. Первый опыт применения инфузии метиленового синего при септическом шоке // Вестн. интенсивн. тер. — 2000. — № 4. — С. 28-30.
12. Козинец Г.П., Слесаренко С.В., Шейман Б.С. Хирургическая детоксикация в комплексном лечении ожоговой болезни // Вестн. неотложн. и восстановит. медицины. — 2002. — Т. 3, № 3. — С. 531-539.
13. Козлов В.К. Сепсис: иммунные дисфункции в патогенезе сепсиса. Возможности диагностики // Укр. журн. екстремальн. медицини ім. Г.О. Можаєва. — 2005. — Т. 6, № 1. — С. 19-25.
14. Козлов В.К., Винницкий Л.И. Дисфункция иммунной системы в патогенезе сепсиса // Общая реаниматология. — 2005. — Т. 1, № 4. — С. 65-76.
15. Маянский Н.А., Заславская М.И., Маянский А.Н. Апоптоз экссудативных нейтрофилов человека // Иммунология. — 2000. — № 2. — С. 11-13.
16. Миронов П.И., Альес В.Ф. Молекулярные аспекты системного воспалительного ответа при сепсисе // Новости науки и техники. Информ. сб. Серия: Медицина. Вып. Реаниматол. и интенсив. терапия. Анестезиол. / ВИНИТИ. — 2000. — № 4. — С. 1-9.
17. Молчанова Л.В., Мороз В.В. Молекулярные аспекты полиорганной недостаточности: Молекулы адгезии (Обзор литературы) // Новости науки и техники. Информ. сб. Серия: Медицина. Вып. Реаниматол. и интенсив. терапия. Анестезиол. / ВИНИТИ. — 1999. — № 2. — С. 10-17.
18. Нестеренко А.Н. Клинико-морфологический анализ танатогенеза хирургического сепсиса // Патологія. — 2005. — Т. 2, № 2. — С. 53-55.
19. Спосіб діагностики порушення детоксикуючої функції легень при критичних станах і сепсисі: Деклараційний патент на корисну модель UA 14703 G 01 N 33/48 / Нестеренко О.М. — Опубл. 15.05.2006, Бюл. № 5.
20. Спосіб прогнозування перебігу хірургічного сепсису: Деклараційний патент на корисну модель UA 15271 G 01 N 33/48 / Нестеренко О.М. — Опубл. 15.06.2006, Бюл. № 6.
21. Останин А.А., Леплина О.Ю., Тихонова М.А. и др. Хирургический сепсис. Часть I. Иммунологические маркеры системной воспалительной реакции // Вестн. хирургии. — 2002. — Т. 161, № 3. — С. 101-107.
22. Островский В.К., Мащенко А.В., Янголенко Д.В., Макаров С.В. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях // Клин. лаб. диагностика. — 2006. — № 6. — С. 50-53.
23. Проскуряков С.Я., Бикетов С.И., Иванников А.И., Скворцов В.Г. Оксид азота в механизмах патогенеза внутриклеточных инфекций // Иммунология. — 2000. — № 4. — С. 9-19.
24. Пятаев Н.А., Котлов И.С., Бояринов Г.А., Кузин В.В. Диагностическое и прогностическое значение различных маркеров эндогенной интоксикации при перитоните // Эфферентная терапия. — 2002. — Т. 8, № 2. — С. 49-52.
25. Рябов Г.А., Азизов Ю.М. Роль оксида азота как регулятора клеточных процессов при формировании полиорганной недостаточности // Анестезиол. и реаниматол. — 2001. — № 1. — С. 8-13.
26. Рябов Г.А., Азизов Ю.М., Пасечник И.Н. и др. Окислительный стресс и эндогенная интоксикация у больных в критических состояниях // Вестн. интенсивн. тер. — 2002. — № 4. — С. 4-7.
27. Семенов В.Н., Пасечник И.Н. Апоптоз и его роль в патогенезе критических состояний // Вестн. интенсивн. тер. — 2004. — № 1. — С. 3-7.
28. Сепиашвили Р.И., Шубич М.Г., Карпюк В.Б. Оксид азота при астме и различных формах иммунопатологии // Астма. — 2001. — Т. 2., № 2. — С. 5-14.
29. Симбирцев А.С. Цитокины — новая система регуляции защитных реакций организма // Цитокины и воспаление. — 2002. — Т. 1, № 1. — С. 9-16.
30. Синяченко О.В., Звягина Т.В. Оксид азота в терапевтической практике. — Донецк: ООО «Юго-Восток Лтд», 2001. — 258 с.
31. Тимченко В.Н., Романцов М.Г. Применение циклоферона в практике врача-педиатра: Методические рекомендации. — СПб, 2000. — 100 с.
32. Фильченков А.А., Стойка Р.С. Апоптоз и рак. — К.: Морион, 1999. — 184 с.
33. Фрейдлин И.С., Шейкин Ю.А. Эндотелиальные клетки в качестве мишеней и продуцентов цитокинов // Медицинская иммунология. — 2001. — Т. 3, № 4. —
С. 501-514.
34. Хаитов Р.М., Пинегин Б.В. Оценка иммунного статуса человека в норме и при патологии // Иммунология. — 2001. — № 4. — С. 4-6.
35. Цитокин. Иммуноферментные тест-системы для количественного определения цитокинов человека и компонентов комплемента // Каталог 2003–2004 ООО «Цитокин». — СПб., 2003. — 37 с.
36. Чередеев А.Н., Ковальчук Л.В. Апоптоз как важный этап оценки иммунной системы по патогенетическому принципу // Клин. лаб. диагностика. — 1997. — № 7. — С. 31-35.
37.Спосіб діагностики фази імунного дистрес-синдрому: Патент UA 56789 А, G 01 N 33/48 / Черній В.І., Шано В.П., Нестеренко О.М., Земляний І.В. — Опубл. 15.05.2003, Бюл. № 5.
38. Черний В.И., Нестеренко А.Н., Шано В.П. и др. Перспективные направления в анестезиологии и интенсивной терапии // Анестезиология: В 5 т.: Авт. пер. с укр. / Под ред. В.И. Черния, Р.И. Новиковой. — К.: Здоров'я, 2004. — Т. 5. — С. 64-116, 132-214.
39. Чурляев Ю.А., Григорьев Е.В., Шерстобитов А.В. и др. Характеристика некоторых компонентов системной воспалительной реакции у больных с распространенным перитонитом // Анестезиол. и реаниматол. — 2003. — № 2. — С. 31-33.
40. Шано В.П., Черний В.И., Нестеренко А.Н. и др. Эндотоксикоз, иммунный дистресс и полиорганные нарушения: клинико-морфологическое обоснование терапии с позиций SIRS // Біль, знебол. і інтенс. тер. — 2001. — № 2 (д). — С. 45-47.
41. Aosasa S., Ono S., Mochizuki H. et al. Activation of monocytes and endothelial cells depends on the severity of surgical stress // World. J. Surg. — 2000. — Vol. 24, № 1. — P. 10-6.
42. Bone R.C. Toward a theory regarding the pathogenesis of the systemic inflammatory response syndrome: what we do and do not know about cytokine regulation // Crit. Care Med. — 1996. — Vol. 24, № 1. — P. 163-72.
43. Bone R.C. Immunology dissonance: a continuing evolution in our understanding of SIRS and the MODS // Ann. Intern. Med. — 1996. — Vol. 125, № 8. — P. 680-687, 690-691.
44. Botha A.J., Moore F.A., Moore E.E. et al. Early neutrophil sequestration after injury: a pathogenic mechanism for multiple organ failure // J. Trauma. — 1995. — Vol. 39, № 3. — P. 411-7.
45. Cabioglu N., Bilgic S., Deniz G. et al. Decreased cytokine expression in peripheral blood leukocytes of patients with severe sepsis // Arch. Surg. — 2002. —
Vol. 137, № 9. — P. 1037-43.
46. Cooper D., Russell J., Chitman K.D. et al. Leukocyte dependence of platelet adhesion in postcapillary venules // Am. J. Physiol. Heart Circ. Physiol. — 2004. — Vol. 286. — P. H1895-H1900.
47. Finney S.J., Evans T.W. Induction of apoptosis in sepsis: cell suicide may be beneficial // Crit. Care Med. — 2002. — Vol. 30. — P. 261-262.
48. Fumeaux T., Pugin J. Role of interleukin-10 in the intracellular sequestration of human leukocyte antigen-DR in monocytes during septic shock // Am. J. Respir. Crit. Care Med. — 2002. — Vol. 166, № 11. — P. 1475-82.
49. Haveman J.W., Muller Kobold A.C., Tervaert J.W. et al. The central role of monocytes in the pathogenesis of sepsis: consequences for immunomonitoring and treatment // Neth. J. Med. — 1999. — Vol. 55, № 3. — P. 132-41.
50. Hawiger J. Innate immunity and inflammation: a transcriptional paradigm // Immunol. Res. — 2001. — Vol. 23, № 2–3. — P. 99-109.
51. Hobbs A. Nitric oxide metabolism linked to sepsis // J. Biol. Chemistry. — 2005. — Vol. 18, № 3. — P. 721-9 (www.ucl.ac.uk).
52. Hotchkiss R.S., Tinsley K.W., Swanson P.E., Karl I.E. Endothelial cell apoptosis in sepsis // Crit. Care Med. — 2002. — Vol. 30 (Suppl. 5). — P. S225-S228.
53. Jedynak M., Siemiatkowski A. The role of monocytes / macrophages and their cytokines in the development of immunosuppression after severe injury // Pol. Merkuriusz Lek. — 2002. — Vol. 13, № 75. — P. 238-41.
54. Kettritz R., Gaido M.L., Haller H. et al. Interleukin-8 delays spontaneous and tumor necrosis factor-alpha-mediated apoptosis of human neutrophils // Kidney-Int. — 1998. — Vol. 53, № 1. — P 84-91.
55. Levy M.M., Marshall J.C., Fink M.P. et al. 2001 SCCM / ESICM / ACCP / ATC / SIS International Sepsis Definitions Conference // Crit. Care Med. — 2003. — Vol. 31, № 4. — P. 1250-1256.
56. Lydon A., Martyn J.A. Apoptosis in critical illness // Int. Anaesthesiol. Clin. — 2003. — Vol. 41. — P. 5-77.
57. Mahidhara R., Billiar T.R. Apoptosis in sepsis // Crit. Care Med. — 2000. — Vol. 28 (Suppl. 4). — P. N105-N113.
58. Martins P.C., van den Berk N., Ulfman L.H. et al. Platelet-monocyte complexes support monocyte adhesion to endothelium by enhancing secondary tethering and cluster formation // Arterioscler. Throm. Vasc. Biol. — 2004. — Vol. 24. — P. 193-199.
59. Monneret G., Elmenkouri N., Bohe J. et al. Analytical requirements for measuring monocytic human lymphocyte antigen DR by flow cytometry: application to the monitoring of patients with septic shock // Clin. Chem. — 2002. — Vol. 48, № 9. — P. 1589-92.
60. Muller Kobold A.C., Tulleken J.E., Zijlstra J.G. et al. Leukocyte activation in sepsis: correlations with disease state and mortality // Intensive Care Med. — 2000. — Vol. 26, № 7. — P. 883-92.
61. Murray H.W. Interferon-gamma in infection and immunoparalysis // Intensive Care Med. — 1996. — Vol. 22 (Suppl. 4). — S455.
62. Oberholzer C., Oberholzer A., Clare-Salzer M., Moldawer L.L. Apoptosis in sepsis: new target for therapeutic exploration // FASEB J. — 2001. — Vol. 15. — P. 879-892.
63. Ono S., Aosasa S., Tsujimoto H. et al. Increased monocyte activation in elderly patients after surgical stress // Eur. Surg. Res. — 2001. — Vol. 33, № 1. — P. 33-8.
64. Payen D., Faivre V., Lukaszewicz A.C., Losser M.R. Assessment of immunological status in the critically ill // Minerva Anestesiol. — 2000. — Vol. 66, № 5. — P. 351-7.
65. Russwurm S., Vickers J., Meier-Hellmann A. et al. Platelet and leukocyte activation correlate with the severity of septic organ dysfunction // Shock. — 2002. — Vol. 17, № 4. — P. 263-8.
66. Saenz J.J., Izura J.J., Manrique A. et al. Early prognosis in severe sepsis via analyzing the monocyte immunophenotype // Intensive Care Med. — 2001. — Vol. 27, № 6. — P. 970-7.
67. Schafer A.I. Thrombocytosis // N. Engl. J. Med. — 2004. — Vol. 350. — P. 1211-9.
68. Schinkel C., Licht K., Zedler S. et al. Interferon-gamma modifies cytokine release in vitro by monocytes from surgical patients // J. Trauma. — 2001. — Vol. 50, № 2. — P. 321-7.
69. Schroeder S., Lindermann C., Decker D. et al. Increased susceptibility to apoptosis in circulating lymphocytes of critically ill patients // Langenbecks Arch. Surg. — 2001. — Vol. 386. — P. 42-46.
70. Sfeir T., Saha D.C., Astiz M., Rackow E.C. Role of interleukin-10 in monocyte hyporesponsiveness associated with septic shock // Crit. Care Med. — 2001. — Vol. 29, № 1. — P.129-33.
71. Wagner D.D., Burger P.C. Platelets in inflammation and thrombosis // Arterioscler. Thromb. Vasc. Biol. — 2003. — Vol 23. — P. 2131-2140.
