Газета «Новости медицины и фармации» Артериальная гипертензия (229) 2007 (тематический номер)
Вернуться к номеру
Вплив бета-адреноблокаторів (атенололу та небівололу) на інсулінорезистентність у пацієнтів з артеріальною гіпертензією та метаболічним синдромом
Авторы: Ю.М. Сіренко, Є.А. Павлюк, С.В. Савицький, О.Л. Рековець, Г.Д. Радченко, ННЦ «Інститут кардіології ім. М.Д. Стражеска» АМНУ, м. Київ
Версия для печати
Проблема інсулінорезистентності є дуже популярною темою багатьох сучасних наукових досліджень у кардіології [1, 3–8, 20, 23, 26–35, 37]. Доведено, що інсулінорезистентність лежить в основі станів, пов''язаних із виникненням цукрового діабету та прогресуванням атеросклерозу [7, 8, 10, 13, 20–22, 25, 28, 31, 33]. Виділено групу пацієнтів з ознаками так званого метаболічного синдрому, при якому часто визначається знижена чутливість тканин до інсуліну. Згідно з визначенням АТР ІІІ, до ознак метаболічного синдрому зараховують: зниження ліпопротеїдів високої щільності (у чоловіків менше 40 мг/дл, у жінок — менше 50 мг/дл), підвищення тригліцеридів 150 мг/дл та більше, рівень артеріального тиску (АТ) 130/85 мм рт.ст. і більше, наявність абдомінального ожиріння (окружність талії понад 88 см у жінок, 102 см у чоловіків), рівень глюкози сироватки крові більше 110 мг/дл [12, 19]. Про пацієнта, який має всі три з вищеназваних ознак, можна говорити, що у нього наявний метаболічний синдром (МС). При цьому, за даними епідеміологічних, ретроспективних та проспективних досліджень, за наявності МС ризик виникнення серцево-судинних ускладнень зростає в 2–4 рази. Цукровий діабет також виникає частіше в пацієнтів із МС, що пов''язують із прогресуванням інсулінорезистентності. Тому в останні роки з''явилося багато наукових робіт, присвячених вивченню проблеми прогресування інсулінорезистентності в пацієнтів із МС, зокрема робіт з вивчення впливу антигіпертензивних препаратів на чутливість тканин до інсуліну.
Вважається, що бета-адреноблокатори негативно впливають на вуглеводний та ліпідний обмін. Тому в багатьох лікарів існують певні перестороги щодо призначення препаратів даної групи. За даними одного з останніх метааналізів, частота виникнення цукрового діабету на фоні приймання різних антигіпертензивних препаратів найбільша в пацієнтів, які вживали бета-адреноблокатори та діуретики [11]. Проте існують супутні клінічні стани (ішемічна хвороба серця, резистентна артеріальна гіпертензія, аритмії та ін.), що потребують призначення бета-адреноблокаторів. З огляду на це актуальним є застосування бета-адреноблокаторів , що не мають негативного впливу на вуглеводний та ліпідний обмін, а особливо в пацієнтів з МС — пацієнтів із вже порушеним обміном ліпідів та вуглеводів, у яких дуже важливо не допустити прогресування інсулінорезистентності.
Дана робота присвячена оцінці факторів, що пов''язані як із самою інсулінорезистентністю, так і з її прогресуванням на фоні терапії, та вивченню впливу нового високоселективного бета-адреноблокатора небівололу на стан інсулінорезистентності в пацієнтів з МС та АГ порівняно з атенололом.
Матеріали та методи
У дослідження було включено 67 пацієнтів із м''якою та помірною АГ та ознаками МС, згідно з критеріями АТР ІІІ [12]. Усі пацієнти мали підвищений АТ в межах 140–179/90–109 мм рт.ст. та не мали цукрового діабету. Виключалися хворі з ішемічною хворобою серця, серцевою недостатністю ІІІ–ІV функціональних класів за класифікацією NYHA, виявленим при первинному дослідженні рівнем глюкози сироватки крові 7,0 ммоль/л та більше, декомпенсованими захворюваннями нирок, печінки, ендокринною патологією, психічними розладами, з загальноприйнятими протипоказаннями до призначення бета-адреноблокаторів.
Усім пацієнтам на початку дослідження та через шість місяців лікування проводили такі дослідження: вимірювання офісного АТ (на початку дослідження — після семиденної відміни попередньо призначеної терапії), вимірювання маси тіла та зросту, вимірювання окружностей талії та стегон, добове моніторування АТ (ДМАТ), біохімічний аналіз крові з визначенням ліпідного спектра, 2-годинний пероральний тест визначення толерантності до глюкози (ПГТТ). Окрім того, визначали спадковість за наявністю АГ або цукрового діабету в близьких родичів у молодому віці.
Офісне вимірювання систолічного (САТ) та діастолічного (ДАТ) АТ проводили на початку дослідження після семиденної (у разі необхідності) відміни усіх антигіпертензивних препаратів та через шість місяців перед прийманням наступної дози препарату. Вимірювали АТ у положенні сидячи тричі з інтервалом 1–2 хвилини за допомогою ртутного сфігмоманометру. Визначали середнє з трьох вимірів. Частоту серцевих скорочень (ЧСС) встановлювали після другого вимірювання.
Індекс маси тіла обчислювали за формулою:
ІМТ = маса тіла (кг) / ріст (м2).
Окружність талії вимірювали горизон тально на рівні пупка, а окружність стегон — на рівні найбільш виступаючої їх частини. Співвідношення «окружність талії/окружність стегон» понад 0,95 у чоловіків та 0,85 у жінок характеризувало наявність ожиріння за абдомінальним типом [4].
ДМАТ проводили за допомогою апарату «АВРМ-04» (Meditech, Угорщина) за стандартною методикою. При цьому вивчали наступні показники: середньодобовий (т), денний (д), нічний (н) та максимальний (max) САТ, середньодобовий, денний, нічний та максимальний ДАТ, ЧСС. При комп''ютерному аналізі ДМАТ для САТ і ДАТ розраховували часовий індекс (Час.Ін.), що характеризує часове перевантаження тиском протягом доби і визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. удень і 120/80 мм рт.ст. уночі. Також встановлювали індекс навантаження тиском (Ін.Пл.) та індекс варіабельності (Ст.від.). Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — відсоток зниження нічного АТ порівняно з денним. Моніторування про водили в наступному режимі: у денний час — кожні 15 хвилин, уночі (з 22.00 до 6.00 години) — кожні 30 хвилин. Хворі при проведенні ДМАТ вели звичайний спосіб життя, виконуючи побутові фізичні та психоемоційні навантаження.
2-годинний ПГТТ проводили за стандартною методикою на фоні трьох днів перебування хворого на звичайній дієті (вміст вуглеводів — 250–300 г, але не менше 150 г) та при звичайному фізичному навантаженні [9, 35]. Пробу проводили вранці після нічного голодування та 20–30 хв відпочинку. Під час проведення дослідження паління та нервові стреси виключалися. Кров брали внутрішньовенно до приймання 75 г глюкози, через годину та через дві години після приймання. Визначали рівень глюкози сироватки крові та рівень інсуліну. Рівень інсуліну встановлювали радіоімунним методом з використанням стандартних ІРМА-наборів (фірма IMMUNOTECH, Чехія). Про порушення толерантності до глюкози говорили при вияв ленні через дві години рівня глюкози понад 7,8, але менше 11,1 ммоль/ л. Якщо рівень глюкози перевищував 11,1 ммоль/ л, то пацієнту виставлявся діагноз цукрового діабету (якщо це було на початку дослідження, пацієнт виключався з подальшого спостереження). При рівні глюкози натще понад 6,1 ммоль/л, але менше 7,0 ммоль/л, а через дві години — менше 7,8 ммоль/л говорили про порушення толерантності до глюкози натще.
Інсулінорезистентність визначали після розрахунку індексу НОМА (гомеостатична модель оцінки інсулінорезистентності) за формулою [9]:
НОМА = глюкоза натще (ммоль/л) × інсулін натще (мкОД/мл) / 22,5.
При величині індексу НОМА 3 і більше вважали, що в пацієнта наявна інсулінорезистентність [28, 33, 37]. Про значне погіршання чутливості тканин до інсуліну говорили, коли НОМА-індекс на фоні лікування збільшувався і ставав 3 і більше. Якщо НОМА-індекс і на початку включення в дослідження і в кінці дослідження був менше 3, то вважалося, що інсулінорезистентність суттєво не змінилася. Якщо ж на початку включення в дослідження НОМА-індекс був 3 і більше, а в кінці дослідження менше 3, то говорили про значне зменшення інсулінорезистентності.
Залежно від лікування всі пацієнти були розподілені на дві групи: у першу групу увійшли 32 пацієнти, яким призначали атенолол у добовій дозі 50–100 мг, у другу групу — 35 пацієнтів, які отримували небіволол у дозі 5–10 мг. Якщо на першому місяці приймання не досягався цільовий рівень артеріального тиску, через місяць додавали гідрохлортіазид у добовій дозі 25 мг/добу. Період спостереження склав 6 місяців. Пацієнтам надавали рекомендації щодо зміни способу життя. На період спостереження не призначалися статини, препарати групи глітазонів та метформін, що могли б впливати на інсулінорезистентність.
Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel та Access. Середні показники обстежених пацієнтів визначали за допомогою пакета аналізу в системі Microsoft Excel. Усі інші статистичні розрахунки проводили за допомогою програми SPSS 13.0. Вірогідність різниці середніх показників між групами визначалася методом незалежного t-тесту для середніх та з використанням аналізу ANOVA з post-hoc тестом Tukey за допомогою програми SPSS 13.0. Вірогідність різниці між показниками на етапах лікування визначалася за допомогою парного двовідбіркового тесту. Також проводили кореляційний непараметричний аналіз та регресійний уні- та мультифакторні аналізи.
Результати
Характеристика пацієнтів залежно від призначеної на початку дослідження терапії подана в табл. 1. Як показано в табл. 1, групи вірогідно не відрізнялися за основними показниками на початку дослідження. За частотою призначення гідрохлортіазиду групи також вірогідно не відрізнялися — у групі атенололу 13 (40,6 %), у групі небівололу 17 (48,6 %).
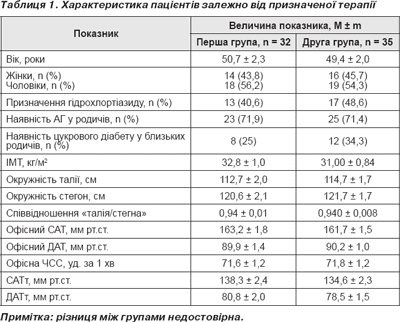
Під впливом лікування в кінці дослідження в обох групах спостерігалося вірогідне зниження офісного САТ/ДАТ та ЧСС — з 163,2 ± 1,8/89,9 ± 1,4 мм рт.ст. та 71,6 ± 1,2 уд. за хв до 123,0 ± 1,2/72,2 ± 1,1 мм рт.ст. (Р < 0,001/Р < 0,001) та 68,3 ± 1,9 уд. за хв (Р = 0,003) у групі атенололу; з 161,7 ± 1,5/90,2 ± 1,0 мм рт.ст. та 71,80 ± 1,23 уд. за хв до 124,3 ± 1,3/71,00 ± 0,98 мм рт.ст. (Р < 0,001/Р < 0,001) та 65,6 ± 1,2 уд. за хв (Р < 0,001). Цільового рівня офісного АТ було досягнуто у всіх пацієнтів, але цільового середньодобового АТ (менше 125/80 мм рт.ст.) було досягнуто в 71,9 % пацієнтів першої групи та 74,3 % пацієнтів другої групи (різниця між групами недостовірна). Ці дані зіставні з даними іншого дослідження, у якому було показано, що небіволол у добовій дозі 5 мг був таким же ефективним у зниженні АТ, як і атенолол у добовій дозі 50 мг. При цьому відсоток пацієнтів, які відповіли зниженням АТ на небіволол, був дуже високим — 96 % [2, 14–17].
Динаміка показників ДМАТ та ліпідного спектру подана в табл. 2. Як видно з табл. 2, в обох групах вірогідно знизилися майже всі показники ДМАТ за деяким виключенням — не змінився ДІ для САТ та ДАТ в обох групах, варіабельність нічного та денного ДАТ. Тобто антигіпертензивне лікування й атенололом, і небівололом було вірогідно ефективним. На фоні терапії в групі небівололу спостерігалося вірогідне зниження рівня загального холестерину (ХС) сироватки крові, тригліцеридів та ліпопротеїдів низької щільності (ЛПНЩ), тоді як у групі атенололу вірогідних змін показників ліпідного спектру не відбулося. Ці дані зіставні з даними деяких інших досліджень, у яких було показано, що небіволол або не змінює [17], або зменшує [16, 36] рівень загального ХС, ЛПНЩ, тригліцеридів. Вважається, що препарати, яким притаманні периферичні вазодилатуючі властивості, покращують кровообіг у мускулатурі та сприяють утилізації ХС та ЛПНЩ. Небіволол є саме бета-адреноблокатором, який, на відміну від атенололу, завдяки збільшенню вивільнення NO (вазодилатуючого агента), викликає розширення периферичних судин [24]. При цьому слід зазначити, що, не дивлячись на рекомендації щодо зміни способу життя, обстежені пацієнти за шість місяців практично жодної з наданих рекомендацій не виконували. Ні ІМТ і окружність талії, ні окружність стегон вірогідно не змінилися в жодній із груп.

На початку дослідження інсулінорезистентність (НОМА-індекс 3 і більше) відмічалася в 23 (34,3 %) пацієнтів: 11 (34,4 %) у першій групі та 12 (34,3 %) — у другій групі (різниця між групами недостовірна). Інсулінорезистентність та/або порушена толерантність до глюкози відзначалася в 30 (44,8 %) пацієнтів: 16 (50 %) у першій групі та 14 (40 %) у другій групі. Тобто за наявності МС у 44,8 % відзначалося порушення вуглеводного обміну. Наявність інсулінорезистентності частіше спостерігалася в пацієнтів з більшим ІМТ (r = 0,30, P = 0,014) та в пацієнтів з більш високим рівнем офісного ДАТ (r = 0,24, P = 0,046). При проведенні уніваріантного регресійного аналізу встановлено, що при величині ІМТ 30 кг/м2 та більше інсулінорезистентність виявляється в 2,7 раза частіше (Р = 0,018, СІ 1,12–6,20), ніж у пацієнтів з ІМТ менше 30 кг/м2. У пацієнтів з ДАТ 90 мм рт.ст. і більше в 2,83 раза частіше (Р = 0,054, СІ 0,94–8,50) виявляється інсулінорезистентність, ніж у пацієнтів з ДАТ менше 90 мм рт.ст. При проведенні мультиваріантного аналізу й ІМТ, і рівень ДАТ незалежно та достовірно були пов''язані з наявністю інсулінорезистентності в обстежених пацієнтів (β = 6,3, Р = 0,026, СІ 1,2–13,4 та β = 3,8, Р = 0,04, СІ 1,1–13,7 відповідно для ІМТ 30 кг/м2 і більше та ДАТ 90 мм рт.ст. і більше).
У цілому виявилося, що прогресування інсулінорезистентнсті відзначалося в 12 (17,9 %) пацієнтів (усі вони приймали атенолол). Покращання чутливості тканин до інсуліну спостерігалося в 10 (14,9 %) пацієнтів (усі приймали небіволол). За допомогою непараметричного кореляційного аналізу ми спробували виявити фактори, з якими було пов''язано погіршання інсулінорезистентності. Виявилося, що частіше погіршення ін сулінорезистенності на фоні лікування відбувалося в пацієнтів з більш високим рівнем офісного САТ (r = 0,32, P = 0,011), з більш низьким рівнем офісного ДАТ (r = –0,27, P = 0,033), з більш високим ПАТ (r = 0,42, P < 0,001), з гіршим контролем середньодобового САТ наприкінці дослідження (r = 0,23, P = 0,05). При мультиваріантному аналізі виявилося , що незалежним фактором, пов''язаним з погіршенням інсулінорезистентності, є офісний ПАТ. При рівні ПАТ 75 мм рт.ст. і більше погіршення чутливості тканин спостерігалося в 4,2 раза частіше, ніж при рівні ПАТ менше 75 мм рт.ст. (Р = 0,01, СІ 1,4–12,3). Тобто в пацієнтів із рівнем ПАТ понад 75 мм рт.ст. (частіше це пацієнти з ізольованою систолічною АГ) достовірність погіршення інсулінорезистентності більша, ніж у пацієнтів із меншим рівнем ПАТ, і тому саме їм не слід призначати препарати, що негативно впливають на обмін вуглеводів.
Слід зауважити, що в пацієнтів, у яких спостерігалося значне збільшення інсулінорезистентності, наприкінці дослідження відзначалися достовірно більші рівні тригліцеридів та ліпопротеїдів дуже низької щільності, ніж у пацієнтів, у яких значного погіршення не спостерігалося — 2,4 ± 0,4 проти 1,40 ± 0,09 ммоль/л (Р < 0,05) та 1,10 ± 0,21 проти 0,660 ± 0,004 (Р < 0,05). При цьому на початку дослідження вони не відрізнялися від інших хворих за даними показниками. Це може свідчити про те, що прогресування інсулінорезистентності супроводжується погіршенням ліпідного обміну. Існують теоретичні пояснення зв''язку між інсулінорезистентністю та змінами ліпідного спектру, згідно з якими дефект активності інсуліну, що розвивається внаслідок інсулінорезистентності, ви- кликає постпрандіальне (після приймання їжі) збільшення вмісту вільних жирних кислот у плазмі крові та підсилення зворотного надходження їх у печінку [13, 15, 28]. Як відомо, вільні жирні кислоти та тригліцериди є основними компонентами ліпопротеїдів дуже низької щільності [34]. Отже, виникає стан, за якого на фоні інсулінорезистентності, що супроводжується компенсаторною гіперінсулінемією, на печінку впливає підвищена концентрація інсуліну, що призводить до стимуляції секреції ліпопротеїдів дуже низької щільності. З іншого боку, інсулінорезистентність призводить до зниження активності ферменту ліпопротеїнліпази, що в свою чергу призводить до зниження кліренсу ЛПНЩ та тригліцеридів [34].
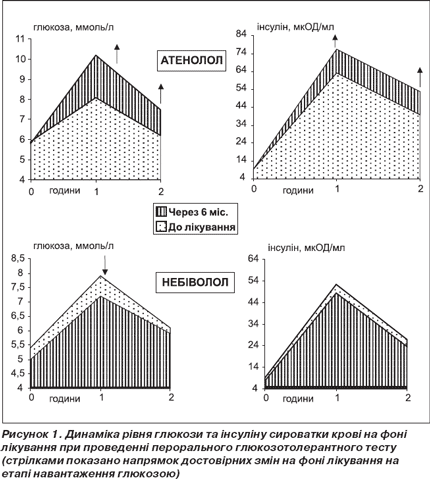
На рис. 1 наведено зміни рівня глюкози та інсуліну сироватки крові під впливом призначеної терапії при проведенні ПГТТ. Як видно з рис. 1, у групі пацієнтів, які отримували атенолол, спостерігалося достовірне збільшення рівня глюкози на етапі одна та дві години після навантаження. При цьому достовірно збільшувався також уміст інсуліну натще та через годину після приймання глюкози. Збільшення рівня інсуліну натще є ознакою прогресування інсулінорезистентності. Величина площі під кривою рівня глюкози на етапах ПГТТ достовірно не змінилася (13,90 ± 0,63 та 16,90 ± 1,76 ммоль/л · год відповідно до та на фоні лікування), а величина площі під кривою рівня інсуліну достовірно збільшилася (87,7 ± 14,7 та 111,1 ± 14,4 мкОД/мл · год, Р = 0,002). НОМА-індекс у групі атенололу збільшився вірогідно з 2,30 ± 0,26 до 4,31 ± 0,53 (Р < 0,001), що свідчить про збільшення інсулінорезистентності на фоні лікування атенололом. Відсоток пацієнтів, у яких була виявлена інсулінорезистентність (НОМА індекс 3 і більше), збільшився з 34,4 до 71,9 % (Р < 0,005) через шість місяців лікування.
Під впливом лікування небівололом спостерігалося достовірне зменшення рівня глюкози сироватки крові через годину після навантаження. Рівні глюкози натще та через дві години після навантаження зменшилися, але недостовірно. Не спостерігалося також достовірних змін рівня інсуліну при проведенні ПГТТ під впливом небівололу. Проте порівняно з групою атенололу у другій групі на етапі 6 місяців лікування всі показники були достовірно меншими (Р = 0,002; 0,037; 0,029; 0,001; 0,012; 0,041 відповідно для рівнів глюкози натще, на першій та другій годинах після навантаження та рівнів інсуліну на цих же етапах). Величини площі під кривими рівня глюкози та інсуліну достовірно не змінилися (відповідно 13,60 ± 0,45 ммоль/л · год та 70,4 ± 5,1 мкОД/мл · год до лікування та 12,5 ± 2,8 ммоль/л · год і 64,0 ± 6,5 мкОД/мл · год після лікування), але на фоні лікування стали достовірно меншими, ніж у групі атенололу (Р = 0,041 та 0,023 відповідно для кривих глюкози та інсуліну). НОМА-індекс у групі небівололу зменшився, але недостовірно (Р = 0,079). При цьому відсоток пацієнтів, у яких виявлялася інсулінорезистентність, зменшився з 34,3 до 2,9 % (P < 0,001), це свідчить про те, що, можливо, небіволол покращує чутливість тканин до інсуліну. Отримані нами дані узгоджуються з даними іншого дослідження, у якому також було показано, що небіволол суттєво не впливає на чутливість до інсуліну на відміну від гідрохлортіазиду [17].
Отже, порушення обміну вуглеводів (інсулінорезистентність, порушення толерантності до глюкози, підвищення глюкози натще) у пацієнтів з м''якою та помірною АГ та МС відзначалося в 44,8 % пацієнтів. Інсулінорезистентність у 2,7 раза частіше спостерігалася в пацієнтів з ІМТ 30 кг/м2 та в 2,83 раза частіше при рівні офісного ДАТ 90 мм рт.ст. і більше. Значне прогресування інсулінорезистентності на фоні антигіпертензивної терапії спостерігалося в 17,9 % пацієнтів. Всі вони приймали атенолол. При однаковому з небівололом антигіпертензивному ефекті терапія атенололом призводила до достовірного збільшення інсулінорезистентності (збільшувався НОМА-індекс, рівень інсуліну натще та на висоті навантаження глюкозою) в обстежених пацієнтів, тоді як терапія небівололом сприяла покращанню чутливості тканин до інсуліну (значно зменшувався відсоток пацієнтів з інсулінорезистентністю) та оптимізації ліпідного обміну (зменшувався рівень загального холестерину, тригліцеридів, ЛПНЩ та ліпопротеїдів дуже низької щільності). Найчастіше прогресування зменшення чутливості тканин до інсуліну відбувалося в пацієнтів із рівнем ПАТ 75 мм рт.ст. і більше. Тому не рекомендується призначати атенолол пацієнтам з МС та, особливо, з високим рівнем ПАТ.
Висновки
1. У 44,8 % обстежених нами пацієнтів з метаболічним синдромом та м''якою або помірною артеріальною гіпертензією відзначалося порушення обміну вуглеводів (інсулінорезистентність, порушення толерантності до глюкози, підвищення глюкози натще).
2. Інсулінорезистентність у 2,7 раза частіше спостерігалася в пацієнтів з ІМТ 30 кг/м2 та в 2,83 раза частіше при рівні офісного ДАТ 90 мм рт.ст. і більше.
3. Значне прогресування інсуліно резис тентності на фоні антигіпертензивної терапії спостерігалося в 17,9 % пацієнтів. Всі вони приймали атенолол. Незалежним фактором, що вірогідно пов''язаний зі значним прогресуванням інсулінорезистентності, був рівень офісного пульсового артеріального тиску — при його рівні 75 мм рт.ст. і більше в 4,2 раза частіше виникала інсулінорезистентність, ніж при рівні ПАТ менше 75 мм рт.ст. (Р = 0,01, СІ 1,4–12,3).
4. При однаковому з небівололом антигіпертензивному ефекті терапія атенололом призводила до достовірного збільшення інсулінорезистентності (збільшувався НОМА-індекс, рівень інсуліну натще та на висоті навантаження глюкозою) в обстежених пацієнтів, тоді як терапія небівололом сприяла покращанню чутливості тканин до інсуліну (значно зменшувався відсоток пацієнтів з інсулінорезистентністю) та оптимізації ліпідного обміну (зменшувався рівень загального холестерину, тригліцеридів, ліпопротеїдів низької щільності та ліпопротеїдів дуже низької щільності).
5. Бета-адреноблокатор небіволол на відміну від атенололу не погіршував, а, навпаки, дещо зменшував інсулінорезистентність, що робить його застосування безпечним у пацієнтів із метаболічним синдромом та м''якою та помірною артеріальною гіпертензією.
1. Талаева Т.В., Братусь В.В. Механизмы развития и роль инсулинорезистентности в кардиальной патологии; возможности фамакологической коррекции // Укр. кардіол. журнал. — 2006. — № 2. — С. 116-122.
2. Сиренко Ю.Н., Радченко А.Д. Небиволол — новый этап применения бета-адреноблокаторов при сердечно-сосудистых заболеваниях // Ліки України. — 1999. — № 9. — С. 20-25.
3. Сіренко Ю.М., Рековець О. Лікування артеріальної гіпертензії та метаболічних порушень: значення подвійного ефекту телмісартану для профілактики розвитку цукрового діабету // Ліки України. — 2005. — № 4. — С. 1-7.
4. 2007 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension // J. Hypertension. — 2007. — Vol. 25. — P. 1105-1187.
5. Bonora E., Targher G., Formentini G. et al. Metabolic Syndrome is an independent predictor of cardiovascular disease in Type 2 diabetic subjects. Prospective data from the Verona Diabetes Complications Study // Diabet Med. — 2004. — Vol. 21, № 1. — P. 52-58.
6. Citrome L. Metabolic Syndrome and Cardiovascular Disease // J. Psychopharmacol. — 2005 November 1. — Vol. 19, № 6 (Suppl.). — P. 84-93.
7. D''Agostino R.B., Jr, Hamman R.F., Karter A.J. et al. for the Insulin Resistance Atherosclerosis Study Investigators Cardiovascular Disease Risk Factors Predict the Development of Type 2 Diabetes // Diabetes Care. — 2004. — Vol. 27. — P. 2234-2240.
8. Depres J.P. The insulin-resistance-dyslipidemia syndrome: the most prevalent cause of coronary artery disease // Can. Med. Assoc. J. — 1993. — Vol. 148. — P. 1339-1341.
9. Ferrannini E., Mari A. How to measure insulin sensitivity // J. Hypertens. — 1998. — Vol. 16. — P. 895-906.
10. Fontbonne A., Charles M.A., Thibault N. et al. Hyperinsulinemia as a predictor of coronary heart disease mortality in a healthy population. The Paris Prospective Study, 15-year follow up // Diabetologia. — 1991. — Vol. 34. — P. 356-361.
11. Elliott W., Meyer P. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis // Lancet. — 2007. — Vol. 369. — P. 201-207.
12. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) // JAMA. — 2001. — Vol. 285. — P. 2486-2497.
13. Iglseder B., Cip P., Malaimare L., Ladurner G., Paulweber B. The Metabolic Syndrome Is a Stronger Risk Factor for Early Carotid Atherosclerosis in Women Than in Men // Stroke. — 2005. — Vol. 36, № 6. — P. 1212-1217.
14. Janssens W.J. Pharmacology of nebivolol // J. Pharm. Belg. — 1992. — Vol. 47. — P. 323-327.
15. Katsuki, Sumida Y., Urakawa H. Increased Visceral Fat and Serum Levels of Triglyceride Are Associated With Insulin Resistance in Japanese Metabolically Obese, Normal Weight Subjects With Normal Glucose Tolerance // Diabetes Care. — 2003. — Vol. 26. — P. 2341-2344.
16. Lacourciere Y., Lefebvre J., Poirier L. Treatment of ambulatory hypertensives with nebivolol or hydrochlorthiazide alone and in combination. A randomized, double-blind, placebo-controlled, factorial design trial // Am. J. Hypertens. — 1994. — Vol. 7. — P. 137-145.
17. Lacourciere Y., Arnott W. Placebo-controlled comparison of the effects of nebivolol and low-dose hydrochlorthiazide as monotherapies and in combination on blood pressure and lipid profile in hypertensive patients // J. Hum. Hypertens. — 1994. — Vol. 8. — P. 283-288.
18. Lenter C. Geigy Scientific Tables. — Basel: CIBA-GEIGY Corporation, 1990. — 278 p.
19. Lui J., Trevisan M., Menotti A. Syndrome X: prevalence in large population study // NMCD. — 1997. — Vol. 7. — P. 70-76.
20. Mancia G., Bombelli M., Corrao G. et al. Metabolic syndrome in the Pressioni Arteriose Monitorate E Loro Associazioni (PAMELA) study: daily life blood pressure, cardiac damage, and prognosis // Hypertens. — 2007. — Vol. 49. — P. 40-47.
21. McAuley K.A., Williams S.M., Mann J.I. et al. Diagnosing Insulin Resistance in the General Population // Diabetes Care. — 2001. — Vol. 24, № 3. — P. 460-464.
22. McNeill A.M., Rosamond W.D., Girman C.J. et al. The Metabolic Syndrome and 11-Year Risk of Incident Cardiovascular Disease in the Atherosclerosis Risk in Communities Study // Diabetes Care. — 2005. — Vol. 28, № 2. — P. 385-390.
23. Meigs J.B., Williams K., Sullivan L.M. et al. Using Metabolic Syndrome Traits for Efficient Detection of Impaired Glucose Tolerance // Diabetes Care. — 2004. — Vol. 27. — P. 1417-1426.
24. Nebivolol. The first highly selective b 1-blocker with NO (nitric oxide) modulating properties // Nebivolol monograph. — London: Churchill Communications Europe, 1996. — 63 р.
25. Palaniappan L., Carnethon M.R., Wang Y. et al. Predictors of the Incident Metabolic Syndrome in Adults // Diabetes Care. — 2004. — Vol. 27. — P. 788-793.
26. Pankow J.S., Jacobs D.R., Steinberger J., Moran A., Sinaiko A.R. Insulin resistance and cardiovascular disease risk factors in children of parents with the snsulin resistance (metabolic) syndrome // Diabetes Care. — 2004 — Vol. 27. — P. 775-780.
27. Reaven G.M. Role of insulin resistance in human disease (syndrome X): an expanded definition // Annu Rev. Med. — 1993. — Vol. 44. — P. 121-131.
28. Reilly M.P., Wolfe M.L., Rhodes T. et al. Measures of Insulin Resistance Add Incremental Value to the Clinical Diagnosis of Metabolic Syndrome in Association With Coronary Atherosclerosis // Circulation. — 2004 August 17. — Vol. 110, № 7. — P. 803-809.
29. Rett K. The relation between insulin resistance and cardiovascular complications of the insulin resistance syndrome // Diabetes Obese. Metab. — 1999. — 1 (Suppl. 1). — S8-S16.
30. Rutter M.K., Meigs J.B., Sullivan L.M., D''Agostino R.B. Sr., Wilson P.W. Insulin Resistance, the Metabolic Syndrome, and Incident Cardiovascular Events in the Framingham Offspring Study // Diabetes. — 2005. — Vol. 54, № 11. — P. 3252-3257.
31. Saely C.H., Aczel S., Marte T. et al. The Metabolic Syndrome, Insulin Resistance, and Cardiovascular Risk in Diabetic and Nondiabetic Patients // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90, № 10. — P. 5698-5703.
32. Scuteri A., Najjar S.S., Morrell C.H., Lakatta E.G. The Metabolic Syndrome in Older Individuals: Prevalence and Prediction of Cardiovascular Events: The Cardiovascular Health Study // Diabetes Care. — 2005. — Vol. 28, № 4. — P. 882-887.
33. Sharma A.M., Chetty V.T. Obesity, hypertension and insulin resistance // Acta Diabetologica. — 2005. — Vol. 42. — P. 3-8S.
34. Taskinen M.R. Diabetic dyslipidemia in NIDDM // Int. Diabetes. Monitor. — 1996. — Vol. 8. — P. 1-7.
35. Tschritter O., Fritsche A., Shirkavand F. et al. Assessing the shapeofthe glucose curveduringan oral glucosetolerancetest // Diabetes Care. — 2003. — Vol. 26. — P. 1395-1401.
36. Van Nueten L., Lacourciere Y., Vyssoulis G. et al. Nebivolol versus nifedipine in the treatment of essential hypertension: a double-blind randomized comparative trial // Am. J. Ther. — 1998. — Vol. 5. — P. 237-243.
37. Van Zwieten P.A., Mancia G. The metabolic syndrome — the therapeutic challenge. — Amsterdam: Van Zuiden Communications B.V., 2007. — 99 p.
