Газета «Новости медицины и фармации» 19 (436) 2012
Вернуться к номеру
Репродуктивное здоровье мужчин
Рубрики: Фтизиатрия
Разделы: Справочник специалиста
Версия для печати
 По определению ведущих научных работников мира, в системе ценностей, которые исповедует любая цивилизованная нация, особое место занимает здоровье людей. Трудно найти другой феномен, которому здоровье уступало бы своей ролью, глубинным внутренним значением и влиянием на различные сферы деятельности [2].
По определению ведущих научных работников мира, в системе ценностей, которые исповедует любая цивилизованная нация, особое место занимает здоровье людей. Трудно найти другой феномен, которому здоровье уступало бы своей ролью, глубинным внутренним значением и влиянием на различные сферы деятельности [2].
Демографический кризис охватил и Украину. Поэтому важное значение как для указанного приоритета, так и для сохранения здоровья нового поколения имеет состояние репродуктивного здоровья [2].
Конференция ООН по вопросам народонаселения и развития, которая состоялась в сентябре 1994 г. в Каире, определила: «Репродуктивное здоровье — это состояние полного физического, психологического и социального благополучия, а не просто отсутствие болезней или недомоганий по всем вопросам, которые относятся к репродуктивной системе, ее функциям и процессам. Репродуктивное здоровье предусматривает удовлетворенность и безопасность сексуальной жизни, возможность воспроизводства новых поколений» [2].
В рамках решений Саммита тысячелетия (Ассамблея тысячелетия ООН — 6–8.09.2000 г., НьюЙорк) Украина обязалась полностью выполнить цели развития тысячелетия (ЦРТ) и уменьшить до 2015 г. по сравнению с базовым 2001 г. на 17 % материнскую смертность и смертность детей в возрасте до 5 лет, а также снизить темпы распространения ВИЧ/СПИДа на 13 % и заболеваемость туберкулезом на 42 % [2].
Фундаментальным документом для сохранения репродуктивного здоровья стала Государственная программа «Репродуктивное здоровье нации на период до 2015 г.», утвержденная Постановлением Кабинета Министров Украины от 27.12.2006 г. № 1849 [2].
Бесплодие — это невозможность оплодотворения после 12 месяцев половой жизни без использования контрацепции [2].
Относительно мужского бесплодия существуют различные точки зрения, но оно является причиной бесплодия от 40 до 60 % супружеских пар [2].
Решающее значение имеет своевременное обследование эякулята мужчины!
Туберкулезом могут поражаться все органы и системы человеческого организма, кроме придатков кожи — волос и ногтей. Поэтому довольно часто туберкулезом поражаются половые органы мужчин.
Урогенитальный туберкулез выявляется у 12 % из впервые выявленных больных туберкулезом легких независимо от экономического развития страны [6].
Сведений о влиянии туберкулезной инфекции на эндокринную, генеративную (репродуктивную) и копулятивную функции мужских половых органов в отечественной литературе крайне недостаточно. В достаточной степени функция этих органов представлена в монографиях «Заболевания предстательной железы» под редакцией А.В. Люлько (1984), «Хронический простатит» В.Н. Ткачука и соавт. (1989), «Болезни мужских половых органов» И.Ф. Юнды (1981, 1989) при неспецифических воспалительных заболеваниях половых органов.
Отрицательное воздействие туберкулезной инфекции испытывают не только яички, их придатки, предстательная железа, семенные пузырьки, семявыносящие и семявыбрасывающие протоки, но и надпочечники, оно проявляется нарушением их функциональной способности. Яички и надпочечники играют важную роль в регуляции половой функции у мужчин за счет образования этими органами жизненно важных гормонов. Функциональное состояние яичек предварительно определяют субъективно на основании патологических изменений, выявленных при осмотре органов мошонки, предстательной железы и семенных пузырьков. Более точную характеристику функции этих органов устанавливают после определения нейтральных и индивидуальных 17кетостероидов.
При обследовании 50 больных мочеполовым туберкулезом с преимущественным поражением наружных и внутренних половых органов выявлены значительные сдвиги в гормональном статусе, указывающие на снижение функциональной способности надпочечников и андрогенной функции яичек [7]. По данным исследований, наблюдались наиболее выраженные сдвиги не общих нейтральных 17кетостероидов, а отдельных их фракций (андростерона и этихоланола), которые в основном вырабатываются в семенниках клетками Лейдига. Указанные изменения связаны с отрицательным воздействием на функциональное состояние надпочечников и семенников туберкулезной интоксикации. После эффективно проведенной химиотерапии противотуберкулезными препаратами и снятия явлений туберкулезной интоксикации у части больных отмечается улучшение копулятивной функции [7].
Расстройства половой функции Т. Тakynada, Н. Кondо (1973) наблюдали у 35 % больных половым туберкулезом, 8 % страдали импотенцией, у 27,6 % отсутствовала эякуляция [4]. Наиболее выраженные расстройства отмечались при сочетанном поражении туберкулезным процессом 2 органов (придатка яичка и предстательной железы). Даже при поражении патологическим процессом только одного придатка яичка в 50,9–69 % случаев отмечалась утрата генеративной функции.
На сегодняшний день нет необходимости говорить об отрицательном воздействии нарушения кровообращения в яичке на его генеративную функцию. В значительно большей степени выражено нарушение кровоснабжения яичка при остром течении патологического процесса и в меньшей степени — при вялом начале и хроническом течении туберкулеза. В последних случаях развиваются элементы коллатерального кровоснабжения, препятствующие быстрому развитию атрофии яичка. В клинической практике чаще наблюдаются случаи атрофии яичка у лиц с преимущественно бурным началом воспалительного процесса, когда придаток яичка и яичко представляют собой единый конгломерат плотной консистенции. При этом имеются выраженные нарушения кровоснабжения в яичке. Развитие дополнительного коллатерального кровообращения не успевает за бурно прогрессирующим патологическим процессом. Результатом острого и хронического нарушения кровоснабжения органов мошонки являются изменения секреторной и инкреторной функции яичек разной степени выраженности.
Так, Th. Burghele, I. Аlbesko (1966), проводя гистологическое исследование препаратов яичка при туберкулезном поражении его придатка, выявляли чередование здоровых извитых семенных канальцев с гиалинизированными тубулами, отек интерстициальной ткани и ее склероз [4]. Следствием этих изменений явились дегенерация зародышевого эпителия с неполным сперматогенезом, гипоплазия лейдиговских клеток и выраженный пикноз элементов клеточного роста (сперматид и сперматозоонов). Аналогичные изменения сперматогенеза наблюдаются и на стороне не пораженного туберкулезом яичка. Эти изменения наступают в результате туберкулезной интоксикации организма и, как правило, носят обратимый характер, в противоположность необратимым изменениям на стороне поражения.
На состоянии сперматогенеза у больных туберкулезом половых органов мы не останавливаемся, так как эти сведения детально изложены в монографиях И.М. Порудоминского «Бесплодие у мужчин» (1964), С.А. Кана «Патология сперматогенеза» (1969) и «Стерильность у мужчин» (1974), Н. Николова и Бр. Папазова «Бесплодие в семье» (1971), «Физиология и патофизиология воспроизводства человека» (под редакцией И. ТеодорескуЭксарку, 1981) и в других изданиях. По этому поводу мы лишь отметим, что нарушение сперматогенеза как при специфических, так и при неспецифических заболеваниях половых органов идентично и имеет общие закономерности развития.
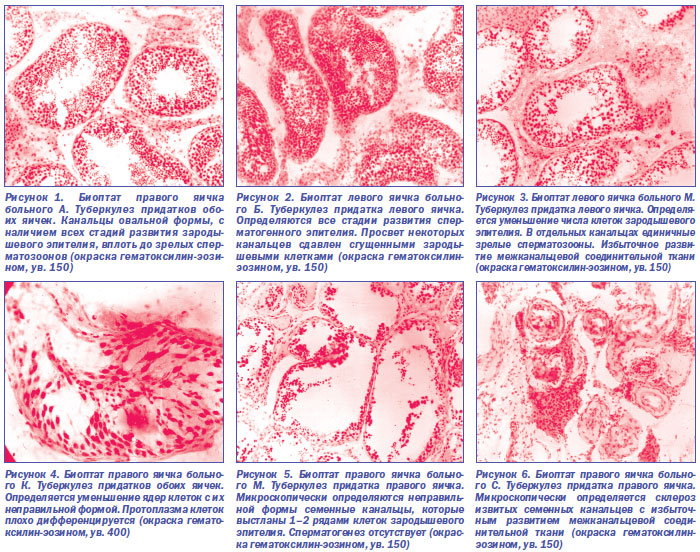
При гистологическом исследовании удаленных яичек по поводу туберкулеза у пациентов в возрасте от 20 до 40 лет выявляется полиморфизм морфологических изменений, характеризующих в той или иной степени нарушение сперматогенеза. В семенных канальцах имеют место все стадии развития сперматогенного эпителия, которые находятся в зависимости от выраженности в них дистрофических и склеротических изменений. В ходе проведенных ранее исследований сотрудником Института урологии и нефрологии АМН Украины д.м.н. В.С. Сакало на базе нашего отделения выявлены нарушения сперматогенеза у 90 % больных туберкулезом придатка яичка [8].
Они возникали не сразу, а в разное время с момента начала заболевания. Расстройства сперматогенеза чаще были более выражены при локализации туберкулезного процесса в головном отделе придатка яичка или при его тотальном поражении. При локализации туберкулезного процесса в хвостовом отделе придатка яичка длительное время сохранялся нормальный сперматогенез. В таких случаях даже при многолетней давности туберкулезного процесса в придатке яичка сперматогенез был без изменений. Его морфологические проявления (в кусочках биоптатов) либо были без отклонений, либо имели место дезорганизация и скопление зародышевых клеток в просвете канальцев. Структура же их была обычной, и прослеживались клетки на всех стадиях развития сперматогенного эпителия.
В других случаях при распространении специфического процесса на тело и хвост придатка яичка отмечались более глубокие нарушения сперматогенеза. Они выражались в уменьшении числа клеток зародышевого эпителия и остановке развития сперматогенных клеток в большинстве извитых семенных канальцев. Отмечались явления дистрофии зародышевых клеток, умеренное утолщение собственной оболочки стенки канальцев и отек стромы яичка.
Описанные изменения в яичке, придаток которого поражен туберкулезом, были выражены тем резче, чем больше туберкулезное воспаление распространялось на тело и головку придатка. Тотальное вовлечение придатка яичка в специфический процесс даже при короткой продолжительности болезни (не более двух месяцев) почти во всех случаях приводит к значительному уменьшению количества зародышевых клеток, вплоть до их полного исчезновения (рис. 1–6).
Состояние эякулята у больных туберкулезом половых органов
Одним из важных показателей репродуктивной функции половых органов при туберкулезе является качественный и количественный состав эякулята.
Объем эякулята
У больных туберкулезом половых органов объем эякулята колебался от 1 капли до 3,5 мл. В среднем он составлял 1,35 ± 0,16 мл, то есть был значительно снижен. У здорового мужчины количество эякулята в норме составляет от 2 до 10 мл.
На генитограммах, выполненных этим больным, в 82,6 % случаев определялись признаки поражения семенных пузырьков и семенных путей. Наименьший объем семенной жидкости наблюдается у пациентов с резко выраженными изменениями в семенных пузырьках, со значительной деформацией их просветов, отсутствием контрастирования семявыбрасывающих протоков, сужением или обтурацией семявыносящих протоков.
У больных с посттуберкулезным склерозом предстательной железы объем эякулята еще более снижен (от 1 капли до 1,5 мл), в среднем 1,10 ± 0,29 мл.
В случаях хронического неспецифического простатита, который выявляется у ряда больных половым туберкулезом, количество семенной жидкости несколько выше — от 1 до 4,0 мл, в среднем 2,10 ± 0,22 мл.
На основании полученных данных можно считать снижение объема эякулята характерным для туберкулеза половых органов. В процессе консервативного лечения антимикобактериальными препаратами количество эякулята в незначительной степени медленно возрастает, однако никогда не восстанавливается до количественных показателей, определяемых до заболевания. Особенно наглядно это прослеживается у больных при сочетанном поражении туберкулезом семенных пузырьков и предстательной железы или органов мошонки и предстательной железы.
Уменьшение количества экскретов у лиц с излеченным туберкулезом предстательной железы объясняется неполноценностью процессов заживления очагов туберкулеза, когда они замещаются рубцовой тканью. Фибропластические процессы во внутритазовых половых органах ведут к снижению их функциональной способности, одним из проявлений которого является уменьшение объема эякулята. Функциональной недостаточностью органа следует объяснять также имеющееся, хотя и менее выраженное уменьшение количества эякулята у больных неспецифическим простатитом в сочетании с туберкулезом мочевыделительных органов.
Цвет эякулята
Изменение цвета эякулята наблюдалось у 25,3 % больных. У 5 % из них макрогемоспермия явилась причиной приобретения эякулятом краснокоричневой окраски. Во всех случаях примеси крови в семенной жидкости на генитограммах констатировали наличие везикулита туберкулезной этиологии. Микрогемоспермия обнаружена у 10 % пациентов. На генитограммах этих больных также выявлены изменения, однако четкая зависимость между степенью выраженности рентгенологических признаков везикулита и гемоспермии не установлена. Гемоспермия наблюдалась, как правило, только у впервые выявленных больных.
В 20,2 % наблюдений эякулят имел желтоватозеленоватую окраску, вызванную значительной примесью гноя. В других случаях примесь лейкоцитов не изменяла цвета экскрета, так как не достигала столь высокой степени. Изменение цвета эякулята, вызванное пиоспермией, также констатировано только у впервые выявленных больных, причем у всех имелось туберкулезное поражение предстательной железы. Частота пиоспермии среди различных групп была следующей: при туберкулезе предстательной железы — у 86,8 % больных, посттуберкулезном склерозе предстательной железы — у 68,7 %, неспецифическом простатите в сочетании с туберкулезом мочевыделительных органов — у 30 %. 18 больным с пиоспермией произведена генитография. В 70,2 % наблюдений рентгенологически определялись изменения в семенных пузырьках (везикулит), в остальных наблюдениях рентгенологическая картина на генитограммах трактовалась как нормальная. В заключение следует отметить, что все случаи макро и микрогемоспермии у обследованных нами больных сочетались с пиоспермией различной степени выраженности.
Таким образом, изменение цвета семенной жидкости зависит от примеси крови или гноя. Степень гемоспермии не зависит от выраженности рентгенологических признаков везикулита и его этиологии. Пиоспермия является довольно характерной для больных урогенитальным туберкулезом в активной стадии как при специфическом, так и при неспецифическом поражении предстательной железы. Ее частота достоверно уменьшается у больных с посттуберкулезным склерозом предстательной железы.
Запах
Эякулят со зловонным запахом наблюдался лишь у одного пациента с туберкулезом предстательной железы с выраженной пиоспермией. При бактериологическом исследовании обнаружена кишечная палочка.
Концентрация водородных ионов
В норме pH эякулята колеблется от 7,2 до 7,6. Определение pH эякулята произведено 56 пациентам. При туберкулезе предстательной железы среднее его значение равнялось 7,9 ± 0,13, при посттуберкулезном склерозе предстательной железы — 7,4 ± 3,1, при хроническом неспецифическом простатите у фтизиоурологических больных — 7,9 ± 0,18. Из представленных данных следует, что у больных урологическим туберкулезом в активной форме имеется тенденция к некоторому повышению концентрации водородных ионов, при излечении туберкулезного процесса в предстательной железе она находится в пределах нормы.
Количество спермиев в 1 мл
У обследованных нами больных сперматозооны в эякуляте обнаружены в 59,5 % случаев, у остальных 40,5 % пациентов эякулят их не содержал. У 46,8 % больных отсутствие спермиев объяснялось обструкцией семенных путей, еще у 28,1 % — рубцовыми изменениями придатка яичка и у 25,0 % — нарушениями сперматогенеза.
Частота нарушений количества сперматозоонов у различных групп больных генитальным туберкулезом, по данным В.С. Сакало (1971), была следующей: при одностороннем туберкулезе придатка яичка олигозооспермия (менее 60 млн сперматозоонов в 1 мл) наблюдалась у 63,3 %, аспермия — у 18,8 %, при двустороннем эпидидимите — соответственно у 5,1 и 94,2 %, при туберкулезном простатовезикулите — у 39,5 и 2,5 % больных [7].
У больных туберкулезом предстательной железы, у которых в эякуляте имелись сперматозооны (26 пациентов), их количество в большинстве случаев было нормальным, хотя колебания величин содержания спермиев в 1 мл были довольно значительными (от 25 до 200 млн/мл), в среднем количество сперматозоонов равнялось 84,46 ± 15,73 млн/мл. При посттуберкулезном склерозе предстательной железы (7 пациентов) содержание спермиев колебалось от 10 до 200 млн/мл, средняя величина достигала 105,7 ± 20,1 млн/мл. Неспецифический простатит у больных туберкулезом мочевыделительных органов (14 больных) также характеризовался достаточным числом сперматозоонов в 1 мл при колебаниях от 25 до 125 млн/мл и среднем значении 88,0 ± 8,9 млн/мл.
Следовательно, среди больных мочеполовым туберкулезом в большом числе cлучаев имеется азооспермия, которая чаще всего связана с туберкулезными или метатуберкулезными изменениями в органах мошонки и семенных путях. В то же время количество сперматозоонов в случае их наличия в эякуляте практически не изменяется и не зависит от специфического или неспецифического поражения предстательной железы.
Подвижность cперматозоонов
Среди обследованных больных подвижные спермии выявлены у 40 %, что составило 65,96 % по отношению к больным с имеющимися в эякуляте сперматозоонами.
При туберкулезе внутритазовых половых органов подвижные спермии имелись у 53,8 % больных, процент подвижности колебался от 20 до 100 %, причем стопроцентную подвижность мы наблюдали лишь в одном случае. Во всех остальных она была снижена и составляла в среднем 46,0 ± 5,3 %. При посттуберкулезном склерозе предстательной железы их подвижность колебалась от 10 до 70 % и в среднем составляла 45 ± 10 %. У больных неспецифическим простатитом показатели количества подвижных спермиев были более высокими. В среднем процент подвижности достигал 85,4 ± 8,2 % при индивидуальных колебаниях его значений от 50 до 100 %. Как уже указывалось, среди этих больных у 3 сперматозооны были неподвижными. Характерно, что в этих случаях туберкулезный процесс в почках был более распространенным, у 2 таких больных имелось обширное поражение легких с резко выраженными симптомами интоксикации.
Таким образом, согласно нашим данным, у больных с поражением половых органов туберкулезом процентное содержание подвижных спермиев снижено и после его излечения не возрастает. У большинства больных туберкулезом мочеполовых органов с явлениями неспецифического простатита процент подвижности находится в пределах нормы, у части из них имеется снижение данного показателя, что, повидимому, связано с общей туберкулезной интоксикацией.
Такой показатель спермограммы, как подвижность сперматозоонов, зависит от многих факторов, в частности от содержания фруктозы в семенной плазме. Количество фруктозы в эякуляте определялось у 57 больных, в число которых вошли 33 пациента с туберкулезом предстательной железы и 15 больных с неспецифическим простатитом. При поражении железы специфическим процессом содержание фруктозы колебалось от 0 до 18,9 ммоль/л, составляя в среднем 8,6 ± 0,9 ммоль/л, при посттуберкулезном склерозе железы — от 0 до 12,8 ммоль/л, среднее содержание — 9,2 ± 1,4 ммоль/л, при неспецифическом простатите — от 3,3 до 25,9 ммоль/л, в среднем 13,4 ± 2,0 ммоль/л. На основании этих данных можно заключить, что имеется некоторое снижение количества фруктозы у больных туберкулезом внутритазовых половых органов. Нижняя граница нормы уровня фруктозы в эякуляте составляет от 13,3 до 14,9 ммоль/л. Однако не всегда наблюдается четкая зависимость процентного содержания подвижных спермиев от количества фруктозы. У 5 больных туберкулезом предстательной железы при содержании фруктозы свыше 13,3 ммоль/л и количестве сперматозоонов свыше 50 млн/мл наблюдалась их полная неподвижность. Противоположная ситуация тоже имела место в одном случае, когда у больного с содержанием фруктозы 4,4 ммоль/л количество подвижных спермиев достигало 70 %. У всех больных наблюдалась выраженная прямая связь между содержанием фруктозы в эякуляте и степенью деструкции семенных пузырьков. Поэтому тот факт, что у больных посттуберкулезным склерозом предстательной железы имеется снижение содержания фруктозы, говорит об угнетении функции органа в процессе лечения антимикобактериальными препаратами, так как содержание фруктозы в эякуляте в первую очередь зависит от функциональной активности железистого эпителия семенных пузырьков. У клинически излеченных больных между рентгенологическими изменениями и количеством фруктозы четкой зависимости не прослеживается. Этот факт свидетельствует в пользу определения количества фруктозы как более чувствительного теста для установления функциональных возможностей семенных пузырьков по сравнению с генитографией. После окончания курса лечения антимикобактериальными препаратами уровень фруктозы в эякуляте повышается при туберкулезе органов мошонки и предстательной железы, в меньшей степени — при поражении везикул.
Используя формулу Фарриса, мы вычислили коэффициент плодовитости у обследованных больных (норма 200). Среди пациентов, страдавших туберкулезом предстательной железы, у 63,2 % этот показатель был равен 0, у 16,6 % среднее его значение равнялось 66,64 ± ± 13,04 и у одного больного достигало 240. У больных посттуберкулезным склерозом предстательной железы нулевое значение коэффициента плодовитости получено в 40,0 % случаев. У остальных он составил в среднем 40,9 ± 11,2. При хроническом неспецифическом простатите у больных туберкулезом почек оплодотворяющая способность эякулята несколько выше. Так, величина коэффициента плодовитости, равная 0, получена у 31,2 % пациентов, у 62,5 % его среднее значение достигало 114,7 ± ± 12,5 и в 6,2 % случаев — 230.
Таким образом, можно заключить, что фертильность наших пациентов снижена. Лишь у 3,1 % из 64 обследованных коэффициент плодовитости превышал нормальную величину.
При вычислении коэффициента плодовитости Фарриса учитываются три фактора — объем эякулята, количество сперматозоонов в 1 мл, процент подвижности. В связи с этим представляет интерес выяснить наиболее вероятные сочетания указанных факторов, определяющие снижение оплодотворяющей способности. С этой целью мы в каждом отдельном случае проанализировали, уменьшение величин каких показателей привело к снижению коэффициента Фарриса.
Так, при туберкулезе предстательной железы и ее посттуберкулезном склерозе нарушение оплодотворяющей способности эякулята чаще всего зависит от его недостаточного объема и низкого процентного содержания подвижных спермиев. При неспецифическом простатите у больных урогенитальным туберкулезом определяющим фактором в генезе снижения плодовитости является недостаточный процент подвижности.
Однако лимфотропная специфическая химиотерапия позволяет ликвидировать туберкулезный процесс в половых органах мужчины и дает возможность более совершенной репарации. Также включение в комплекс терапии туберкулеза предстательной железы и семенных пузырьков прямой трансуретральной электростимуляции позволило нормализовать качество их секретов [4].
Нами отмечено, помимо нормализации копулятивной функции, восстановление фертильности у больных с аспермией. Из 38 мужчин с аспермией в возрасте от 21 года до 33 лет у 35 (92,1 %) имел место двусторонний туберкулезный эпидидимит, а у 3 (7,9 %) — туберкулез придатка единственного яичка. У всех пациентов туберкулезом были поражены предстательная железа и семенные пузырьки. После проведенного комплексного лечения с применением лимфотропной химиотерапии и трансуретральной электростимуляции специфический патологический процесс в придатках яичек, предстательной железе и семенных пузырьках был ликвидирован, что способствовало появлению сперматозоонов в эякуляте, от 28 до 50 млн/мл, непосредственно после лечения. Через год у 33 (86,8 %) мужчин олигозооспермия исчезла, а индекс плодовитости нормализовался у 28 (73,7 %). При изучении отдаленных результатов лечения у всех 28 больных отмечена стойкая нормализация эякулята с индексом плодовитости в пределах нормы. У 15 из них в браке родились дети.
Следовательно, включение в комплекс лечения мужчин, больных туберкулезом половых органов, лимфотропной химиотерапии и прямой трансуретральной электростимуляции позволяет нормализовать копулятивную функцию и дает возможность восстановления фертильности у молодых пациентов [3–5, 8].
Также следует отметить, что в последнее время в силу изменчивости микобактерий туберкулеза (МБТ) в 90 % случаев у пациентов имеет место микст: помимо МБТ выявляется неспецифическая флора и инфекции TORCHкомплекса, которые в значительной мере влияют на репродуктивное здоровье мужчин.
Инфекции, передающиеся половым путем (ИППП)
Хламидия, уреаплазма, микоплазма, гарднерелла — эти микроорганизмы сами по себе влияют на фертильность, вызывая непроходимость семявыносящих протоков и маточных труб, потерю беременности, оказывают существенное влияние на перинатальную смертность [1].
Эти ИППП могут вызывать атрофию яичек, эпидидимит, орхит. Они способны выступать как триггер образования антиспермальных антител и сопутствующее иммунное бесплодие. Более того, эти инфекции могут вызвать уменьшение количества сперматозоидов, параметров их подвижности, вязкости семенной жидкости [1].
Поэтому проведение ранней диагностики этих инфекций, в том числе с помощью полимеразной цепной реакции (ПЦР) определения ДНК и иммуноферментного анализа (ИФА) определения антител (АТ) Ig A, M, G, и своевременной терапии может предотвратить развитие осложнений [1, 5].
Также следует уделить особое внимание выявлению генитального герпеса. Он вызывается вирусом простого герпеса 1го и 2го типов, который нарушает сперматогенез и дифференциацию сперматозоидов, уменьшая концентрацию сперматозоидов и увеличивая количество с микроголовками и цитоплазматической каплей в шейке, а также влияет на внутриутробное развитие плода. А у мужчины, инфицированного цитомегаловирусом (ЦМВ), урогенитальный тракт является главным резервуаром этого возбудителя. Хроническая ЦМВинфекция способствует изменению уровня цитокинов семенной жидкости, что влияет на формирование партнерспецифической мукозальной толерантности. А это открывает новое направление исследований взаимодействия между женщиной и ее партнером [1].
Поэтому своевременное и адекватное обследование мужчин на вышеуказанные инфекции, их раннее выявление и комплексное своевременное и адекватное лечение позволяют эффективно влиять на фертильность мужчин.
Резюмируя все вышесказанное, можно сделать следующие выводы:
1) у больных урогенитальным туберкулезом имеются незначительно выраженные половые расстройства, которые в большинстве случаев не препятствуют больным совершать половые акты;
2) у больных туберкулезом мочевыделительных органов при отсутствии или излечении туберкулезного поражения половых органов имеются определенные патологические сдвиги в сперматограмме, это прежде всего снижение объема эякулята и содержания подвижных сперматозоонов;
3) плодовитость этих больных снижена, что при относительно молодом возрасте пациентов обусловливает социальный аспект проблемы;
4) клиническое исследование эякулята малопригодно для дифференциальной диагностики специфических и неспецифических заболеваний половых органов, так как аналогичные сдвиги спермограммы встречаются при других патологических состояниях данного органа;
5) изменения эякулята, наблюдающиеся при активном туберкулезе половых органов, в основном остаются характерными и для пациентов с клинически излеченным процессом;
6) включение в комплекс лечения мужчин, больных туберкулезом половых органов, лимфотропной химиотерапии и прямой трансуретральной электростимуляции позволяет нормализовать копулятивную функцию и дает возможность восстановления фертильности у молодых пациентов;
7) своевременное и адекватное обследование мужчин на инфекции, передающиеся половым путем, генитальный герпес, цитомегаловирус, их раннее выявление и комплексное своевременное и адекватное лечение позволяют эффективно влиять на фертильность мужчин.
1. Гаврилюк А.М., Чопяк В.В., Наконечный А.И., Курпиш М. Мужской фактор в патогенезе женского бесплодия // Медицинские аспекты здоровья мужчины. — 2012. — №1 (3). — С. 4248.
2. Гойда Н.Г., Бисярин О.Ю. Нормативноправовое регулирование деятельности службы планирования семьи и сохранения репродуктивного здоровья // Український медичний часопис. — 2012. — № 4 (90). — С. 2025.
3. Камышан И.С., Степанов П.И. Роль лимфотропной химиотерапии в восстановлении фертильности у мужчин при туберкулезе половых органов // Матлы IV Всесоюз. съезда урологов. — М., 1990. — С. 476.
4. Камышан И.С., Федун З.В., Степанов П.И. Туберкулез половых органов мужчин и женщин. — Донецк: Экспресс, 2002. — 287 с.
5. Камышан И.С., Степанов П.И., Зяблицев С.В. и др. Роль полимеразной цепной реакции в диагностике туберкулеза мочевых и мужских половых органов // Урология. — 2003. — № 3. — С. 3639.
6. Кульчавеня Е.В. Туберкулез мочеполовой системы // Матлы ХI съезда урологов России. — 2007. — С. 655675.
7. Сакало В.С. Морфологические изменения в яичках при туберкулезном эпидидимите // Урол. и нефрология. — 1971. — № 3. — С. 4043.
8. Сакало В.С. Восстановление фертильности после лечения туберкулеза половых органов у мужчин // Урология. — Киев, 1991. — Вып. 25. — С. 119122.
9. Степанов П.И. Восстановление фертильности после консервативного лечения туберкулезного эпидидимита // Клинич. хирургия. — 1989. — № 12. — С. 4950.