Газета «Новости медицины и фармации» 6 (450) 2013
Вернуться к номеру
Цитопротекторные и гемодинамические эффекты Милдроната GX у больных ИБС на фоне полиморбидности
Авторы: Кочуев Г.И., доцент, Кочуева М.Н., профессор, Корж А.Н., профессор, Краснокутский С.В., доцент,
Шалимова А.С., ассистент, Харьковская медицинская академия последипломного образования
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Ишемическая болезнь сердца (ИБС) в сочетании с гипертонической болезнью (ГБ) в настоящее время является одной из основных причин инвалидизации и смертности населения в экономически развитых странах. ИБС, ГБ и хроническая сердечная недостаточность (ХСН), нередко сопутствуя сахарному диабету 2го типа (СД2), становятся непосредственной причиной смерти больных СД2 более чем в половине случаев [1].
ИБС, ГБ, СД2 и ХСН имеют теснейшие патогенетические взаимосвязи. Для этих заболеваний характерны формирование эндотелиальной дисфункции с преобладанием вазоконстрикторных и протромботических реакций, развитие нарушений микроциркуляции, ишемии органов и тканей, метаболических расстройств, активация пролиферативных процессов [2, 3]. При дефиците кровотока метаболические нарушения предшествуют клиническим проявлениям ишемии и становятся инициирующим звеном в цепи ишемического каскада [4].
Традиционно принято считать, что клиническим эквивалентом ишемии миокарда является приступ стенокардии. Однако до развития клинически манифестных форм гипоксии в миокарде происходят метаболические сдвиги, не проявляющиеся болевым синдромом. Подобные нарушения метаболизма происходят при ХСН и СД2, причем ишемические расстройства имеют место не только в миокарде, а практически во всех органах и тканях, включая мышечную. При ХСН этот факт документирует наличие мышечной слабости, развитие атрофии поперечнополосатых мышц и нормохромной нормоцитарной анемии (синдром malabsorption).
Таким образом, можно считать, что при сочетании ИБС, ГБ, СД2 и ХСН имеется тотальная дисметаболическая ситуация, требующая фармакологической коррекции.
Существует множество патогенетических предпосылок для использования в комплексной терапии больных с ассоциацией ИБС, ГБ, СД2 и ХСН препаратов, корректирующих нарушения внутриклеточного метаболизма, в частности парциальных ингибиторов жирных кислот (рFOX ингибиторов), одним из которых являетcя инновационная форма мельдония — мельдония фосфат (Милдронат GX производства АО «Гриндекс», Латвия).
Целью настоящего исследования явилось изучение влияния 16недельной терапии Милдронатом GX на толерантность к физической нагрузке, болевую и безболевую ишемию миокарда (БИМ), частоту нарушений сердечного ритма, показатели систолической и диастолической функций левого желудочка (ЛЖ) сердца, степень эндотелийзависимой вазодилатации плечевых артерий (ЭЗВД), липидный спектр крови и инсулинорезистентность у больных ИБС и ГБ с ХСН в сочетании с СД2.
Клиническая характеристика больных и методы их обследования
Проведено открытое сравнительное рандомизированное клиническое исследование в параллельных группах на клинических базах кафедры общей практики — семейной медицины и кафедры терапии и нефрологии Харьковской медицинской академии последипломного образования. Включение пациентов в исследование проводилось после получения их информированного согласия.
Критериями включения в исследование явились наличие ХСН II и III функционального класса (ФК) по НьюЙоркской классификации сердца (NYHA), развившейся на фоне сочетания ИБС, ГБ и СД2, наличие субкомпенсации СД2, стабильное течение ХСН на протяжении последних двух месяцев на фоне проводимой стандартной терапии, сниженная или сохраненная систолическая функция левого желудочка сердца, наличие синусового ритма.
Критериями исключения из исследования были наличие обострений ХСН, требующих парентерального введения петлевых диуретиков и сердечных гликозидов, мерцательная аритмия, выраженная эмфизема легких, острые инфекционные заболевания, диффузные заболевания соединительной ткани и другая системная патология, онкологические заболевания, гипо и гипертиреоз, хронические гепатиты, хроническая почечная недостаточность.
В исследовании участвовали 120 больных в возрасте от 58 до 70 лет, из них 71 мужчина и 49 женщин. Все пациенты имели ИБС, подтвержденную перенесенным инфарктом миокарда, ГБ III cтадии, ХСН II и III ФК и СД2. 60 больных имели сниженную систолическую функцию левого желудочка (фракция выброса (ФВ) ≤ 45 %), 60 больных — сохраненную систолическую функцию левого желудочка (ФВ > 45 %).
Все больные получали стандартную терапию, которая включала 2,5–5,0 мг/сут бисопролола, 10–20 мг/сут лизиноприла, 50 мг/сут верошпирона, 100 мг/сут ацетилсалициловой кислоты, 20 мг/сут аторвастатина. Часть больных дополнительно получала амлодипин в дозе 5 мг/сут и индапамид в суточной дозе 2,5 мг. Все пациенты получали сахароснижающую терапию — 60 мг/сут гликлазида утром до еды и 500–1500 мг/сут метформина (после обеда и ужина). По клиниколабораторному статусу больные соответствовали критериям субкомпенсации СД2 (гликемия натощак < 6,5 ммоль/л; гликозилированный гемоглобин (HbA1c) < 7,5 ммоль/л). Указанная стандартная терапия не менялась в течение последних 6 недель до включения пациентов в исследование. Все больные методом рандомизации были разделены на 2 группы по 60 человек в зависимости от терапии, которую им проводили в течение дальнейших 16 недель. В каждую группу включили по 30 пациентов со сниженной и по 30 пациентов с сохраненной ФВ ЛЖ. Больные первой группы получали стандартную терапию, больные второй группы на фоне стандартной терапии дополнительно получали Милдронат GX в суточной дозе 1,0 г однократно утром.
Пациенты обеих групп были сопоставимы по полу, возрасту, уровням систолического (САД) и диастолического артериального давления (ДАД), частоте сердечных сокращений (ЧСС), другим параметрам клиниколабораторного статуса и получали одинаковую базисную терапию (табл. 1).
Всем пациентам, включенным в исследование, проводилась оценка толерантности к физической нагрузке с помощью теста с 6минутной ходьбой (Т6м), одно и двухмерная эхокардиография в импульсном режиме фазированным датчиком с частотой 2–4 МГц, спектральная и тканевая допплерэхокардиография из стандартных доступов на аппарате ULTIMA PRO 30 («Радмир», Украина). Исследования проводились в трех сердечных циклах с усреднением полученных данных по общепринятой методике.
Оценка диастолической функции ЛЖ сердца проводилась методами спектральной и тканевой допплерэхокардиографии по стандартным методикам. При спектральном допплеровском исследовании трансмитрального кровотока (ТМК) измерялись максимальная скорость потока раннего диастолического наполнения ЛЖ (Е), максимальная скорость диастолического потока при сокращении предсердий (А), их соотношение (Е/А), время замедления потока раннего диастолического наполнения, время изоволюмического расслабления ЛЖ. Оценивались скорости указанных потоков при тканевом допплеровском исследовании (е, а, е/а) и соотношение скоростей потоков раннего диастолического наполнения ЛЖ по данным спектрального и тканевого допплеровских исследований (Е/е), маркирующее тип диастолической дисфункции (ДД) ЛЖ.
Для суточного мониторирования (СМ) ЭКГ использовали систему мониторирования фирмы «Сольвейг» (Украина). Определяли среднее количество эпизодов депрессии сегмента ST за 24 часа, количество эпизодов болевой, безболевой депрессии сегмента ST, их длительность, глубину смещения сегмента ST и соответствующую ему ЧСС.
Критериями ишемии миокарда считали преходящее горизонтальное или косонисходящее снижение сегмента ST на 1 мм и более от исходного уровня, а также его подъем на 1,5 мм в точке J + 80 мс продолжительностью не менее 60 секунд. При этом оценивали количество болевых и безболевых эпизодов ишемии миокарда, общую длительность болевых и безболевых смещений сегмента ST, наличие и количество желудочковых (ЖЭ) и суправентрикулярных (СЭ) экстрасистол.
Для изучения функционального состояния эндотелия всем больным проводилось определение ЭЗВД в пробе с реактивной гиперемией. Исследование проводили линейным широкополосным датчиком 5–12 МГц в допплеровском режиме с цветным картированием трижды на левой и правой плечевых артериях с 15минутным перерывом между пробами по методике D.S. Celermajer (1994) в модификации О.В. Ивановой Диаметр артерий измерялся от передней до задней линии, разделяющих мышечную и адвентициальную оболочки сосудов. Изменение диаметра плечевой артерии отражалось как процентное соотношение максимального диаметра после проведения пробы к диаметру сосуда до пробы. В норме степень максимальной вазодилатации превышала 10 % от исходного диаметра. Одновременно проводились измерения толщины комплексов интимамедиа (ТИМ) сонных артерий.
Всем пациентам определяли содержание глюкозы крови натощак, уровень HbA1c. Уровень инсулина в сыворотке крови определялся методом иммуноферментного анализа с использованием реактивов компании DRG (США). Индекс HOMAIR (Homeostasis Model Assessment of Insulin Resistance) рассчитывали по формуле:
HOMAIR = глюкоза натощак (ммоль/л) ´´ инсулин натощак (мкЕд/мл) : 22,5.
За пороговое значение инсулинорезистентности принимали HOMAIR, равный 2,77. Показатели липидного спектра крови определяли ферментативным методом.
Для статистической обработки полученных в результате исследования данных использовался пакет программ Statistica for Windows версии 6.0. Распределения всех анализируемых количественных показателей достоверно отличались от нормального (критерий Колмогорова — Смирнова), поэтому для определения различий между группами применялись методы непараметрической статистики: для связанных выборок (динамика лечения) использовались критерий знаков и критерий Вилкоксона, для несвязанных выборок (разделение на подгруппы по признаку) — критерии Колмогорова — Смирнова и Манна — Уитни. В тексте для характеристики показателей использовались медиана (Me) и межквартильный интервал (МИ).
Результаты исследования и обсуждение
Анализ результатов клинического и ультразвукового обследования больных с сохраненной и сниженной ФВ ЛЖ сердца выявил преобладание в группе пациентов со сниженной ФВ более тяжелого типа диастолической дисфункции ЛЖ (псевдонормального), III ФК ХСН и достоверно меньшую медиану дистанции Т6м (p < 0,05) по сравнению с больными с сохраненной ФВ ЛЖ, у которых преобладали гипертрофический тип диастолической дисфункции ЛЖ и II ФК ХСН (табл. 2).
Достоверных отличий медиан ТИМ и ЭЗВД в группах больных с различной ФВ выявлено не было (p > 0,05). Больные, имеющие сниженную ФВ ЛЖ сердца, по сравнению с пациентами с ФВ более 45 %, характеризовались достоверно бо́льшими значениями медиан объема левого предсердия (ЛП), конечного систолического (КСР) и конечного диастолического размера (КДР) ЛЖ, среднего давления в легочной артерии (ДЛА), соотношения Е/е (p < 0,05) (табл. 3).
После 8недельного лечения у больных, получавших на фоне базисной терапии Милдронат GX в суточной дозе 1000 мг, достоверно увеличились медианы дистанции Т6м, ЭЗВД, ФВ (p < 0,05 для всех показателей). Увеличение ФВ ЛЖ у них не зависело от ее исходного состояния. У пациентов, не получавших на фоне базисной терапии Милдронат GX, медианы Т6м и ЭЗВД имели лишь тенденцию к увеличению (p > 0,05). При этом медиана ФВ ЛЖ достоверно увеличилась только у пациентов с ее исходным уровнем менее 45 % (p < 0,05). У больных с сохраненной и сниженной ФВ ЛЖ сердца после восьми недель терапии наблюдались снижения медиан ДЛА и Е/е, достигающие статистической значимости только у пациентов, получавших Милдронат GX (p < 0,05 для обоих показателей). Позитивная динамика показателей диастолического наполнения ЛЖ сердца у больных, получавших базисную терапию, свидетельствовала о положительных гемодинамических эффектах базисных средств терапии, а достоверное улучшение условий диастолического наполнения ЛЖ у больных, получавших Милдронат GX, — о дополнительных эффектах Милдроната GX, связанных с его способностью увеличивать синтез оксида азота и корректировать энергетический метаболизм клеток, прежде всего кардиомиоцитов, в пользу активации гликолитического пути образования АТФ как более рационального и эффективного в условиях ишемии [5, 6].
Существенной динамики медиан ТИМ, КДР ЛЖ, КСР ЛЖ, толщины стенок ЛЖ сердца через 8 недель лечения ни в одной из наблюдаемых групп больных выявлено не было (p > 0,05). Через 16 недель терапии в обеих группах больных наблюдалось дальнейшее увеличение медиан дистанции Т6м и ФВ ЛЖ сердца (p > 0,05 для обоих показателей по сравнению с их значениями через 8 недель терапии). Медиана ЭЗВД продолжала нарастать только в группе больных, получавших Милдронат GX. Наблюдалось дальнейшее снижение медиан ДЛА (p > 0,05 относительно значения через 8 недель терапии и p < 0,05 относительно исходной величины) и соотношения Е/е (p > 0,05 относительно исходного значения у пациентов, не получавших Милдронат GX). При сравнении динамики медиан Т6м, ФВ и ЭЗВД было выявлено, что в группе больных, получавших Милдронат GX, ее степень оказалась достоверно больше, чем у пациентов группы сравнения (p < 0,05). Динамика медианы Т6м у больных, получавших базисную терапию, свидетельствовала об отсутствии изменений в принадлежности их к определенному ФК ХСН, при этом в группе пациентов, получавших на фоне базисного лечения Милдронат GX, наблюдалось снижение ФК ХСН у 62,50 % больных с сохраненной ФВ ЛЖ и у 36,51 % больных с ФВ менее 45 %. Ни в одной из наблюдаемых групп больных за 16 недель лечения не произошло существенных изменений величин медиан ТИМ и толщины стенок ЛЖ сердца (p > 0,05). Динамика медиан изучаемых показателей представлена в табл. 4.
Результаты исследования свидетельствовали о том, что включение Милдроната GX в суточной дозе 1000 мг в течение 16 недель в схему базисной терапии больных ИБС с ХСН на фоне ГБ и СД2 приводит к достоверно большему увеличению дистанции Т6м, ФВ ЛЖ и степени ЭЗВД плечевых артерий, а также к статистически значимому улучшению параметров диастолического наполнения ЛЖ независимо от исходной величины ФВ ЛЖ сердца по сравнению с их динамикой на фоне базисной терапии без использования Милдроната GX.
В результате исследования выявлено благоприятное влияние назначения Милдроната GX на состояние углеводного обмена и выраженность инсулинорезистентности у обследованных больных. Через 16 недель терапии отмечали уменьшение уровня HbA1c в обеих группах наблюдения, однако если на фоне базисной терапии эта динамика носила характер тенденции, то в группе пациентов, получавших Милдронат GX, она оказалась статистически значимой (–13 % vs –4 %) (р = 0,03). Медиана индекса HOMAIR после 16 недель терапии снизилась с 3,8 до 3,5 (р > 0,05) в группе базисной терапии и с 3,9 до 2,5 (р < 0,05) — в группе пациентов, дополнительно получавших Милдронат GX.
Таким образом, 16недельная терапия с включением Милдроната GX достоверно уменьшала инсулинорезистентность у пациентов с ИБС и сочетанной патологией, что демонстрирует определенные преимущества данного терапевтического подхода.
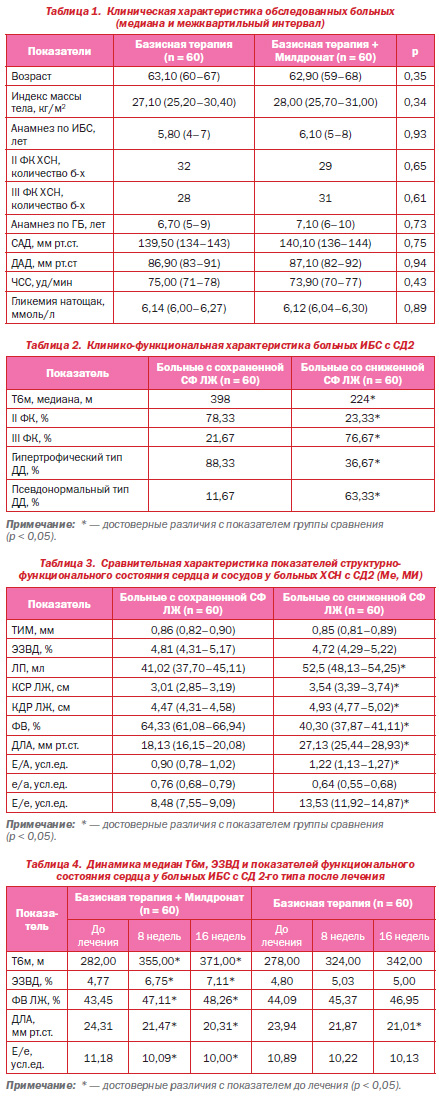
Всем больным, включенным в исследование, проводилось суточное мониторирование ЭКГ. Анализировались среднее количество эпизодов депрессии сегмента ST за 24 часа, количество эпизодов болевой и безболевой депрессии сегмента ST, количество СЭ и ЖЭ. При анализе показателей суточного мониторирования ЭКГ установлено, что у всех обследованных больных регистрировался синусовый ритм. Эпизодов мерцательной аритмии не отмечалось. До начала исследования у всех пациентов обеих групп отмечались эпизоды горизонтальной депрессии сегмента ST (¯ST) на 1–2 мм на 0,08 с от точки J. В группе базисной терапии медиана количества эпизодов ¯ST за 24 часа составила 5,6 (межквартильный интервал — 3,9–6,5), а в группе пациентов, получавших Милдронат GX, — 5,8 (МИ — 4,1–7,0) (р > 0,05). В количестве безболевых и болевых эпизодов ¯ST и суммарной продолжительности ¯ST за 24 часа исходных различий между группами выявлено не было (p > 0,05).
Степень ЭЗВД в общей группе больных коррелировала с количеством безболевых (r = 0,44; p = 0,01) и болевых эпизодов ¯ST (r = 0,62; p = 0,00) и суммарной продолжительностью ¯ST за 24 часа (r = 0,64; p = 0,00), что свидетельствовало о патогенетическом значении эндотелиальной дисфункции в развитии ишемии миокарда [7].
В процессе терапии отмечена положительная динамика показателей, характеризующих ишемию миокарда в обеих группах, при этом в группе пациентов, получавших Милдронат GX, она носила более выраженный характер. Так, к концу периода наблюдения общее количество эпизодов депрессии ST за 24 часа в группе базисной терапии уменьшилось на 32,2 %, а в группе терапии Милдронатом GX — на 58,6 % (р = 0,002), при этом количество болевых эпизодов ишемии снизилось на 35,3 и 46,9 % соответственно (р < 0,05).
В результате 16недельной терапии Милдронатом GX наиболее значимые различия в динамике по данным СМ ЭКГ выявлены в отношении частоты эпизодов безболевой депрессии ST — они уменьшились на 73,1 % в группе лечения с использованием Милдроната GX против 27,4 % в группе базисной терапии (р = 0,002) (табл. 5, рис. 1, 2).
В последние годы проблема безболевой ишемии миокарда стала предметом активного изучения, поскольку этот феномен является весьма распространенным и имеет неблагоприятное прогностическое значение как у пациентов с документированной и клинически манифестной ИБС, так и у лиц без ее клинических проявлений, но имеющих факторы риска сердечнососудистых заболеваний [8]. У всех обследованных нами больных имелись ИБС, ГБ, ХСН и СД2, причем для последнего весьма характерно наличие безболевой ишемии миокарда [9]. БИМ представляет собой преходящие нарушения перфузии миокарда, проявляющиеся специфическими изменениями на ЭКГ и другими объективными признаками ишемии при отсутствии болей или иных эквивалентов стенокардии. Одной из важнейших причин формирования БИМ у больных ИБС и СД2 является повреждение внутримиокардиальных афферентных нервных волокон вследствие перенесенного инфаркта миокарда или диабетической нейропатии (автономной кардиальной нейропатии) [10]. Полученные нами данные об антиишемических эффектах Милдроната согласуются с данными других исследований. Так, в многоцентровом рандомизированном двойном слепом плацебоконтролируемом исследовании МИЛСС II с участием пациентов со стабильной стенокардией напряжения установлено, что дополнительное назначение Милдроната повышает толерантность пациентов к физической нагрузке, увеличивает время до возникновения приступа стенокардии, увеличивает время до возникновения депрессии сегмента ST, улучшает качество жизни пациентов [11]. Пропионат (Милдронат GX (мельдония фосфат), АО «Grindex») снижает интенсивность бетаокисления свободных жирных кислот (ЖК) путем предотвращения поступления их в митохондрии: он ограничивает транспорт через мембраны митохондрий длинноцепочечных ЖК, в то время как короткоцепочечные могут свободно проникать в митохондрии и окисляться, при этом не происходит накопления недоокисленных ЖК внутри митохондрий изза торможения поступления в клетку карнитина, с помощью которого обеспечивается перенос длинноцепочечных ЖК через мембрану. Таким образом предотвращается токсическое, повреждающее действие недоокисленных ЖК на мембрану кардиомиоцитов, уменьшается накопление ионов Са2+, снижается адренергический ответ миокарда, оптимизируется синтез АТФ в клетке [12, 13]. При анализе СМ ЭКГ у обследованных нами больных было установлено, что у всех пациентов до начала лечения регистрировались нарушения сердечного ритма. В группе базисной терапии медиана суточного количества СЭ составила 279, желудочковых — 385, групповых желудочковых (≥ 5 экстрасистол подряд) — 14; в группе пациентов, получавших Mилдронат GX, — 284, 391 и 17 соответственно. Исходные различия между группами были статистически незначимыми (р > 0,05). Через 8 недель терапии в группе базисной терапии достоверной динамики количества аритмий не отмечалось, в то время как в группе Mилдроната GX зафиксировано статистически значимое снижение всех видов аритмий. К концу периода наблюдения (16 недель) произошла дальнейшая положительная динамика — статистически значимое уменьшение всех видов экстрасистолии как в группе базисной терапии, так и в группе пациентов, которые получали Милдронат GX, при этом снижение в группе Милдроната было более выраженным (различия степени динамики в группах в конце лечения оказались статистически значимыми, р < 0,05 для всех показателей) (табл. 6).
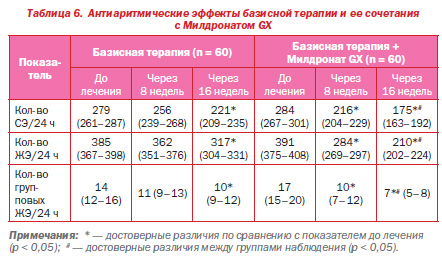
Выявленные нами антиаритмические эффекты Милдроната GX могут объясняться снижением внутриклеточной концентрации свободных ЖК, которые обладают мощным аритмогенным действием и способствуют возникновению аритмий, а также уменьшением проницаемости мембран для ионов кальция и угнетением ассоциированного с ним bадренергического ответа миокарда [14, 15].
Анализ динамики показателей липидного обмена показал, что в обеих группах обследованных пациентов через 2 месяца терапии наблюдалась тенденция к снижению уровней общего холестерина (ОХС), холестерина (ХС) липопротеидов низкой плотности (ЛПНП) и триглицеридов (ТГ), а также к повышению уровня ХС липопротеидов высокой плотности (ЛПВП) (р > 0,05). Через 16 недель терапии, т.е. к концу периода наблюдения, отмечено статистически значимое уменьшение медиан содержания ХС ЛПНП и ТГ в группе базисной терапии и ОХС, ХС ЛПНП и ТГ в группе Милдроната (р < 0,05 для всех показателей). Уровень ХС ЛПВП повысился в обеих группах, причем более выраженно у пациентов, получавших Милдронат GX. После лечения различия всех изучаемых липидных показателей между группами были статистически значимыми (р < 0,05) (табл. 7).
Нарушения липидного обмена являются одним из важнейших факторов риска сердечнососудистых осложнений у больных ИБС, АГ, ХСН и СД2. В нашем исследовании терапия Милдронатом GX на фоне базисных препаратов, включавших аторвастатин, привела к более выраженной положительной динамике показателей липидного спектра крови. Эти эффекты можно объяснить снижением окислительной модификации липопротеидов под влиянием Милдроната GX, улучшением функции мембран кардиомиоцитов и рецепторного метаболизма апоВсодержащих липопротеидов [16, 17].
Таким образом, реализация цитопротекторного и гемодинамического эффектов Милдроната GX в комплексной терапии больных ИБС с полиморбидным фоном привел к дополнительным позитивным результатам — уменьшению инсулинорезистентности, улучшению эндотелийзависимой вазодилатации, снижению суточного количества болевых и безболевых эпизодов депрессии ST, улучшению липидного спектра крови и гемодинамических параметров, что сопровождалось увеличением толерантности к физической нагрузке, снижением функционального класса ХСН и улучшением клинического статуса больных. Все вышеизложенное обосновывает целесообразность включения Милдроната GX в комплексную терапию больных с коморбидной патологией, а именно с сочетанием ИБС, ГБ, ХСН и СД 2го типа.
Выводы
1. Включение Милдроната GX в суточной дозе 1000 мг (по 2 табл. 1 раз в день) в течение 16 недель в схему базисной терапии больных ИБС с ХСН в сочетании с ГБ и СД2 приводит к достоверно большему увеличению дистанции Т6м, ФВ ЛЖ сердца и степени ЭЗВД плечевых артерий, а также к статистически значимому улучшению параметров диастолического наполнения ЛЖ независимо от исходной величины ФВ ЛЖ по сравнению с их динамикой на фоне базисной терапии без использования Милдроната GX.
2. У больных ИБС с ХСН в сочетании с ГБ и СД2 прием Милдроната GX в суточной дозе 1000 мг (по 2 табл. 1 раз в день) в течение 16 недель на фоне базисной терапии способствует достоверному снижению уровня HbA1c, индекса HOMAIR и содержания в крови ОХС, ХС ЛПНП И ТГ, что свидетельствует о позитивном влиянии Милдроната GX на параметры углеводного и липидного обмена.
3. Включение в схему базисной терапии больных ИБС с ХСН в сочетании с ГБ и СД2 Милдроната GX в суточной дозе 1000 мг (по 2 табл. 1 раз в день) к концу 8й недели лечения приводит к статистически значимому уменьшению количества суправентрикулярных и желудочковых экстрасистол, эпизодов групповой экстрасистолии с сохранением указанной положительной динамики в течение 16 недель приема Милдроната GX, свидетельствуя о дополнительных антиаритмических эффектах препарата.
4. У больных ИБС с ХСН в сочетании с ГБ и СД2 прием Милдроната GX в суточной дозе 1000 мг (по 2 табл. 1 раз в день) в течение 16 недель на фоне базисной терапии оказывает дополнительные антиишемические эффекты, способствуя более выраженному уменьшению суточного количества эпизодов болевой и безболевой ишемии и суточного количества эпизодов депрессии сегмента ST по сравнению с их снижением у больных, не принимавших Милдронат GX.
1. Медикосоціальні аспекти хвороб системи кровообігу: Аналіт.статист. посібник / В.М. Коваленко, В.М. Корнацький. — К.: ННЦ Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, 2009. — С. 75.
2. Бабак О.Я. Артериальная гипертензия и ишемическая болезнь сердца, эндотелиальная дисфункция: современное состояние вопроса / О.Я. Бабак, Ю.Н. Шапошникова, В.Д. Немцова // Укр. терапевт. журн. — 2004. — 1. — С. 1421.
3. Агеев Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечнососудистых заболеваний // ЖСН. — 2004. — Т. 4, № 1. — С. 2122.
4. Opie L.H. Особенности метаболизма миокарда при ишемической болезни сердца // Медикография. — 1999. — № 2. — С. 24.
5. Dzerve V., Matisone D., Kukulis I. et al. Mildronate improves peripheral circulation in patients with chronic heart failure: results of clinical trial (the first report) // Seminars in Cardiology. — 2005. — Vol. 11, № 2. — Р. 5664.
6. Skarda I., Klincare D., Dzerve V. et al. Modulation of myocardial energy metabolism with mildronate — an effective approach in the treatment of chronic heart failure // Proceedings of the Latvian Academy of Sciences. — 2001. — Vol. 55, № 2–3. — P. 7379.
7. Артюшкова Е.В., Покровский М.В., Артюшкова Е.Б. и др. Эндотелио и кардиопротективные эффекты мельдония и триметазидина при LNAMEиндуцированной эндотелиальной дисфункции в эксперименте // Курский научнопрактический вестник «Человек и его здоровье». — 2010. — № 32. — С. 510.
8. D’Antono B., Dupuis G., Arsenault A. et al. Silent ischemia: silent after all? // J. Cardiol. — 2008. — Vol. 24, № 4. — Р. 28591.
9. Ватутин Н.Т., Калинкина Н.В., Долженко Е.В. и др. Безболевая ишемия миокарда // Український кардіологічний журнал. — 2007. — № 3. — С. 97103.
10. Ziegler D. Cardiovascular autonomic neuropathy: clinical manifestations and measurement // Diabetes Reviews. — 1999. — № 7. — P. 342357.
11. Дзерве В. Эффективность Милдроната в лечении ишемической болезни сердца: результаты исследования MILSS II // Здоров’я України — 2010. — № 7(236).
12. Серкова В.К. Метаболическая кардиоцитопротекция в терапии больных ишемической болезнью сердца: роль парциальных ингибиторов окисления жирных кислот // Рациональная фармакотерапия. — 2008. — № 1. — С. 1517.
13. Дамброва М., Дайя Д., Лиепиньш Э. и др. Биохимические механизмы действия милдроната в условиях ишемического стресса // Врачебное дело. — 2004. — № 2. — С. 6874.
14. Люсов В.А., Савчук В.И., Дудаев В.А. и др. Влияние милдроната на электрическую стабильность миокарда // Экспер. клин. фармакол. — Рига: Зинатне, 1991. — Вып. 19. — С. 153158.
15. Корягина Н.А., Василец Л.М., Туев А.В. Возможности милдроната в комплексной антиаритмической терапии желудочковой экстрасистолии у пациентов с ишемической болезнью сердца // Материалы XIV Российского национального конгресса «Человек и лекарство». — М., 2007. — С. 122123.
16. Зорькина А.В., Александровский А.А., Бин Хатабин Х.А. Влияние милдроната и мексидола на некоторые показатели липидного обмена у больных ишемической болезнью сердца // Материалы XIV Российского национального конгресса «Человек и лекарство». — М., 2007. — С. 117119.
17. Сергиенко И.В., Кухарчук В.В., Габрусенко С.А и др. Оценка влияния комбинированной терапии милдронатом на липидный спектр, факторы воспаления и функцию эндотелия у больных ишемической болезнью сердца // Рациональная фармакотерапия в кардиологии. — 2007. — Т. 3, № 3. — С. 2831.

