Газета «Новости медицины и фармации» Антимикробная терапия (223) 2007 (тематический номер)
Вернуться к номеру
Нежелательные лекарственные реакции и взаимодействия при антибиотикотерапии: аллергические реакции
Авторы: Л.В. БОГУН, И.Г. БЕРЕЗНЯКОВ, Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Аллергология
Разделы: Справочник специалиста
Версия для печати
Под нежелательной лекарственной реакцией (НЛР) подразумевают любое неблагоприятное явление, которое развивается в момент клинического использования лекарственного препарата и не относится к его заведомо ожидаемым терапевтическим эффектам [1].
НЛР имеют медицинское, экономическое, социальное значение [2, 3] вследствие того, что они:
— являются причиной 5 % всех госпитализаций;
— развиваются у 10–20 % пациентов, находящихся на стационарном лечении;
— являются непосредственной причиной смерти у 0,1 % больных;
— снижают качество жизни пациентов;
— способствуют развитию недоверия больного к врачу;
— повышают стоимость лечения пациента;
— приводят к резкому уменьшению назначений данного препарата, которое зачастую не соответствует реальной вероятности развития НЛР;
— могут симулировать различные заболевания, что приводит к ненужным обследованиям больного и к ошибкам в тактике лечения.
Существует несколько подходов к клас сификации НЛР. Одна из классификаций предусматривает выделение двух типов НЛР — тип А (фармакологические реакции) и тип В (идиосинкразия). НЛР типа А встречаются значительно чаще; на их долю приходится около 80 % всех случаев НЛР [4]. Они развиваются или вследствие усиления первичного фармакологического эффекта препарата (например, брадикардия и нарушение атриовентрикулярной проводимости при применении бета-адреноблокаторов), или вследствие вторичных фармакологических эффектов, которые не являются целью лечения, однако легко прогнозируются и вытекают из особенностей фармакодинамики/фармакокинетики лекарства (например, бронхоспазм при лечении бета-адреноблокаторами). Эти НЛР дозозависимы и поэтому уменьшаются или исчезают при снижении дозы препарата или его отмене. К типу В НЛР относятся непредвиденные НЛР, развитие которых невозможно предсказать, исходя только из особенностей фармакокинетики/фармакодинамики лекарственного вещества. Считается, что во многие реакции идиосинкразии вовлекается иммунная система [5].
Удельный вес аллергических реакций (АР) на антибиотики в общей структуре НЛР невелик. Так, частота кожных НЛР (самой частой АР при антибиотикотерапии) составляет всего 2,2 % среди всех НЛР. Тем не менее АР являются серьезными НЛР, поскольку сопровождаются относительно высокой заболеваемостью и смертностью [6].
Лекарственный препарат инициирует развитие иммунологических НЛР посредством образования гаптенов [7]. Согласно этой теории, небольшие по размерам молекулы лекарства могут становиться иммуногенами –— веществами, способными вызывать специфический иммунный ответ, — только после ковалентного связывания с макромолекулами белков и образования гаптенов [7]. Тип реакции гиперчувствительности зависит от характера иммунного ответа и от места образования антигенов. Например, клеточный иммунитет играет ведущую роль в реакциях гиперчувствительности замедленного типа (макулопапулезная сыпь, буллезная экзантема), а IgЕ-опосредованные реакции являются реакциями немедленного типа (крапивница, анафилаксия) [8]. По- дробная классификация и механизм развития АР представлены в табл. 1 [9].
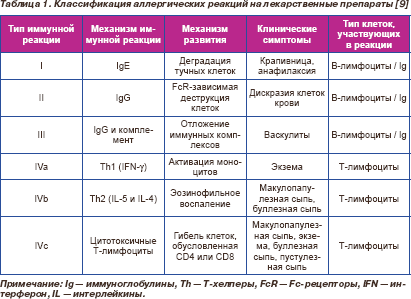
Диагностика АР. Наиболее значимым фактором риска развития АР на антибиотик является наличие АР на антибиотик данного класса в прошлом. Особенно большую роль играют анамнестические указания на АР на пенициллин и цефалоспорины. У больных с АР на пенициллин риск развития АР на любой лекарственный препарат повышен примерно в 3 раза [10]. Наличие атопических заболеваний, таких как аллергический ринит, бронхиальная астма или атопический дерматит, не является независимым фактором риска возникновения АР на бета-лактамные антибиотики. Однако если анафилактическая реакция развивается, то больные с атопическими заболеваниями, особенно больные бронхиальной астмой, имеют худший прогноз вследствие более тяжелого течения АР и большей частоты летального исхода [11]. Доказано, что такая сопутствующая патология, как ВИЧ-инфекция, муковисцидоз, инфекционный мононуклеоз, предопределяет более высокую вероятность развития АР [12].
При подозрении на АР на антимикробный препарат следует прежде всего убедиться в ее иммунологическом характере и исключить другие НЛР с неиммунологическими механизмами развития. Важное значение имеет также правильная оценка собственно АР — механизма ее развития и тяжести течения. Гипердиагностика АР, во-первых, может приводить к снижению эффективности антимикробной терапии, повышению стоимости лечения и формированию резистентности микроорганизмов за счет необоснованной смены антимикробного препарата, иногда с заменой его на менее эффективный; а во-вторых, точное установление типа реакции и ее тяжести определяет дальнейшую тактику ведения больного, в частности выбор антимикробного препарата. Поэтому у больных с АР на антибиотики следует тщательно собрать анамнез болезни. Необходимо ясно описать симптомы (крапивница, кожный зуд, ангионевротический отек, нарушения дыхания) и их тяжесть (умеренно выраженные или угрожающие жизни). Следует четко установить время начала развития реакции и ее связь с приемом препарата. При этом необходимо зафиксировать все лекарственные препараты, которые больной принимал на момент начала АР, поскольку АР может быть вызвана не только антимикробным препаратом. Следует тщательно собрать сведения о переносимости всех антимикробных препаратов в прошлом. Наличие АР на многие классы антимикробных препаратов существенно суживает возможности антибактериальной терапии у данного больного. Сведения об отсутствии АР на те или иные антибиотики в прошлом не только существенно облегчают выбор антимикробных препаратов для лечения пациента, но и иногда ставят под сомнение сам факт наличия АР на антибиотик в конкретном случае.
В табл. 2 [13, 14] представлены вопросы, позволяющие с достаточной вероятностью подтвердить аллергический характер НЛР и выявить основной механизм ее развития, прежде всего анафилаксию как наиболее опасный и потенциально летальный вид АР.

Необходимо тщательно фиксировать в медицинской документации все случаи НЛР, имевшиеся у больного, что существенно облегчает трактовку лекарственных АР в последующем.
Клинические проявления АР на антибиотики чрезвычайно разнообразны по симптоматике, тяжести течения и тропности к различным органам и системам, что зависит от вида антибиотика, заболевания, по поводу которого он назначается, и иммунологического состояния больного [3].
Клинические проявления аллергических реакций на различные классы антибактериальных препаратов [8]:
1. Пенициллины:
— крапивница;
— ангионевротический отек;
— анафилаксия;
— макулопапулезная сыпь;
— эксфолиативный дерматит;
— везикулезные высыпания;
— многоформная эритема;
— синдром Стивенса — Джонсона;
— токсический эпидермальный некролиз;
— реакции по типу сывороточной болезни;
— васкулиты;
— цитопении.
2. Цефалоспорины:
— крапивница;
— ангионевротический отек;
— анафилаксия;
— макулопапулезная сыпь;
— многоформная эритема;
— синдром Стивенса — Джонсона;
— токсический эпидермальный некролиз;
— нарушение функции почек;
— токсическая нефропатия;
— нарушение функции печени;
— апластическая анемия;
— гемолитическая анемия.
3. Сульфаниламиды:
— крапивница;
— ангионевротический отек;
— анафилаксия;
— макулопапулезная сыпь;
— эксфолиативный дерматит;
— многоформная эритема;
— синдром Стивенса — Джонсона;
— токсический эпидермальный некролиз;
— аллергический миокардит;
— узелковый полиартериит;
— реакции по типу сывороточной болезни;
— фотосенсибилизация.
4. Макролиды:
— крапивница;
— ангионевротический отек;
— анафилаксия;
— кожная сыпь;
— фотосенсибилизация;
— синдром Стивенса — Джонсона;
— токсический эпидермальный некролиз.
5. Фторхинолоны:
— крапивница;
— ангионевротический отек;
— кожный зуд;
— фотосенсибилизация;
— покраснение кожи;
— лихорадка;
— озноб;
— узловатая эритема;
— анафилаксия;
— гиперпигментация.
6. Тетрациклины:
— крапивница;
— ангионевротический отек;
— анафилаксия;
— перикардит;
— полиартралгия;
— обострение системной красной волчанки;
— эозинофильные инфильтраты в легких.
7. Ванкомицин:
— анафилаксия;
— лекарственная лихорадка;
— эозинофилия;
— кожные высыпания, в том числе эксфолиативный дерматит;
— синдром Стивенса — Джонсона;
— токсический эпидермальный некролиз;
— васкулиты.
Наиболее частыми АР при антибактериальной терапии являются кожные проявления — макулопапулезная сыпь, крапивница и кожный зуд [15]. Эти реакции развиваются, как правило, через несколько дней или недель после начала приема препарата, в течение которых происходит сенсибилизация организма. В случаях повторного контакта с лекарством характерно более быстрое возникновение АР, иногда в течение нескольких часов или даже минут [16].
Если поражения кожи сочетаются с такими системными проявлениями, как гипертермия свыше 40 °С, лимфаденопатия, артралгии или артриты, вовлечение в процесс слизистых, отек лица, тахипноэ, гипотензия, бронхоспазм, эозинофилия (выше 1000/мм3), лимфоцитоз с появлением атипичных лимфоцитов, изменение функциональных проб печени, то это свидетельствует о тяжелой аллергической реакции и требует немедленной отмены препарата [17].
Значительно реже аллергия на антибиотики проявляется в виде лихорадки, эозинофилии и других симптомов, не связанных с поражением кожных покровов [18]. Например, комбинация амоксициллина с клавулановой кислотой может вызывать печеночный холестаз, а высокие дозы пенициллинов и цефалоспоринов — гемолиз и цитопению вследствие образования специфических для этих препаратов антител [19].
Тяжелые аллергические IgE-опосредованные реакции по типу анафилаксии, к счастью, встречаются редко. И хотя теоретически анафилаксия может развиться в ответ на введение любого антибиотика, документально зарегистрирована только частота случаев анафилаксии в ответ на введение пенициллина: 1 случай на 5–10 тысяч курсов пенициллинотерапии [20].
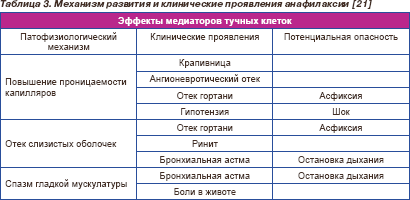
Под анафилаксией понимают тяжелую системную АР. Единого определения анафилаксии пока не разработано, так как она имеет множество проявлений, причем ведущие компоненты выделить трудно. Многие клиницисты пользуются рабочим определением понятия анафилаксии, согласно которому под этим термином понимают наличие хотя бы одного из двух тяжелых симптомов: нарушения дыхания (вследствие отека гортани или астмы) или гипотензии (обморок, коллапс, потеря сознания). Данный подход имеет существенный недостаток, поскольку умеренно выраженные проявления анафилаксии (генерализованная крапивница, ангионевротический отек и ринит) при отсутствии нарушений дыхания и гипотензии выпадают за рамки определения анафилаксии, хотя принадлежат к тому же типу реакций гиперчувствительности немедленного типа.
В основе анафилаксии лежит взаимодействие аллергена со специфическими IgE-антителами, связывание IgE с Fc-рецепторами тучных клеток и базофилов, что приводит к активации и дегрануляции тучных клеток с высвобождением медиаторов (в том числе гистамина) и высвобождению вновь образуемых медиаторов, которые синтезируются с большой скоростью. Быстрое поступление в системный кровоток большого количества медиаторов приводит к повышению проницаемости капилляров и отеку слизистых оболочек с соответствующими клиническими проявлениями (табл. 3) [21].
Лабораторные методы исследования направлены на выявление биохимических или иммунологических маркеров, свидетельствующих об активации иммунопатологических реакций, лежащих в основе предполагаемого механизма АР.
Лабораторные методы исследования при АР [17]:
I. Тип I (IgE-опосредованная):
1. Кожные пробы (положительные пробы информативны, отрицательная проба информативна только для пенициллина).
2. Тест с радиоиммуносорбентом in vitro (поскольку иммуногенные детерминанты для большинства лекарственных средств изучены плохо, предсказательная ценность этого теста невелика, его чувствительность ниже чувствительности кожных тестов).
3. Определение триптазы сыворотки крови (уровень гистамина в сыворотке крови повышается через 5 мин после начала и нормализуется через 30 мин после окончания АР; уровень триптазы — через 1 и 2–4 часа соответственно. Эти тесты используются для подтверждения острых IgE-опосредованных АР, однако их отрицательный результат не исключает АР).
II. Тип II (цитотоксическая):
1. Прямая или непрямая проба Кумбса (реакции этого типа сопровождаются развитием гемолитической анемии, тромбоцитопении и нейтропении. Гемолитический характер анемии подтверждается прямой или непрямой пробой Кумбса, свидетельствующей о наличии комплемента и/или гаптена на мембранах эритроцитов).
III. Тип III (образование иммунных комплексов):
1. СОЭ, С-реактивный белок (неспецифические маркеры воспаления).
2. Иммунные комплексы; комплемент (CH50, C3, C4). Положительный результат подтверждает клинический диагноз, однако отрицательный результат не исключает АР.
3. Антиядерные антитела (свидетельствуют о системном васкулите, обусловленном лекарственным препаратом).
4. Иммунофлюоресцентное исследование биоптата ткани.
IV. Тип IV (отсроченная, клеточная):
1. Местные пробы (появление эритемы, индурации кожи или везикулопапулезной сыпи после нанесения пластыря с лекарством на 48 часов подтверждает АР).
2. Исследование пролиферации лимфоцитов (применяется для научно-исследовательских целей).
Кожные пробы. Тактика лечения АР зависит прежде всего от механизма ее развития, т.е. от того, является ли она реакцией замедленного или немедленного типа. Для выявления реакций немедленного типа, т.е. IgE-опосредованных реакций по типу анафилаксии, проводится кожная проба. Отрицательный результат кожной пробы не означает отсутствия IgE-антител, за исключением кожной пробы с пенициллином, отрицательные результаты которой действительно свидетельствуют о низком риске реакций немедленного типа. Причина этого кроется в отсутствии четких данных об иммуногенных структурах большинства лекарственных препаратов, каковыми также могут быть неидентифицированные метаболиты антибиотиков или продукты их распада. Поэтому для подавляющего большинства антибактериальных препаратов в настоящее время не существует диагностических тестов, апробированных in vivo и in vitro, которые позволяли бы выявить все специфичные для этих антибиотиков IgE-антитела [8]. И хотя отдельные структурные компоненты антибиотика могут использоваться при постановке кожных проб, отрицательный результат следует интерпретировать не как отсутствие IgE-антител к данному препарату, а как следствие недостаточной чувствительности применяемой методики или, скорее, как результат неадекватного выбора с точки зрения иммуногенности структурного компонента антибиотика [22].
Кожные пробы обладают высокой диагностической точностью для выявления АР на пенициллин, поскольку клинически значимые антигенные детерминанты пенициллина хорошо изучены. К ним относятся основной антиген пенициллина — пенициллоила полилизин и несколько второстепенных антигенных детермин ант. Кожная проба проводится с пенициллоила полилизином в сочетании с раствором пенициллина G 10 тыс. ЕД в 1 мл или в сочетании со смесью второстепенных антигенов, из которых чаще всего используют 0,01М раствор бензила пенициллоата, бензила пениллоата и бензил-n-пропиламина [23].
Вначале выполняется кожная скарификационная проба с нанесением полной тестовой дозы, и если ее результаты отрицательны через 15 минут, то еще одна тестовая доза вводится внутрикожно. Увеличение диаметра волдыря на 3 мм и более по сравнению с контролем при наличии эритемы свидетельствует о положительной реакции. По результатам кожной пробы пенициллинспецифические IgE-антитела выявляются менее чем у 20 % больных с АР на пенициллин в анамнезе [24]. Отрицательный результат кожной пробы свидетельствует или о том, что предшествующие АР не были опосредованы IgE-антителами, или об отсутствии таких антител в настоящее время; в любом случае назначение пенициллина возможно. При этом риск развития реакций гиперчувствительности немедленного типа минимален (менее 4 %) и не отличается от такового у лиц без предшествующих АР на пенициллин в анамнезе [25].
Другие пробы. Кожные пробы неинформативны в диагностике АР, механизм развития которых не связан с образованием IgE-антител. В этих случаях возможно применение других диагностических тестов, которые выполняются или в момент развития АР, или сразу же после ее завершения. Положительная проба Кумбса указывает на клеточный механизм образования антител (например, обусловленная пенициллином гемолитическая анемия), а низкие уровни комплемента отражают вовлечение в АР системы комплемента (например, реакция по типу сывороточной болезни при применении миноциклина) [26]. Для подтверждения анафилактического характера НЛР используют определение уровня триптазы — нейтральной пептидазы, специфичной для тучных клеток. Повышение ее уровня в сыворотке крови указывает на системную активацию тучных клеток и сохраняется в течение нескольких часов после анафилаксии и других НЛР анафилактоидного типа.
Также используют тесты, нацеленные на выявление специфических для лекарственного препарата Т-лимфоцитов, которые образуются при некоторых реакциях гиперчувствительности, — так называемые тесты трансформации лимфоцитов in vitro . Положительные результаты данных тестов свидетельствуют о сенсибилизации больного к препарату, которая может иметь место даже при отсутствии явных клинических проявлений. Описаны положительные результаты этих проб при АР немедленного и замедленного типов в ответ на бета-лактамы, сульфаниламиды и хинолоны [27]. Однако перспективы широкого использования данных тестов в клинической практике нуждаются в уточнении. В настоящее время эти пробы используются преимущественно для научно-исследовательских целей.
Для подтверждения гиперчувствительности к антибиотику можно использовать провокационную пробу, заключающуюся во введении 3–6 постепенно увеличивающихся доз до достижения стандартной дозы препарата [28]. Однако эти пробы небезопасны для больного, так как могут приводить к развитию реакций гиперчувствительности немедленного типа (по данным одного из исследований, частота развития таких реакций при провокационных пробах достигает 17,6 %) [28]. И хотя эти реакции в подобных случаях обычно протекают сравнительно благоприятно, т.е. менее выражены по длительности и тяжести, провокационные пробы могут проводиться только специально обученным медицинским персоналом в отделениях интенсивной терапии, имеющих оборудование для сердечно-легочной реанимации.
Десенсибилизация к препарату проводится при необходимости использования антибиотика, вызывающего АР немедленного типа [23]. Например, существуют ситуации, когда нельзя избежать назначения бета-лактамов (бактериальный эндокардит, вызванный энтерококками; абсцесс мозга; бактериальный менингит; большинство инфекций, вызванных стафилококками или синегнойной палочкой, включая остеомиелит и сепсис; листериоз; нейросифилис; сифилис у беременных). Перед проведением десенсибилизации необходимо отменить бета-блокаторы, включая бета-блокаторы в виде глазных капель, а пациенты с бронхиальной астмой должны получать адекватную базисную терапию. Процедура десенсибилизации проводится специально обученным персоналом в отделениях интенсивной терапии, оснащенных аппаратурой для легочно-сердечной реанимации. В течение всей процедуры мониторируется ЭКГ. Десенсибилизацию не следует осуществлять под защитой Н1-блокаторов и глюкокортикоидов, так как эти препараты могут маскировать развитие аллергии.
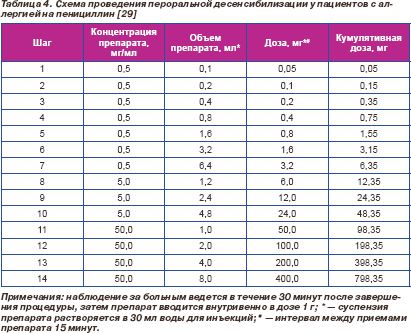
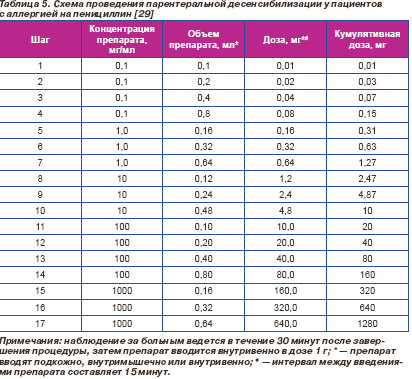
Суть десенсибилизации заключается в постепенном и медленном (в течение нескольких часов) введении возрастающей дозы антибиотика, пока не будет достигнута его полная терапевтическая доза. Начальные дозы обычно составляют несколько микрограммов препарата, путь введения может быть парентеральным или пероральным, причем последний предпочтительнее, поскольку редко приводит к развитию анафилаксии. Доза препарата удваивается каждые 15–30 минут, и в большинстве случаев терапевтическая доза антибиотика достигается в течение 4–5 часов [23].
Разработаны схемы для проведения как пероральной, так и парентеральной десенсибилизации для пенициллина (табл. 4, 5) [29].
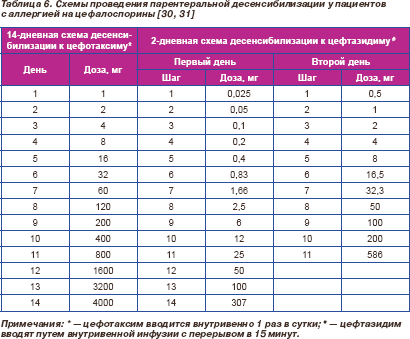
Десенсибилизация к цефалоспоринам проводится при невозможности их замены антибиотиками другого класса у больных с тяжелыми, опасными для жизни АР на пенициллин или цефалоспорин в анамнезе, а также у больных с АР и положительной кожной пробой на пенициллин. Схемы десенсибилизации к цефалоспоринам описаны, но не стандартизованы (табл. 6) [30, 31], и опыт их применения существенно меньше по сравнению с пенициллином.
Осложнения пероральной десенсибилизации включают умеренный зуд, крапивницу во время процедуры и регистрируются у 5–25 % пациентов. Острые реакции требуют применения соответствующей терапии (антигистаминные препараты при крапивнице, ингаляционные бета-агонисты при бронхоспазме) и уменьшения дозы и/или увеличения интервалов между приемами антибиотика. В случае развития легких системных реакций (зуд, преходящая крапивница, ринит) доза препарата, которая вызвала их появление, должна вводиться повторно до тех пор, пока пациент не станет переносить ее нормально. Более серьезные реакции, такие как гипотензия, отек гортани, астма, требуют соответствующей терапии и отмены антимикробного препарата. Если десенсибилизацию решают все же продолжить, дозу следует снизить минимум в 10 раз и не изменять до тех пор, пока состояние пациента не стабилизируется.
Каким образом достигается переносимость антибиотика после проведения десенсибилизации, точно не известно. Полагают, что это происходит за счет антигенспецифической десенсибилизации тучных клеток [32].
По данным ретроспективного исследования [33], десенсибилизация при IgЕ-опосредованной АР на пенициллин была эффективна у 43 из 67 больных (75 %), осложнения в виде тяжелых АР во время процедуры (анафилаксия) или спустя несколько дней после ее завершения (реакция по типу сывороточной болезни) развились у 19 % пациентов, и 3 процедуры были прекращены по причинам, не связанным с АР. Важно подчеркнуть, что состояние десенсибилизации проходит через 24–48 часов, поэтому при повторном применении пенициллина необходимо снова проводить кожную пробу. Ввиду этого кожную пробу и десенсибилизацию нельзя проводить «на будущее», если предполагается перерыв перед использованием полной дозы препарата. При необходимости назначить пенициллин повторно десенсибилизацию следует проводить снова. Поддерживать состояние десенсибилизации можно с помощью длительного перорального приема пенициллина 2 раза в сутки, например у пациентов с муковисцидозом.
Как правило, неудачи при десенсибилизации связаны с наличием иных, отличных от IgЕ-опосредованных, НЛР; кроме того, десенсибилизация чаще неэффективна у больных с муковисцидозом [34].
В случаях АР, не связанных с образованием IgЕ-антител, тактика ведения больного зависит от клинических проявлений реакции. Если АР проявлялась в виде макулопапулезной сыпи, возможно применение ступенчатой пробной терапии, которая по своей сути сходна с провокационной пробой [23], отличаясь от последней более высокими начальными дозами (миллиграммы вместо микрограммов) и более длительными интервалами между дозами (от нескольких часов до нескольких дней и даже недель вместо 15–30 минут). В течение всего периода ступенчатой пробной терапии за больным тщательно наблюдают для выявления побочных реакций, которые чаще всего протекают в виде кожных изменений. Решение об отмене антибиотика зависит от тяжести побочной реакции: при появлении волдырей или при вовлечении в процесс слизистых оболочек препарат следует отменить, а при развитии более легких реакций, таких как макулопапулезная сыпь, ступенчатую пробную терапию можно продолжить на фоне терапии антигистаминными препаратами и/или глюкокортикостероидами. Данный подход, например, оказался достаточно успешным (эффект достигнут у 75 % больных) при лечении сульфаметоксазолом у больных СПИДом, у ко торых АР на этот препарат отмечались в 58 % случаев [35]. Метод ступенчатой пробной терапии противопоказан при анамнестических указаниях на тяжелые, опасные для жизни АР, даже если их механ изм развития и не был связан с образованием IgЕ-антител (например, лекарственная гемолитическая анемия, синдром Стивенса — Джонсона, т оксический эпидермальный некролиз и т.д.). Однако прогнозировать эффективность данного метода затруднительно. Кроме того, он потенциально представляет опасность для больного. Например, описан случай развития анафилаксии на введение 1 г цефалоти на у больного, у которого отсутствовали АР на предшествующие более низкие дозы препарата [36]. Поэтому ступенчатая пробная терапия, как и провокационная проба, должна проводиться в специально оборудованных отделениях интенсивной терапии.
Аллергия на пенициллин. При подтверждении АР на пенициллин дальнейшее ведение больного возможно по одному из трех вариантов. Первый, наиболее распространенный, вариант заключается в выборе антимикробного препарата другого класса, не принадлежащего к бета-лактамам: макролида, фторхинолона, сульфаниламида, гликопептида. Достоинством данного подхода является отсутствие риска перекрестной аллергии; к недостаткам следует отнести выбор менее эффективного антимикробного средства, повышение стоимости лечения, угрозу развития резистентности микроорганизмов (особенно к ванкомицину). Тем не менее этот вариант весьма привлекателен при наличии широкого выбора альтернативных антимикробных препаратов, эффективных в данной клинической ситуации, а также в случаях, когда предшествующие АР на пенициллин протекали тяжело.
Второй распространенный подход ведения больного с подтвержденной АР на пенициллин заключается в назначении антибиотика из группы цефалоспоринов. Этот вариант применяется, если риск АР на цефалоспорин невелик и ниже пользы от применения антибиотика из числа не бета-лактамов или же пользы от дальнейшего обследования больного. Такой подход основан на известном факте, что тяжелые АР на цефалоспорины развиваются достаточно редко. Хотя авторы руководства по диагностике и лечению НЛР [35] относятся к данному варианту неодобрительно, о н осуществляется на практике при наличии совокупности следующих условий: 1) предшествующая АР носила нетяжелый характер и не была реакцией немедленного типа; 2) имеются строгие клинические показания к использованию цефалоспоринов; 3) выполнение кожной пробы на пенициллин неосуществимо; 4) имеются лекарственные препараты и оборудование для лечения возможных АР.
Наконец, третий подход предусматривает использование кожных проб при обследовании больного с анамнестическими указаниями на АР на пенициллин. По данным статистики, частота отрицательных кожных проб на пенициллин у таких больных высока (80–90 %). Таким образом, большинству больных назначать цефалоспорины можно. К недостаткам этого метода относится необходимость иметь специальные наборы для проведения кожных проб и, соответственно, удорожание лечения больного. Данный вариант показан пациентам с тяжелыми АР на пенициллин в анамнезе, у которых в конкретной клинической ситуации невозможно заменить цефалоспорины на антибиотики других групп.
Аллергия на цефалоспорины. Кожные пробы с пенициллином информативны и для больных с АР на цефалоспорины для решения вопроса о возможности применения пенициллина. При отрицательных результатах пробы назначение пенициллина возможно, при положительных — назначается антибиотик другой группы (не бета-лактам) или проводится предварительная десенсибилизация к пенициллину.
При АР на данный цефалоспорин назначение этого антибиотика в дальнейшем противопоказано. Риск перекрестных АР на другие цефалоспорины у больных с АР на один из них неизвестен. По некоторым данным, вероятность перекрестной гиперчувствительности невелика [37], поскольку при АР на цефалоспорины образуются преимущественно антитела к боковым цепям цефалоспоринов [38].
Наличие перекрестной аллергии на цефалоспорины и другие бета-лактамные антибиотики в какой-то мере можно объяснить строением боковых цепей. Боковые цепи цефамандола, цефалотина и цефалоридина очень сходны по своему строению с таковыми у пенициллина G [39]. Боковая цепь цефалексина сходна по строению с боковой цепью ампициллина, цефадроксила — с амоксициллином, цефтазидима — с азтреонамом. Однако насколько такое структурное сходство повышает риск перекрестной аллергии, неизвестно [40].
Развитие реакций по типу сывороточной болезни на цефаклор связано с наследственно обусловленными дефектами метаболизма, поэтому больные с такой АР на цефаклор могут принимать другие цефалоспорины без риска АР, включая лоракарбеф, сходный по своему строению с цефаклором [41].
Аллергия на карбапенемы. У 50 % пациентов с положительными кожными пробами на пенициллин определяются положительные кожные пробы на имипенем, что подтверждает наличие высокого уровня перекрест ного реагирования между этими группами антибиотиков. Поэтому назначение карбапенемов противопоказано при положительных кожных пробах с пенициллином [42].
Аллергия на монобактамы. В химической формуле монобактамов присутствует одна кольцевая структура в отличие от двойного кольца у других бета-лактамов. Перекрестное реагирование между монобактамами и другими бета-лактамами клинического значения не имеет. Поэтому азтреонам с высокой степенью безопасности может применяться у пациентов с аллергией на пенициллин [42].
При использовании фторхинолонов АР возникают у 0,4–2,2 % пациентов. Особенного внимания заслуживают фототоксические реакции, которые развиваются при облучении с длиной волны 320–400 нм. Эти реакции чаще регистрируются при использовании ломефлоксацина, спарфлоксацина, пефлоксацина, флероксацина. При приеме ломефлоксацина в вечернее время риск развития фототоксических реакций у больных достоверно снижается по сравнению с приемом в утренние часы [42].
Значительно реже встречаются лекарственная лихорадка, крапивница, отек Квинке, васкулиты, сывороточноподобный синдром, анафилактоидные реакции. Так, при прим енении ципрофлоксацина в расчете на 1 миллион случаев использования препарата анафилактический шок развивался в 0,33 % случая; анафилактические реакции — в 0,2 %; отек гортани — в 0,55 %; отек Квинке — в 0,9 %; сывороточноподобный синдром — в 0,025 %; аутоиммунная гемолитическая анемия — в 0,013 % случая. Описаны единичные случаи развития синдрома Лайелла, кожного васкулита, фиксированных высыпаний, аллергической нефропатии при использовании ципрофлоксацина. Перекрестное реагирование между фторхинолонами изучено недостаточно, однако имеющиеся в настоящее время данные позволяют предполагать наличие высокой частоты перекрестных реакций между препаратами этой группы [42].
АР при применении макролидов отмечаются редко — до 0,5–1,0 % случаев. Наиболее часто аллергия на макролиды проявляется в виде кожных форм — крапивницы и макулопапулезных экзантем. В литературе описаны единичные случаи развития анафилаксии при использовании макролидов. Данные о перекрестной аллергии сразу к нескольким макролидам отсутствуют, поэтому при наличии анамнестических указаний на аллергию к какому-либо макролиду допускается применение других макролидных антибиотиков. По частоте развития АР макролидные анти биотики располагаются следующим образом: кларитромицин (1–3 %) > эритромицин (1 %) > азитромицин (0,7– 1,8 %) > рокситромицин (0,8 %) > мидекамицин (0,15 %) [42].
Тетрациклины обладают относительно низким индексом сенсибилизации. Значительно чаще наблюдаются фототоксические реакции при применении хлортетрациклина и доксициклина [42].
Апластическая анемия после лечения хлорамфениколом не является аллергической. Иммунологический механизм лежит в основе редких проявлений IgE-зависимых (крапивница, анафилаксия), а также клеточно-опосредованных реакций [42].
При применении аминогликозидов АР развиваются очень редко. Описаны лекарственная лихорадка, макулопапулезная сыпь, эксфолиативный дерматит при применении стрептомицина [42].
Основные проявления АР, вызываемых рифампицином, состоят в кожных высыпаниях (макулопапулезного характера), тромбоцитопении, гемолитической анемии, лекарственной лихорадке, интерстициальном нефрите. Опубликованы единичные сообщения о развитии синдрома Лайелла, фиксированной лекарственной эритемы [42].
Введение ванкомицина в ряде случаев может вызывать прямое высвобождение медиаторов аллергии из тучных клеток и, как следствие, развитие анафилактоидных реакций, проявляющихся внезапной гипотензией и синдромом «красного человека». Для последнего характерны генерализованная эритема, кожный зуд, жжение. Медленное, в течение одного часа и более, внутривенное введение ванкомицина предупреждает развитие реакций у большинства пациентов [42].
Аллергия на сульфаниламиды. У больных с АР на сульфаниламидные ан тимикробные препараты актуален вопрос о возможности использования других сульфа ниламидсодержащих препаратов — диуретиков, целекоксиба, производных сульфонилмочевины (пероральные гипогликемические средства). Однако структура антимикробных сульфаниламидов (сульфаметоксазол, сульфадиазин, сульфизоксазол и сульфацетамид) за счет наличия ароматической аминовой группы в позиции N4 и замещающего кольца в позиции N1 отличается от структуры других сульфаниламидсодержащих медикаментов. Таким образом, перекрестная аллергия между этими препаратами маловероятна [43].
Однако результаты большого обсервацинного исследования показали другое: по сравнению с больными, не имевшими АР в анамнезе, у пациентов с АР на сульфаниламидные антимикробные средства повышен риск развития АР на другие сульфани-ламидсодержащие препараты и даже на пенициллин [44]. Такое расхождение теории и практики объясняется следующим: связь между АР на антимикробные сульфаниламиды и другие сульфаниламидсодержащие препараты обусловлена не наличием перекрестной аллергии, а более высокой предрасположенностью данной категории больных к АР в целом [44]. Кроме того, сами результаты данного исследования нужно оценивать с осторожностью: использование закодированных диагнозов АР и ретроспективный характер исследования могли способствовать ошибочной диагностике аллергических и неаллергических НЛР.
Заключение
Больные с АР на антибиотики в анамнезе требуют тщательного обследования для подтверждения иммунного характера НЛР и выявления типа АР. Вопрос о целесообразности дальнейшего назначения антибиотика, вызвавшего АР, зависит от клинической ситуации и возможности применения препарата другого класса. В ряде случаев при невозможности адекватной замены антибиотика на представителя другого класса допускается применение других антибиотиков этого же класса (при нетяжелых АР в анамнезе, низком риске перекрестной аллергии), а при тяжелых АР в прошлом — проведение специфических методов лечения (десенсибилизация, ступенчатая пробная терапия).
1. Asscher A.W., Parr G.D., Whitmarsh V.B. Towards the safer use of medicines // BMJ. — 1995. — 311. — 1003-1005.
2. Bates D.W., Spell N., Cuilen D.J., Burdick E., Laird N., Petersen L.A. et al. The costs of adverse drug events in hospitalized patients // JAMA. — 1997. — 277. — 307-311.
3. Classen D.C., Pestotnik S.L., Evans R.S., Lloyd J.F., Burke J.P. Adverse drug events in hospitalized patients. Excess length of stay, extra costs, and attributable mortality // JAMA. —1997. — 277. — 301-306.
4. Einarson T.R. Drug-related hospital admissions // Ann. Pharmacother. — 1993. — 27. — 8 32-840.
5. Park B.K., Pirmohamed M., Kitteringham N.R. Idiosyncratic drug reactions: a mechanistic evaluation of risk factors // Br. J. Clin. Pharmacol. — 1992. — 34. — 377-395.
6. Bigby M., Jick S., Jick H., Arndt K. Drug-induced cutaneous reactions: a report from the Boston Collaborative Drug Surveillance Program on 15,438 consecutive inpatients, 1975 to 1982 // JAMA. — 1986. — 256. — 3358-3363.
7. Park B.K., Coleman J.W., Kitteringham N.R. Drug disposition and drug hypersensitivity // Biochem. Pharmacol. — 1987. —36. — 581-590.
8. Gruchalla R.S., Pirmohamed M. Antibiotic allergy // N. Engl. J. Med. —2006. — 354. — 601-609.
9. Janeway C., Travers C., Walport M., Shlomchik M., Immunology: The Immune System in Health and Disease. — 5th ed. — New York: Garland, 2001.
10. Smith J.W., Johnson J.E. III, Cluff L.E. Studies on the epidemiology of adverse drug reactions. II. An evaluation of penicillin allergy // N. Engl. J. Med. — 1966. — 274. —998-1002.
11. DeSwarte R.D., Patterson R. Drug allergy // Allergic diseases: diagnosis and management / Еd. by R. Patterson, L.C. Grammer, P.A. Greenberger. — 5th ed. — Philadelphia: Lippincott–Raven, 1997. — 317-412.
12. Pirmohamed M., Park B.K. HIV and drug allergy // Curr. Opin. Allergy Clin. Immunol. — 2001. — 1. — 311-316.
13. Mori K., Maru C., Takasuna K. Char acterization of histamine release induced by fluoroquinolone antibacterial agents in vivo and in vitro // J. Pharm. Pharmacol. — 2000. — 52. — 577-584.
14. Veien M., Szlam F., Holden J.T., Yamaguchi K., Denson D.D., Levy J.H. Mechanisms of nonimmunological histamine and tryptase release from human cutaneous mast cells // Anesthesiology. — 2000. — 92. — 1074-1081.
15. Lee C.E., Zembower T.R., Fotis M.A. et al. The incidence of antimicrobial allergies in hospitalized patients: implications regarding prescribing patterns and emerging bacte rial resistancе // Arch. Intern. Med. — 2000. — 160. — 2819-2822.
16. Pirmohamed M., Breckenridge A.M., Kitteringham N.R., Park B.K. Adverse drug reactions // BMJ. — 1998. — 316. — 1295-1298.
17. Roujeau J.C., Stern R.S. Severe adverse cutaneous reactions to drugs // N. Engl. J. Med. — 1994. — 331. — 1272-1285.
18. Sullivan J.R., Shear N.H. The drug hypersensitivity syndrome: what is the patho genesis? // Arch. Dermatol. — 2001. — 137. — 357-364.
19. Pirmohamed M., Kitteringham N.R., Park B.K. The role of active metabolites in drug toxicity // Drug. Saf. — 1994. — 11. — 114-144.
20. Rudolph A.H., Price E.V. Penicillin reactions among patients in venereal disease clinics: a national survey // JAMA. — 1973. — 223. — 499-501.
21. Pirmohamed M., Breckenridge A.M., Kitteringham N.R., Park B.K. Adverse drug reactions // BMJ. — 1998. — 316. — 1295-1298.
22. Empedrad R., Darter A.L., Earl H.S., Gruchalla R.S. Nonirritating intradermal skin test concentrations for commonly prescribed antibiotics // J. Allergy Clin. Immunol. — 2003. — 112. — 629-630.
23. Bernstein I., Gruchalla R.S., Lee R., Nicklas R., Dykewicz M. Executive summary of disease management of drug hypersensitivity: a practice parameter // Ann. Allergy Asthma Immunol. — 1999. — 83. — 665-700.
24. Gadde J., Spence M., Wheeler B., Adkinson N.F. Jr. Clinical experience with penicillin skin testing in a large inner-city STD clinic // JAMA. — 1993. — 270. — 2456-2463.
25. Macy E., Mangat R., Burchette R.J. Penicillin skin testing in advance of need: multiyear follow-up in 568 test result-negative subjects exposed to oral penicillins // J. Allergy Clin. Immunol. — 2003. — 111. — 1111-1115.
26. Malakar S., Dhar S., Shah Malakar R. Is serum sickness an uncommon adverse effect of minocycline treatment? // Arch. Dermatol. — 2001. — 137. — 100-101.
27. Pichler W.J., Tilch J. The lymphocyte transformation test in the diagnosis of drug hypersensitivity // Allergy. — 2004. — 59. — 809-820.
28. Messaad D., Sahla H., Benahmed S., Godard P., Bousquet J., Demoly P. Drug provocation tests in patients with a history sug gesting an immediate drug hypersensitivity reaction // Ann. Intern. Med. — 2004. — 140. — 1001-1006.
29. Страчунский Л.С., Рафальский В.В. Аллергические реакции на антибиотики. Методическое пособие www.antibiotic.ru/rus/all/metod/aballergy/02.shtml#4
30. Papakonstantinou G., Bogner J.R., Hofmeister F., Hehlmann R. Cefotaxime desensitization // Clin. Investig. — 1993. — 71. — 165-167.
31. Ghosal S., Taylor C.J. Intravenous de sensitization to ceftazidime in cystic fibrosis patients //J. Antimicrob. Chemother. — 1997. — 39. — 556-557.
32. Naclerio R., Mizrahi E., Adkinson N.F. Jr. Immunologic observations during desensitization and maintenance of clinical tolerance to penicillin // J. Allergy Clin. Immunol. — 1983. — 71. — 294-301.
33. Turvey S.E., Cronin B., Arnold A.D., Dioun A.F. Antibiotic desensitization for the allergic patient: 5 years of experience and practice // Ann. Allergy Asthma Immunol. — 2004. — 92. — 426-432.
34. Burrows J.A., Toon M., Bell S.C. Antibiotic desensitization in adults with cystic fibrosis // Respirology. — 2003. — 8. —359-364.
35. Rich J.D., Sullivan T., Greineder D., Kazanjian P.H. Trimethoprim/sulfamethoxazole incremental dose regimen in human im munodeficiency virus-infected persons // Ann. Allergy Asthma Immunol. — 1997. — 79. — 409-414.
36. Zeok S.S., Tsueda K. Failure of a cephalothin test dose to produce anaphylaxis // Anesth. Analg. — 1980. — 59. — 393-394.
37. Saxon A., Beall G.N., Rohr A.S., Adelman D.C. Immediate hypersensitivity reactions to beta-lactam antibiotics // Ann. Intern. Med. — 1987. — 107. — 204-215.
38. Hamilton-Miller J.M., Abraham E.P. Specificities of haemagglutinating antibodies evoked by members of the cephalosporin C family and benzylpenicillin // Biochem. J. —1971. — 123. — 183-190.
39. Batchelor F.R., Dewdney J.M., Weston R.D., Wheeler A.W. The immunogenicity of cephalosporin derivatives and their cross-reaction with penicillin // Immunology. — 1966. — 10. — 21-33.
40. Kelkar P.S., Li J.T.-C. Cephalosporin Allergy // N. Engl. J. Med. — 2001. — 345. — 804-809.
41. Mendelson L.M. Adverse reactions to β-lactam antibiotics // Immunol. Allergy Clin. North. Am. — 1998. — 18. — 745-57.
42. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — М.: Боргес, 2002. —384 с.
43. Brackett C.C., Singh H., Block J.H. Likelihood and mechanisms of cross-allerge nicity between sulfonamide antibiotics and other drugs containing a sulfonamide functional group // Pharmacotherapy. — 2004. — 24. — 856-870.
44. Strom B., Schinnar R., Apter A. et al. Absence of cross-reactivity between sulfonamide antibiotics and sulfonamide nonantibiotics // N. Engl. J. Med. — 2003. — 349. — 1628-1635.
