Газета «Новости медицины и фармации» Антимикробная терапия (223) 2007 (тематический номер)
Вернуться к номеру
Антибактериальная терапия обострений хронического обструктивного заболевания легких
Авторы: Л.В. БОГУН, кафедра терапии Харьковской медицинской академии последипломного образования
Рубрики: Семейная медицина/Терапия, Пульмонология
Разделы: Справочник специалиста
Версия для печати
1. Что подразумевается под обострением хронического обструктивного заболевания легких?
Инфекции дыхательных путей, исходя из анатомических и клинических предпосылок, традиционно подразделяют на инфекции верхних и нижних дыхательных путей. Инфекции верхних дыхательных путей (ИВДП) обычно имеют вирусную этиологию, характеризуются нетяжелым течением, отмечается возможность самопроизвольного выздоровления. Инфекции нижних дыхательных путей (ИНДП), как правило, имеют бактериальную этиологию, характеризуются более тяжелым течением и необходимостью проведения терапии. В свою очередь ИНДП подразделяют на острый бронхит, пневмонию, обострение хронического обструктивного заболевания легких (ХОЗЛ) и обострение бронхоэктатической болезни. Эти заболевания различаются по этиологической структуре, в частности по удельному весу вирусных и бактериальных возбудителей, по тяжести течения и потребности в специфических лечебных вмешательствах. Однако такой подход является упрощенным, поскольку ИВДП и ИНДП могут существовать одновременно или последовательно у одного и того же больного. Более того, клинические проявления заболеваний дыхательных путей довольно неспецифичны и не позволяют однозначно определить не только анатомическую область поражения, но и саму инфекционную этиологию заболевания. Например, кашель возникает как при респираторных инфекциях (ИВДП и ИНДП), так и при интерстициальной патологии легких, левожелудочковой недостаточности и может быть проявлением нежелательных лекарственных явлений. Таким образом, клинические проявления респираторных инфекций неоднозначны, их трактовка является довольно субъективной, и одному и тому же больному с определенным набором клинических симптомов разными врачами может быть выставлен различный диагноз.
Факторы, затрудняющие диагностику ИНДП [1]:
— отсутствие четкой связи между клиническими симптомами и анатомической областью поражения;
— субъективность при выявлении физикальных признаков респираторных инфекций;
— субъективность при трактовке совокупности клинических симптомов респираторных инфекций;
— отсутствие четкого общепринятого подхода к диагностике ИНДП;
— отсутствие общепринятого определения различных нозологий при проведении клинических исследований, вытекающие из этого различия в исследуемых группах больных, а в итоге — в результатах;
— субъективный подход при выборе жесткости излучения при проведении рентгенографии органов грудной клетки;
— субъективный подход при оценке рентгенограмм: результаты компьютерной томографии доказывают возможность наличия пневмонии при нормальной рентгенограмме легких.
Обострение ХОЗЛ (в англоязычной литературе используется термин «acute exacerbation», что дословно переводится как «острое обострение») развивается на фоне хронического течения заболевания, имеющего свое собственное определение, обсуждение которого выходит за рамки данной работы. В настоящий момент продолжаются попытки разработать определение обострения ХОЗЛ (ОХОЗЛ), которое было бы приемлемым и для клинических, и для исследовательских целей.
В руководстве Британского торакального общества под ОХОЗЛ понимается «ухудшение ранее стабильного состояния», проявлениями которого могут быть повышение гнойности и/или количества мокроты, одышка, сухие свистящие хрипы, напряженность грудной клетки и задержка жидкости [2].
Недавний консенсус описывает ОХОЗЛ как «стойкое ухудшение состояния больного по сравнению со стабильным течением заболевания с учетом возможных ежедневных колебаний, которое характеризуется острым началом и требует изменения обычной терапии [3].
Наиболее употребляемым является определение понятия ОХОЗЛ, предложенное N.R. Antho nisen et al. и основанное на клинических проявлениях этого состояния [4]. Для постановки диагноза ОХОЗЛ требуется наличие одного и более из нижеследующих признаков: повышение гнойности мокроты, повышение продукции мокроты и/или усиление одышки. Если присутствует только один из этих трех компонентов, тогда еще требуется наличие минимум одного дополнительного симптома: боль в горле, насморк, лихорадка, увеличение количества сухих свистящих хрипов или кашля, или увеличение частоты дыхательных движений или частоты сердечных сокращений на 20 % по сравнению с исходными уровнями.
В соответствии с более поздним подходом об ОХОЗЛ говорят при наличии минимум двух выраженных симптомов (одышка, гнойность мокроты, ее количество) или одного выраженного и одного слабо выраженного симптома (насморк/заложенность носа, сухие свистящие хрипы, боль в горле, кашель) в течение двух дней подряд [5].
В ряде исследований пользуются весьма либеральным подходом, полагаясь на мнение клинициста [6].
Еще одна проблема в диагностике связана с возможностью манифестации ХОЗЛ в виде обострения, т.е. когда обострение развивается у больного без установленного ранее диагноза ХОЗЛ. Причины такой ситуации разнообразны: например, истинная манифестация ХОЗЛ в виде его обострения или ошибочная диагностика, когда вместо существовавшего ранее ХОЗЛ устанавливался диагноз «бронхиальная астма». Ситуация усугубляется затруднениями диагностики ХОЗЛ в период обострения, поскольку верификация диагноза инструментальными методами исследования (спирометрия) не всегда возможна и достоверна в период обострения. Кроме того, высока частота перекреста между различными нозологическими формами ИНДП. Так, применение компьютерной томографии высокого разрешения позволило выявить недиагностированные ранее бронхоэктазы у 29 % больных с ОХОЗЛ [7].
В итоге, учитывая разнообразие диагностических подходов и влияние субъективного фактора, синдромный диагноз ИНДП может быть выставлен с большей степенью точности, чем выделение той или иной нозологии, входящей в совокупность ИНДП. Не исключено, что в будущем именно такой подход сочтут целесообразным.
Одним из наиболее авторитетных источников информации для врачей по вопросам диагностики и лечения различных заболеваний являются клинические рекомендации, подготовленные ведущими медицинскими специалистами на основе современных доказательных данных. Применительно к проблеме диагностики и лечения больных с внебольничными ИНДП ими стали рекомендации Европейского респираторного общества, опубликованные в 1998 г.
Однако в последующие годы представления об ИНДП претерпели значительные изменения: появились современные данные об этиологии респираторных инфекций; были получены новые сведения о резистентности ключевых бактериальных возбудителей заболеваний, пополнился арсенал антибактериальных препаратов. Кроме того, значительно увеличилась доказательная база, составляющая основу современных рекомендаций; были опубликованы результаты большого числа контролируемых клинических исследований, метаанализов и систематических обзоров. Все эти обстоятельства предопределили создание новых рекомендаций, подготовленных экспертами Европейского респираторного общества (European Respiratory Society — ERS) и Европейского общества по клинической микробиологии и инфекционным болезням (European Society of Clinical Microbiology and Infectious Diseases — ESCMID) [1]. Согласно данным рекомендациям, обострение ХОЗЛ является проявлением естественного течения заболевания и характеризуется усилением одышки, кашля и/или выделения мокроты по сравнению с обычным течением заболевания с учетом ежедневных его колебаний, выраженность которого требует изменений планового лечения больного.
Данное определение с небольшими изменениями легло в основу определения ОХОЗЛ, приведенного в руководстве GOLD (пересмотр 2006 г.). Согласно данному руководству, обострение ХОЗЛ является проявлением естественного течения заболевания, которое характеризуется следующим: 1) изменением одышки, кашля и/или выделения мокроты по сравнению с обычным их уровнем с учетом ежедневных колебаний; 2) острым началом; 3) может потребовать изменений предшествовавшего лечения ХОЗЛ [8].
2. Какова роль бактериальной инфекции в развитии обострения ХОЗЛ?
Обострения ХОЗЛ могут быть обусловлены как неинфекционными (курение, факторы внешней среды) так и инфекционными агентами (вирусная, бактериальная инфекция). Роль бактериальной инфекции неоднозначна, поскольку, как показывают результаты исследований с применением бронхоскопии, бактериальная контаминация нижних отделов дыхательных путей имеет место у части больных в период стабильного течения ХОЗЛ (у 25 %) и по крайней мере у 50 % больных во время обострения [9, 10].
Хроническая бронхиальная колонизация отнюдь не является «безразличной» для макроорганизма, поскольку, например, продукты метаболизма H.influenzae стимулируют продукцию бронхиального секрета и активируют IgA-протеазы, тем самым негативно влияя на локальную неспецифическую резистентность. В последующем повторные эпизоды респираторной инфекции могут выступать в качестве ведущей причины обострения заболевания [11].
Таким образом, дыхательные пути у больных ХОЗЛ нестерильны, бактерии колонизируют дыхательные пути и в период ремиссии, не вызывая при этом клинической симптоматики. Хроническая бронхиальная колонизация отражает некое равновесное состояние, когда противоинфекционная защита макроорганизма способна лишь ограничивать бактериальное присутствие в нижних дыхательных путях, но не способна элиминировать микроорганизмы. В результате наблюдается хроническое экссудативно-деструктивное воспаление, в основе которого лежат нарушение мукоцилиарного клиренса, протеазно-антипротеазного баланса, дефекты полиморфноядерных лейкоцитов, нарушение кооперации иммунокомпетентных клеток и др. Размножение и распространение бактерий в слизистой бронхов стимулирует развитие воспалительного ответа организма. Острое воспаление, вызванное бактериальными агентами, приводит к образованию эпителиальными клетками большого количества провоспалительных медиаторов (фактор некроза опухоли α, интерлейкины-6, 8, ИЛ). При этом стенка бронха инфильтрируется активированными нейтрофилами. Продукция ими протеаз и активных форм кислорода превышает потенциал факторов защиты макроорганизма. Данные факторы агрессии вызывают повреждение эпителия и стимулируют слизеобразование. В результате нарушается мукоцилиарный клиренс, продолжается инфицирование, воспалительный процесс становится хроническим [12]. Нейтрофильная эластаза индуцирует продукцию эпителиальными клетками ИЛ-8, способствуя увеличению количества нейтрофилов в слизистой оболочке. Кроме того, разрушение антител, компонентов и рецепторов комплемента нарушает процесс фагоцитоза. Острая фаза сопровождается образованием секреторных иммуноглобулинов (IgА) — антител в бронхиальном содержимом, что ведет к снижению концентрации бактериальных агентов. Длительное воздействие факторов патогенности бактериальных агентов и лизосомальных гидролаз полиморфноядерных лейкоцитов вызывает разрушение соединительнотканной стромы легких, а в этих условиях скопление в слизистой и подслизистой оболочках бронхов макрофагов и Т-лимфоцитов способствует фиброгенезу [13]. У больных с хронической бактериальной колонизацией бронхов и рецидивирующими инфекциями отмечается постоянная секреция бактериальных экзопродуктов, на которую макроорганизм отвечает воспалительной реакцией с прогрессирующим ухудшением функции бронхиального эпителия и снижением продукции IgA и уровня фагоцитоза [13, 14]. Показано, что H.influenzae, S.pneumoniae и M.catarrhalis способны вырабатывать субстанции, вызывающие мукоцилиарную дисфункцию, а H.influenzae оказывает прямое повреждающее действие на эпителий воздухоносных путей. К тому же длительная персистенция H.influenzae ассоциируется с прогрессирующим усугублением дисфункции легких и уменьшением продолжительности «светлых» промежутков ремиссии. Таким образом, формируется замкнутый самоподдерживающийся воспалительный процесс, способствующий прогрессированию уже существующих вентиляционно-перфузионных нарушений.
Хроническая бактериальная колонизация нижних отделов дыхательных путей может создавать определенную проблему в идентификации бактериального возбудителя в период обострения. Имеются доказательства того, что период обострения характеризуется возрастанием титра бактерий (так называемая бактериальная нагрузка), появлением P.aeruginosa в нижних отделах дыхательных путей независимо от титра или появлением новых штаммов бактериальных возбудителей, персистировавших в период стабильного течения ХОЗЛ [15].
Связь обострений ХОЗЛ с появлением новых штаммов бактерий доказана для H.influenzae, S.pneumoniae, M.catarrhalis.
Роль атипичных возбудителей менее ясна. В большинстве исследований показана этиологическая значимость C.pneumoniae (в 4–20 % обострений), роль M.pneumoniae доказана меньше [16].
C.pneumoniae часто обнаруживается в ассоциации с другими бактериальными и вирусными возбудителями.
Вирусная инфекция также является частым этиологическим фактором обострения ХОЗЛ. Частота выделения вирусов колеблется в зависимости от применяемых методов исследования. На долю вирусной инфекции при обострении ХОЗЛ может приходиться до 39 % случаев, а наибольший удельный вес принадлежит риновирусной и риносинцитиальной инфекциям. Другими часто выделяемыми вирусами являются пикорнавирусы и вирус гриппа А [17].
Впервые гипотеза о роли инфекции в развитии и прогрессировании бронхиальной обструкции была выдвинута более 40 лет назад и получила название британской гипотезы [18]. Однако классическое исследование Fletcher, дизайн которого был нацелен на проверку этой гипотезы, показало отсутствие связи между хроническим кашлем, выделением мокроты, рецидивирующей респираторной инфекцией и снижением функции легких [19]. Был сделан вывод о том, что хронический бронхит (кашель, выделение мокроты и эпизоды обострений бронхита) является вторичным явлением по отношению к прогрессированию ХОЗЛ.
Такой взгляд на патогенез ХОЗЛ оставался неизменным вплоть до недавнего времени, когда результаты других исследований позволили предположить, что британская гипотеза все-таки имеет под собой основания: в двух исследованиях было показано, что наличие рецидивов респираторной инфекции сопровождается более быстрым снижением функции легких у больных с ХОЗЛ [20, 21] и, более того, степень снижения функции легких зависит от количества бактерий в мокроте [22]. С целью проверки британской гипотезы были проведены исследования маркеров воспаления и мокроты у больных с ХОЗЛ. Исследование Banerjee et al. [23], выполненное у больных со стабильным средним и тяжелым течением ХОЗЛ, принимающих ингаляционные кортикостероиды, показало наличие бактерий в мокроте у всех больных, причем у 40 % выделялись патогенные микроорганизмы H.influenzae, M.catarrhalis и S.pnuemoniae. По сравнению с больными, у которых были выделены непатогенные микроорганизмы, у вышеуказанных пациентов зарегистрированы более высокие уровни маркеров воспаления и большее количество нейтрофилов в мокроте, а также более высокие уровни фибриногена в плазме крови и более низкое качество жизни. Результаты данного исследования позволили сделать два важных вывода: во-первых, подтверждена роль патогенных микроорганизмов в патогенезе ХОЗЛ; во-вторых, получены доказательства системного воспаления в ответ на воспаление в бронхиальном дереве. Наличие системного и локального воспаления при обострении ХОЗЛ было показано и в других исследованиях [17, 24].
В связи с этим возникают вопросы: во-первых, какую роль в прогрессирующем поражении дыхательных путей и, в частности, легких играют воспалительные процессы, имеющие место и при стабильном течении ХОЗЛ и при обострении; во-вторых, какова роль хронической респираторной инфекции в развитии воспаления и в патогенезе ХОЗЛ?
По данным Banerjee et al. [23], патогенные микроорганизмы вызывают более выраженное воспаление по сравнению с непатогенными, хотя есть и противоположные результаты, свидетельствующие о том, что маркеры воспаления и скорость снижения функции легких не зависят от патогенности микроорганизмов, а связаны с количеством микроорганизмов в мокроте и имеется значительный перекрест в маркерах воспаления у больных с патогенными микроорганизмами в мокроте и без них [25, 26].
Формальное объяснение таких различий в результатах можно представить следующим образом: 1) непатогенные микроорганизмы способны вызывать воспаление при наличии уже существующего поражения дыхательных путей; 2) всегда существует вероятность погрешностей при сборе мокроты и пропуска патогенных бактерий; 3) небактериальные микроорганизмы (вирусы) могут также вызывать хроническое воспаление в дыхательных путях.
Более того, существует вероятность того, что результаты, получаемые при исследовании откашливаемой мокроты, отражают процессы, происходящие в крупных бронхах, которые не играют существенной роли в обструктивных процессах.
Итак, на настоящий момент можно считать доказанным, что обострения ХОЗЛ per se способствуют более быстрому снижению функции легких, а вот роль хронической инфекции дыхательных путей в этом процессе до конца не ясна.
3. Можно ли по клинических признакам выделить больных, у которых обострение ХОЗЛ обусловлено именно бактериальной инфекцией?
Обострение ХОЗЛ бактериальной этиологии характеризуется выделением мокроты гнойного характера, когда активация защитных сил макроорганизма сопровождается мобилизацией большого количества нейтрофилов в нижние дыхательные пути [27].
Лабораторным критерием, позволяющим четко разграничить гнойный или слизистый характер мокроты, является уровень миелопероксидазы в мокроте. Низкое значение этого показателя наблюдается при низком уровне бактериальной обсемененности (≤ 107 колониеобразующих единиц в 1 мл мокроты (КОЕ/мл)), высокое значение — при высокой степени бактериального обсеменения (> 107 КОЕ/мл) [28].
Другим приемлемым способом верификации бактериального генеза обострения ХОЗЛ могут служить результаты самонаблюдения больных и данные анамнеза. По результатам исследования [27], сообщение больным данных самонаблюдения о гнойном характере мокроты с высокой вероятностью свидетельствует о высоком уровне бактериальной обсемененности (> 102 КОЕ/мл при взятии образцов мокроты с использованием метода защищенных щеток). Положительная предсказательная ценность таких сообщений составляет 77 %, отрицательная — 89 %. Зеленый цвет мокроты также является высокодо- стоверным критерием бактериального характера обострения ХОЗЛ (чувствительность 94 % и специфичность 77 %) [29]. На бактериальный характер обострения ХОЗЛ указывают предшествующие госпитализации, частые (более 4 раз в год) обострения и выраженная бронхиальная обструкция (объем форсированного выдоха за 1 с (ОФВ1) менее 50 %) [27].
4. Каковы ключевые возбудители бактериального обострения ХОЗЛ и их резистентность к антимикробным препаратам?
По совокупным данным многих исследований, бактериальные патогены выявляются у 50–60 % больных с обострением ХОЗЛ. Это чаще всего H.influenzae, S.pneumoniae, M.catarrhalis. В генезе тяжелых обострений ХОЗЛ значительно возрастает роль грамотрицательных микроорганизмов, в том числе P.aeruginosa. По данным исследования [30], проведенного у больных с классическими признаками обострения ХОЗЛ (кашель диспноэ, продукция гнойной мокроты, лихорадка, внезапное начало обострения) на фоне тяжелой стадии ХОЗЛ в период стабильного течения заболевания, потенциальные возбудители были выделены у 68 % больных. Материалом для исследования служила спонтанно экспекторированная мокрота или жидкость бронхоальвеолярного лаважа (БАЛ), диагностически значимым титром считали КОЕ > 106/мл для мокроты и > 104/мл для БАЛ. Доминирующими микроорганизмами у больных с ОХОЗЛ при тяжелом течении в стабильном периоде являлись P.aeruginоsa и другие виды Pseudomonas (всего 29 %). Второе место занимали H.influenzae и H.parainfluenzae (всего 20 %), далее следовали S.pneumoniae (14 %), S.aureus (11 %), M.catarrhalis (10 %), K.pneumoniae (8 %), еще реже встречались другие виды энтеробактерий, включая Acinetobacter spp. , Enterobacter spp. , E.coli и др. Ассоциации микроорганизмов были выявлены в 16 % образцов, в большинстве случаев выделялось по два возбудителя и значительно реже — по 3 микроорганизма.
При анализе чувствительности микроорганизмов к антибиотикам была установлена достаточно хорошая чувствительность S.pneumoniae к ампициллину (90 %) и эритромицину (90 %), а также чувствительность всех пневмококков к цефалоспоринам III поколения и к имипенему.
Все штаммы Haemophilus spp. были чувствительны к ципрофлоксацину, имипенему и цефтазидиму, уровень резистентности к ампициллину достигал 27 %.
Все штаммы M.catarrhalis были резистентны к ампициллину, однако сохраняли высокую чувствительность к ципрофлоксацину, цефалоспоринам III поколения, аминогликозидам и имипенему.
В отношении Pseudomonas spp. наибольшую активность проявляли имипенем (81 %) и ципрофлоксацин (81 %).
В некоторых регионах мира определенную роль в генезе обострения ХОЗЛ играют C.pneumoniae — до 22 % в Турции, Legionella spp. — до 17 % в Израиле. Также причиной обострения ХОЗЛ могут являться вирусные инфекции (до 30 % случаев). Однако идентификация вирусов и атипичных микроорганизмов основана чаще всего на серологических методах, которые требуют взятия парных сывороток с интервалом не менее 2 нед., поэтому информация, получаемая с их помощью, имеет лишь эпидемиологическое значение и редко оказывает влияние на тактику антимикробной терапии.
На протяжении последних лет во всем мире наблюдается стремительный рост резистентности респираторных возбудителей к антибактериальным препаратам.
Для многих возбудителей картина резистетности является сходной в различных регионах мира. Это, например, относится к M.catarrhalis и атипичным микроорганизмам.
К особенностям M.catarrhalis относится высокая частота продукции бета-лактамаз, разрушающих природные и полусинтетические пенициллины, но чувствительных к действию ингибиторов. В России частота продукции бета-лактамаз этим микроорганизмом достигает 90–98 %. Устойчивость к антибактериальным препаратам других групп (фторхинолонам, макролидам, тетрациклинам, ко-тримоксазолу) отсутствует или минимальна [31].
Что касается атипичных возбудителей, то они практически не имеют проблем с развитием приобретенной устойчивости к антибиотикам [30, 31].
Однако для S.pneumoniae и H.influenzae распространенность и выраженность резистентности значительно варьирует как между странами, так и между регионами одной страны.
S.pneumoniae. Основное внимание привлекают проблемы распространения устойчивости среди S.pneumoniae. Это связано с тем, что данный микроорганизм обусловливает наиболее тяжелое течение респираторных инфекций (прежде всего пневмонии), а в части случаев может быть причиной летальных исходов. Имея в виду отсутствие данных по мониторированию уровня резистентности респираторных возбудителей в Украине и принимая во внимание сходные традиции по назначению антимикробных препаратов, что играет важную роль в развитии приобретенной резистентности микроорганизмов к антибактериальным препаратам, в Украине и России, автор полагает, что с высокой долей вероятности данные о резистентности, полученные в России, могут быть экстраполированы и в Украину, особенно в ее восточные регионы. Возможно, в западных регионах нашей страны следует также принимать во внимание данные о чувствительности респираторных патогенов, полученные в сопредельных странах (Польша, Венгрия, Словакия).
Из всех регионов Российской Федерации распространение антибиотикорезистентности среди пневмококков наиболее подробно изучено для Москвы, где систематические исследования проводятся с 1998 г.
Средствами выбора для лечения пневмококковых инфекций на протяжении многих лет считаются бета-лактамные антибиотики. Для легких инфекций применяют аминопенициллины, для тяжелых — цефалоспорины II, III поколений. Поскольку продукция бета-лактамаз у пневмококков не описана, применение защищенных аминопенициллинов не имеет каких-либо преимуществ по сравнению с незащищенными препаратами.
На протяжении всего периода наблюдения в отдельные годы регистрировали значительные различия в частоте выделения как резистентных к пенициллину, так и умеренно устойчивых штаммов. Тем не менее общей тенденцией было увеличение частоты выделения штаммов с высоким уровнем устойчивости и снижение частоты выделения умеренно устойчивых штаммов. Несмотря на то что in vitro между пенициллином и основным аминопенициллином для приема внутрь — амоксициллином — наблюдают практически полную перекрестную резистентность, благодаря особенностям фармакокинетики последний антибиотик сохраняет клиническую и бактериологическую эффективность в отношении умеренно устойчивых и части устойчивых пневмококков. Учет особенностей фармакокинетики амоксициллина позволил скорректировать критерии чувствительности пневмококков к этому антибиотику. При интерпретации результатов оценки чувствительности к амоксициллину с использованием новых критериев за весь период наблюдения к устойчивым были отнесены лишь несколько штаммов.
Данные, полученные для амоксициллина, могут быть полностью перенесены на амоксициллин/клавуланат.
Частота выделения штаммов со сниженной чувствительностью к цефотаксиму в течение всего периода наблюдения была также подвержена значительным колебаниям. Несмотря на о бщую невысокую частоту выделения штаммов со сниженной чувствительностью, основной тенденцией было увеличение частоты как умеренно, так и высоко устойчивых штаммов. Максимальные показатели нечувствительности пневмококков к цефотаксиму наблюдали в 2006 г. — 1,9 и 1,2 % соответственно. При этом, однако, необходимо учитывать, что для цефотаксима существуют различные критерии чувствительности в зависимости от источника выделения бактерий: из дыхательных путей или из цереброспинальной жидкости при менингите. При использовании критериев, рекомендуемых для менингита, в 2006 г. частота нечувствительных к цефотаксиму штаммов составила 7,9 %.
Частота устойчивости пневмококков к эритромицину в течение всего периода наблюдения была подвержена значительным колебаниям: от 7,4 до 19 % , сколько-нибудь явной тенденции к росту или снижению устойчивости выявить не удалось. Минимальные значения были отмечены в 2000–2001 и 2004 гг., максимальные — в 2003 и 2006 гг. Результаты оценки чувствительности пневмококков к азитромицину и кларитромицину, как и следовало ожидать, практически полностью совпали с данными, полученными для эритромицина.
Практически важной тенденцией, отчетливо проявившейся в течение всего периода наблюдения, было увеличение частоты выделения штаммов пневмококков, демонстрировавших MLSb-фенотип резистентности. Для этого фенотипа характерен высокий уровень полной перекрестной резистентности между макролидами, линкозамидами и стрептограмином В. Генетической основой этого фенотипа является наличие гена ermB, кодирующего фермент метилазу. В конце 90-х годов ХХ века в Москве циркулировали в основном штаммы М-фенотипа, устойчивость которых к макролидам определялась mef-генами, кодирующими активное выведение (эффлюкс) 14- и 15-членных макролидов, но не влияющими на 16-членные макролиды и линкозамиды. В настоящее время превалируют штаммы, обладающие одновременно двумя детерминантами резистентности (erm- и mef-генами). Очевидно, что за прошедшее время к эффлюксному механизму устойчивости присоединилось метилирование.
Для практики важным следствием этих процессов оказалось следующее: если в 90-е годы прошлого века в отношении штаммов, устойчивых к эритромицину, азитромицину и кларитромицину, сохраняли активность клиндамицин и 16-членные макролиды, то в настоящее время наблюдают практически полную перекрестную устойчивость между всеми макролидами и линкозамидами.
Устойчивость пневмококков к респираторным фторхинолонам (левофлоксацину и моксифлоксацину) в настоящее время не является реальной проблемой для Российской Федерации. В отдельные годы выделяли лишь единичные устойчивые штаммы (менее 1 %), при этом к моксифлоксацину уровень устойчивости был ниже, чем к левофлоксацину.
Частота устойчивости пневмококков к ко-тримоксазолу и тетрациклину за период наблюдения варьировала в очень широких пределах: от 8,4 до 44,7 % и от 23,6 до 42,6 % соответственно. При выявленном уровне распространения резистентности применение указанных препаратов для эмпирической терапии пневмококковых инфекций нецелесообразно.
Распространение антибиотикорезистентности среди пневмококков в других регионах Российской Федерации изучено менее подробно. В период с 2004 по 2006 г. частота резистентности к основным антибактериальным препаратам среди пневмококков, циркулирующих в Санкт-Петербурге, была сопоставима с уровнем, выявленным в Москве. В других регионах частота устойчивости к макролидам и бета-лактамам была приблизительно в 2 раза ниже, чем в Москве, а частота устойчивости к ко-тримоксазолу и тетрациклину была приблизительно на одинаковом уровне во всех регионах [31].
По данным European Antimicrobial Resistance Surveillance System, частота инфекций, вызываемых резистентными штаммами пневмококков, является наибольшей в Испании и Греции — более 30 %, Бельгии, Польше, Венгрии и Словении — 10–29 %, а в Германии, Австрии, Голландии и Болгарии — наименьшей (менее 3 %) [32].
По данным работы [30], большинство штаммов пневмококка у больных с обострениями ХОЗЛ сохраняют свою чувствительность к ампициллину (90 %) и эритромицину (90 %).
H.influenzae. По сравнению с пневмококками спектр природной чувствительности гемофильной палочки к антибиотикам несколько уже. Микроорганизм малочувствителен к пенициллину, из бета-лактамов наибольшей активностью характеризуются аминопенициллины, защищенные аминопенициллины, цефалоспорины II, III поколений. Именно эти препараты составляют основу терапии как легких, так и тяжелых инфекций, вызываемых H.influenzae. Основным механизмом устойчивости H.influenzae к бета-лактамам является продукция бета-лактамаз, разрушающих аминопенициллины, не действующих на цефалоспорины и чувствительных к действию ингибиторов (клавулановой кислоты и сульбактама). Штаммы, продуцирующие бета-лактамазы, устойчивы к ампициллину, но чувствительны к амоксициллину/клавуланату и цефалоспоринам. Вторым, менее актуальным механизмом устойчивости к бета-лактамам является модификация мишеней действия этих антибиотиков — пенициллинсвязывающих белков. При наличии этого механизма бактерии проявляют устойчивость и к ампициллину и к амоксициллину/клавуланату. Возможны сочетания двух описанных механизмов. Данные о динамике распространения устойчивости H.influenzae к основным бета-лактамам в Москве свидетельствуют о том, что во все годы наблюдения основным механизмом устойчивости к ампициллину была продукция бета-лактамаз, при этом общая частота устойчивости в период с 2002 по 2005 г. колебалась в пределах от 3,0 до 4,9 %. Рост частоты устойчивости к ампициллину до 10,7 % наблюдали в 2006 г., в основном за счет продукции бета-лактамаз. Штаммов, устойчивых к цефтриаксону, выявлено не было.
При интерпретации результатов оценки чувствительности H.influenzae к бета-лактамам необходимо обратить внимание на одну особенность. В документах, регламентирующих оценку антибиотикочувствительности, отсутствуют критерии чувствительности микроорганизма к амоксициллину. На практике оценивают чувствительность к ампициллину и переносят результаты на амоксициллин.
Интерпретация результатов оценки чувствительности H.influenzae к макролидам является спорным моментом. С микробиологической точки зрения H.influenzae можно считать чувствительной к макролидным антибиотикам, при этом наибольшей природной активностью в отношении микроорганизма характеризуется азитромицин, эритромицин ему уступает, еще менее активен кларитромицин. Наличие активного метаболита у кларитромицина повышает его активность в отношении H.influenzae за счет суммирования антимикробных эффектов антибиотика и его метаболита.
Минимальная подавляющая концентрация (МПК) всех макролидов в отношении этого микроорганизма существенно выше, чем в отношении грамположительных бактерий. Этот факт объясняется наличием у H.influenzae конститутивно функционирующей системы активного выведения макролидов. Фармакодинамические расчеты свидетельствуют, что концентрации макролидных антибиотиков, создающиеся в очаге инфекции, недостаточны для эрадикации H.influenzae. Эти данные подтверждаются клиническими наблюдениями о недостаточной бактериологической эффективности макролидов при гемофильных инфекциях.
Приведенные факты в достаточной степени подтверждают точку зрения о том, что H.influenzae следует считать природно устойчивой к макролидным антибиотикам и обосновывают скептическое отношение к многочисленным публикациям о низкой частоте устойчивости H.influenza e к макролидам.
Из других антибактериальных препаратов, применяемых для лечения инфекций, вызванных H.influenzae, следует отметить фторхинолоны. Ципрофлоксацин, офлоксацин и моксифлоксацин обладают сходной активностью в отношении H.influenzae, устойчивости к этим препаратам в Российской Федерации не зарегистрировано.
Частота устойчивости к тетрациклину и ко-тримоксазолу среди H.influenzae колеблется в пределах 8–10 % и 30–40 % соответственно.
Частота бета-лактамазопродуцирующих штаммов H.influenzae в Европе значительно варьирует и достигает во Франции 22 %, Великобритании — 18,0 %, Германии — 6,7 %, Польше — 2,0 %, Италии — 2,0 % [33].
Значительную проблему представляет резистентность P.aeruginоsa. По данным исследования [30], внебольничные респираторные штаммы Pseudomonas spp. были устойчивы к цефтазидиму в 29 % случаев, к амикацину — в 24 %, к имипенему и ципрофлоксацину — в 19 % случаев.
В любом случае, поскольку риск инфицирования резистентной микрофлорой у конкретного больного тесно связан с предшествующим применением антибиотиков, сведения о применяемых ранее антибиотиках всегда должны учитываться при индивидуальном выборе стартовой эмпирической антимикробной терапии [1].
5. Можно ли по каким-либо признакам прогнозировать этиологию бактериальных обострений ХОЗЛ без проведения микробиологического анализа мокроты?
Исследования, выполненные у больных с легкими обострениями ХОЗЛ, не нуждавшихся в госпитализации, показали, что наиболее частыми этиологическими агентами являются H.influenzae (нетипируемые и некапсулированные), S.pneumoniae и M.catarrhalis [34]. У больных с тяжелым течением обострения ХОЗЛ, нуждающихся в проведении искусственной вентиляции легких (ИВЛ), у которых значение ОФВ 1 в среднем составляло 30 % от должного, эти микроорганизмы выделялись значительно реже, зато возрастала значимость грамотрицательных палочек и P.aeruginosa [35].
В других исследованиях была установлена четкая зависимость этиологической структуры обострения ХОЗЛ от ОФВ1. У больных с легким обострением ХОЗЛ преобладающим возбудителем является S.pneumoniae, по мере снижения ОФВ1 возрастает роль H.influenzae и M.catarrhalis. У больных с тяжелым обострением ХОЗЛ, частыми обострениями, для купирования которых требуется применение антимикробных препаратов и глюкокортикостероидов, этиологическая структура является более сложной, с преобладанием грамотрицательных палочек и P.aeruginosa [36] (рис. 1).
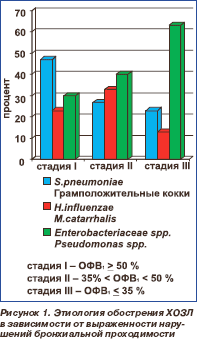
6. Каковы факторы риска инфицирования P.aeruginosa у больных с обострением ХОЗЛ?
Инфекция, обусловленная P.aeruginosa , заслуживает самого пристального внимания, так как требует проведения специфической и длительной антимикробной терапии. По данным исследований, посвященных проблемам респираторных инфекций (обострение ХОЗЛ, нозокомиальная пневмония, бронхоэктатическая болезнь), высокий риск возникновения синегнойной инфекции может быть связан с низкими функциональными показателями легких, частотой проведения курсов антимикробной терапии, терапией системными стероидами, истощением больного и наличием бронхоэктазов. По данным российского исследования с использованием логистической регрессионной модели, единственным значимым независимым предиктором синегнойной инфекции оказалось число госпитализаций больного более 4 раз в год. Фактор, имевший значение по данным одновариантной модели — повторные курсы лечения системными стероидами, утратил свою силу в многовариантной модели, что можно объяснить высокой корреляцией между числом курсов терапии стероидами и числом госпитализаций. В то же время оценка числа госпитализаций более точна, и этот показатель лучше подходит для оценки риска [30].
В Европейском руководстве 2005 года [1] к группе высокого риска инфицирования P.aeruginosa относятся больные, к которым применимы минимум два из следующих критериев: 1) недавнее пребывание в стационаре; 2) частое (более 4 раз за год) или недавнее (в течение 3 предшествующих месяцев) применение антибиотиков; 3) тяжелое течение ХОЗЛ (ОФВ1 < 30 %); 4) выделение P.aeruginosa во время предыдущих обострений ХОЗЛ или доказательства колонизации дыхательных путей больного P.aeruginosa.
7. В каких случаях больным с обострением ХОЗЛ следует проводить микробиологические исследования мокроты?
Основные цели, которые преследуют микробиологические исследования при ИНДП, в том числе и при обострении ХОЗЛ: 1) выявить больных, которым антибактериальная терапия (АБТ) принесет очевидную пользу путем верификации бактериального генеза обострения ХОЗЛ и 2) обеспечить возможность «прицельной» этиотропной терапии антимикробным препаратом с узким спектром активности для предотвращения развития резистентности микрофлоры, уменьшения количества нежелательных лекарственных явлений и уменьшения стоимости лечения. В ряде случаев микробиологические исследования имеют целью выявление особых патогенов, представляющих серьезную угрозу для общества, например туберкулезной палочки или легионеллы.
Поиск этиологического агента обострения ХОЗЛ в бронхиальном секрете при помощи культуральных методов представляет определенные проблемы. С учетом того, что у части больных ХОЗЛ даже в период стабильного течения заболевания доказано присутствие микроорганизмов в дыхательных путях (колонизация), сам по себе факт обнаружения бактерий в бронхиальном секрете еще не служит доказательством бронхиальной инфекции. Лишь доказательство увеличения бактериальной нагрузки в дистальных отделах дыхательных путей является признаком острого инфекционного процесса.
Еще одной трудностью при исследовании мокроты является орофарингеальная контаминация. Преодолеть эту проблему позволяет метод биопсии с использованием защищенных щеток, при котором образец секрета из дистальных дыхательных путей не контактирует с орофарингеальным секретом, что препятствует контаминации материала микроорганизмами из верхних дыхательных путей. Однако несмотря на некоторые преимущества метода биопсии с использованием защищенных щеток, его использование в рутинной клинической практике дорого и обременительно.
Более простым и доступным методом является посев экспекторированной мокроты (или реже жидкости БАЛ). Перед микробиологическим исследованием материала, полученного подобным образом, обязательна предварительная оценка его пригодности. Критерии пригодности образца мокроты достаточно жесткие, ориентированы на получение наиболее достоверного результата и должны соответствовать критериям Murrey — Washington (< 10 эпителиальных клеток и > 25 лейкоцитов в поле зрения (при увеличении ×100)). Наряду с этим диагностическое значение имеет и концентрация бактерий: > 106 КОЕ/мл. Однако следует принимать во внимание, что исследований, посвященных диагностической ценности окрашивания образцов мокроты по Граму, крайне мало, а в исследованиях, изучавших возможности этого метода верификации респираторных патогенов у госпитализированных больных с инфекциями НДП, выявлена низкая чувствительность данного метода [1].
Недостатки и ограничения метода окраски мокроты по Граму распространяются также на культуральные методы исследования мокроты и на определение антигенов пневмококка в мокроте и моче. Причинами сдержанного отношения к перечисленным методам являются: 1) их низкая чувствительность — вероятный респи раторный патоген определяется только у 20–50 % больных; 2) невозможность достоверного разграничения колонизации и новой бактериальной инфекции.
Учитывая вышеизложенное, следует отметить, что микробиологические исследования в рутинной клинической практике у больных с ОХОЗЛ не являются обязательными. Эмпирическая антимикробная терапия осуществляется с учетом оценки тяжести клинических проявлений ХОЗЛ и данных о локальной чувствительности респираторных патогенов.
Проведение микробиологического исследования (культуральное исследование мокроты или эндотрахеального аспирата у больных, находящихся на искусственной вентиляции легких) показано: 1) для пациентов с тяжелым обострением ХОЗЛ; 2) больных, имеющих факторы риска инфицирования отдельными возбудителями (P.aeruginosa); 3) больных с факторами риска инфицирования резистентной микрофлорой (предшествующая терапия антибиотиками, системными стероидами, большая длительность ХОЗЛ, более 4 обострений в год, ОВФ1 < 30 %); 4) в случае неэффективности стартовой антимикробной терапии [1].
8. Влияет ли антибактериальная терапия на течение и прогноз при ХОЗЛ?
Имеющиеся доказательства роли бактериальной инфекции в развитии ОХОЗЛ, подтвержденные культуральными исследованиями мокроты, бронхоскопическими исследованиями, типированием штаммов респираторных патогенов, иммунологическими методами, а также усугубление прогрессирования ХОЗЛ вследствие рецидивов обострений, казалось бы, должны служить твердой теоретической предпосылкой для эффективности антимикробной терапии в лечении ОХОЗЛ. Тем не менее ее эффективность продолжает вызывать дискуссии по двум основным причинам: 1) стойкая колонизация дыхательных путей в период стабильного течения заболевания часто теми же микроорганизмами, которые выделяются у больных в период обострения ХОЗЛ; 2) наличие других, небактериальных причин обострения ХОЗЛ.
Результаты исследований, изучающих роль бактериальной инфекции и эффективность антимикробной терапии у больных с обострением ХОЗЛ, противоречивы. Анализ эффективности антимикробной терапии ОХОЗЛ проводится по таким основным направлениям: 1) влияние на течение эпизода обострения ХОЗЛ; 2) способность антибиотиков предотвращать обострения ХОЗЛ; 3) их способность предотвращать прогрессирующее снижение функциональных показателей легких, характерное для ХОЗЛ.
В метаанализе плацебо-контролируемых исследований, изучавших влияние антибиотиков на течение ОХОЗЛ, применение антибиотиков сопровождалось незначительным, но достоверным улучшением купирования обострения и пиковой скорости выдоха [37].
Однако в большинстве исследований, оценивающих влияние антимикробной терапии на краткосрочный прогноз (под которым понимается значительное улучшение клинической симптоматики, позволяющее отменить антимикробную терапию), сравнивают один антибиотик с другим. Это приводит к сравнению неоднородных групп больных, с различной тяжестью заболевания. Кроме того, большинство таких исследований обладают недостаточной статистической мощностью, чтобы доказать преимущества антимикробного препарата [38]. В результате почти во всех подобных исследованиях демонстрируется клиническая эквивалентность, даже если один из сравниваемых препаратов обеспечивает достоверно лучшую эрадикацию возбудителя [38]. Данное противоречие объясняется следующим: большинство респираторных инфекций, вызывающих обострение ХОЗЛ, относятся к поверхностным, хотя могут захватывать слизистую оболочку, и при достаточной иммунной защите макроорганизма возможно спонтанное выздоровление [39]. Поэтому вероятность выявления разницы в эффективности различных антибиотиков должна быть выше у больных с более тяжелым течением ХОЗЛ или у больных с факторами риска неблагоприятного исхода [38]. В то же время у больных, у которых антимикробная терапия не привела к эрадиакации респираторных патогенов, возможно клиническое улучшение вследствие уменьшения количества бактерий (бактериальной нагрузки), хотя купирование обострения будет неполным и с более быстрым наступлением рецидива, что обусловливает необходимость проведения исследований с длительным наблюдением за больными [40].
В целом АБТ не влияет на количество эпизодов обострения ХОЗЛ, но уменьшает количество обусловленных ними дней нетрудоспособности, хотя у больных с тяжелой бронхиальной обструкцией, особенно у выделяющих гнойную мокроту, антимикробная терапия значительно уменьшает длительность клинических проявлений обострения и имеет преимущества с точки зрения соотношения «стоимость/эффективность» [41].
В недавнем исследовании были показаны преимущества моксифлоксацина над стандартной терапией по такому показателю, как полнота эрадикации, что выражалось в более длительном безинфекционном периоде в течение первых 5 месяцев после обострения [42]. Таким образом, получено косвенное подтверждение того, что эффективная антимикробная терапия, приводящая к успешной эрадикации респираторных патогенов, может предотвращать рецидивы обострения по крайней мере в течение первых месяцев после лечения.
9. Для каких больных с обострением ХОЗЛ целесообразно проведение антимикробной терапии?
Ответом на этот вопрос могут служить результаты классического исследования Anthonisen и соавт., показавшие эффективность антибактериальной терапии, достоверно превышающую таковую плацебо, у больных со всеми тремя симптомами обострения ХОЗЛ: усиление одышки, увеличение объема и гнойности мокроты (I тип обострения ХОЗЛ по Anthonisen) [4]. У больных с обострением II типа (два симптома из трех вышеперечисленных) и III типа (один из трех симптомов) эффективность антибиотиков достоверно не отличалась от эффективности плацебо.
Это исследование, однако, было выполнено у амбулаторных больных, а критерии Anthonisen и соавт. не проверялись у пациентов, нуждающихся в госпитализации.
По данным Кокрейновского обзора, включавшего 11 рандомизированных контролируемых исследований (РКИ), выполненных у больных с обострениями ХОЗЛ средней и тяжелой степени, назначение антибиотиков сопровождалось снижением риска смерти на 77 %, риска неэффективности лечения на 53 %, гнойности мокроты на 44 %. При этом незначительно повышался риск антибиотикассоциированной диареи, а влияниt антимикробной терапии на газовый состав артериальной крови и пиковую скорость выдоха выявлено не было. Авторы обзора сделали вывод о том, что применение антимикробной терапии эффективно у больных с обострениями ХОЗЛ средней и тяжелой степени, у которых имеется усиление кашля и гнойности мокроты [43].
В двух рандомизированных исследованиях уточняли показания к назначению антимикробных препаратов. В одном из них, включавшем амбулаторных больных с легких обострением ХОЗЛ, показано отсутствие эффекта от применения антибиотиков [44], в другом, проведенном у пациентов с тяжелым обострением ХОЗЛ, требующих проведения ИВЛ, установлено, что отсутствие антимикробной терапии сопровождается ухудшением прогноза и повышением частоты внутрибольничных инфекций [45].
С учетом полученных данных в настоящее время показаниями для антимикробной терапии при обострении ХОЗЛ являются: 1) обострение I типа (усиление одышки, увеличение продукции и гнойности мокроты); 2) обострение II типа, если одним из двух симптомов является повышение гнойности мокроты; 3) обострение у больных с тяжелым течением ХОЗЛ, требующих инвазивной или неинвазивной искусственной вентиляции легких [1].
10. Чем обусловлен выбор стартовой антимикробной терапии при обострении ХОЗЛ?
Для эмпирического выбора стартовой антимикробной терапии целесообразно проводить стратификацию больных с ОХОЗЛ на группы в зависимости от наличия наиболее вероятных респираторных патогенов. Такая стратификация должна учитывать множество факторов, относящихся к больному: факторы риска инфицирования тем или иным микроорганизмом, прежде всего штаммами S.pneumoniae, резистентными к пенициллину и макролидам, бета-лактамазопродуцирующими штаммами H.influenzae, — в первую очередь недавний прием антимикробных препаратов; факторы риска инфицирования P.aeruginosa; клинические проявления обострения ХОЗЛ. Использование ОФВ1 не всегда приемлемо для проведения стратификации больных, например в неотложной ситуации. Тем не менее этот показатель коррелирует с этиологической структурой бактериального обострения ХОЗЛ и широко используется при выборе стартовой эмпирической антимикробной терапии.
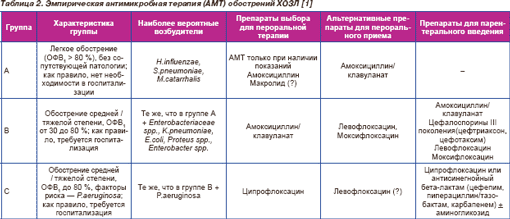
Предлагается следующая стратификация больных на группы [1]:
Группа А: больные с легким обострением (ОФВ1 ≥ 80 %), без сопутствующей патологии; как правило, не требующие госпитализации.
Группа В: больные с обострением средней тяжести (ОВФ1 от 50 до 80 %) или тяжелым обострением (ОФВ1 от 30 до 50 %), без факторов риска инфицирования P.aeruginosa; нуждаются в госпитализации.
Группа С: больные с обострением ХОЗЛ от средней до тяжелой и очень тяжелой степени (ОФВ1 < 50 %) и факторами риска инфицирования P.aeruginosa; необходима госпитализация.
У больных группы А наиболее частыми возбудителями являются (в порядке убывания значимости) H.influenzae, S.pneumoniae, M.catarrhalis. Препаратами выбора являются амоксициллин, ампициллин или доксициклин, предпочтительный путь введения — прием внутрь [1].
При выборе аминопеницилиинов для перорального приема у больных данной группы, учитывая фармакокинетические / фармакодинамические особенности препаратов, предпочтение следует отдавать амоксициллину (табл. 1).
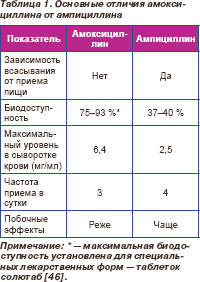
Однако в странах с высоким уровнем резистентности S.pneumoniae, а также при высокой частоте бета-лактамазопродуцирующих штаммов H.influenzae данные препараты могут приводить к клиническим неудачам.
Амоксициллин проявляет клиническую и бактериологическую эффективность в отношении умеренно устойчивых и части устойчивых пневмококков. В случае высокой частоты штаммов H.influenzae, продуцирующих бета-лактамазы, целесообразно назначение амоксициллина/клавуланата, возможно повышение разовой дозы до 875 мг амоксициллина и 125 мг клавуланата.
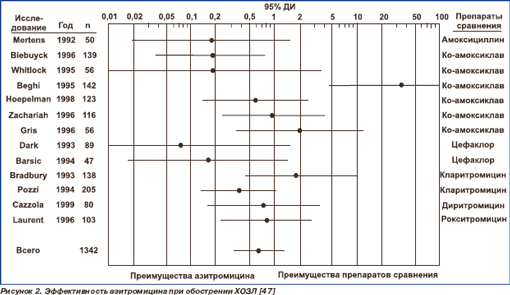
Хотя многие штаммы пневмококка (до 30– 50 %) и H.influenzae устойчивы к макролидам в странах Западной Европы, результаты клинических исследований свидетельствуют о хорошей клинической эффективности макролидов, сопоставимой с другими антибактериальными препаратами, в том числе амоксициллином и амоксициллином/клавуланатом. Возможным объяснением является наличие у макролидов противовоспалительных эффектов (рис. 2).
Группа В. Наиболее типичными респираторными патогенами у больных данной группы являются микроорганизмы, актуальные и для группы А, но увеличивается частота выделения грамотрицательной флоры — представителей семейства Enterobacteriaceae: K.pneumoniae, E.coli, Proteus spp., Enterobacter spp. Факторы риска инфицирования синегнойной палочкой отсутствуют.
Препаратами выбора являются амоксициллин/клавуланат и респираторные фторхинолоны. Левофлоксацин и моксифлоксацин высокоактивны в отношении S.pneumoniae и H.influenzae и создают высокие концентрации в бронхиальном секрете, намного превышающие МПК для данных возбудителей, а также обладают высокой активностью в отношении грамотрицательных палочек (моксифлоксацин, кроме P.aeruginosa).
Предпочтительный путь введения пероральный, при необходимости возможно и парентеральное введение этих препаратов.
Альтернативными препаратами являются цефалоспорины III поколения (цефтриаксон и цефотаксим), также обладающие хорошей активностью в отношении потенциальных возбудителей. Преимущества цефтриаксона заключаются в возможности однократного внутримышечного введения, поэтому он может применяться в амбулаторных условиях.
Группа С. Наиболее актуальные патогены — те же, что и в группе В, но имеются и факторы риска инфицирования P.aeruginosa.
Наиболее предпочтительным антимикробным препаратом для приема внутрь является ципрофлоксацин, обладающий хорошей активностью в отношении P.aeruginosa, H.influenzae, M.catarrhalis и других грамотрицательных палочек. Недостатком является его низкая антипневмококковая активность, но у больных данной группы пневмококк выделяется редко.
Серьезную угрозу представляет рост резистентности P.aeruginosa, наблюдаемый в большинстве европейских стран. С целью преодоления возможной резистентности рекомендуется доза ципрофлоксацина 750 мг каждые 12 часов, обеспечивающая высокие концентрации препарата в сыворотке крови и бронхиальном секрете.
Левофлоксацин получил одобрение FDA (Food and Drug Administration, США) в дозе 750 мг/сут. в качестве антисинегнойного препарата, хотя клинические данные о его эффективности в настоящее время недостаточны [48].
При необходимости парентерального введения антибиотиков возможно применение ципрофлоксацина или антисинегнойных бета-лактамов. Как правило, они назначаются вместе с аминогликозидами, хотя убедительных данных о преимуществах комбинированной антимикробной терапии не получено [1].
Выбор антимикробой терапии для больных с обострениями ХОЗЛ представлен в табл. 2.
11. Какова продолжительность антимикробной терапии обострения ХОЗЛ?
Длительность антимикробной терапии при ОХОЗЛ составляет в среднем 7–10 дней. В ряде исследований показано, что эффективность 5-дневной терапии левофлоксацином и моксифлоксацином сопоставима с эффективностью 10-дневной терапии бета-лактамными антибиотиками.
Если антибиотик сначала вводился парентерально, целесообразен переход на пероральный прием антибиотиков при клинической стабилизации больного, как правило, через 3–5 дней после начала парентеральной антимикробной терапии [1].
12. Существуют ли другие факторы кроме собственно антимикробной активности препарата, влияющие на выбор антимикробного препарата для лечения обострения ХОЗЛ?
Результаты метаанализа 19 РКИ показали одинаковое влияние макролидов, фторхинолонов и амоксициллина/клавуланата на краткосрочный прогноз у больных с бактериальным обострением хронического бронхита. При этом фторхинолоны характеризовались лучшей микробиологической эффективностью и меньшей частотой рецидивов по сравнению с макролидами, а амоксициллин/клавуланат имел наибольшее количество нежелательных лекарственных явлений (преимущественно антибиотикассоциированная диарея) [49].
Учитывая клиническую эквивалентность антимикробных препаратов основных классов, при выборе антимикробных препаратов, очевидно, следует ориентироваться на профиль безопасности антибиотика, а также на угрозу роста резистентности возбудителей. И с этой точки зрения широкое назначение фторхинолонов больным с нетяжелым обострением ХОЗЛ следует ограничивать, что позволит сдерживать рост резистентности к этому классу препаратов [50].
В то же время у ряда больных стартовая терапия фторхинолонами может быть оправдана. При сравнительном анализе эффективности различных антимикробных препаратов, выполненном методом математического моделирования, были показаны достоверно более высокая клиническая эффективность фторхинолонов (левофлоксацин, ципрофлоксацин, моксифлоксацин) и высоких доз амоксициллина/клавуланата у больных с обострениями ХОЗЛ легкой / средней и тяжелой степени (89,2–90,5 % и 80,3–88,1 % соответственно). Антимикробные препараты других групп (цефаклор, азитромицин, эритромицин и кларитромицин) проявляли более низкую клиническую эффективность при обострениях легкой / средней и тяжелой степени (79,1–81,3 % и 51,8–55,6 % соответственно), которая не намного отличалась от эффективности плацебо (45,5–73,6 %) [51].
И хотя результаты этой работы следует воспринимать с определенной осторожностью, поскольку она выполнена методом математического прогнозирования, большая вероятность положительного клинического исхода делает эту группу препаратов достаточно привлекательной для больных с высоким риском неблагоприятного исхода. В данную категорию попадают: больные пожилого возраста (старше 65 лет); лица с ОФВ1 < 50 % в стабильную фазу ХОЗЛ (повышается вероятность инфицирования P.aeruginosa); пациенты с 3 и более обострениями ХОЗЛ в течение последнего года; больные, у которых имеется сопутствующая патология (особенно сердечно-сосудистые заболевания); лица, госпитализированные в отделение интенсивной терапии вследствие тяжелого обострения ХОЗЛ; пациенты с факторами риска инфицирования резистентной микрофлорой [49].
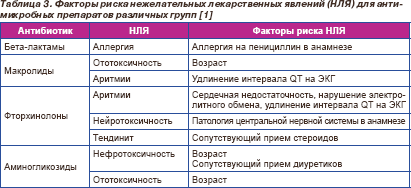
Выбор антимикробных препаратов с учетом профиля безопасности представлен в табл 3.
13. Каковы причины неэффективности стартовой антимикробной терапии обострения ХОЗЛ и методы их коррекции?
Примерно у 10–20 % больных стартовая эмпирическая антибактериальная терапия неэффективна. После пересмотра возможных причин неэффективности терапии, не связанных с собственно антимикробной терапией (неадекватная сопутствующая терапия, нераспознанные эмболия легочной артерии, сердечная недостаточность и т.д.) рекомендуется микробиологическое исследование мокроты, которое позволяет выделить возбудителя и определить спектр его чувствительности к антибиотикам.
Наиболее частые причины неэффективности стартовой антимикробной терапии, связанные с микробиологическими аспектами: инфицирование P.aeruginosa, S.aureus (включая штаммы, резистентные к метициллину), ацинетобактерии и другие неферментирующие микроорганизмы. Реже встречаются случаи инфицирования Aspergillus spp. (особенно у больных, длительно получающих терапию стероидами) и высокорезистентные штаммы S.pneumoniae.
Возможно также присоединение внутрибольничных респираторных инфекций, особенно у больных, находящихся на инвазивной ИВЛ [1].
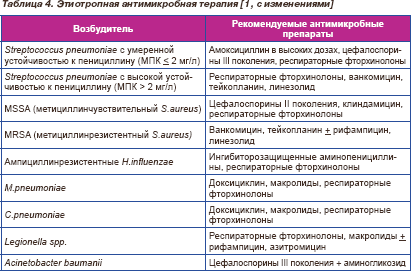
После получения результатов микробиологического исследования проводится коррекции антимикробной терапии. Препараты, рекомендованные для лечения респираторных инфекций, вызванных известными патогенами, представлены в табл. 4.
1. Woodhead. M. et al. // Eur. Respir. J. — 2005. — 26: 1138-80.
2. BTS guidelines for the management of chronic obstructive pulmonary disease. The COPD Guidelines Group of the Standards of Care Committee of the BTS // Thorax. — 1997. — 52 (Suppl. 5). — S1-S28.
3. Rodriguez-Roisin R. // Chest. — 2000. — 117 (5 Suppl. 2). — 398S-401S.
4. Anthonisen N.R. et al. // Ann. Intern. Med. — 1987. — 106. — 196-204.
5. Seemungal T.A. et al. // Am. J. Respir. Crit. Care Med. — 1998. — 157 (5 Pt 1). — 1418-22.
6. Ball P. et al. // QJM. — 1995. — 88. — 61-8.
7. O'Brien C. et al. // Thorax. — 2000. — 55. — 635-42.
8. From the Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2006. http://www.goldcopd.org
9. Monso E. et al. // Am. J. Respir. Crit. Care Med. — 1995. — 152. — 1316-20.
10. Rosell A. et al. // Arch. Intern . Med . — 2005. — 165 (8). — 891-7.
11. Гучев И.А., Сидоренко С.В. // Инфекции и антимикробная терапия. — 2003. — 6 (5).
12. Ноников В.Е., Ленкова Н.И. // РМЖ. — 2003. — 11 (22). — 1263-5.
13. Федосеев Г.Б. Механизмы воспаления бронхов и легких и противовоспалительная терапия. — Санкт-Петербург, 1998.
14. Караулов А.В., Кокушков Д.В. // Пульмонология и аллергология. — 2005. — (3). — 61-3.
15. Sethi S. et al. // N. Engl. J. Med. — 2002. — 347. — 465-71.
16. Lieberman D. et al. // Eur. J. Clin. Microbiol. Infect. Dis. — 2001. — 20. — 698-704.
17. Seemungal T. et al. // Am. J. Respir. Crit. Care Med. — 200. — 1618-23.
18. Fletcher C.M. // Am. Rev. Respir. Dis. — 1959. — 80. — 483-94.
19. Fletcher C., Peto R., Tinker C., Speizer F.E. The natural history of chronic bronchitis and emphysema. — New York; Toronto: Oxford University Press, 1976.
20. Kanner R.E. et al. // Am. J. Respir. Crit. Care Med. — 2001. — 164. — 358-64.
21. Donaldson G.C. et al. // Thorax. — 2002. — 57. — 847-52.
22. Wilkinson T.M.A. et al. // Am. J. Respir. Crit. Care Med. — 2003. — 167. — 1090-5.
23. Banerjee D. et al. // Eur. Respir. J. — 2004. — 23. — 685-91.
24. Bhowmik A. et al. // Thorax. — 2000. — 55. — 114-20.
25. Hill A.T. et al. // Am. J. Med. — 2000. — 109. — 288-95.
26. Sin D.D., Man S.F.P. // Circulation. — 2003. — 107. — 1514-9.
27. Soler N. et al. // Thorax. — 2007. — 62. —29-35.
28. Hill A.T. et al. // Am. J. Respir. Crit. Care Med. — 1999. — 160. — 893-8.
29. Stockley R.A. et al. // Chest. — 2000. — 117. — 1638-45.
30. Авдеев С.Н. и соавт. // Клин. микробиол. антимикроб. химиотер. — 2005. — 7 (3). — 245-54.
31. Сидоренко С.В. // Consilium-medicum. — 2007. — 9 (1).
32. European Antimicrobial Resistance Surveillance System.database. www.earss.rivm.nl/PAGINA/interweb-site/home_earss.html
33. Schito G.C. // J. Antimicrob. Chemother. — 2000. — 11-15.
34. Monso E. et al. // Eur. Respir. J. — 1999. — 13. — 338-42.
35. Soler N. et al. // Am. J. Respir. Crit. Care Med. — 1998. — 157. — 1498-1505.
36. Eller J. et al. // Chest. — 1998. — 113. — 1542-48.
37. Saint S.K. et al. // JAMA. — 1995. — 273. — 957-60.
38. Wilson R. // Eur. Respir. J. — 2001. — 17. — 995-1007.
39. Bandi V. et al. // FEMS Immunol. Med. Microbiol. — 2003. — 37. — 69-75.
40. Wilson R. et al. // Thorax. — 2006. — 61. — 337-42.
41. Dever L.L. et al. // Expert. Opin. Investig. Drugs. — 2002. — 11 (7). — 911-25.
42. Wilson R. et al. // Chest. — 2004. — 125. — 953-64.
43. Ram F.S. et al. Antibiotics for exacerbations of chronic obstructive pulmonary disease // Cochrane Database Syst Rev. — 2006 Apr 19. — (2). — CD004403.
44. Evans A.T. et al. // Lancet. — 2002. — 359. — 1648-54.
45. Nouira S. et al. // Lancet. — 2001. — 358. — 2020-5.
46. Практическое руководство по анти инфекционной химиотерапии / Под ред. Л.С. Страчункского, Ю.Б. Белоусова, С.Н. Козлова. — Москва: Боргес, 2002.
47. Contopoulos-Ioannidisa D.G. // J. Antimicrob Chemother. — 2001 Nov. — 48 (5). — 691-703.
48. Dewan N.A. et al. // Chest. — 2000. — 117. — 662-71.
49. Siempos I.I. et al. // Eur. Respir. J. — 2007. — 29. — 1127-37.
50. Miravitlles M., Torres A. // Eur. Respir. J. — 2004. — 24. — 896-7.
51. Canut A. et al. // J. Antimicrob. Chemother. doi: 10.1093/jac/dkm228 JAC Advance Access published online on June 26, 2007.
