Газета «Новости медицины и фармации» Гастроэнтерология (473) 2013 (тематический номер)
Вернуться к номеру
Клиническая эффективность комбинации эссенциальных фосфолипидов и глутаргина при хроническом абдоминальном ишемическом синдроме
Авторы: Губергриц Н.Б., Агапова Н.Г. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Авторы подробно изучили влияние комбинации эссенциальных фосфолипидов и глутаргина на проявления абдоминального ишемического синдрома. Доказана эффективность комбинированной терапии в отношении уменьшения выраженности клинических проявлений, коррекции липидного спектра крови, улучшения функционального состояния печени и поджелудочной железы. При лечении комбинацией эссенциальных фосфолипидов и глутаргина существенно повысился уровень метаболитов оксида азота в крови, улучшились психосоматический статус и качество жизни больных.
В практической деятельности врача нередко встречаются пациенты с «необъяснимыми» болями в животе. При этом не выявляется органических изменений органов брюшной полости, которые могли бы объяснить столь интенсивные боли. В ряде случаев этот болевой синдром связан с абдоминальной ишемией. Хронический абдоминальный ишемический синдром (АИС) в течение многих лет является сложной проблемой для практического врача. Причем если еще 2–3 десятка лет назад диагностика АИС действительно была сложной изза необходимости подтверждения диагноза с помощью ангиографии, то в настоящее время диагноз можно поставить с помощью доступного неинвазивного метода — допплерографии. Диагностика и лечение АИС являются важными задачами как в научном, так и в практическом отношении. Нерешенными частями общей проблемы АИС являются недостаточные знания о патогенезе, функциональных нарушениях со стороны органов брюшной полости и недостаточная эффективность лечения [3, 4].
Целью нашего исследования явилось изучение эффективности и переносимости комбинированной терапии препаратами, содержащими эссенциальные фосфолипиды, и глутаргином при хроническом АИС.
Задачи исследования:
— Изучить влияние исследуемой комбинации препаратов на состояние функции печени и поджелудочной железы, липидный и углеводный обмен у больных с хроническим абдоминальным ишемическим синдромом.
— Изучить влияние исследуемой комбинации препаратов на психосоматический статус и качество жизни пациентов.
— Изучить переносимость и возможные побочные явления исследуемой комбинации препаратов.
Материалы и методы
Обследовано 60 пациентов с АИС до и после лечения, а также 30 практически здоровых. При отборе больных мы пользовались следующими критериями включения:
— мужчины и женщины в возрасте 50–75 лет;
— клинические и инструментальные признаки АИС;
— отсутствие резкого повышения (не больше чем в 3 раза) уровней АЛТ, АСТ, щелочной фосфатазы (ЩФ), глутамилтранспептидазы (ГГТ), амилазы, панкреатической изоамилазы (Ризоамилазы), липазы крови;
— пациенты, способные дать согласие перед включением в исследование и выполнять процедуры исследования.
Критериями исключения были: участие в какомлибо клиническом испытании в предшествующие настоящему исследованию 30 дней; одновременное участие в другом клиническом испытании; несоответствие больного критериям протокола включения; алкоголизм, алкогольная зависимость (прием этанола > 80 г/день для мужчин и > 40 г/день для женщин); ВИЧинфицирование пациента; наркомания; печеночная недостаточность; цирроз печени; механическая желтуха; вирусный гепатит (положительные реакции на HBsAg, antiHBcor, antiHCV); признаки энцефалопатии; новообразования печени и других органов и систем; острые инфекционные заболевания; острый холецистит; острый панкреатит; признаки портальной гипертензии; психические заболевания; признаки нарушения гемокоагуляции; постоянный гемодиализ; известная гиперчувствительность к эссенциальным фосфолипидам, аргинина глутамату или к любому неактивному компоненту исследуемых препаратов; хронические заболевания с декомпенсацией органов и систем II–III степени; больные, которые, вероятно, не будут выполнять требования протокола или не способны выполнить их, включая предоставление согласия (неспособность дать согласие изза умственной отсталости или языкового барьера); трудность поддержания контакта с больным во время исследования; чрезмерное, по мнению врача, употребление чая, кофе, табака; беременность и лактация; заболевания почек и мочевыводящей системы с ХПН (креатинин 0,15 ммоль/л); лейкоциты ниже 2000/мкл; тромбоциты ниже 70 000/мкл; выраженная гипербилирубинемия. Кроме того, в исследование не включались пациенты, которые нуждались в приеме запрещенных для данного протокола препаратов: средств, влияющих на уровень липидов в крови; других гепатопротекторов; других препаратов, содержащих Lаргинин (кроме глутаргина); глюкокортикоидов (в том числе ингаляционных); интерферонов; иммуносупрессоров; иммуномодуляторов; любых препаратов, обладающих гепатотоксическим действием.
Для оценки эффективности лечения оценивали динамику субъективных проявлений АИС (болевого, диспептического синдромов), проводили аускультацию брюшного отдела аорты, определяли индекс массы тела, психосоматический статус (опросник САН) и качество жизни пациентов (опросник SF36).
Интенсивность боли и других субъективных проявлений оценивалась с помощью полуколичественной шкалы: 0 баллов — проявления отсутствуют, 1 балл — проявления минимальные, 2 балла — проявления умеренные, 3 балла — проявления выраженные или очень выраженные. С учетом этой шкалы вычисляли среднюю степень тяжести (ССТ) различных клинических проявлений по формуле:
a + 2b + 3c
ССТ = ___________,
a + b + c + d
где а — количество больных с оценкой признака в 1 балл; b — количество больных с оценкой признака в 2 балла; c — количество больных с оценкой признака в 3 балла; d — количество больных с отсутствием признака.
До и после лечения изучали содержание в крови общих липидов, липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности (ЛПВП), липопротеидов очень низкой плотности (ЛПОНП), триглицеридов, холестерина, холестерина, уровни глюкозы, иммунореактивного Спептида, активность АЛТ, АСТ, ЩФ, ГГТП. Кроме того, исследовали показатели билирубина и его фракций, общего белка, протеинограммы, метаболитов NO в крови. Для выявления феномена «уклонения» панкреатических ферментов в кровь и оценки внешнесекреторной функции поджелудочной железы анализировали активность амилазы, Ризоамилазы в крови и моче, липазы крови. Анализировали дебиты уроамилазы (D) и коэффициенты индукции эндогенного панкреозимина (К) натощак (D1), через 30 (D2 и К1) и 60 (D3 и К2) минут после стандартной пищевой нагрузки (100 г белого хлеба, 20 г сливочного масла, 100 г творога, 200 мл чая с 5 г сахара). Проводили прямое (зондовое) исследование внешнесекреторной функции поджелудочной железы. Для этого использовали двухканальный гастродуоденальный зонд и эуфиллинкальциевый тест [2]. В получаемом дуоденальном содержимом изучали его объем, дебитчас амилазы, Ризоамилазы, бикарбонатов. Дуоденальное зондирование проводили только один раз — после лечения (во избежание усиления панкреатических болей при поступлении больных в клинику). Кроме того, изза наличия ИБС, артериальной гипертензии это исследование проведено не всем больным (выполнено у 36 пациентов).
Активность амилазы и Ризоамилазы в крови, моче и дуоденальном содержимом исследовали на биохимическом анализаторе Vitalab Flexor2000 (Нидерланды) с использованием наборов фирмы Lachema (Чехия). Показатели липазы крови и дуоденального содержимого изучали кинетическим калориметрическим методом с помощью наборов Sentinell (Италия) на том же анализаторе. Уровень бикарбонатов в дуоденальном содержимом определяли методом обратного титрования [1].
Уровень иммунореактивного Спептида в крови определяли с помощью наборов фирмы CIS (Франция) на счетчике «Гамма12» Киевского завода медицинского оборудования.
Для определения уровня нитратов/нитритов в крови использовали наборы R&D Systems (США). Используемый метод является непрямым и основан на определении стабильных метаболитов NO — нитратов (NO3– ) и нитритов (NO2– ). Метод включает восстановление нитратов до нитритов с помощью нитратредуктазы, далее проводится реакция Грисса. Результаты оценивают фотоколориметрически по абсорбции при длине волны 540–570 нм. У здоровых уровень метаболитов NO в крови составил 44,2 ± ± 3,5 мкмоль/л.
Остальные биохимические показатели изучались общепринятыми методами с использованием стандартных наборов на указанном выше биохимическом анализаторе.
Результаты
До лечения болевой синдром был выраженным у 22 (36,7 %) больных, умеренным — у 26 (43,3 %) больных и минимальным — у 12 (20,0 %) больных. Таким образом, ССТ болевого синдрома при поступлении больных в клинику составила 2,17. После окончания лечения болевой синдром остался выраженным у 4 (6,7 %) больных, умеренным — у 18 (30,0 %) больных, стал минимальным у 27 (45,0 %) больных, а у 11 (18,3 %) пациентов боли исчезли. Таким образом, в результате лечения комбинацией эссенциальных фосфолипидов и глутаргина ССТ болевого синдрома значительно снизилась — до 1,25 (рис. 1).
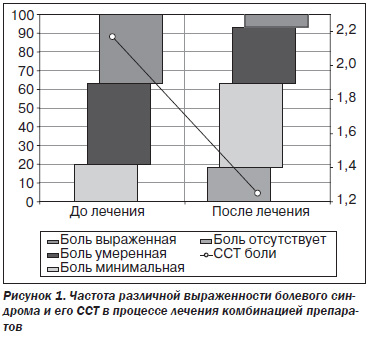
Отчетливое улучшение было выявлено и в отношении диспептических явлений. До лечения они были выраженными у 24 (40,0 %) больных, умеренными — у 25 (41,7 %) больных и минимальными — у 11 (18,3 %) больных. ССТ диспептического синдрома составила 2,22. В результате терапии на выраженные диспептические явления указывали только 7 (11,7 %) больных, на умеренные — 17 (28,3 %) больных, на минимальные — 8 (13,3 %) больных, диспептических явлений не было вообще у 28 (46,7 %) пациентов. ССТ диспептического синдрома к окончанию лечения составила 1,05.
При аускультации у 12 (20,0 %) больных выслушивался систолический шум на 2–4 см ниже мечевидного отростка по срединной линии. У 7 (11,7 %) пациентов шум выслушивался на 1–2 см выше пупка. В первом случае аускультативные данные указывали на преимущественное поражение атеросклерозом брюшной аорты и/или чревного ствола, во втором — на преимущественное поражение верхней брыжеечной артерии. У 8 (13,3 %) больных определялась болезненность при пальпации брюшного отдела аорты. После лечения частота аускультативных и пальпаторных данных в пользу АИС уменьшилась очень незначительно. Так, шум ниже мечевидного отростка выслушивался у 11 (18,3 %) больных, выше пупка — у 7 (11,7 %) больных. Пальпаторная болезненность имела место у 6 (10,0 %) больных.
Индекс массы тела до лечения составил 21,3 ± 1,2 кг/м2, а после лечения — 24,6 ± 1,1 кг/м2(p < 0,05). Как уже указывалось выше, потеря массы тела является одним из существенных диагностических признаков АИС, поэтому повышение массы в процессе лечения, безусловно, указывает на его эффективность. Однако, на наш взгляд, повышение массы тела у обследованных больных нельзя объяснить только действием комбинации изучаемых препаратов, так как больные получали также ферментные препараты (креон). У здоровых индекс массы тела составил 25,7 ± 1,4 кг/м2.
Лечение способствовало значительному улучшению показателей липидного обмена. Так, уровень общего холестерина крови снижался с 9,62 ± 0,26 ммоль/л до 7,16 ± ± 0,29 ммоль/л (p < 0,05), ЛПНП (липопротеидов) — с 52,3 ± 1,4 % до 41,3 ± 0,9 % (p < 0,05); ЛПОНП (прелипопротеидов) — с 36,4 ± 1,5 % до 25,3 ± 1,2 % (p < 0,05); уровень ЛПВП (липопротеидов) увеличился с 23,2 ± ± 1,3 % до 30,0 ± 0,7 % (p < 0,05). Индекс атерогенности снизился с 5,25 ± 0,61 до 3,60 ± 0,54 (p < 0,05) (рис. 2).
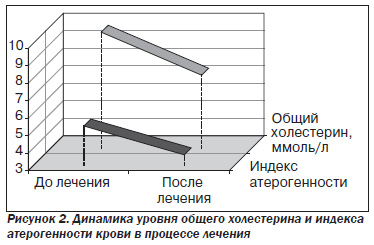
Содержание общих липидов в крови снизилось в процессе лечения с 9,2 ± 0,6 г/л до 7,6 ± 0,5 г/л (p < 0,05). Показатель триглицеридов в крови также уменьшился с 2,32 ± 0,14 ммоль/л до 1,86 ± 0,17 ммоль/л (p < 0,05). Уровень холестерина увеличился с 1,26 ± 0,11 ммоль/л до 1,79 ± 0,13 ммоль/л (p < 0,05). Важно, что показатели общих липидов, триглицеридов, ЛПНП, ЛПОНП, ЛПВП, холестерина, индекса атерогенности после лечения вошли в рамки нормы. Повышенным остался только уровень общего холестерина крови.
У здоровых уровень общих липидов составлял 5,4 ± ± 0,5 г/л, общего холестерина — 5,2 ± 1,8 ммоль/л, триглицеридов — 1,26 ± 0,21 ммоль/л, холестерина — 1,89 ± ± 0,16 ммоль/л, ЛПНП — 47,3 ± 2,1 %, ЛПОНП — 27,8 ± ± 2,1 %, ЛПВП — 32,1 ± 1,7 %. Индекс атерогенности составлял 3,12 ± 0,74.
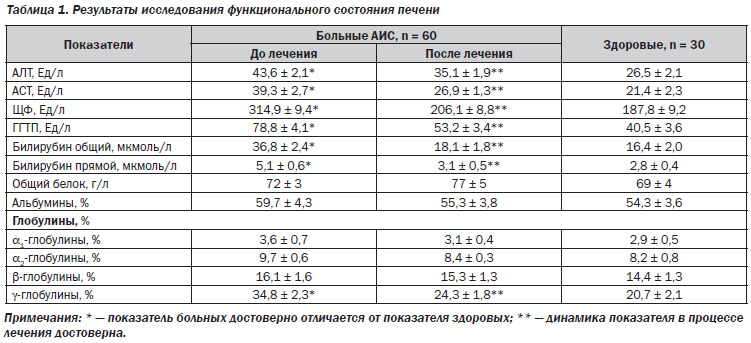
Из данных, представленных в табл. 1, видно, что у обследованных больных АИС при поступлении в клинику были несколько повышены показатели АЛТ, АСТ, ЩФ, ГГТП, общего и прямого билирубина, глобулинов в крови. Лечение способствовало существенному снижению всех этих показателей. Это является результатом гепатопротекторных свойств эссенциальных фосфолипидов и глутаргина, а также отражает улучшение белковосинтетической функции печени в процессе лечения.
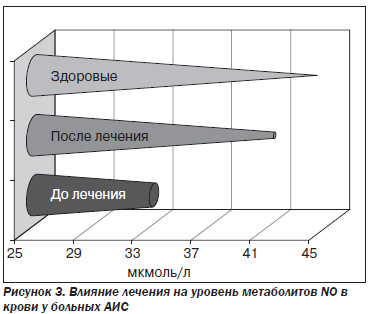
Одним из важнейших показателей при обследовании наших больных мы считали уровень метаболитов NO в крови. Как и предполагалось, он был понижен до 33,1 ± 2,8 мкмоль/л (у здоровых — 44,2 ± 3,5 мкмоль/л, p < 0,05). Лечение способствовало значительному росту содержания нитратов/нитритов в крови до 41,3 ± ± 1,7 мкмоль/л (p < 0,05), причем показатель достигал нижней границы нормы (рис. 3).
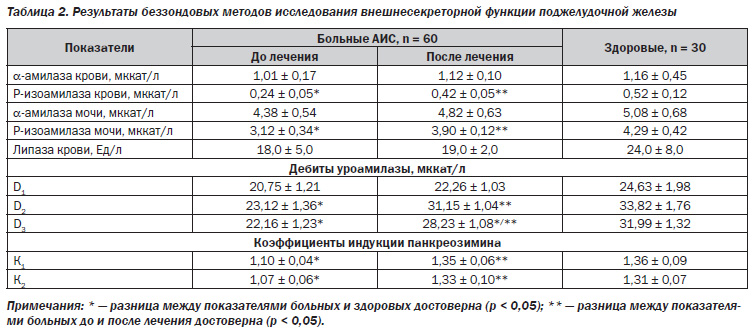
Для изучения нарушений со стороны поджелудочной железы, оценки ее функционального состояния у больных АИС до и после лечения исследовали активность амилазы, Ризоамилазы, липазы крови, амилазы и Ризоамилазы мочи, а также вычисляли дебиты уроамилазы до и после пищевой нагрузки (D1, D2, D3), коэффициенты индукции эндогенного панкреозимина (К1, К2). Кроме того, проводили зондовое исследование внешней панкреатической секреции в конце лечения. Результаты беззондовых тестов представлены в табл. 2.
У больных АИС при поступлении в клинику были достоверно снижены показатели Ризоамилазы крови и мочи, в то время как активность амилазы крови и мочи, а также липазы крови до лечения не имели существенных отличий от данных здоровых, а лишь недостоверную тенденцию к снижению. Это объясняется тем, что амилаза и липаза не являются панкреатоспецифическими ферментами и их уровень в крови (моче) определяется также достаточной продукцией другими (внепанкреатическими) источниками (слюнная изоамилаза, желудочная липаза и др.). То есть даже при снижении продукции амилазы и липазы поджелудочной железой их показатели в биологических жидкостях обычно сохраняются в норме, что и имело место у обследованных нами больных (табл. 2). Следует отметить, что как достоверное снижение показателей Ризоамилазы крови и мочи, так и тенденция к снижению активности амилазы крови и мочи, липазы крови свидетельствуют о гипофункции поджелудочной железы и, конкретно, о снижении ее внешней секреции (является отражением хронической ишемии поджелудочной железы, на фоне которой происходят постепенные атрофия паренхимы и фиброз органа). В процессе лечения комбинацией эссенциальных фосфолипидов и глутаргином было выявлено достоверное повышение продукции поджелудочной железой Ризоамилазы, что нашло свое отражение в существенном увеличении активности ферментов в крови и моче. Такие данные, вероятно, объясняются как улучшением кровоснабжения поджелудочной железы под влиянием терапии, так и улучшением белковосинтетической функции печени в процессе лечения (табл. 1), положительным влиянием глутаргина на белковый обмен. Очень важно, что показатели панкреатических ферментов крови и мочи после лечения не имели достоверных отличий от показателей здоровых. Это свидетельствует, вопервых, о том, что у обследованных больных не было тяжелых необратимых изменений панкреатической секреции, и, вовторых, о возможности эффективного улучшения внешнесекреторной функции поджелудочной железы при включении в терапию АИС комбинации эссенциальных фосфолипидов и глутаргина.
Умеренная гипофункция поджелудочной железы у обследованных больных АИС подтверждается также существенным снижением дебитов уроамилазы и коэффициентов индукции эндогенного панкреозимина через 30 и 60 минут после приема стандартной пищевой нагрузки (табл. 2). При этом D1 достоверно не снижался, то есть базальная панкреатическая секреция существенно не страдала при АИС, и лишь при предъявлении к поджелудочной железе более высоких требований при необходимости повышения внешней секреции в ответ на пищевую стимуляцию выявлялось снижение функциональных возможностей органа. Важно отметить, что у больных АИС при поступлении в клинику имело место правильное соотношение D2 > D3 и К1 > К2, что косвенно свидетельствует об отсутствии отчетливых нарушений оттока панкреатического секрета, которые характерны для обструктивного хронического панкреатита. Это подтверждает данные о патогенезе поражения поджелудочной железы при АИС с преимущественным первичным нарушением не оттока секрета (что характерно, например, для билиарного панкреатита), а паренхимы органа с прогрессирующим угасанием его функции.
В процессе лечения достигнуто существенное увеличение D2, D3, К1 и К2. Это так же, как и рост показателей Ризоамилазы под влиянием терапии, отражает улучшение внешнесекреторной функции поджелудочной железы. Однако так как условия пищевой стимуляции, как уже было сказано выше, предъявляют повышенные требования к продукции панкреатических ферментов, то показатель D3 и после лечения остался достоверно сниженным по сравнению с нормой (табл. 2). Удалось достичь нижней границы данных здоровых только в отношении D1, D2, К1 и К2. Действительно, по данным литературы, условия кровоснабжения органов брюшной полости при АИС особенно ухудшаются после функциональной, то есть пищевой нагрузки. Именно после нее особенно вероятно появление ишемических болей в животе, ухудшение показателей допплеровского исследования и усугубление функциональных нарушений не только со стороны поджелудочной железы, но и других органов пищеварения [4].
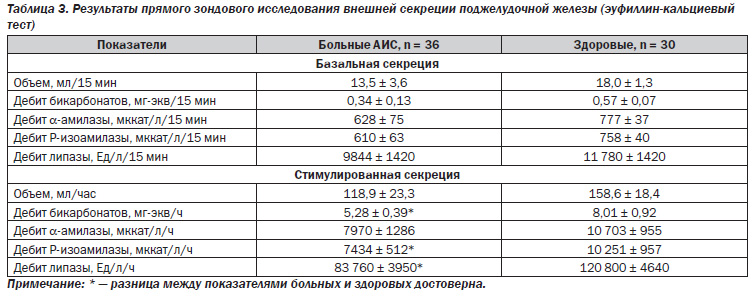
Результаты зондового исследования внешнесекреторной функции поджелудочной железы представлены в табл. 3.
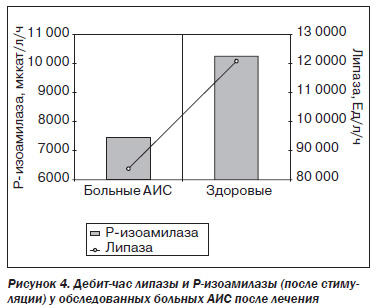
Базальная панкреатическая секреция не имела достоверных отличий у больных АИС и здоровых, показатели больных имели лишь недостоверную тенденцию к понижению (табл. 3). Исследование стимулированной внешней секреции поджелудочной железы оказалось более информативным. Так, дебиты бикарбонатов, Ризоамилазы и липазы у обследованных больных были существенно снижены, что является прямым свидетельством достоверного уменьшения внешнесекреторной функции поджелудочной железы. Объем стимулированной секреции у обследованных больных не был достоверно снижен, что еще раз подтверждает отсутствие четкого обструктивного компонента в патогенезе ишемического поражения поджелудочной железы. Дебит амилазы также имел лишь несущественную тенденцию к снижению, чем еще раз подчеркивается меньшее клиническое значение показателей этого фермента по сравнению с показателями Ризоамилазы (табл. 3, рис. 4).
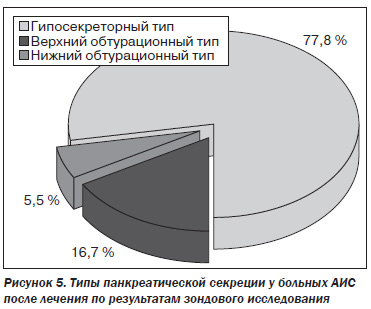
Полученные результаты исследования внешнесекреторной функции поджелудочной железы по данным беззондовых и зондового методов исследования соответствовали типам панкреатической секреции. У обследованных больных АИС чаще всего встречался гипосекреторный тип панкреатической секреции — у 28 (77,8 %) пациентов; верхний обтурационный тип панкреатической секреции выявлялся у 6 (16,7 %) пациентов и нижний обтурационный тип — у 2 (5,5 %) пациентов. Полученные данные свидетельствуют о том, что у небольшого количества обследованных больных (8 пациентов) кроме ишемического поражения паренхимы поджелудочной железы, для которого, как было указано выше, характерно постепенное угасание функции органа с последующим развитием гипосекреторного варианта секреции, имели место и другие варианты поражения. Эти варианты находили свое отражение в развитии верхнего и нижнего обтурационных типов секреции. Наиболее вероятно, что верхний обтурационный тип секреции был связан с алкогольным поражением поджелудочной железы (это подтвердилось при углубленном выяснении анамнеза), а нижний обтурационный тип секреции — с сочетанием ишемического поражения органа с билиарным панкреатитом (у обеих больных с таким типом секреции выявлена желчнокаменная болезнь). Важно, что у обследованных больных гиперсекреторный и нормальный типы панкреатической секреции вообще не встречались. Частота различных типов внешней секреции поджелудочной железы у больных АИС после лечения представлена на рис. 5.
Для оценки эндокринной функции поджелудочной железы оценивали динамику уровней глюкозы и Спептида крови. Уровень глюкозы крови до лечения был повышен у 9 (15,0 %) больных (диагностирован II тип сахарного диабета). После лечения показатель нормализовался у 7 (11,7 %) из этих больных, однако следует учесть, что им дополнительно назначались таблетированные сахароснижающие препараты.
Уровень Спептида крови до лечения у больных был достоверно снижен и составлял 0,42 ± 0,06 пмоль/мл при норме 0,69 ± 0,09 пмоль/мл. В процессе лечения зарегистрирован достоверный рост продукции Спептида до 0,58 ± 0,05 пмоль/мл (p < 0,05).
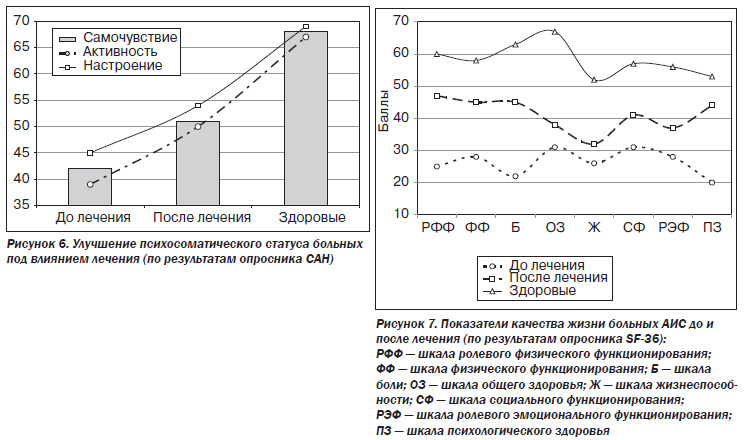
В соответствии с уменьшением болевого и диспептического синдромов, улучшением функционального состояния печени и поджелудочной железы, улучшением кровотока по брюшной аорте и ее ветвям у больных отмечалось улучшение психосоматического статуса, то есть самочувствия, активности и настроения (по результатам опросника САН) (рис. 6).
Общим итогом, подтверждающим эффективность комбинации предложенных препаратов в лечении АИС, является повышение качества жизни пациентов (рис. 7).
Выводы
1. Под влиянием терапии АИС комбинацией препаратов, содержащих эссенциальные фосфолипиды, и глутаргином значительно уменьшается выраженность клинических проявлений заболевания.
2. Включение эссенциальных фосфолипидов и глутаргина в комплексное лечение АИС способствует коррекции липидного спектра крови, улучшению функционального состояния печени и поджелудочной железы, увеличению содержания метаболитов NO в крови.
3. Препараты, содержащие эссенциальные фосфолипиды, в комбинации с глутаргином способствуют улучшению психосоматического статуса и качества жизни больных АИС.
Перспективы исследования состоят в изучении эффективности применения данной комбинации в лечении заболеваний органов пищеварения у больных пожилого возраста, у пациентов с липидным дистресссиндромом и метаболическим синдромом.
1. Богер М.М. Методы исследования поджелудочной железы. — Новосибирск: Наука, 1982. — 240 с.
2. Губергриц Н.Б., Христич Т.Н. Клиническая панкреатология. — Донецк: Лебедь, 2000. — 416 с.
3. Лазебник Л.Б. Заболевания органов пищеварения у пожилых. — М.: Анахарсис, 2003. — 208 с.
4. Лазебник Л.Б., Звенигородская Л.А. Хроническая ишемическая болезнь органов пищеварения. — М.: Анахарсис, 2003. — 136 с.