Газета «Новости медицины и фармации» 17 (471) 2013
Вернуться к номеру
Особенности профилактики послеоперационного пареза кишечника в гинекологической практике
Авторы: Коньков Д.Г., к.м.н., доцент, Степанюк Л.И., к.м.н., доцент - Винницкий национальный медицинский университет им. Н.И. Пирогова, кафедра акушерства и гинекологии № 1
Разделы: Клинические исследования
Версия для печати
 Одной из важнейших проблем в полноценном лечении гинекологических пациентов после хирургического вмешательства является профилактика и восстановление нарушений моторноэвакуаторной функции желудка и кишечника [1, 5, 8, 13]. Моторноэвакуаторная функция желудка, тонкой и толстой кишок является единым синхронным механизмом, обеспечивающим процесс пищеварения. Дезорганизацию работы желудка, тонкой и толстой кишок по синхронизации, преемственности моторноэвакуаторной функции в раннем послеоперационном периоде считают причиной различных нарушений желудочнокишечного тракта (ЖКТ) [3, 19].
Одной из важнейших проблем в полноценном лечении гинекологических пациентов после хирургического вмешательства является профилактика и восстановление нарушений моторноэвакуаторной функции желудка и кишечника [1, 5, 8, 13]. Моторноэвакуаторная функция желудка, тонкой и толстой кишок является единым синхронным механизмом, обеспечивающим процесс пищеварения. Дезорганизацию работы желудка, тонкой и толстой кишок по синхронизации, преемственности моторноэвакуаторной функции в раннем послеоперационном периоде считают причиной различных нарушений желудочнокишечного тракта (ЖКТ) [3, 19].
Тяжесть нарушений моторноэвакуаторной функции ЖКТ пропорциональна степени выраженности патологического процесса. По образному выражению Моше Шайна: «Пока живот открыт, хирург контролирует его, как только вы его закрыли — он контролирует вас», своевременное восстановление моторики ЖКТ является тестом успешности выполненной операции. По данным ряда авторов, тошнота и рвота у пациентов, оперированных на органах брюшной полости, встречается в 14–82 % случаев, а послеоперационный парез кишечника (ППК) — от 3,5 до 75 % наблюдений [3, 4, 9].
Под термином «послеоперационный парез кишечника» понимают угнетение двигательной активности желудочнокишечного тракта с накоплением и задержкой отхождения у пациента газов и стула, что проявляется отсутствием или заметным угнетением выслушиваемых перистальтических шумов и увеличением объема живота. Этот термин наиболее часто используется в литературе для обозначения состояния, возникшего в результате нарушения моторноэвакуаторной деятельности кишечника в послеоперационном периоде. Синонимами этого термина являются названия: «функциональная непроходимость кишечника», «послеоперационный метеоризм», «динамическая кишечная непроходимость», «паралитическая кишечная непроходимость», «функциональный стаз». Другие исследователи [5, 7, 17] считают, что одним из факторов развития послеоперационного пареза являются тяжелые водноэлектролитные нарушения в дооперационном периоде, особенно калиевая недостаточность.
Патогенез ППК весьма сложен и, видимо, имеет не одну, а несколько причин развития [4, 6, 8]. Чаще всего парез желудочнокишечного тракта встречается после обширных абдоминальных операций [5, 9, 16]. Многие авторы это объясняют тем, что при подобных оперативных вмешательствах травмируется богатая рецепторами брюшина, первоначально в месте травмы запускается выброс провоспалительных цитокинов, кининов, фактора некроза опухоли, которые формируют не только местную реакцию, но и системный ответ организма, вследствие чего развиваются циркуляторные расстройства в стенке органов желудочнокишечного тракта, повышается тонус симпатической нервной системы с выбросом в кровь большого количества катехоламинов [6, 17, 21]. В связи с этим многие авторы оценивают развитие послеоперационного пареза желудочнокишечного тракта как защитную реакцию на операционную травму в ближайшие 2–3 дня после операции [18].
При развитии воспаления в брюшной полости одним из патогенетических механизмов, определяющих изменение моторной функции желудочнокишечного тракта, является нарушение взаимоотношения между симпатической и парасимпатической нервными системами. Гипертонус симпатической нервной системы распространяется не только на гладкие мышцы кишечной стенки, но и на снабжающие их сосуды, что приводит, с одной стороны, к угнетению моторики кишечника, с другой (в результате нарастающего артериального спазма) — к резкому снижению регионарного кровотока [6, 13].
В начале развития парез желудочнокишечного тракта может быть обусловлен дисфункцией со стороны эндокринных механизмов регуляции:
1) выбросом катехоламинов;
2) активацией калликреинкининовой системы с избыточным поступлением в кровоток гистамина, брадикинина, протеолитических ферментов и других биологически активных веществ;
3) снижением биологической активности клеток APUDсистемы (серотонина (субстанции Р) и мотилина), участвующих в работе мигрирующего миоэлектрического комплекса кишки и периферической гемоциркуляции;
4) дисрегуляторным поступлением секретина, холецистокинина и энтероглюкагона.
Отмечается большая активация симпатического отдела вегетативной нервной системы в сравнении с парасимпатическим. Следует отметить наличие значительного количества альфаадренорецепторов в ЖКТ. Вазоконстрикция ведет к нарушениям микроциркуляции, реологических свойств крови, к развитию ишемии и гипоксии тканей, ацидозу [22, 23]. Согласно данной концепции дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. В дальнейшем миоциты оказываются неспособными к восприятию нервных импульсов ввиду выраженных метаболических сдвигов и внутриклеточных электролитных нарушений. Все это ведет к растяжению кишечных петель и повышению внутриполостного давления, вызывая повреждение как всей пищеварительной системы, так и других функциональных систем гомеостаза [19].
Возникающий застой сопровождается местным повышением венозного давления, приводя к угнетению резорбции газов и дальнейшему увеличению внутрикишечного давления. Когда величина последнего достигает уровня диастолического давления, прекращается всасывание жидкости, что, в свою очередь, обусловливает еще более выраженное растяжение тонкой кишки и нарушение питания кишечной стенки [5, 17].
Эти процессы усугубляются прогрессирующей эндогенной интоксикацией, которая увеличивает степень гипоксии кишечной стенки, формируя порочный круг. Токсическое действие на кишечную стенку прямо и косвенно оказывают экзо и эндотоксины, а также факторы агрессии и продукты метаболизма непрерывно размножающейся микрофлоры, колонизирующей проксимальные отделы [16]. Когда к угнетению моторики кишечника присоединяется снижение интрамурального кровотока, интенсивность процессов переваривания и всасывания резко снижается, достигая критического уровня. Объем нарушения местного кровотока в первую очередь зависит от степени дилатации петли кишечника и силы компрессии сосудов в ее стенке. При уровне давления в просвете кишки выше 100 мм рт.ст. наблюдается глубокое нарушение фильтрационной функции капилляров с резким ограничением потребления кислорода тканями и нарастанием ишемии кишечной стенки, последняя развивается при снижении кровотока в кишечной стенке на 50 % от должного объема [8].
В условиях кишечной ишемии происходит уменьшение содержания в тканях кислорода и питательных веществ (при увеличении концентрации активных токсических окислителей), развивается тканевый ацидоз, возникает гиперпродукция паракринных субстратов (гистамина, серотонина, брадикинина, оксида азота, лейкотриенов, тромбоксанов, интерлейкинов1, 2, 4, 6, 8, 10, эндотелинов, комплемента и тромбина) [3, 9, 20]. Таким образом, на наш взгляд, происходит истощение запасов этих веществ, что может приводить в последующем к их стойкому дефициту.
При развитии пареза кишечника и, как следствие, задержке пассажа кишечного содержимого происходят интенсивный рост и изменения микрофлоры тонкой кишки. А в условиях воспаления брюшины развивается дисбаланс между различными видами микроорганизмов и их распределением по различным отделам кишечника. Усиленное размножение патогенной аллохтонной (чужеродной, не из данного участка желудочнокишечного тракта) микрофлоры ослабляет местную иммунную защиту слизистой оболочки, приводя к снижению ее барьерной функции; угнетению функциональной активности лимфатической и ретикулоэндотелиальной систем; потере антагонистических свойств у нормальной микрофлоры кишечника по отношению к патогенным и гнилостным микробам; угнетению витаминообразующей и ферментной функции [6, 20].
Это в значительной мере сказывается на эффективности противоинфекционной защиты в целом. Выделяемые патогенными микроорганизмами капсульные антигены белковой и полисахаридной природы обеспечивают избирательную возможность их адгезии к поверхности энтероцитов. После фиксации микробных клеток наблюдается их пролиферация. Выделяющийся при этом энтеротоксин (эндотоксин) вызывает нарушение транспорта электролитов, приводя к усиленной секреции в просвет кишки, водному дисбалансу и выраженной дегидратации организма. Образованные аллохтонными патогенными микроорганизмами экзотоксины приводят к метаболической дисфункции покровных клеток, нарушению соотношения между секрецией и абсорбцией жидкости; оказывают цитотоксический эффект, сопровождающийся разрушением клеточных мембран эпителиоцитов [6, 18, 22].
Разнонаправленное воздействие этих многочисленных патогенных факторов на структурные образования слизистой оболочки кишечника приводит к резкому изменению ее свойств (особенно барьерных) и «прорыву» патогенной микрофлоры в лимфатическое русло, портальный кровоток и даже в свободную брюшную полость. Процесс этот получил название «бактериальная транслокация». Именно с интенсивностью бактериальной транслокации связывают характер и выраженность эндогенной интоксикации, развитие и прогрессирование синдрома полиорганной дисфункции [8].
С учетом вышеперечисленных звеньев патогенеза строится примерная программа лечебных мероприятий, направленных на разрешение послеоперационного пареза и связанных с ним метаболических нарушений. В каждом конкретном случае проводится индивидуальная коррекция, каждый пункт которой направлен на выполнение задачи не одного, а нескольких патогенетически обоснованных лечебных направлений.
Что касается методов лечения послеоперационного пареза желудочнокишечного тракта на современном этапе, то большинство авторов склоняются к комплексной терапии. Во многих хирургических клиниках лечение послеоперационного пареза желудочнокишечного тракта остается рутинным и порой односторонним [2, 5, 10, 12, 16]. Многие авторы предлагают различные схемы медикаментозного воздействия для разрешения послеоперационного пареза [6, 7, 11].
При оценивании лекарственной терапии, направленной на стабилизацию желудочнокишечной моторики в условиях пареза, замечено, что многие препараты малоэффективны и дают побочные эффекты [20]. В обычной клинической практике основными препаратами для лечения парезов остаются антихолинэстеразные (прозерин, убретид и др.). Эффективность их не всегда однозначна, а побочные эффекты выражены. Так, прозерин и его аналоги оказывают отрицательное инотропное и хронотропное действие на сердце и в связи с этим противопоказаны при бронхиальной астме, стенокардии, брадикардии. Кроме того, действие прозерина на гладкую мускулатуру желудка и тонкой кишки кратковременно, а на толстую кишку он вообще не оказывает никакого действия [6].
Операции гинекологического профиля неизбежно приводят к раздражению интерорецепторов, поэтому патогенетически оправданно применение ганглиоблокаторов [5]. Применение временной ганглиоплегии пентамином в сочетании с традиционными методами лечения пареза кишечника у больных разлитым гнойным перитонитом позволяет улучшить микроциркуляцию за счет восстановления симпатических влияний и повысить эффективность центральной гемодинамики. А за счет нормализации парасимпатических воздействий вегетативной нервной системы — раньше восстановить моторноэвакуаторную функцию желудочнокишечного тракта и вследствие этого уменьшить выраженность синдрома системного воспалительного ответа и болевого абдоминального синдрома. Однако выраженный вазоплегический эффект этих препаратов является препятствием для использования их у пациентов, которые имеют склонность к гипотонии [6].
Для стимуляции моторноэвакуаторной функции желудочнокишечного тракта в качестве прокинетиков у пациентов отделений реанимации и интенсивной терапии экспертами разных международных медицинских ассоциаций (ESPEN, American Society for Parenteral and Enteral Nutrition и Society of Critical Care Medicine) рекомендованы метоклопрамид и эритромицин [14].
Но после углубленного изучения оказалось, что метоклопрамид снижает суммарную электрическую активность в основном желудка и тонкой кишки, угнетая их сократительную активность и способствуя восстановлению сокращений двенадцатиперстной кишки [5].
Анализ результатов фармакологического лечения послеоперационного пареза показал, что положительного эффекта адреноблокаторов, холиномиметиков и антихолинэстеразных препаратов на моторику желудочнокишечного тракта можно ожидать лишь при парезах легкой и средней степени тяжести [16].
Возможно, что оптимальным прокинетиком у пациенток гинекологического профиля, перенесших оперативное вмешательство, является пероральное введение домперидона, поскольку домперидон в отличие от метоклопрамида практически лишен центральных антидопаминовых эффектов [2]. Многочисленные положительные свойства этого прокинетика зарегистрированы при его применении в гастроэнтерологии и педиатрии [6, 12, 16, 20]. В экспериментальных исследованиях доказано, что домперидон наряду с тримебутином является наиболее эффективным прокинетиком после операций на органах брюшной полости. Вне зависимости от наличия или отсутствия эндотоксемии он ускоряет сроки восстановления электрической активности желудка, двенадцатиперстной и тощей кишки с появлением мигрирующего миоэлектрического комплекса, способствует нормализации антродуоденальной координации и транзита содержимого по кишечнику [6].
Цель нашей работы — апробация патогенетически обоснованной программы лечебных мероприятий, направленных на профилактику послеоперационного пареза, путем сравнительной оценки клинической эффективности домперидона и метоклопрамида.
Материалы и методы
Исследования были проведены у 32 женщин в возрасте от 37 до 62 лет (48,9 ± 8,2 года), которых оперировали в гинекологическом отделении Винницкого городского клинического родильного дома № 1 (клинической базы кафедры акушерства и гинекологии № 1 ВНМУ им. Н.И. Пирогова).
В исследование были включены пациентки, которые поступили на плановое оперативное вмешательство. Операции были проведены лапаротомным доступом. Всем больным в условиях тотальной внутривенной анестезии с интубацией трахеи и искусственной вентиляцией легких кислородовоздушной смесью произведена ампутация или экстирпация матки по поводу миомы.
Исходя из методик терапевтической профилактики пареза кишечника, пациентки были разделены на 2 группы. Больным І группы (18 женщин) проводилась традиционная анальгетическая, инфузионная и прокинетическая терапия (метоклопрамид) в послеоперационном периоде.
Пациенткам ІІ клинической группы (14 прооперированных) в качестве компонента прокинетической терапии применяли домперидон (Брюлиум Лингватабс, Brupharmexport, Бельгия).
Прокинетики больным І группы (2 мл метоклопрамида) назначали сразу после операции с интервалом 6 часов, а больным ІІ группы (Брюлиум Лингватабс 20 мг) — через 2 часа после операции 4 раза в сутки.
Инфузионная терапия у больных исследуемых групп проводилась раствором Рингера с добавлением через 6 часов после операции растворов, содержащих сорбит или ксилит (сорбилакт, реосорбилакт, глюксил, ксилат).
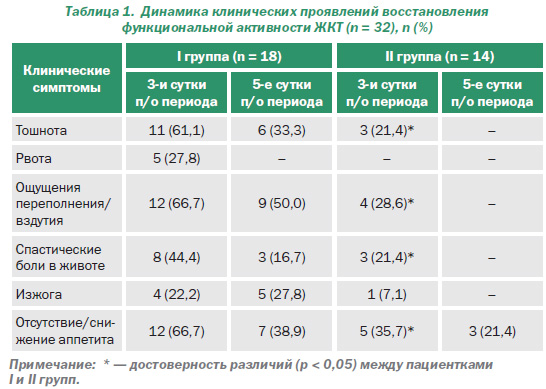
Динамику восстановления функциональной активности ЖКТ оценивали согласно критериальному анализу, по модифицированной шкале оценки симптомов желудочнокишечных расстройств — Gastrointestinal Symptom score (GIS) [18]. Эта шкала состоит из 10 симптомов, характерных для функциональной диспепсии: боль в эпигастральной области, боль в области желудка, тошнота, позывы на рвоту, рвота, ощущение переполнения, вздутие, спастические боли в животе, чувство раннего насыщения, изжога, отрыжка, отсутствие или снижение аппетита, ретростернальный дискомфорт.
Критерии нашего исследования включали: вздутие живота, отхождение газов, тошноту, отрыжку, боль или изжогу, отсутствие улучшения после дефекации или отхождения газов, отсутствие либо снижение аппетита (табл. 1).
Выраженность представленных симптомов определялась по пятибалльной шкале Ликерта (Likert scale): 0 — отсутствие симптома, 1 — легкий, 2 — умеренный, 3 — тяжелый, 4 — очень тяжелый, значительно нарушающий качество жизни пациента [18]. Оценка проводилась на 3й и 5й дни терапии. После окончания исследования проводили субъективную оценку клинического эффекта препарата по шкале: эффективный, малоэффективный, неэффективный.
Безопасность и переносимость препарата оценивали по отсутствию или наличию ожидаемых побочных эффектов.
Исследование проведено с соблюдением требований GCP. Статистическая обработка данных проведена с применением программы Statistica 6. Пороговый уровень статистической значимости при парном сравнении результатов: р ≤ 0,05. Клиническая значимость определялась отдельно для каждого параметра.
Результаты и их обсуждение
В соответствии с клиническими проявлениями ППК в течение первых послеоперационных 12 ч терапии существенных различий между группами по таким критериям, как выраженность вздутия живота и характеристика перистальтических шумов (с использованием классификации Ш.И. Каримова и Б.Д. Бабаджанова), не выявлено. Во всех группах отмечали преимущественно умеренное (перкуторно тимпанит определялся на площади 2/3 брюшной стенки) или значительное вздутие живота (тимпанит отмечали во всех отделах), перистальтические шумы, как правило, не выслушивались. К концу 1х суток и в начале 2х в І группе (метоклопрамид) для 11 пациентов (61,1 %) было характерно увеличение вздутия живота до выраженного (определялся резкий тимпанит во всех отделах и умеренное напряжение брюшной стенки), иногда выслушивались единичные перистальтические шумы. К концу 2х — началу 3х суток у больных І группы отрицательная симптоматика достигала максимального уровня: наблюдалось выраженное или резко выраженное вздутие живота при отсутствии перистальтики или крайней ее вялости. В последующие 4–5 суток отмечали вначале появление нерегулярных кишечных шумов, в основном в ближайшие часы после введения стимуляторов моторики, при сохраняющемся вздутии живота, затем, при благоприятном течении процесса, перистальтические шумы приобретали регулярный характер, однако продолжало сохраняться умеренное вздутие живота. Полное разрешение вышеуказанной клинической симптоматики в І клинической группе (метоклопрамид), как правило, отмечали только к 6м суткам послеоперационного периода. Особенностью динамики разрешения послеоперационного пареза у пациентов І группы (метоклопрамид) являлось длительное время сохраняющееся значительное или умеренное вздутие живота на фоне выслушивающихся после введения стимуляторов моторики перистальтических шумов обычной или ослабленной звучности.
Пациентки, принимающие Брюлиум Лингватабс, к концу 1х — началу 2х суток отмечали меньшее вздутие живота по сравнению с І группой (метоклопрамид) и отсутствие его дальнейшего увеличения к концу 2х — началу 3х суток. В отличие от женщин, которые для профилактики ППК прнимали метоклопрамид, больные во ІІ клинической группе (домперидон — Брюлиум Лингватабс) отмечали более отчетливую перистальтику к началу 2х и 3х суток послеоперационного периода. Таким образом, в послеоперационном периоде у пациенток при комплексном применении в составе ранней энтеральной терапии прокинетика домперидона и полиионных растворов на основе многоатомных спиртов (реосорбилакт, сорбилакт, глюксил, ксилат) через 48 часов лечения статистически достоверно определялись менее выраженные клинические проявления ППК, чем у больных с ранее применявшейся методикой лечения (метоклопрамид + полиионные растворы).
Также хотелось бы отметить и динамику клинических проявлений восстановления функциональной активности ЖКТ, с учетом внутригруппового распределения (табл. 1).
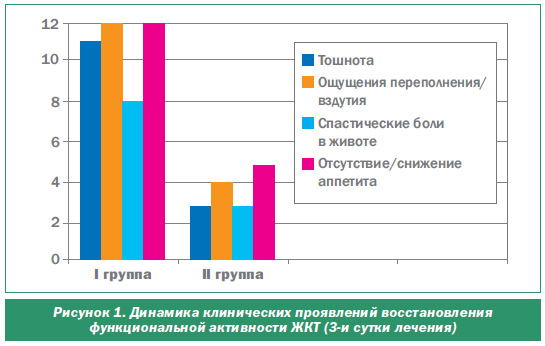
В І группе на третьи сутки п/о периода, после начала медикаментозной терапии, направленной на ликвидацию пареза, превалирующими жалобами были ощущения переполнения/вздутия и отсутствие/снижение аппетита, которые отмечали 66,7 % пациентов. Жалобы на тошноту предъявляли 61,1 % обследуемых.
У пациенток, принимавших Брюлиум Лингватабс, наблюдалась аналогичная симптоматика, но у гораздо меньшего количества женщин — 28,6 и 35,7 % соответственно. Жалобы на тошноту отмечены у 21,4 % больных (рис. 1).
На 5е сутки послеоперационного периода женщины, принимающие метоклопрамид, отмечали некоторое уменьшение симптомов, хотя жалобы на вздутие сохранились у 50 % обследуемых, отсутствие аппетита — у 38,9 % и тошноту — у 33,3 %. В то же время среди пациенток, которые с целью профилактики ППК получали Брюлиум Лингватабс, только 21,4 % жаловались на снижение аппетита.
Субъективную оценку «эффективно» в отношении проведенной терапии прокинетиком Брюлиум Лингватабс поставили 12 пациенток (85,7 %), оценку «малоэффективно» поставили 2 пациентки (14,3 %), мнений о препарате как о неэффективном не было. Результаты исследования по препарату метоклопрамид были следующими: «эффективно» — 9 (50,0 %), «малоэффективно» — 7 (38,9 %) и «неэффективно» — 2 (11,1 %).
При анализе безопасности препаратов не было зафиксировано ни одного случая аллергических реакций, ожидаемых побочных эффектов и индивидуальной непереносимости. Отказов от приема препаратов не было.
Помимо вышеперечисленного, пациентки, принимающие Брюлиум Лингватабс, отмечали удобство приема препарата: в течение нескольких секунд таблетка растворялась на поверхности языка, ее можно было проглотить со слюной, не запивая водой, кроме того, препарат имел приятный вкус.
Нормальная моторика является результатом координированной контрактильной активности гладких мышц на всем протяжении желудочнокишечного тракта. Эта активность регулируется местными факторами, моделирующими деятельность гладких мышц, рефлексами, пути которых замыкаются в пределах вегетативной нервной системы, гормонами и влиянием центральной нервной системы. По данным многих исследователей, каждая из этих систем играет, возможно, независимую патогенетическую роль в развитии послеоперационного пареза желудочнокишечного тракта, и потому лечение должно быть многокомпонентным [15, 21].
Анализируя неудовлетворительные результаты в разрешении послеоперационных парезов желудочнокишечного тракта, клиницисты связывают их с двумя основными причинами. Вопервых, в широкой клинической практике доминирует стандартный подход врачей к выбору лечебных мероприятий без учета патогенеза заболевания [8, 20]. Вовторых, практический опыт лечения послеоперационных парезов свидетельствует о том, что борьба с ними начинается лишь тогда, когда они уже развились, в то время как мероприятия по лечению пареза должны проводиться в раннем послеоперационном периоде, до появления его клинических признаков [4, 13].
По данным литературы, есть предположение о возможно более эффективном использовании метоклопрамида в однократной дозе 20 мг. Однако высокий процент побочных эффектов (у более 40 % пациентов при использовании этого прокинетика в дозе 10 мг) препятствует подобному подходу. В противоположность этому обычная начальная дозировка домперидона составляет 20 мг 3–4 раза в сутки и (по показаниям) может быть быстро увеличена до 30 мг однократно. Максимальная рекомендуемая его суточная доза составляет 120 мг [18].
Таким образом, Брюлиум Лингватабс производства Brupharmexport, примененный в терапевтических дозах, оказался более эффективным для профилактики послеоперационного пареза кишечника, чем метоклопрамид, у пациенток после оперативного лечения миомы.
Оптимальное соотношение цена/качество также отличает препарат Брюлиум Лингватабс, делая его доступным для населения с разным уровнем доходов.
Выводы
1. Применение домперидона в виде препарата Брюлиум Лингватабс в течение 5 суток для профилактического лечения послеоперационного пареза кишечника в гинекологической практике достоверно способствует быстрому купированию симптоматики и улучшению общего самочувствия пациенток.
2. Упреждающий характер предложенной патогенетически обоснованной программы профилактики и лечения парезов кишечника способствует раннему восстановлению функций желудочнокишечного тракта и предупреждает развитие осложнений в оперативной гинекологии.
3. Проведенное исследование позволяет рекомендовать препарат Брюлиум Лингватабс для рутинного использования в профилактике ППК в раннем послеоперационном периоде.
Список литературы находится в редакции