Журнал «» 6 (32) 2013
Вернуться к номеру
Застосування мельдонію при лікуванні хворих на діабетичну нефропатію
Авторы: Топчій І.І., Денисенко В.П. - Застосування мельдонію при лікуванні
хворих на діабетичну нефропатіюДУ «Національний інститут терапії імені Л.Т. Малої НАМН України», м. Харків
Рубрики: Семейная медицина/Терапия, Кардиология, Эндокринология
Разделы: Клинические исследования
Версия для печати
Обстежені 20 здорових осіб, 80 хворих на гіпертонічну хворобу і 360 хворих на діабетичну нефропатію. Визначено стан обміну NO та проведено обстеження кардіальної гемодинаміки. Аналіз отриманих результатів засвідчив, що у хворих на діабетичну нефропатію прогресують прояви ендотеліальної дисфункції та формується діабетичне серце. Мельдоній на тлі препаратів базисної терапії сприяє покращенню морфологічної структури та скоротливої функції міокарда за рахунок комплексного впливу на метаболічні процеси та обмін оксиду азоту.
Обследовано 20 здоровых лиц, 80 больных гипертонической болезнью и 360 больных диабетической нефропатией. Определено состояние обмена NO и проведено обследование кардиальной гемодинамики. Анализ полученных результатов показал, что у больных диабетической нефропатией прогрессируют проявления эндотелиальной дисфункции и формируется диабетическое сердце. Мельдоний на фоне препаратов базисной терапии приводит к улучшению морфологической структуры и сократительной функции миокарда за счет комплексного воздействия на метаболические процессы и обмен оксида азота.
Twenty healthy persons, 80 patients with essential hypertension and 360 patients with diabetic nephropathy were examined. The authors determine the state of NO exchange and carried out the study of cardiac hemodynamics. Analysis of the findings showed that patients with diabetic nephropathy were detected with progression of endothelial dysfunction manifestations and development of diabetic heart. Use of meldonium against the background of preparations of basic therapy leads to improvement of the morphological structure and contractile function of the myocardium due to complex effects on metabolic processes and the exchange of nitric oxide.
ендотеліальна дисфункція, кардіальна гемодинаміка, діабетична нефропатія, мельдоній.
эндотелиальная дисфункция, кардиальная гемодинамика, диабетическая нефропатия, мельдоний.
endothelial dysfunction, cardiac hemodynamics, diabetic nephropathy, meldonium.
Вступ
На сьогодні тривалість життя хворих на цукровий діабет (ЦД) зросла у декілька разів. Смертність від гострих ускладнень ЦД, таких як діабетичні коми, не перевищує 1 %. Однак одночасно зі збільшенням тривалості життя хворих на ЦД з’явилася нова проблема — проблема судинних ускладнень.
Ендотеліальна дисфункція приводить до формування діабетичної нефропатії (ДН), активації пресорних компонентів ренінангіотензинової системи (РАС), прогресування артеріальної гіпертензії (АГ) із ремоделюванням усієї судинної системи організму [1–3]. Крім того, на тлі порушень ліпідного обміну ініціюються процеси атерогенезу, що ведуть до формування ішемічної хвороби серця та серцевої недостатності [3, 4]. У літературі комплекс змін анатомії та функції міокарда на тлі цукрового діабету вже отримав назву діабетичного серця.
Серцевосудинна смертність серед хворих на ЦД із ДН значно вища порівняно з особами, які не мають цього захворювання, що пов’язано і з порушеннями енергетичного метаболізму в міокарді. Навіть за відсутності ішемії кардіоміоцити хворих на ЦД поглинають менше глюкози й лактату. Абсолютно домінуючу роль як джерело енергії в цієї категорії хворих відіграє βокислення жирних кислот.
Задачею комплексного медикаментозного лікування хворих на ЦД із ДН є насамперед органопротекція, що забезпечується покращенням кровотоку та метаболізму в основних органахмішенях. Із препаратів вибору для покращення кровотоку перше місце посідають модулятори РАС — інгібітори ангіотензинперетворюючого ферменту (ІАПФ), антагоністи кальцію (АК) та антагоністи рецепторів ангіотензину II (АРА), а із засобів, які впливають на метаболізм, — мельдоній та триметазидин. Метаболічне лікування хворих на ЦД та ДН має бути спрямоване в тому числі й на зниження інтенсивності βокислення жирних кислот і відновлення спряженості між гліколізом й окислювальним декарбоксилюванням пірувату. З цієї точки зору найбільший інтерес становить мельдоній.
Мельдоній — 3(2,2,2триметилгідразиній) пропіонат, аналог гаммабутиробетаїну. Зменшує інтенсивність βокислення жирних кислот за допомогою запобігання надходженню їх у мітохондрії: обмежує транспорт через мембрани мітохондрій тільки довголанцюжкових жирних кислот, у той час як коротколанцюжкові можуть вільно проникати в мітохондрії і там окислюватися, при цьому не відбувається накопичення недоокислених жирних кислот усередині мітохондрій. Це вигідно відрізняє мельдоній від триметазидину, який як прямий інгібітор βокислення жирних кислот гальмує в мітохондріях βокислення і довго, і коротколанцюжкових жирних кислот, блокуючи останню реакцію 4стадійного процесу їх окислення (3кетоацилКоАтіолазу), що не заважає накопиченню активованих жирних кислот і їх недоокислених форм у мітохондріях.
В умовах ішемії мельдоній відновлює рівновагу процесів доставки кисню і його споживання в клітинах, попереджує порушення транспорту АТФ; одночасно з цим активує гліколіз, який перебігає без додаткового споживання кисню. У результаті зниження концентрації карнітину посилено синтезується гаммабутиробетаїн, який має вазодилатуючі властивості.
Установлено й інші позитивні ефекти мельдонію, перш за все антиоксидантний. Мельдоній зменшує інтенсивність перекисного окислення ліпідів і підвищує активність ендогенних антиоксидантів, нівелюючи наслідки окислювального стресу. В експерименті та клініці показано, що мельдоній здатний позитивно впливати на дисфункцію ендотелію і, відповідно, сприяти нормалізації судинного тонусу. Розглядається й інший механізм підвищення біодоступності оксиду азоту на фоні застосування мельдонію — зменшення інтенсивності його вільнорадикальної інактивації. Крім того, в експерименті препарат проявляє й інші судинні ефекти: зменшує периферичний опір судин, усуває вазоспазм, викликаний адреналіном й ангіотензином. Засіб також справляє цілий ряд плейотропних ефектів: підвищує чутливість до інсуліну, змінює метаболізм глюкози та ліпідів.
Механізм дії визначає різноманіття його фармакологічних ефектів:
— антигіпоксична та кардіопротекторна дія;
— вазодилатуюча дія, покращення мікроциркуляції в тканинах;
— поліпшення переносимості фізичних навантажень.
Метою нашого дослідження є визначення впливу мельдонію на обмін оксиду азоту (NO) та кардіальну гемодинаміку хворих на ДН на тлі базисної органопротекторної терапії.
Об’єкт і методи дослідження
Було обстежено 360 хворих на ЦД із ДН I–ІV стадії за класифікацією C.E. Mogensen (1983), середній вік хворих — 58,6 ± 6,1 року, група порівняння — 80 хворих на гіпертонічну хворобу (ГХ) ІІ–ІІІ ст. відповідного віку, група контролю — 20 практично здорових людей віком 26,2 ± 3,4 року.
Уміст нітриту у плазмі венозної крові визначали фотометричним методом за реакцією Гриса. Уміст суми метаболітів оксиду азоту визначали за реакцією Гриса після відновлення нітрату до нітриту цинковим пилом. NOсинтазну активність у сироватці крові визначали за зростанням концентрації нітриту в реакційній суміші, що містила 50 мМ КН2РО4 (рН 7.0), 1 мМ МgCl2, 1 мM NADPH та 2 мМ СаCl2 (для вимірювання активності конститутивної NOS) або 4 мM ЕДТА (для зв’язування ендогенного Са2+ при вимірюванні активності індуцибельної NOS) упродовж 15 хвилин при 37 oC.
Серцева гемодинаміка вивчалася методом кількісної ехокардіографії із розрахунками параметрів кардіогемодинаміки за L. Teicholz et al. (1972) та синхронним записом ЕКГ. Оцінювали такі показники: кінцеводіастолічний (КДО) та кінцевосистолічний об’єм (КСО) лівого шлуночка, індекс маси міокарда, фракцію вигнання (ФВ), кінцевосистолічний (ЛПс) та кінцеводіастолічний (ЛПд) розміри лівого передсердя, індекс жорсткості міокарда лівого шлуночка (ІЖМ), тиск наповнення лівого шлуночка (ТНЛШ), розмір правого шлуночка.
Для оцінки діастолічної функції лівого шлуночка у всіх хворих вивчали трансмітральний кровотік методом імпульсної допплерехокардіографії за стандартною методикою. Визначали такі показники: відношення Vе/Vа (де Vе — максимальна швидкість потоку періоду раннього наповнення, а Vа — максимальна швидкість потоку періоду пізнього наповнення), час уповільнення періоду раннього наповнення (Т(упов.)e), час ізоволемічного розслаблення (IVRT) та кінцеводіастолічний тиск лівого шлуночка (КДТ).
Терапію проводили з використанням ІАПФ (лізиноприл 10–20 мг на добу) та АК (лерканідипін 10–20 мг на добу) в усіх хворих. Комбіновану терапію ІАПФ, АК та препарат мельдонію мілдракор (Новофарм) отримували 68 хворих. Мельдоній призначали внутрішньовенно по 10 мл упродовж 10 діб, а в подальшому перорально по 1000 мг на добу впродовж 1 місяця.
Отримані результати обробляли методами варіаційної і непараметричної статистики за допомогою пакета прикладних статистичних програм Exсel та Statistica.
Результати та їх обговорення
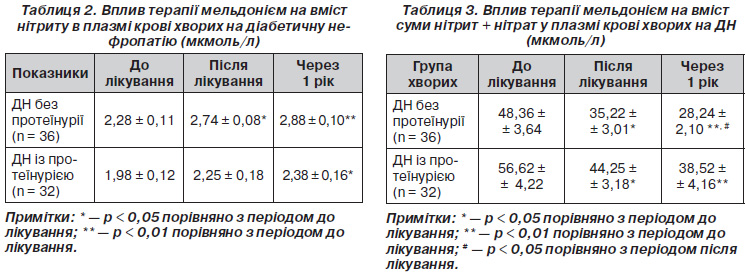
При вивченні стану обміну NO встановлено такі дані. Під час аналізу вмісту нітриту в плазмі крові хворих на ДН нами встановлено, що при прогресуванні захворювання рівень нітриту суттєво зменшувався — на 23,7 % (p < 0,05) у хворих на ДН без протеїнурії та, особливо, на стадії протеїнурії — на 38,3 % (p < 0,05) порівняно з контролем, що виявилось вірогідно нижче, ніж у групі хворих із ГХ (p < 0,05) (табл. 1).
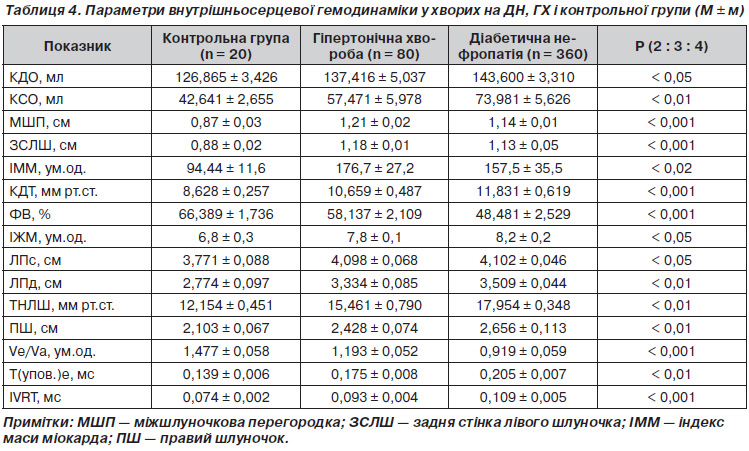
Навпаки, уміст у плазмі суми нітрит ++ нітрат достовірно зростав у міру прогресування ДН: на 80,7 % при ДН без протеїнурії (p < 0,05) та на 111,5 % при ДН із протеїнурією (p < 0,01) порівняно з контролем.
Виявлені зміни відбивають напружений режим функціонування системи регуляції судинного тонусу під впливом прогресуючої дисфункції ендотелію на тлі окислювального стресу та метаболічного впливу високих концентрацій глюкози.
Препарати базисної терапії у хворих на ДН позитивно вплинули на ендотеліальну функцію, що виражалося в збільшенні вмісту нітриту до 2,85 ± 0,24 мкмоль/л (на 16,3 %, p < 0,05) та зменшенні вмісту суми нітрит + нітрат до 27,11 ± 2,40 мкмоль/л (на 23,1 %, p < 0,05).
Комплексна схема лікування хворих на ДН, що включала мельдоній, забезпечила додаткове зростання вмісту нітриту та зменшення вмісту суми нітрит + нітрат (табл. 2, 3).
Найбільш виражений ефект відзначено у хворих на ДН без протеїнурії навіть через 1 рік спостереження: зростання вмісту нітриту на 26,3 % (p < 0,05) та зниження вмісту суми метаболітів NO на 41,6 % (р < 0,01).
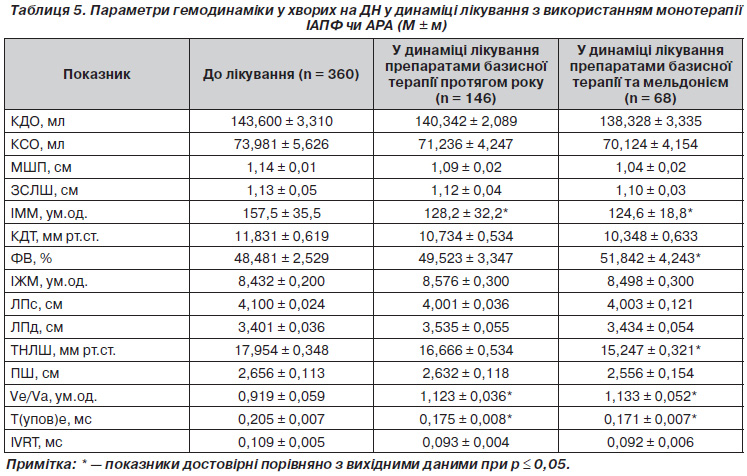
Регресивний аналіз стану кардіальної гемодинаміки хворих на ДН показав, що в першу чергу вже на початкових етапах відзначається підвищення ІЖМ, на що вказує достовірно більша величина ІЖМ порівняно з групою пацієнтів із гіпертонічною хворобою (на 5,1 %) та контрольними значеннями (на 20,6 %). Наступною в часі зміною стану кардіальної гемодинаміки є суттєве порушення діастолічної функції ЛШ саме за рахунок підвищення ІЖМ (табл. 4).
На дану закономірність указує характер змін профілю трансмітрального кровотоку. Так, у хворих на ДН відзначається: достовірно менше значення співвідношення Ve/Va (0,919 ± 0,059 ум.од. проти 1,193 ± 0,052 ум.од. та 1,477 ± 0,058 ум.од. відповідно у хворих на АГ та в контрольній групі); значно більша тривалість часу сповільнення ранньодіастолічного потоку (0,205 ± 0,007 мс проти 0,175 ± 0,008 мс та 0,139 ± 0,006 мс відповідно) та періоду ізоволюмічного розслаблення (0,109 ± 0,005 мс проти 0,093 ± 0,004 мс та 0,074 ± 0,002 мс відповідно). На цьому фоні вже на ранніх стадіях діабетичної нефропатії (ДН I–II ст.), у тому числі й у пацієнтів без артеріальної гіпертензії, формується гіпертрофія міокарда лівого шлуночка, що швидко прогресує при наявності гіпертензії.
Із III стадії у хворих на ДН відзначається прогресуюча дилатація лівих відділів серця. Так, КДО ЛШ у хворих даної групи становить 143,60 ± 3,31 мл порівняно до 126,865 ±± 3,426 мл у групі контролю (Р < 0,05). Величина КСО ЛШ пацієнтів із ДН групи є найбільшою (73,981 ± 5,626 мл) серед обстежених хворих (57,471 ± 5,978 мл та 42,641±± 2,655 мл відповідно при гіпертонічній хворобі та в контролі, р < 0,01). Подібний статистичний розподіл характерний і для розміру ЛПд (3,509 ± 0,044 см проти 3,334 ± 0,085 см та 2,774 ± 0,097 см відповідно).
На цьому тлі у хворих на ДН відзначається порушення систолічної функції лівого шлуночка. Так, у даній групі фракція викиду ЛШ на 27,0 % нижча порівняно з контрольною групою та на 16,6 % менша порівняно з хворими з гіпертонічною хворобою (Р < 0,001).
При аналізі підгруп пацієнтів із ДН відмічається прогресуюче збільшення КДО і КСО та зменшення ФВ залежно від стадії нефропатії та часу існування захворювання.
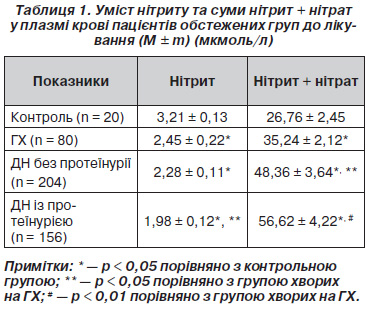
Аналізуючи одержані дані щодо впливу на кардіокінетику препаратів базисної терапії, ми виявили суттєвий кардіопротекторний ефект терапії протягом 1 року нагляду за хворими (табл. 5).
Із наведених матеріалів випливає здатність препаратів викликати регресію гіпертрофії ЛШ, про що свідчить вірогідне зниження ІММ та суттєве зменшення товщини міокарда ЛШ. Окрім того, виходячи з огляду на параметри трансмітрального кровотоку в більшості пацієнтів (48 %), відмічається тенденція до нормалізації діастолічної функції міокарда. Так, в обстежених хворих достовірно збільшується співвідношення Ve/Va, суттєво зменшується час зниження ранньодіастолічного потоку та періоду ізоволемічного розслаблення.
При додаванні до схеми лікування мельдонію ми відзначали суттєвий приріст ефективної кардіопротекції: у хворих додатково зменшувалися КДО та КСО, у результаті чого ФВ зросла майже на 5 %. Ці зміни проходили на тлі подальшого покращення діастолічної функції ЛШ (недостовірно збільшилося співвідношення Ve/Va).
Слід також відзначити, що в 56 % хворих із наявністю супутньої ІХС (n = 44) при призначенні мельдонію мало місце зменшення ступеня депресії сегмента ST. Клінічний ефект препарату проявлявся на 5ту — 7му добу лікування й досягав максимуму до кінця 3 тижнів.
Отже, мельдоній у комплексній терапії хворих на ДН значно зменшує ендотеліальну дисфункції, про що свідчать зміни в стані системи NO. Скоріше за все мельдоній є опосередкованим індуктором покращення функціонування системи NO за рахунок впливу на процеси окислювального стресу. Оптимізуючи синтез АТФ у мітохондріях кардіоміоцитів, препарат покращує метаболізм тканин серця, зменшує потребу їх у кисні і підвищує стійкість до кисневої недостатності. Тим самим препарат, діючи на механізми енергетичного обміну та сприяючи артеріальній вазодилатації, покращує морфологічні параметри серця та серцеву кінетику, що дає можливість запобігти прогресуванню серцевої недостатності у хворих на ДН.
Таким чином, наявні на сьогодні експериментальні та клінічні дані свідчать про універсальну здатність мілдракор® справляти оптимізуючий вплив на енергетичний обмін, зменшуючи потребу тканини в кисні, незалежно від її виду та локалізації. Саме це визначає показання та можливості використання препарату для корекції кардіальних змін у хворих на ДН, які супроводжуються явищами ішемії і гіпоксії, активацією вільнорадикальних процесів, і дозволяє назвати мілдракор® перспективним лікарським засобом і широко впроваджувати його в загальнотерапевтичну практику.
Висновки
1. У хворих на ЦД із ДН на тлі прогресування ендотеліальної дисфункції формується діабетичне серце, що в першу чергу характеризується діастолічною дисфункцією міокарда. Дані зміни відбуваються у зв’язку з проліферативними процесами та фіброзом міокарда. У хворих на ДН, розпочинаючи з III стадії, спостерігається порушення систолічної функції серця, що в подальшому приводить до формування серцевої недостатності.
2. Препарати базисної терапії (ІАПФ та АК) позитивно діють як на прояви ендотеліальної дисфункції, так і на структуральні зміни міокарда, захищаючи його від подальшого ремоделювання.
3. Додаткове призначення мельдонію приводить до подальшого покращення морфологічної структури та скоротливої функції міокарда за рахунок комплексного впливу на метаболічні процеси та обмін оксиду азоту.
1. Артюшкова Е.В., Покровский М.В., Корокин М.В., Гуреев В.В., Бобраков К.Е. Исследование эндотелиопротективных эффектов препарата Кардионат на ADMAподобной модели дефицита азота при специфической блокаде NOсинтазы // International Journal on Immunorehabilitation (Международный журнал по иммунореабилитации). — 2009. — № 11(1). — С. 6667.
2. Гусев В.В. Опыт применения препарата Кардионат при цереброгенной астении // Справочник поликлинического врача. — 2009. — № 10. — С. 2930.
3. Задионченко В.С., Шехян Г.Г., Багатырова К.М., Снеткова А.А., Ялымов А.А. Терапевтическая эффективность триметазидина у больных ишемической болезнью сердца // Русский медицинский журнал. — 2012. — № 11. — С. 548553.
4. Задионченко В.С., Шехян Г.Г., Тимофеева Н.Ю., Снеткова А.А., Ялымов А.А. Цитопротекция в общетерапевтической практике // Участковый терапевт. — 2012. — № 4. — С. 37.
5. Задионченко В.С., Шехян Г.Г., Ялымов А.А., Заседателева Л.В. Микроциркуляция и морфофункциональный статус больных хронической сердечной недостаточностью при лечении триметазидином // Кардиоваскулярная терапия и профилактика. — 2004. — Т. 3, № 5. — С. 7480.
6. Киселев А.Р., Шварц В.А., Посненкова О.М. Влияние терапии препаратом Кардионат на качество жизни у больных острым инфарктом миокарда с подъемом сегмента ST в раннем постинфарктном периоде. ФГУ «Саратовский НИИ кардиологии Росмедтехнологий» // Consilium Medicum. — 2010. — № 12(5). — С. 9498.
7. Корокин М.В., Артюшкова Е.В., Покровский M.В. и др. Исследование эндотелио и кардиопротективных свойств препарата Кардионат при моделировании LNameиндуцированного дефицита оксида азота // Курский научнопрактический вестник «Человек и его здоровье». — 2007. — № 3. — С. 59.
8. Кузнецова А.В., Тепляков А.Т. Оценка влияния Кардионата на эффективность антиангинальной терапии и функциональное состояние миокарда у больных ИБС в сочетании с артериальной гипертензией, ассоциированной с сахарным диабетом типа 2 // Фарматека. — 2007. — № 3. — С. 8184.
9. Михин В.П. Кардиоцитопротекторы — новое направление клинической кардиологии // Архив внутренней медицины. — 2011. — № 1. — С. 2128.
10. Михин В.П., Поздняков Ю.М., Хлебодаров Ф.Е., Кольцова О.Н. Милдронат в кардиологической практике — итоги, новые направления, перспективы // Кардиоваскулярная терапия и профилактика. — 2012. — № 11(1). — С. 96103.
11. Пустозеров В.Г., Красильникова И.П., Костромина М.А., Михайлова М.Н. Опыт применения Кардионата в геронтологической практике // Справочник поликлинического врача. — 2009. — № 9. — С. 2021.
12. Стаценко М.Е., Евтерева Е.Д., Туркина С.В. Возможность применения миокардиального цитопротектора в комбинированной терапии больных с хронической сердечной недостаточностью и метаболическим синдромом // Consiliun Mеdicum (кардиология). — 2010. — № 12(10). — С. 7682.
13. Стаценко М.Е., Туркина С.В., Спорова О.Е. Применение препарата Кардионат в комбинированной терапии хронической сердечной недостаточности ишемической этиологии у больных с метаболическим синдромом // Российский кардиологический журнал. — 2010. — № 4. — С. 3539.
14. Сыркин А.Л., Добровольский А.В. Антиишемические препараты метаболического действия // Consilium Medicum. — 2002. — № 4(11). — С. 572575.
15. Dzerve V., MILSS I Study Group. A DoseDependent Improvement in Exercise Tolerance in Patients With Stable Angina Treated With Mildronate: A Clinical Trial «MILSS I» // Medicina (Kaunas). — 2011. — Vol. 47(10). — Р. 544551.
16. Van Bilsen M., Smeets P.J., Gilde A.J., van der Vusse G.J. Metabolic remodelling of the failing heart: the cardiac bumout syndrome? // Cardiovasc. Res. — 2004. — Vol. 61(2). — Р. 218226.