Журнал "Гастроэнтерология" 1 (51) 2014
Вернуться к номеру
Молекулярні особливості розвитку запалення слизової оболонки шлунка у дітей із хелікобактерною інфекцією, асоційованою з CagA(+)-штамами Н.pylori
Авторы: Абатуров О.Є., Герасименко О.М. - Державний заклад «Дніпропетровська медична академія Міністерства охорони здоров’я України»
Рубрики: Гастроэнтерология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета. Оцінити роль NF-κB та факторів рекогніції вродженого імунітету (TLR4, sCD14) в розвитку запалення слизової оболонки шлунка (СОШ) у дітей, хворих на хронічні гастродуоденальні захворювання, залежно від наявності CagA(+)- та CagA(–)-штамів Н.pylori.
Матеріали та методи. Обстежено 66 дітей віком 7–17 років із хронічною гастродуоденальною патологією в стадії загострення. Рівень експресії гена TLR4 в біоптаті СОШ у режимі реального часу визначали методом полімеразної ланцюгової реакції, рівень експресії NF-κB+ СD40+-клітинами — з використанням моноклональних антитіл методом проточної цитофлуориметрії.
Результати. Показано, що у дітей, інфікованих CagA(+)-штамами Н.pylori, при збереженні виражених клініко-ендоскопічних запальних змін СОШ відзначалося зниження активності експресії TLR4 в біоптаті СОШ та рівня експресії ядерного фактора NF-κB+ у лімфоцитах, на відміну від пацієнтів, інфікованих CagA(–)-штамами Н.pylori, і від дітей, захворювання яких не було пов’язане з інфікуванням Н.pylori
(Pu < 0,05). Доведено, що у пацієнтів із позитивним Н.pylori-статусом, інфікованих CagA(+)-штамами Н.pylori, реєструвались вищі рівні концентрації sCD14, ніж у дітей із негативним Н.pylori-статусом та інфікованих CagA(–)-штамами Н.pylori (Pu < 0,05).
Цель. Оценить роль NF-κB и факторов рекогниции врожденного иммунитета (TLR4, sCD14) в развитии воспаления слизистой оболочки желудка (СОЖ) у детей, больных хроническими гастродуоденальными заболеваниями, в зависимости от наличия CagA(+)- и CagA(–)-штаммов Н.pylori.
Материалы и методы. Обследовано 66 детей в возрасте 7–17 лет с хронической гастродуоденальной патологией в стадии обострения. Уровень экспрессии гена TLR4 в биоптате СОЖ в режиме реального времени определяли методом полимеразной цепной реакции, уровень экспрессии NF-κB+ СD40+-клетками — с использованием моноклональных антител методом проточной цитофлуориметрии.
Результаты. Показано, что у детей, инфицированных CagA(+)-штаммами Н.pylori, при сохранении выраженных клинико-эндоскопических воспалительных изменений СОЖ отмечалось снижение активности экспрессии TLR4 в биоптате СОЖ и уровня экспрессии ядерного фактора NF-κB+ в лимфоцитах в отличие от пациентов, инфицированных CagA(–)-штаммами , и от детей, у которых заболевание не было связано с инфицированием Н.pylori (Pu < 0,05). Доказано, что у пациентов с положительным Н.pylori-статусом, инфицированных CagA(+)-штаммами Н.pylori, регистрировались более высокие уровни концентрации sCD14, чем у детей с негативным Н.pylori-статусом и инфицированных CagA(–)-штаммами Н.pylori (Pu < 0,05).
Objective. To evaluate the role of NF-κB and factors of recognition innate immunity (TLR4, sCD14) in the development of inflammation of the gastric mucosa (GM) in children with chronic gastroduodenal diseases, depending on the presence of CagA(+) and CagA(–) strains of H.pylori.
Materials and Methods. The study involved 66 children aged 7–17 years with chronic gastroduodenal pathology in the acute stage. TLR4 gene expression level in the biopsy material in real time was performed by polymerase chain reaction, the level of expression of NF-κB+ by CD40+ cells was determined using monoclonal antibodies by flow cytofluorometry.
Results. It is shown that in children infected with CagA(+) strains of H.pylori, while maintaining the expressed clinical and endoscopic inflammatory changes in GM, we detected a decrease in activity of the expression of TLR4 in GM biopsy material and the level of expression of nuclear factor NF-κB+ in lymphocytes, in contrast to patients infected with CagA(–) strains of H.pylori, and to children whose disease was not associated with H.pylori infection (Pu < 0.05). It is shown that in H.pylori-positive patients infected with CagA(+) strains we registered higher sCD14 concentrations, than in H.pylori-negative children and in those infected by CagA(–) strains of H.pylori (Pu < 0.05).
Helicobacter pylori, вроджений імунітет, TLR4, sCD14, NF-κB, діти.
Helicobacter pylori, врожденный иммунитет, TLR4, sCD14, NF-κB, дети.
Helicobacter pylori, innate immunity, TLR4, sCD14, NF-κB, children.
Статья опубликована на с. 13-17
/13/13.jpg)
Вступ
Сигнальні трансмембранні тол–подібні рецептори (toll-like receptor, TLR) є ключовою ланкою образ-розпізнавальних рецепторів (PRR) і займають центральне місце в багаторівневій системі розпізнавання консервативних патоген-асоційованих молекулярних структур мікроорганізмів (pathogen-associated molecular patterns, PAMP). TLR відіграють визначальну роль в активації вроджених імунних механізмів захисту при вторгненні патогенів, у тому числі і Helicobacter pylori (H.рylori). Ліпополісахариди (lipopolysaccharide, LPS) — структурні компоненти зовнішньої мембрани грамнегативних бактерій є одними з найвпливовіших РАМР, у т.ч. H.pylori. Основними PRR для LPS H.pylori є TLR4 [1, 2].
Рекогніція PAMP TLR відбувається при безпосередній взаємодії або за допомогою аксесуарних молекул. TLR4 розпізнає LPS H.рylori через аксесуарні молекули: ліпополісахарид-зв’язуючий білок (lipopolysaccharide binding protein, LBP), CD14, MD-2. В екстрацелюлярному просторі LPS H.рylori зв’язується з солютабним LBP, який функціонує як опсонін для глікозилфосфатидилінозитол-зв’язуючого білка CD14. Взаємодія з мембранним CD14 комплексу LPS/LBP каталізує зв’язування LPS із мембраноасоційованим протеїном MD-2 [6].
У подальшому каскаді молекулярних подій комплекс LPS/MD-2 взаємодіє з TLR4, викликаючи його димеризацію і збудження [12]. Асоційований з ендоплазматичною мембраною клітини мультимера LPS/TLR4/MD-2, взаємодіючи з адаптерними молекулами Mal і MyD88, призводить до активації каскаду сигнальних молекул, обумовлюючи збудження ядерного фактора транскрипції κB (NF-κB) та синтез прозапальних цитокінів. Мультимер LPS/TLR4/MD-2, перебуваючи на мембрані ранньої ендосоми, рекрутує адаптерні молекули TRAM, TRIF та активує інтерферонрегулюючий транскрипційний фактор 3 (IRF3), що призводить до продукції інтерферону β (IFN-β) [10, 11].
Таким чином, основними складовими вродженої імунної відповіді на інфекцію H.pylori є LBP, CD14, TLR4 і NF-κB.
Мета дослідження — оцінити роль NF-κB та факторів рекогніції вродженого імунітету (TLR4, sCD14) у розвитку запалення слизової оболонки шлунка у дітей, хворих на хронічні гастродуоденальні захворювання, залежно від Н.pylori-статусу.
Матеріали та методи дослідження
Обстежено 66 дітей віком 7–17 років із хронічною гастродуоденальною патологією (ХГДП) у стадії загострення. Діти були під спостереженням і лікувались у спеціалізованому дитячому гастроентерологічному відділенні комунального закладу «Дніпропетровська дитяча міська клінічна лікарня № 1» Дніпропетровської обласної ради». За наявністю Н.pylori пацієнти були розподілені на дві групи. До першої (основної) групи увійшли пацієнти з позитивним Н.pylori-статусом — 44 (66,7 %), до другої (порівняння) — діти, у яких Н.pylori був відсутнім, — 22 (33,3 %). Було отримано інформовану згоду батьків пацієнтів на участь у науковому дослідженні, яке проводили з дозволу локальної комісії з біоетики ДЗ «ДМА МОЗ України».
Обстеження пацієнтів, які були під спостереженням, проведено за уніфікованим протоколом діагностики та лікування органів травлення та включало комплексне клініко-лабораторне й інструментальне обстеження, ендоскопічне дослідження за загальноприйнятою методикою стравоходу, шлунка і дванадцятипалої кишки (ФЕГДС) (Pentax FG-15W, Японія), УЗД органів черевної порожнини.
Ідентифікація Н.pylori-статусу проводилась за допомогою швидкого уреазного Хелпіл-тесту та дихального Хелік-тесту (ТОВ «АМА», Росія, м. Санкт-Петербург); визначення в сироватці венозної крові сумарних імуноглобулінів (Ig M, A, G) до Ag СаgА білка H.pylori методом ІФА (використовували діагностичні тест-системи «ХелікоБест-антитіла», «Вектор-Бест», Росія).
Рівень експресії гена TLR4 визначався методом полімеразної ланцюгової реакції (ПЛР) у режимі реального часу (Real-time). Виділення загальної РНК із клітин слизової оболонки шлунка (СОШ) проводили за допомогою комплекту реагентів «РИБО-золь-В» (AmpliSens, Росія). Для отримання кДНК у реакції оберненої транскрипції використовували праймер оліго(dT)18. Аналізували експресію гена тол-подібного рецептора TLR4 методом ПЛР у реальному часі при забарвленні SYBR Green I шляхом відносного кількісного аналізу. Як референтний ген використовували ген β-актину. Для аналізу даних застосовували відносний Ср-метод із розрахунком за формулою:
∆Ср = Ср (TLR4) – Ср (β-актину) [7].
Для визначення експресії NF-kB СD40+-клітинами суспензію мононуклеарів периферичної крові інкубували з моноклональними антитілами (мкАТ) до поверхневих антигенів CD40. До 50 мкл суспензії (105 клітин) додавали 5 мкл мкАТ, мічених FITC, проти CD40 (Caltag, США) й інкубували 20 хв при 4 °С. Потім клітини відмивали шляхом центрифугування з 1 мл фосфатно-сольового буфера (ФСБ) при 1500 об/хв протягом 5 хв. Ресуспендовані клітини фіксували розчином (Caltag, США) 20 хв при 4 °С. Пермеабілізацію проводили за наявності мкАТ проти субодиниці р65 молекули NF-kB (BD Biosciences Pharmingen, США) протягом 40 хв при 4 °С. Після одноразового відмивання до ресуспендованих клітин додавали інші мкАТ, мічені РЕ (Caltag, США). Після 20-хвилинної інкубації клітини відмивали, додавали 0,5 мл ФСБ та аналізували проби на проточному цитофлуориметрі EPIX LX-MCL (Beckman Coulter, США), використовуючи програму System IITM Software. Для збудження флуоресценції використовували аргоновий лазер із довжиною хвилі 488 нм. Додатково до флуоресцентних параметрів проводили реєстрацію прямого та бокового світлорозсіювання клітин, що дозволяло виключати з аналізу конгломерати клітин, їх уламки. Визначення експресії NF-kB у лімфоцитах та експресії гена TLR4 у біоптаті СОШ проводилося в НДІ генетичних та імунних основ розвитку патології та фармакогенетики ВДНЗ «Українська медична стоматологічна академія», м. Полтава.
Статистичну обробку отриманих результатів проведено за допомогою пакетів комп’ютерних статистичних програм Statgraf, Matstat, Statistica 6.0. При вивченні значущості відмінностей статистичних вибірок використовувались пара- і непараметричні критерії. Вірогідність розходжень при розподілі, відмінному від нормального, оцінювалася за допомогою U-критерію Манна — Уїтні, для даних із нормальним розподілом — t-критерію Стьюдента. Для порівняння частоти ознаки між досліджуваними групами використовували критерій χ2 (Сhi-square test) з кількістю ступенів свободи, що дорівнювала 1. Статистично значущими вважали відмінності при р < 0,05 [4, 5].
Результати дослідження та їх обговорення
Характеристика обстежених пацієнтів залежно від Н.pylori-статусу наведена в табл. 1.
Середній вік дітей у групі з позитивним Н.pylori-статусом становив (13,52 ± 0,46) року, у групі порівняння — (14,09 ± 0,69) року. Розподіл за статтю в обох групах був майже однаковим. Дівчатка незначно переважали в групі дітей із позитивним Н.pylori-статусом (31,8 проти 27,3 %), хлопчики — в групі дітей з негативним Н.pylori-статусом (72,7 проти 68,2 %). Діти з Н.pylori-позитивним статусом мали вищий індекс маси тіла на відміну від групи порівняння (Pu < 0,01). Частота загострень у дітей, які перебували під спостереженням, залежала від наявності хелікобактерної інфекції. Так, кількість загострень ХГДП у дітей із позитивним Н.pylori-статусом була вищою й у середньому становила на рік (2,50 ± 0,26), у групі порівняння — (2,00 ± 0,13) (Pu = 0,01). Сезон загострення був дещо відмінним, але ці відмінності не мали статистичної значущості.
Проведене нами дослідження показало, що у 35 із 66 обстежених дітей у крові виявлені сумарні Ig A, M, G до Ag CagA Н.pylori в діагностичній концентрації (1 : 5–1 : 80). Це дало нам можливість стверджувати, що 53,0 % дітей, хворих на різні форми хронічних запальних та ерозивно-виразкових гастродуоденальних захворювань, які спостерігались, інфіковані цитотоксичними CagA(+)-штамами Н.pylori. У дуже низьких титрах (< 1 : 5) антитіла до CagA-антигену були присутні у 9 дітей (13,6 %), це дозволило вважати, що вони інфіковані нетоксигенними CagA(–)-штамами Н.pylori.
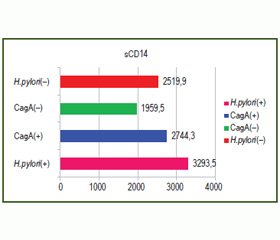
Нами проаналізовано особливості експресії TLR4 у біоптаті слизової оболонки шлунка та ядерного фактора kB (NF-kB+) у лімфоцитах, рівня концентрації TLR4-аксесуарної молекули розчинного CD14 (sCD14) у сироватці крові залежно від Н.pylori-статусу, CagA(+)- та CagA(–)-інфікованих дітей, хворих на ХГДП (рис. 1, 2).
При порівнянні показників рівня концентрації sCD14 відмічена їх вірогідна відмінність у групах залежно від Н.pylori-статусу. Так, у пацієнтів, інфікованих CagA(+)-штамами Н.pylori, реєструвались вищі рівні концентрації sCD14, ніж у дітей із негативним Н.pylori-статусом та інфікованих CagA(–)-штамами Н.pylori (Pu < 0,05).
СD14 — корецептор TLR4, компонент рецепторного комплексу CD14/TLR4/MD2, що розпізнає LPS, є інтегральною складовою вродженої імунної відповіді на інфекцію Н.pylori. Ген CD14 кодує дві форми білка: 50 і 55 кДа. Білок 55 кДа (mCD14) містить ділянку з глікозилфосфатидилінозитолом, який утримує білок у мембрані. Скорочена форма білка 50 кДа (солютабний sCD14) не містить «заякореної» ділянки і є розчинним білком, який моноцити і клітини печінки секретують у кров. sCD14 також зв’язує ліпополісахарид, але виконує іншу роль, ніж mCD14. Взаємодія з sCD14 комплексу LPS/LBP зумовлює ізоляцію і подальшу елімінацію LPS з організму [3].
Наші результати збігаються з даними J. Karhukorpi та співавт. [8], Dan Zhao та співавт. [14], які у своїх дослідженнях також відмічають підвищення рівня концентрації sCD14 у пацієнтів з активним перебігом хелікобактерної інфекції.
Аналіз результатів молекулярно-генетичних досліджень свідчить про те, що у дітей, інфікованих CagA(+)-штамами Н.pylori, при збереженні виражених клініко-ендоскопічних запальних змін СОШ відзначалося зниження активності експресії TLR4 у біоптаті СОШ та рівня експресії ядерного чинника NF-κB+ у лімфоцитах на відміну від пацієнтів, інфікованих CagA(–)-штамами Н.pylori, і від дітей, захворювання яких не було пов’язане з інфікуванням Н.pylori (Pu < 0,05).
Рекогніція LPS H.pylori TLR4 призводить до активації адаптерних молекул MyD88, що індукує мітоген-активовані протеїнкінази, забезпечуючи активацію фактора транскрипції NF-kB. Проте були отримані й інші експериментальні дані, які заперечують необхідність активації TLR4 у процесі збудження епітеліоцитів СОШ [15].
Враховуючи, що протеїн CagA H.pylori, використовуючи мотив CRPIA, незалежно від фосфорилювання, може викликати різноманітні клітинні відповіді, в тому числі активацію факторів транскрипції — ядерного фактора NF-κВ активуючого протеїну 1 (AP-1), ядерного фактора активованих Т-клітин (NFAT), сироваткового елементу відповіді (SRE) і сироваткового фактора відповіді (SRF), сприяючи розвитку запального процесу, є одним із найважливіших факторів, що ініціюють процес запалення в СОШ [9].
У даний час виділено 12 різних внутрішньоклітинних сигнальних шляхів, за допомогою яких H.pylori активує фактор транскрипції NF-kB T4SS-залежним і T4SS-незалежним способом. T4SS-залежний каскад внутрішньоклітинних молекулярних шляхів, що активують фактор транскрипції NF-kB, у свою чергу, ділять на CagA-залежний і CagA-незалежний [13].
До T4SS-залежних і CagA-залежних відносяться:
/16/16.jpg)
Збудження фактора транскрипції NF-kB обумовлює індукцію синтезу прозапальних хемокінів, у тому числі IL-8, цитокінів, молекул адгезії, синтази монооксиду азоту.
Отримані нами дані свідчать, що у пацієнтів із хронічними CagA(+) HP-асоційованими гастродуоденальними захворюваннями спостерігаються тенденційно більш низькі рівні експресії фактора транскрипції NF-kB, які супроводжуються збільшенням концентрації sCD14. Подібне поєднання змін активності молекулярних компонентів LPS-асоційованого прозапального каскаду дозволяє припустити, що CagA(+)-штами H.pylori здатні індукувати запальний процес в обхід sCD14, який попереджає зв’язування LPS із mCD14 і, як наслідок, збудження TLR4. Проте медикаментозна модуляція концентрацією sCD14 може бути одним із можливих напрямків терапії хелікобактерної інфекції у дітей.
Можливо, що запальний процес СОШ підтримується активністю інших прозапальних факторів транскрипції.
Висновки
1. Провідним молекулярним компонентом, активність якого визначає розвиток запального процесу в СОШ дітей, хворих на хронічні гастродуоденальні захворювання, є фактор транскрипції NF-kB.
2. У пацієнтів з активним перебігом хелікобактерної інфекції, інфікованих CagA(+)-штамами Н.pylori, спостерігається вірогідне підвищення концентрації солютабної форми CD14 у сироватці крові.
3. У дітей, інфікованих CagA(+)-штамами Н.pylori, при збереженні виражених клініко-ендоскопічних запальних змін СОШ відзначається зниження активності експресії TLR4 у біоптаті СОШ на відміну від пацієнтів, інфікованих CagA(–)-штамами Н.pylori, і від дітей, захворювання яких не було пов’язане з інфікуванням Н.pylori.
1. Абатуров А.Е. Рецепторные механизмы инициации воспалительного процесса при инфекционных заболеваниях [Текст] / А.Е. Абатуров, А.П. Волосовец, Е.И. Юлиш // Здоровье ребенка. — 2012. — № 4(39). — С. 138–141.
2. Абатуров О.Є. Модуляція активності TLR4 епітеліоцитів слизової оболонки шлунка при хелікобактерній інфекції [Текст] / О.Є. Абатуров, О.М. Герасименко // Современная педиатрия. — 2009. — № 6(28). — С. 141–146.
3. Абатуров О.Є. Особливості експресії TLR4 та TLR–аксесуарних молекул у дітей, хворих на хронічний гастродуоденіт [Текст] / О.Є. Абатуров, О.М. Герасименко // Современная педиатрия. — 2011. — № 3(37). — С. 100–103.
4. Гублер Е.В. Математические методы анализа и распознавания патологических процессов / Е.В. Гублер. — Л.: Медицина, 1978. — 294 с.
5. Гублер Е.Н. Применение непараметрических методов статистики в медико–биологических исследованиях / Е.Н. Гублер, А.А. Генкин. — Л.: Медицина, 1973. — 141 с.
6. Akashi–Takamura S., Miyake K. TLR accessory molecules. [Text] // Curr. Opin. Immunol. — 2008. — 20(4). — 420–425. doi: 10.1016/j.coi.2008.07.001. Epub 2008 Jul 24.
7. Allhorn S. TLR3 and TLR4 expression in healthy and diseased human endometrium / S. Allhorn, C. Boing, A.A. Koch [et al.] // Reproductive Biology and Endocrinology. — 2008. — Vol. 6, № 40. — doi:10.1186/1477-7827-6-40.
8. Effect of CD14 promoter polymorphism and H.pylori infection and its clinical outcomes on circulating CD14 [Text] / J. Karhukorpi, Y. Yan, S. Niemela, J. Valtonen [et al.] // Clin. Exp. Immunol. — 2002. — 128(2). — 326–332. doi: 10.1046/j.1365-2249.2002.01837.x.
9. Helicobacter pylori CagA phosphorylation–independent function in epithelial proliferation and inflammation [Text] / M. Suzuki, H. Mimuro, K. Kiga [et al.] // Cell. Host. Microbe. — 2009 Jan 22. — 5(1). — 23–34. doi: 10.1016/j.chom.2008.11.010.
10. Host innate immune receptors and beyond: making sense of microbial infections [Text] / K. J. Ishii, S. Koyama, A. Nakagawa [et al.] // Cell. Host. & Microbe. — 2008. — 3. — 352–363.
11. Kawai T., Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors [Text] // Nat. Immunol. — 2010. — 11(5). — 373–84. doi: 10.1038/ni.1863.
12. Lu Y.C. LPS/TLR4 signal transduction pathway [Text] // Y.C. Lu, W.C. Yeh, P.S. Ohashi // Cytokine. — 2008. — 42(2). — 145–51. doi: 10.1016/j.cyto.2008.01.006.
13. NF-kappaB activation and potentiation of proinflammatory responses by the Helicobacter pylori CagA protein[Text] / S. Brandt, T. Kwok, R. Hartig [et al.] // Proc. Natl. Acad. Sci USA. — 2005. — 102(26). — 9300–5.
14. Role of CD14 Promoter Polymorphisms in Helicobacter pylori Infection Related Gastric Carcinoma [Text] / D. Zhao, T. Sun, X. Zhang [et al.] // Clin. Cancer Res. — 2007. — 13(8). — 2362–2368.
15. Toll-like receptor–dependent activation of antigen–presenting cells affects adaptive immunity to Helicobacter pylori [Text] / R. Rad, L. Brenner, A. Krug [et al.] // Gastroenterology. — 2007. — 133(1). — 150–163.e3. doi:10.1053/j.gastro.2007.04.071.

/15/15.jpg)
/15/15_2.jpg)