Журнал "Гастроэнтерология" 1 (51) 2014
Вернуться к номеру
Вікові особливості вмісту окремих про- та протизапальних цитокінів у крові хворих на цироз печінки невірусної етіології
Авторы: Присяжнюк В.П. - Кафедра пропедевтики внутрішніх хвороб Буковинського державного медичного університету, м. Чернівці
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Вивчено вікові особливості вмісту фактора некрозу пухлин α, інтерлейкіну-4 та трансформуючого фактора росту β1 у крові у хворих на цироз печінки та їх взаємозв’язки з біохімічними маркерами ушкодження печінки. Виявлено, що у хворих на цироз печінки невірусного походження суттєвих змін зазнає цитокінова система, що проявляється в збільшенні концентрації фактора некрозу пухлин-α і трансформуючого фактора росту β1 у плазмі крові порівняно з практично здоровими людьми та віковим зростанням рівня зазначених цитокінів. Уміст інтерлейкіну-4 в крові пацієнтів із цирозом печінки був знижений порівняно з контрольними показниками, вікових особливостей концентрації цитокіну в крові не виявили. Встановлені кореляційні зв’язки між умістом прозапальних цитокінів та біохімічними маркерами цитолітичного, холестатичного та мезенхімально-запального синдромів вказують на вагому роль цитокінової ланки імунної системи в розвитку та прогресуванні цирозу печінки.
Изучены возрастные особенности содержания фактора некроза опухолей α, интерлейкина-4 и трансформирующего фактора роста β1 в крови у больных циррозом печени и их взаимосвязь с биохимическими маркерами повреждения печени. Выявлено, что у больных циррозом печени существенные изменения испытывает цитокиновая система, что проявляется в увеличении концентрации фактора некроза опухолей α и трансформирующего фактора роста β1 в плазме крови по сравнению с практически здоровыми людьми и возрастным увеличением уровня указанных цитокинов. Содержание интерлейкина-4 в крови пациентов с циррозом печени было снижено по сравнению с контрольными показателями, возрастных особенностей концентрации этого цитокина в крови не установили. Установлены корреляционные связи между содержанием провоспалительных цитокинов и биохимическими маркерами цитолитического, холестатического и мезенхимально-воспалительного синдромов, что указывает на важную роль цитокинового звена иммунной системы в развитии и прогрессировании цирроза печени.
Age-dependent features of tumor necrosis factor α, interleukin-4 and transforming growth factor β1 in the blood of patients with liver cirrhosis and their correlation with biochemical markers of liver injury were studied. It was found that in patients with liver cirrhosis cytokine system underwent significant changes. This resulted in increased blood plasma concentration of tumor necrosis factor α and transforming growth factor β1 compared with apparently healthy patients and in age-dependent increase of these cytokines. The blood content of interleukin-4 in patients with liver cirrhosis was reduced compared with controls, age-dependent changes of this cytokine concentration in blood weren’t detected. Correlation between the proinflammatory cytokine plasma levels and biochemical markers of cytolytic, cholestatic and mesenchymal-inflammatory syndromes was established, indicating a significant role of cytokine component of the immune system in the development and progression of liver cirrhosis.
цироз печінки, фактор некрозу пухлин α, інтерлейкін-4, трансформуючий фактор росту β1.
цирроз печени, фактор некроза опухолей α, интерлейкин-4, трансформирующий фактор роста β1.
liver cirrhosis, tumor necrosis factor α, interleukin-4, transforming growth factor β1.
Статья опубликована на с. 37-43
/37/37.jpg)
Актуальність
Загальновідомо, що цитокіни є середниками апоптозу та некрозу гепатоцитів і відіграють важливу роль у процесах запалення, холестазу та фіброзоутворення в печінковій тканині. Прозапальні цитокіни — важливі чинники в розвитку захворювань печінки, водночас протизапальні цитокіни відіграють вагому роль у її регенерації [1, 2]. Унаслідок пошкодження та руйнування гепатоцитів при різних патологічних станах виділяються різноманітні біологічно активні речовини, з–поміж яких окремі здатні активувати зірчасті клітини Іто. Це, насамперед, трансформуючий фактор росту-β1 (TGF-β1), фактор некрозу пухлин-α (TNF-α), інтерлейкін-1, пероксиди, оксид азоту (ІІ) та ендотелін [3]. Зокрема збільшення концентрації TGF-β1 корелює з концентрацією білокзв’язаного оксипроліну, який є маркером активності фіброгенезу в печінці [4]. TGF-β виявляє свої властивості опосередковано через активацію цитоплазматичних середників Smad, які модулюють транскрипцію генів-мішеней, у тому числі генів проколагену I і III типів [3, 5]. Зазначений цитокін стимулює також синтез ламініну та колагену IV типу ендотеліальними та зірчастими клітинами печінки [6]. Інгібування впливів TGF-β1 зменшує активність фіброзу печінки на 50–70 % [7]. Для пацієнтів із хронічним гепатитом та цирозом печінки (ЦП) характерне зростання концентрацій TNF-α в сироватці крові [2]. Причому більш високий уміст такого цитокіну спостерігається в пацієнтів із вірусними гепатитами порівняно з хворими на токсичні та алкогольні захворювання печінки [8]. В експерименті на мишах показано, що у тварин із малою кількістю рецепторів I типу до TNF-α не розвивалися ураження печінки після тривалого введення етанолу [2]. В експериментальних дослідженнях виявлено, що TNF-α сприяє активації зірчастих клітин, збільшенню вироблення білків позаклітинного матриксу, пригнічує апоптоз активованих зірчастих клітин, стимулює синтазу оксиду азоту (ІІ) та індукує продукцію оксиду азоту (ІІ) [9]. Встановлено, що TNF-α є незалежним предиктором фіброгенезу в хворих на неалкогольну хворобу печінки, а синтезований у відповідь на вплив алкоголю може призвести до розвитку гепатиту [9]. Згідно з дослідженнями окремих авторів, поряд із TNF-α інтерлейкін-4 (IL-4) є важливим цитокіном, який бере участь у процесах фіброгенезу [10]. У хворих на токсичний ЦП концентрація протизапального IL-4 часто знижена, водночас у пацієнтів із вірусним ЦП цей показник підвищений [10].
В останній час різні вчені приділяють увагу вивченню вікових особливостей активності про- та протизапальних цитокінів [11–13]. Зокрема, у дослідженнях P. Sansoni et al. показано, що активність прозапальних інтерлейкіну-2, інтерферону-γ та TNF-α у здорових осіб зростає з віком та є найвищою в довгожителів [11]. Водночас уміст TGF-β1 у плазмі крові є найбільшим у дитячому віці і вірогідно знижується в людей зрілого та літнього віку [13]. Незважаючи на глибоке та різностороннє вивчення ролі цитокінової ланки імунної системи у розвитку та прогресуванні ЦП [1–10], актуальним залишається питання висвітлення вікових аспектів впливу про- та протизапальних цитокінів на процеси фіброгенезу в контексті виявлених особливостей перебігу ЦП у хворих різного віку [14, 15].
Мета дослідження: вивчити вікові особливості вмісту TNF-α, IL-4 та TGF-β1 в крові у хворих на ЦП та їх взаємозв’язки з біохімічними маркерами ушкодження печінки.
Матеріал і методи
Обстежено 112 хворих на ЦП віком від 30 до 74 (54,2 ± 10,0) років. Серед обстежених пацієнтів переважали чоловіки — 76 (67,9 %). Тривалість захворювання з моменту встановлення діагнозу ЦП становила від 1 до 5 років. Усіх обстежених хворих та практично здорових осіб (ПЗО) поділено за віковим аспектом згідно з прийнятою Європейським регіональним бюро ВООЗ класифікацією періодів життя людини. До першої групи (30–44 роки) увійшли 30 пацієнтів із ЦП, до другої (45–59 років) — 45 хворих на ЦП, до третьої (60–74 роки) — 37 осіб із ЦП.
Ступінь тяжкості ЦП оцінювали за критеріями C.G. Child (1964) у модифікації K.N.H. Pugh (1973). Детальна характеристика хворих на ЦП різних вікових груп залежно від ступеня тяжкості циротичного процесу за Чайлдом — П’ю наведена у табл. 1.
/38/38.jpg)
Кількість хворих із компенсованою, суб- та декомпенсованою стадіями ЦП у різних вікових групах була порівняною, із тенденцією до збільшення кількості пацієнтів із суб- та декоменсованим ЦП серед хворих другої та третьої вікових груп. Контрольну групу становили 30 практично здорових волонтерів, репрезентативних за віком та статтю до обстежених пацієнтів. Перед проведенням обстеження всі пацієнти та практично здорові волонтери дали письмову інформовану згоду на проведення дослідження. Біохімічні дослідження крові виконували на біохімічному аналізаторі Accent-200 Cormay S.A. (Польща). Методом імуноферментного аналізу в плазмі крові проводили визначення TNF-α із використанням набору реактивів Diaclone (Франція), TGF-β1 (Bender MedSystems GmbH, Австрія), IL-4 (Diaclone, Франція) за допомогою імуноферментного аналізатора Statfax 303+ (США).
Аналіз отриманих показників проводили, попередньо визначаючи тип розподілу даних за порівнянням середньої арифметичної, моди та медіани, аналізом гістограм розподілу даних, за допомогою тестів Шапіро — Уїлка та Левене. Для визначення статистичних відмінностей між двома незалежними групами використовували t-критерій Стьюдента для незалежних груп у тому разі, коли дані відповідали нормальному розподілу. У випадку непараметричних даних для цього використовували критерій Манна — Уїтні. Кореляційний аналіз у випадку нормального розподілу даних проводили за допомогою методу Пірсона, у випадку розподілу даних, відмінного від нормального, користувались методом Спірмена. Кореляційний зв’язок із силою r ≤ 0,25 розцінювався як слабкий, із силою 0,25 < r < 0,75 — середньої сили та r ≥ 0,75 — сильний кореляційний зв’язок.
Результати дослідження
У всіх обстежених хворих спостерігались однотипні патологічні відхилення біохімічних показників крові. Концентрація загального білірубіну у групах хворих на ЦП вірогідно переважала відповідні контрольні показники: для І групи — у 2,1 раза (р < 0,05), для ІІ групи — у 3,6 раза (р < 0,05), для ІІІ групи — у 5,9 раза (р < 0,001) (рис. 1).
Відбувалося зростання концентрації загального білірубіну в хворих на ЦП ІІІ групи порівняно з І групою на 96,4 % (р < 0,05) та ІІ групою на 25,0 % (р < 0,05) (табл. 2). У цілому динаміка порушень пігментного обміну відображала ступінь активності циротичного процесу та меншою мірою — вікових особливостей.
Активність аспартатамінотрансферази (АсАТ) у хворих на ЦП переважала таку в практично здорових осіб у 2,7 раза (р < 0,001) для І групи, у 2,9 раза (р < 0,001) — для ІІ групи, у 3,3 раза (р < 0,001) — для ІІІ групи (рис. 2). Найвищою активність АсАТ була в хворих літнього віку, що, ймовірно, пов’язано з наявністю ішемічної хвороби серця, дифузного кардіосклерозу й інших уражень міокарда в цих осіб, проте вірогідним таке збільшення порівняно з пацієнтами молодого та зрілого віку не було. Для встановлення причини підвищення АсАТ у плазмі крові був використаний коефіцієнт де Рітіса, що визначається відношенням активності АсАТ до аланінамінотрансферази (АлАТ). Значення цього коефіцієнта нижче 1,33 вказують на ураження печінки, водночас вищі показники свідчать про ушкодження серцево-судинної системи [16].
Для хворих на ЦП була властива тенденція до збільшення активності загальної лактатдегідрогенази (ЛДГ). Зокрема, у пацієнтів І групи вона була більшою на 40,2 % (р = 0,06), а в хворих ІІІ групи — на 24,5 % (р = 0,07) порівняно з показниками відповідних контрольних груп.
В обстежених пацієнтів усіх вікових груп значення коефіцієнта де Рітіса були вищі за порогові, зокрема у хворих молодого віку він становив 1,44, у пацієнтів зрілого віку — 1,44, у хворих літнього віку — 1,66. Зважаючи на вищезазначене, вікове зростання активності АсАТ вірогідно пов’язане з наявністю в обстежених хворих уражень серцево-судинної системи, зокрема ішемічного генезу, на тлі яких екзогенні та ендогенні токсичні чинники призводили до більш значного ураження міокарда.
У всіх групах хворих на ЦП зростала активність АлАТ порівняно з контрольними показниками. Зокрема, у пацієнтів молодого та зрілого віку вона в 2 рази (р < 0,01), а у хворих літнього віку в 2,5 раза (р < 0,001) переважала відповідні контрольні значення (рис. 3).
З віком тенденції до зростання активності АлАТ на відміну від АсАТ не спостерігали, що свідчить про порівнянну активність процесів цитолізу в печінці обстежених хворих різних вікових груп (табл. 2).
У пацієнтів із ЦП молодого віку спостерігали збільшення активності лужної фосфатази (ЛФ) на 57,3 % порівняно з активністю цього ферменту в групі молодих практично здорових осіб, вірогідність такого зростання була близька до статистично значимої (р = 0,06). В інших вікових групах пацієнтів із ЦП спостерігали вірогідне підвищення активності ЛФ порівняно з контролем. Зокрема, у хворих на ЦП ІІ групи вона зростала у 2,1 раза (р < 0,001), а у пацієнтів ІІІ групи — у 2,7 раза (р < 0,001) порівняно з відповідними контрольними показниками. З віком відбувалось поступове збільшення активності цього ферменту: у пацієнтів ІІ групи — на 46,1 % (р < 0,05), а в хворих ІІІ групи — на 65,8 % (р < 0,05) порівняно з такою в пацієнтів І групи. Зазначене свідчить про вікове наростання холестазу в обстежених хворих (табл. 2).
Активність гама–глутамілтранспептидази (ГГТП) збільшувалась у хворих на ЦП усіх вікових груп. У пацієнтів І дослідної групи таке зростання відбувалось у 4,2 раза (р < 0,05), ІІ групи — в 5,2 раза (р < 0,001), ІІІ групи — в 6,6 раза (р < 0,001) порівняно з відповідними контрольними показниками (рис. 4). Відомо, що активність ГГТП у крові підвищується внаслідок регургітації жовчі з її подальшим надходженням у кров, що разом із підвищеною активністю ЛФ вказує на наявність холестатичного синдрому та метаболічної інтоксикації. У хворих на ЦП різних вікових груп активність ГГТП була порівнянною.
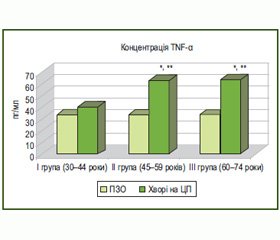
Уміст TNF-α зростав у крові обстежених пацієнтів усіх вікових груп на тлі подібних ступенів активності та тяжкості ЦП. Проте вірогідним таке збільшення спостерігалось лише в хворих зрілого та літнього віку на 86,3 % (р < 0,001) та 88,9 % (р < 0,01) порівняно з відповідними контрольними показниками (рис. 5).
У пацієнтів цих груп спостерігалось також вірогідне зростання концентрації TNF–α у крові порівняно з таким у хворих молодого віку: на 55,7 % (р < 0,01) та 57,9 % (р < 0,01) відповідно. Найвищих значень рівень TNF–α досягав у пацієнтів літнього віку, у яких він майже у 2 рази перевищував відповідний показник у практично здорових осіб (табл. 3).
Для пацієнтів молодого віку встановлений прямий кореляційний зв’язок середньої сили між концентрацією TNF-α та активністю АсАТ (r = 0,61, p < 0,05) і ГГТП (r = 0,67, p < 0,05). Для цієї групи хворих виявлений сильний прямий кореляційний зв’язок між умістом прозапального цитокіну та концентрацією загального білка (r = 0,76, p < 0,05), що відбувалось на тлі тенденції до зниження концентрації альбуміну. Зазначене, ймовірно, вказує на зростання вмісту загального білка за рахунок інших його фракцій. В інших вікових групах такі кореляційні зв’язки не були статистично підтверджені.
Концентрація IL-4 у крові хворих на ЦП була знижена порівняно з такою в практично здорових осіб і мала тенденцію до вікового зростання (табл. 3).
Концентрація TGF-β1 мала тенденцію до зростання вже в пацієнтів молодого віку (рис. 6). У хворих на ЦП зрілого віку на тлі порівнянної із пацієнтами молодого віку активності циротичного процесу така тенденція поглиблювалась, проте вірогідною ще не була. Лише у пацієнтів літнього віку вміст цього цитокіну був вірогідно вищим: на 82,8 % (р < 0,05) порівняно з таким у практично здорових осіб (табл. 3).
У хворих цієї групи вміст TGF-β1 вірогідно переважав такий у пацієнтів із ЦП молодого та зрілого віку: на 69,1 % (р < 0,05) та 62,3 % (р < 0,05) відповідно. У пацієнтів усіх вікових груп встановлений прямий кореляційний зв’язок середньої сили між концентрацією TGF-β1 та вмістом загального білірубіну у крові: для хворих І групи (r = 0,74, p < 0,05), ІІ групи (r = 0,49, p < 0,05), ІІІ групи (r = 0,70, p < 0,05). Такі ж кореляційні зв’язки виявлені для концентрації прямого білірубіну: для хворих І групи він був сильним (r = 0,79, p < 0,05), для пацієнтів зрілого та літнього віку — середньої сили (r = 0,48, p < 0,05, та r = 0,55, p < 0,05, відповідно). Для хворих молодого віку властивий прямий кореляційний зв’язок середньої сили між рівнем TGF-β1 та вмістом загального білка в крові (r = 0,72, p < 0,05). В інших вікових групах така кореляція не виявлена. Для пацієнтів цієї групи характерні також прямий кореляційний зв’язок середньої сили між концентрацією цитокіну й активністю АсАТ (r = 0,72, p < 0,05), сильні прямі кореляційні зв’язки між умістом TGF–β1 та активністю ГГТП (r = 0,84, p < 0,01). Для пацієнтів зрілого та літнього віку виявлений кореляційний зв’язок середньої сили між концентрацією цитокіну та активністю ГГТП (r = 0,65, p < 0,05, та r = 0,61, p < 0,05, відповідно).
Аналіз та узагальнення
Порівнюючи досліджувані показники в пацієнтів із однаковими чи близькими ступенями активності та тяжкості ЦП, ми виявили, що в крові хворих на ЦП з віком вірогідно зростав уміст загального білірубіну та його фракцій, сечовини та креатиніну, підвищувалась активність ЛФ водночас зі зниженням концентрації альбуміну в плазмі крові. Активність АсАТ та АлАТ, ЛДГзаг. та ГГТП була вірогідно вищою в пацієнтів із ЦП усіх вікових груп, ніж у практично здорових людей, з віком спостерігали лише тенденцію до зростання їх активності. Вікові та інші супутні захворювання не спричиняли помітного впливу на досліджувані показники.
У хворих на ЦП невірусного походження суттєвих змін зазнає цитокінова система, що проявляється у збільшенні концентрації TNF-α та TGF-β1 у плазмі крові. Для обстежених пацієнтів із однаковими чи близькими ступенями активності та тяжкості цирозу печінки властиве було вікове зростання рівня зазначених цитокінів. Уміст IL-4 у крові пацієнтів із ЦП був знижений порівняно з контрольними показниками, вікових особливостей концентрації цитокіну в крові не встановили.
За даними літератури, для пацієнтів із хронічним гепатитом та ЦП характерне зростання концентрації TNF-α у сироватці крові [2]. Більш високий уміст цього цитокіну визначається в хворих на гепатит вірусної етіології порівняно з його токсичною та алкогольною формами [8]. У нашому дослідженні також виявлено вищий вміст TNF-α у крові пацієнтів усіх вікових груп порівняно з контрольними показниками. У хворих зрілого та літнього віку спостерігалась вірогідно вища (на 55,7 та 57,9 %, р < 0,01) концентрація цитокіну в крові, ніж у пацієнтів молодого віку.
Різні науковці звертають увагу на участь TGF-β у процесах фіброгенезу внаслідок його здатності посилювати синтез фібронектину, ламініну та колагену IV типу ендотеліальними та зірчастими клітинами печінки [4, 5]. У роботах A.M. Gressner et al. встановлено, що інгібування впливів TGF-β1 зменшує активність фіброгенезу на 50–70 % [7]. У обстежених хворих виявлено тенденцію до зростання концентрації TGF-β1 у пацієнтів молодого та зрілого віку порівняно з такою в практично здорових осіб. Вірогідно вищим на 82,8 % (р < 0,05) порівняно з контрольними показниками вміст цитокіну був у хворих літнього віку, у яких він також вірогідно переважав аналогічний показник у пацієнтів із ЦП молодого та зрілого віку на 69,1 % (р < 0,05) та 62,3 % (р < 0,05) відповідно. Слід зазначити, що у хворих літнього віку високий рівень TGF-β1 позитивно корелював із вмістом загального (r = 0,70, p < 0,05) та прямого білірубіну (r = 0,55, p < 0,05), активністю ГГТП (r = 0,61, p < 0,05), які також були найвищими у пацієнтів цієї вікової групи. Виявлені особливості вмісту TGF-β1 підтверджують вагоме значення цитокіну у визначенні активності фіброгенезу [6–8] та вказують, що найбільшого зростання його концентрація набуває у хворих літнього віку зі значною давністю циротичного процесу.
Окремі дослідники підкреслюють, що поряд із TNF-α та TGF-β1 важливу участь у процесах фіброгенезу бере IL-4 [10]. У дослідженнях R. Sugimoto et al. встановлено, що концентрація протизапального IL-4 знижена в хворих із токсичним ЦП, а у хворих на вірусний ЦП цей показник підвищений [10]. Результати нашого дослідження також виявили зменшення концентрації IL-4 у крові хворих на ЦП невірусної етіології порівняно з такою в практично здорових осіб.
Висновки
1. У хворих на цироз печінки суттєвих змін зазнає цитокінова ланка імунної системи, що виявляється в збільшенні концентрації фактора некрозу пухлин-α, трансформуючого фактора росту-β1 у плазмі крові. Для обстежених пацієнтів властивим було зростання вмісту зазначених цитокінів з віком. Рівень інтерлейкіну-4 у крові хворих на цироз печінки був нижчий порівняно з контрольними показниками, вірогідних вікових особливостей концентрації цитокіну не виявили.
2. Встановлені кореляційні зв’язки між умістом прозапальних цитокінів і біохімічними маркерами цитолітичного, холестатичного та мезенхімально-запального синдромів вказують на вагому роль цитокінової ланки імунної системи в розвитку та прогресуванні цирозу печінки.
1. Стародуб Є.М. Особливості цитокінового профілю при цирозі печінки / Є.М. Стародуб, О.Є. Самогальська, Т.Б. Лазарчук // Вісник наукових досліджень. — 2006. — № 4. — С. 29–31.
2. Tumor necrosis factor polymorphisms and alcoholic liver disease: A HuGE Review and Meta-Analysis / M. Marcos, M. Gómez-Munuera, I. Pastor [et al.] // American Journal of Epidemiology. — 2009. — № 8. — P. 948–956.
3. Wynn T.A. Cellular and molecular mechanisms of fibrosis / T.A. Wynn // Journal of Pathology. — 2008. — № 2. — P. 199–210.
4. Cui W. Mechanism of the transforming growth factor–beta induction of fibronectin expression in hepatic stem-like cells / W. Cui, H.B. Jin, Z.W. Li // Brazilian Journal of Medecal and Biological Research. — 2010. — № 1. — P. 36–42.
5. TGF-beta/Smad signaling in the injured liver / K. Breitkopf, P. Godoy, L. Ciuclan [et al.] // Journal of Gastroenterology. — 2006. — № 1. — P. 57–66.
6. Meyer C. TGF-beta signaling in alcohol induced hepatic injury / C. Meyer, N.M. Meindl-Beinker, S. Dooley // Front Bioscience. — 2010. — № 1. — P. 740–749.
7. Gressner A.M. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets / A.M. Gressner, R. Weiskirchen // Journal of Cellular Molеcular Medecine. — 2006. — № 1. — Р. 76–99.
8. Influence of transforming growth factor-β1 and tumor necrosis factor-α genes polymorphisms on the development of cirrhosis and hepatocellular carcinoma in chronic hepatitis C patients / M.I. Radwan, H.F. Pasha, R.H. Mohamed // Cytokine. — 2012. — Vol. 60. — P. 271–276.
9. Does the simultaneous tumor necrosis factor receptor 2, tumor necrosis factor promoter gene polymorphism represent a higher risk for alcoholic liver disease? / M.V. Machado, A. Martins, R. Almeida [et al.] // Europеan Journal Gastroenterology and Hepatology. — 2009. — № 2. — P. 201–205.
10. Effect of IL-4 and IL-13 on collagen production in cultured LI90 human hepatic stellate cells / R. Sugimoto, M. Enjoji, M. Nakamuta [et al.] // Liver International. — 2005. — Vol. 25. — P. 420–428.
11. The immune system in extreme longevity / P. Sansoni, R. Vescovini, F. Fagnoni et al. // Experimental Gerontology. — 2008. — Vol. 43. — P. 61–65.
12. Resistance training at eight-repetition maximum reduces the inflammatory milieu in elderly women / M.D. Phillips, M.G. Flynn, B.K. McFarlin et al. // Medicine and Science in Sports and Exercise. — 2010. — № 2. — P. 314–325.
13. Age-dependent decrease in serum transforming growth factor (TGF)-beta 1 in healthy Japanese individuals; population study of serum TGF-beta 1 level in Japanese / Y. Okamoto, Y. Gotoh, O. Uemura et al. // Disease Markers. — 2005. — Vol. 21. — P. 71–74.
14. Nutritional status and prognosis in cirrhotic patients / M. Sasidharan, S. Nistala, R.T. Narendhran [et al] // Tropic Gastroenterology. — 2012. — Vol. 33. — P. 257–264.
15. Determinants of long-term outcome in severe alcoholic hepatitis / J.R. Potts, S. Goubet, M.A. Heneghan [et al] // Aliment. Pharmacol. Therapy. — 2013. — № 6. — 584–595.
16. Клиническая интерпретация лабораторых исследований. — Спб.: ЭЛБИ–СПб, 2006. — 384 с.

/39/39.jpg)
/39/39_2.jpg)
/40/40.jpg)
/41/41_2.jpg)
/41/41.jpg)