Международный эндокринологический журнал 2 (58) 2014
Вернуться к номеру
Результаты длительного наблюдения за пациентами с доброкачественными очаговыми образованиями щитовидной железы
Авторы: Болгов М.Ю., Таращенко Ю.Н., Янчий И.Р. - ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев
Рубрики: Хирургия, Эндокринология, Онкология
Разделы: Клинические исследования
Версия для печати
Цель исследования — провести автоматизированный анализ долгосрочного наблюдения за пациентами с доброкачественными очаговыми новообразованиями щитовидной железы. Изучены результаты наблюдения за 7083 пациентами. Выявлено, что дальнейшему оперативному лечению подлежали 28,7 % пациентов. В течение первого года наблюдения было прооперировано 22,3 %. Среди всех прооперированных пациентов при патогистологическом исследовании были обнаружены высокодифференцированные карциномы в 10,2 % случаев. Максимальный процент карцином (25 %) обнаружен в группе небольших очаговых новообразований щитовидной железы величиной 5–10 мм.
Мета дослідження — провести автоматизований аналіз довгострокового спостереження за пацієнтами з доброякісними вогнищевими новоутвореннями щитоподібної залози. Вивчені результати спостереження за 7083 пацієнтами. Виявлено, що подальшому оперативному лікуванню підлягали 28,7 % пацієнтів. Протягом першого року спостереження було прооперовано 22,3 %. Серед усіх прооперованих пацієнтів при патогістологічному дослідженні були виявлені високодиференційовані карциноми в 10,2 % випадків. Максимальний відсоток карцином (25 %) виявлений у групі невеликих вогнищевих новоутворень щитоподібної залози розміром 5–10 мм.
The aim of the study was to conduct automated analysis of long-term follow up of patients with benign focal tumors of the thyroid gland. We have studied the results of observation of 7083 patients. It is revealed that 28.7 % of patients have to undergo further surgical treatment. During the first year of observation 22.3 % of patients were operated. Among all operated patients during pathohistological study there were found the highly differentiated carcinoma in 10.2 % of cases. Maximum proportion of carcinomas (25 %) was found in the group of small focal thyroid tumors with a size 5–10 mm.
доброкачественные узлы щитовидной железы, долгосрочное наблюдение, карцинома щитовидной железы.
доброякісні вузли щитоподібної залози, довгострокове спостереження, карцинома щитоподібної залози.
benign thyroid nodules, long-term follow-up, thyroid carcinoma.
Статья опубликована на с. 9-14
Введение
Современное представление об онкогенезе исходит из того, что каждая опухоль является генетически уникальной. Фактически возникновение опухоли следует рассматривать скорее не как локальное повреждение ткани, а как нарушение иммунологического ответа на некоторую генетически чужеродную ткань, у которой появляется возможность существовать и размножаться [1]. Механизмы этих нарушений продолжают оставаться во многом невыясненными, но можно считать доказанным то, что каждая опухоль является генетически уникальной. Отсюда понятны сложности, которые возникают как при диагностике, так и при лечении опухолей.
Наше познание неизбежно нуждается в группировке подобных случаев, ибо только тогда возможна разработка некоторых подходов, их статистический анализ и, наконец, внедрение в клиническую практику на основе той или иной степени доказательности. А любая группировка принципиально различных (генетически уникальных) объектов, в частности опухолей, приводит к той или иной погрешности. На практике это означает невозможность точно предсказать дальнейшее развитие опухолевого процесса в каждом конкретном случае. Как следствие, наши рекомендации, начиная с определения показаний к операции и заканчивая ее объемом, еще далеки от совершенства. Тем не менее многие выясненные аспекты развития тех или иных опухолей позволяют современной онкологии добиваться значительных успехов. Применительно к эндокринологии такими достаточно эффективно излечиваемыми являются папиллярные и фолликулярные карциномы щитовидной железы (ЩЖ). Однако ценой такой успешности является полное удаление органа. Иными словами, речь идет не о лечении в истинном смысле этого слова (как о возвращении пациенту исходного состояния здоровья, как до болезни), а об удалении органа вместе с развившейся в нем опухолью. Безусловно, это является меньшим злом для пациента и совершенно оправданно исходя из имеющихся сегодня у медицины возможностей. Но когда речь идет о доброкачественных узловых образованиях, то акценты значительно смещаются. Смысл удаления всей ЩЖ и даже ее части оказывается не таким очевидным при наличии доброкачественного узла, особенно небольшого размера. Именно здесь и проявляется наиболее ярко несовершенство нашего понимания онкогенеза. Все многообразие форм доброкачественной очаговой патологии, несмотря на имеющиеся группировки по тем или иным гистологическим характеристикам, мы не можем однозначно разделить на «опасные», т.е. требующие удаления, и «безобидные», т.е. те, которые наверняка останутся небольшими и доброкачественными в течение всей жизни пациента.
С этих позиций долгосрочные наблюдения за пациентами с очаговыми образованиями щитовидной железы (ООЩЖ) продолжают оставаться актуальными как тот первичный базис наших знаний, на котором может быть основана та или иная тактика. Наиболее существенным вопросом в этом контексте является оценка необходимости хирургического удаления небольших доброкачественных ООЩЖ. С одной стороны, в последних рекомендациях Американской и Европейской тиреоидных ассоциаций [2, 3] имеется четкое указание на то, что доброкачественные узлы не представляют угрозы для пациента и потому не требуют удаления. С другой стороны, во всех современных рекомендациях так или иначе указывается, что большие размеры, косметический дефект, быстрый рост и даже желание пациента избавиться от узла могут быть достаточным обоснованием для выбора хирургического лечения тех же доброкачественных очаговых образований. Разумеется, что объективизировать понятие «косметического дефекта» сложно, но даже «большие размеры» и «быстрый рост» по сегодняшний день не являются терминами из области доказательной медицины.
Все это оставляет актуальным дальнейшее проведение долгосрочных наблюдений за пациентами с доброкачественными ООЩЖ как основного источника фактического материала для поиска закономерностей и выработки эффективных клинических протоколов ведения этой группы пациентов. В литературе подобные наблюдения немногочисленны, что можно связать с техническими сложностями организации сбора информации о пациентах в течение продолжительного времени и длительностью подобных исследований. В недавнем исследовании Y. Choi с соавт. была проанализирована история наблюдения за 700 ООЩЖ у 673 пациентов с первично доброкачественными результатами цитологических исследований, выполненных в 7 различных медицинских центрах Кореи [4]. В исследование включались очаговые образования размером 1 см и более у пациентов, которые впоследствии оперировались, проходили повторные цитологические исследования (и имели доброкачественные заключения), включая пациентов с отсутствием динамики изменения размера узла на протяжении периода длительностью не менее 1 года. Под ростом размеров узла подразумевалось увеличение его объема минимум на 50 % или увеличение линейных размеров узла минимум на 20 %. Пациенты прослежены на протяжении 1–5 лет. По полученным результатам за время наблюдения оперировано 89 пациентов, из них у 12 патогистологически были выявлены злокачественные опухоли ЩЖ (1,7 % случаев от всех наблюдаемых и 13,4 % от всех оперированных). Авторами изучены ультразвуковые характеристики узлов по наличию или отсутствию признаков, косвенно указывающих на злокачественность, таких как гипоэхогенность, неровность контуров, наличие кальцификатов. Частота данных признаков в группе пациентов со злокачественными опухолями была достоверно выше, чем в группе пациентов с доброкачественными узлами. Авторы предлагают при наличии УЗ–признаков злокачественности проводить повторную пункционную биопсию данного узла.
В работе J. Luo и соавт. [5], которая заключалась в ретроспективном анализе тиреоидэктомий у пациентов с множественными (2 и более) ООЩЖ, отмечено, что из 260 карцином, подтвержденных гистологически, дооперационную цитологическую верификацию имели только 46 % пациентов. По мнению авторов, это связано с ограничением использования тонкоигольной аспирационной пункционной биопсии ввиду наличия множественных узлов, а также есть указания на большое количество (около 50 %) ложно–доброкачественных цитологических заключений [6].
В исследовании I. Botrugno с соавт. [7], посвященном изучению факторов риска наличия карциномы ЩЖ (размером 1 см и менее) на фоне многоузлового зоба, отмечено, что среди 462 пациентов, оперированных с 2000 по 2008 год по поводу многоузлового зоба, у 41 пациента была выявлена карцинома ЩЖ (8,9 % случаев).
Данных об аналогичных исследованиях в Украине в доступной литературе не найдено. В то же время известно, что после Чернобыльской катастрофы у жителей пострадавших регионов значительно возросло количество как злокачественных, так и доброкачественных ООЩЖ, которое трудно объяснить только повышенной настороженностью и более активным скринингом [8, 9]. С учетом этой особенности Украинского региона можно говорить о новизне и высокой актуальности предложенного исследования.
Материалы и методы
Исследование проведено по данным электронного реестра пациентов клиники Института эндокринологии и обмена веществ им. В.П. Комиссаренко, который поддерживается медицинской информационной системой TherDep [10]. В настоящее время в реестре, работающем в режиме реального времени, хранится информация о более чем 190 тыс. пациентов с разнообразной эндокринной патологией. Около 77 % амбулаторных карт электронного реестра содержат данные ультразвукового исследования ЩЖ. Наш реестр работает с 1996 г. и как по общему объему данных, так и по длительности существования не имеет аналогов в Украине.
В настоящее исследование были включены все случаи доброкачественных (по данным цитологического исследования пунктатов) ООЩЖ, которые наблюдались в последующем в клинике института (включая оперированных). Всего таких пациентов оказалось 7083. Для проведения анализа был разработан оригинальный алгоритм, на основе которого создана утилита как дополнение к медицинской информационной системе TherDep. Первичный анализ данных проведен полностью в автоматическом режиме. Все случаи выявления при последующем наблюдении карцином и значительного роста очаговых образований были рассмотрены персонально.
Следует остановиться на некоторых специфических особенностях данного исследования, связанных с проведением ретроспективного анализа по базе данных, работающей в режиме реального времени. Методика выполнения работы в данных условиях была избрана следующая. Вначале, на тестовой копии базы данных, отрабатывались все механизмы автоматического поиска и анализа данных по пациентам. Затем, когда программные модули были оттестированы и признаны готовыми для использования, выполнялся их запуск (проход) по актуальной базе данных с фиксацией необходимых параметров для дальнейшей обработки. В контексте проводимого анализа одним из ключевых параметров был срок наблюдения за пациентом. Исходя из специфики ретроспективной работы с базой данных, работающей в режиме реального времени, этот срок мог быть получен только как интервал между началом наблюдения (датой первичной информативной пункционной биопсии) и датой последнего обследования. Именно этот временной интервал, исчисляемый в полных годах, и использовался при составлении итоговых таблиц и оценке результатов.
Результаты и обсуждение
Изучены результаты наблюдения за 7083 пациентами, у которых по данным цитологического исследования пункционного материала, полученного из ООЩЖ, не установлено признаков злокачественности или подозрения на нее. Исключались также случаи фолликулярных неоплазий и подозрений на нее. Иными словами, рассматривались только варианты в разной степени пролиферирующего узлового зоба, в том числе с кистозной трансформацией, что соответствует первой группе (доброкачественное образование) цитологических заключений по Бетестовской классификации [11]. Такой подход был не случайным. Нас интересовала именно та группа пациентов, которые попадают под категорию не требующих оперативного лечения в общем случае. Именно тактика ведения этих пациентов является предметом наиболее оживленных дискуссий, в которых можно встретить достаточно разные подходы: от максимальной хирургической активности до подавляюще выжидательной тактики. И даже последние международные рекомендации оставляют наименее определенным вопрос необходимости операции именно для этой категории цитологических заключений [2, 3]. По этим соображениям наличие в аспирате признаков атипии фолликулярного эпителия также было поводом для исключения из рассматриваемой группы, так как этот признак рассматривается как «подозрительный» и может сам по себе выступать в качестве решающего фактора в пользу оперативного лечения.
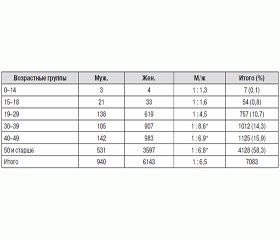
Характеристика всей группы по полу и возрастным группам на момент анализа результатов, т.е. окончания наблюдения, приведена в табл. 1.
Дети и подростки в общем числе доброкачественных ООЩЖ обследуемой группы составили всего лишь 0,9 % случаев, в то время как основная их масса (около 60 %) выявлена у пациентов старше 50 лет. По данным литературы, тиреоидная патология (включая новообразования) чаще встречается у женщин, чем у мужчин [12, 13]. Такая тенденция зафиксирована и в наших исследованиях, но не во всех возрастных группах. Среднее соотношение мужчин и женщин составило 1 : 6,5, но у детей соотношение м : ж практически равно, у подростков оно уже выше, а достоверное превалирование лиц женского пола начинается лишь после 30–летней возрастной отметки (табл. 1).
Данные о количестве оперированных пациентов по годам наблюдения представлены в табл. 2.
Годы наблюдения указаны как максимальный период, за который имеются данные. Если же была выполнена операция, то ее дата считалась как окончание наблюдения, что соответствует действительности в том контексте, что далее за доброкачественным узлом наблюдение не продолжалось. Полученные данные позволяют заключить, что максимальная хирургическая активность (22,3 %) наблюдается в первый год, после проведения пункционной биопсии, что в подавляющем большинстве совпадает с началом наблюдения. Иными словами, процент оперированных в течение первого года дает представление о той части пациентов (с доброкачественными очаговыми образованиями по цитологическому заключению), которая признается специалистами клиники как требующая хирургического лечения. За следующий год наблюдения процент оперированных пациентов достоверно снижается. Та же ситуация наблюдается за третий год наблюдения (полных два года), в течение которого оперируется достоверно меньший процент пациентов (от наблюдаемых за год), чем за предыдущий. Начиная с четвертого года наблюдения процент оперированных от наблюдаемых изменяется незначительно и статистически не достоверно, хотя в целом снижается до 0,7 после 10 лет наблюдения.
В табл. 3 представлены данные о характере патологического процесса по данным гистологического исследования ООЩЖ у оперированных пациентов по годам наблюдения. За все годы наблюдения было прооперировано 28,7 % пациентов. Карцином среди них по патогистологическому заключению выявлено 207, что составляет 2,9 % от всех наблюдавшихся и 10,2 % от всех оперированных, что можно рассматривать как подтверждение правильного выбора клиницистов в сторону оперативного лечения именно этого контингента пациентов. Понятно, что при наличии доброкачественного пункционного заключения показаниями к хирургическому удалению ООЩЖ выступали другие признаки (размер, плотность, давность существования, темп роста). Этот вывод также вытекает из того, что 77,8 % прооперированных были подвергнуты хирургическому лечению в течение первого года наблюдения. Тем не менее 22,2 % пациентов, у которых при окончательном гистологическом исследовании была установлена карцинома ЩЖ, были прооперированы позже, чем в первый год, т.е. и у клиницистов не вызывали сомнений в доброкачественности.
В табл. 4 приведено распределение всех случаев по первичным размерам очаговых образований по данным УЗИ. При наличии нескольких дополнительных образований в расчет принимался только максимальный размер узла. Приведено как абсолютное число случаев, так и проценты выявления карцином в каждой группе в зависимости от размера образования. Максимальный процент карцином (25 %) оказался в группе новообразований размерами 5–10 мм, а наименьший (7,4 %) — более 5 см. Это может свидетельствовать о том, что именно при небольших ООЩЖ основными показаниями к удалению служат те или иные косвенные признаки злокачественности: повышенная плотность, нечеткость контуров, принадлежность к группам повышенного риска и т.д. Когда же речь идет о более значительных по линейным размерам очаговых образованиях, то основными факторами в пользу операции выступают такие, как косметический дефект, ощущение давления в области шеи, т.е. не имеющие отношения к подозрению на злокачественность. Как следствие, процент выявления карцином в этих случаях оказывается значительно ниже. Таким образом, суммируя эти данные, мы можем говорить о подтверждении клинической значимости используемых клиницистами косвенных признаков злокачественности. Среди наблюдавшихся без операции наиболее многочисленной группой были пациенты с очаговыми образованиями 11–20 мм, что составило 46,4 %. В табл. 4 приведено распределение всех случаев по первичным размерам очаговых образований по данным УЗИ. При наличии нескольких дополнительных образований в расчет принимался только максимальный размер узла.
Приведены как абсолютные количества случаев, так и проценты выявления карцином в каждой группе в зависимости от размера образования. Максимальный процент карцином (25 %) оказался в группе новообразований размером 5–10 мм, а наименьший (7,4 %) — более 5 см. Это может свидетельствовать о том, что именно при небольших ООЩЖ основными показаниями к удалению служат те или иные косвенные признаки злокачественности: повышенная плотность, нечеткость контуров, принадлежность к группам повышенного риска и т.д. Когда же речь идет о более значительных по линейным размерам очаговых образованиях, то основными факторами в пользу операции выступают такие как косметический дефект, ощущение давления в области шеи, т.е. не имеющие отношения к подозрению на злокачественность. Как следствие, процент выявления карцином в этих случаях оказывается значительно ниже. Таким образом, суммируя эти данные, мы можем говорить о подтверждении клинической значимости используемых клиницистами косвенных признаков злокачественности. Среди наблюдавшихся без операции наиболее многочисленной группой были пациенты с очаговыми образованиями 11–20 мм, что составило 46,4 %.
Сравнительный анализ данных по солитарным и множественным очаговым образованиям (табл. 5) не показал достоверных различий выявления карцином, хотя все же больший их процент отмечался в случаях одиночных узлов.
Был также проведен анализ наличия признаков хронического тиреоидита в узле ЩЖ по первичным цитологическим заключениям (табл. 6).
При оценке достоверности различия в группах пациентов с наличием тиреоидита и без него по критерию x2–-теста было выявлено, что среди неоперированных пациентов достоверно чаще (p < 0,01) встречаются признаки хронического тиреоидита, чем среди пациентов, у которых была выявлена карцинома ЩЖ. При этом нет достоверной разницы наличия признаков тиреоидита в группах оперированных и неоперированных пациентов.
Выводы
1. Среди 7083 пациентов, у которых по данным цитологического исследования установлено наличие доброкачественного очагового образования щитовидной железы, за все годы наблюдения прооперировано 28,7 % больных, за первый год наблюдения — 22,3 %.
2. В исследованной группе по патогистологическому заключению выявлено 207 карцином, что составляет 2,9 % от всех наблюдавшихся и 10,2 % от всех оперированных, что можно рассматривать как подтверждение правильного выбора клиницистов в сторону оперативного лечения именно этого контингента пациентов.
3. Максимальный процент карцином (25 %) выявлен в группе очаговых образований щитовидной железы 5–10 мм, а наименьший (7,4 %) — в группе образований размером более 5 см.
4. У неоперированных пациентов достоверно чаще (p < 0,05) встречаются признаки хронического тиреоидита и, соответственно, у оперированных они достоверно чаще отсутствуют. При этом в группе оперированных нет достоверной разницы между пациентами с доброкачественными и злокачественными по патогистологическому исследованию очаговыми образованиями.
1. Кордюм В.А. Опухоль — как она видится сегодня с позиций молекулярной генетики / В.А. Кордюм // Біополімери і клітина. — 2001. — Т. 17, № 2. — С. 109–139.
2. AACE/AME/ETA Thyroid Nodule Guidelines / Gharib H., Papini E., Paschke R. et al. // Endocr. Pract. — 2010. — Vol. 16 (Suppl. 1).
3. American Association of Clinical Endocrinologists (AACE), Associazione Medici Endocrinologi (AME), and European Thyroid Association (ETA) Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules / Gharib H., Papini E., Paschke R. et al. // Hot Thyroidol. — 2009. — Vol. 4/10.
4. Thyroid nodule with benign cytology: is clinical follow-up enough? / Choi Y.J., Jung I., Min S.J. et al. // PLoS One. — 2013 May 24. — 8(5). — e63834. — doi: 10.1371/journal.pone.0063834. Print 2013.
5. Luo J., McManus C., Chen H., Sippel R.S. Are there predictors of malignancy in patients with multinodular goiter? // J. Surg. Res. — 2012. — Vol. 174, № 2. — P. 207–210.
6. Pinchot S.N., Al-Wagih H., Schaefer S., Sippel R., Chen H. Accuracy of fine-needle aspiration biopsy for predicting neoplasm or carcinoma in thyroid nodules 4 cm or larger // Arch. Surg. — 2009. — Vol. 144(7). — P. 649–655.
7. Botrugno I., Lovisetto F., Cobianchi L. et al. Incidental carcinoma in multinodular goiter: risk factors // Am. Surg. — 2011. — Vol. 77, № 11. — P. 1553–1558.
8. Тимченко А.М., Місюра К.В. Динаміка розповсюдження тиреоїдної патології серед населення в регіонах з різним ступенем йодного дефіциту та напрямки профілактики // Міжнародний ендокринологічний журнал. — 2007. — Т. 9, № 3. — С. 32–35.
9. Комиссаренко И.В., Рыбаков С.И., Коваленко А.Е., Омельчук А.В. Заболевания щитовидной железы, возникшие после аварии на ЧАЭС и требующие хирургического лечения // Международный журнал радиационной медицины. — 2006. — Т. 8, № 1. — С. 52–53.
10. Болгов М.Ю. Автоматизация медицинских учреждений (Руководство пользователя TherDep5). — Куприянова, 2006. — 464 с.
11. The Bethesda System for Reporting Thyroid Cytopathology Definitions, Criteria and Explanatory Notes / Еd. Ali Syed Z., Cibas, Edmund S. — 2010. — XIV. — 174 p.
12. Хайкина И.А., Фадеев В.В. Узловой коллоидный зоб: результаты проспективных контролируемых исследований // Клиническая и экспериментальная тиреоидология. — 2008. — T. 4, № 2. — С. 24–32.
13. Зайратьянц О.В. Эпидемиология и этиологическая структура узлового зоба по данным аутопсий // Актуальные проблемы заболеваний щитовидной железы: Материалы 2-го Всероссийского тиреоидологического конгресса. — М., 2002. — С. 50–60.

/11/11.jpg)
/12/12.jpg)
/13/13.jpg)