Международный эндокринологический журнал 2 (58) 2014
Вернуться к номеру
Ендотеліальна дисфункція та її корекція у пацієнтів з гіпертонічною хворобою і цукровим діабетом 2-го типу
Авторы: Шалімова А.С. - Харківська медична академія післядипломної освіти
Рубрики: Семейная медицина/Терапия, Педиатрия/Неонатология, Эндокринология
Разделы: Клинические исследования
Версия для печати
У статті наведені результати вивчення ефективності впливу α-ліпоєвої кислоти у складі комплексної терапії на ступінь вираженості ендотеліальної дисфункції в пацієнтів із гіпертонічною хворобою і цукровим діабетом 2-го типу. Установлене вірогідне поліпшення метаболічного гомеостазу, зменшення вираженості ендотеліальної дисфункції, зниження рівнів прозапальних цитокінів при додатковому застосуванні α-ліпоєвої кислоти порівняно зі стандартною терапією.
В статье представлены результаты изучения эффективности влияния α-липоевой кислоты в составе комплексной терапии на степень выраженности эндотелиальной дисфункции у пациентов с гипертонической болезнью и сахарным диабетом 2-го типа. Установлено достоверное улучшение метаболического гомеостаза, уменьшение выраженности эндотелиальной дисфункции, снижение уровней провоспалительных цитокинов при дополнительном применении α-липоевой кислоты по сравнению со стандартной терапией.
The article provides the results of studying the effectiveness of α-lipoic acid impact as a part of complex therapy on endothelial dysfunction in patients with essential hypertension and type 2 diabetes mellitus. There were revealed a significant improvement in metabolic homeostasis, decreased severity of endothelial dysfunction, reduced levels of inflammatory cytokines under additional use of α-lipoic acid compared with standard therapy.
ендотеліальна дисфункція, гіпертонічна хвороба, цукровий діабет 2-го типу, α-ліпоєва кислота, інсулінорезистентність, цитокіни.
эндотелиальная дисфункция, гипертоническая болезнь, сахарный диабет 2-го типа, α-липоевая кислота, инсулинорезистентность, цитокины.
endothelial dysfunction, essential hypertension, type 2 diabetes mellitus, α-lipoic acid, insulin resistance, cytokines.
Статья опубликована на с. 33-39
Цукровий діабет 2-го типу (ЦД 2) є важливою медико-соціальною проблемою та перебуває серед пріоритетів національних систем охорони здоров’я майже в усіх країнах світу [1, 9, 10, 13]. ЦД 2 є одним із головних незалежних чинників ризику серцево-судинної патології, що в більшості випадків визначає прогноз у цих хворих. Близько 75 % хворих на ЦД 2 помирають від серцево-судинних ускладнень (ССУ), у тому числі серцевої недостатності (СН) [1, 8, 15, 17].
Коморбідність гіпертонічної хвороби (ГХ) і ЦД 2 є особливо серйозною проблемою, що пов’язано з більш раннім розвитком ураження органів-мішеней і подальшими серцево-судинними катастрофами [2, 4, 30]. Установлено, що підвищення систолічного артеріального тиску (АТ) на кожні 10 мм рт.ст. у хворих на ЦД 2 збільшує ризик розвитку ССУ на 20 % [8, 9, 18]. Наявність ГХ при ЦД 2 діагностується в 50–80 % хворих, що значно збільшує ризик не лише макросудинних (ішемічна хвороба серця (ІХС), СН, інсульт), але й мікросудинних (діабетична нефропатія, ретинопатія) ускладнень [3, 5, 30].
Дослідження останніх років показали, що патогенетичні механізми, які обумовлюють розвиток артеріальної гіпертензії (АГ), інсулінорезистентності (ІР) та ЦД 2, багато в чому перегукуються і призводять до прогресування захворювань та розвитку ускладнень [3, 5, 11]. Гіперінсулінемія та ІР є одними з чинників, які визначають частоту розвитку ССУ при ЦД 2.
На сьогодні у науковій літературі не існує єдиного уявлення про механізми, за допомогою яких ІР викликає атеросклеротичне ураження стінок судин [7, 8, 35, 36]. Гіперінсулінемія є постійним компенсаторним компонентом ІР і може прямо впливати на атерогенез, що пов’язано зі стимуляцією синтезу ліпідів у стінці артерій і проліферацією гладком’язових клітин (ГМК) судинної стінки. З іншого боку, атеросклероз може бути і наслідком низки супутніх метаболічних порушень [19, 35, 36]. Було висловлено припущення про те, що ІР збільшує ризик атеросклерозу за допомогою багатьох механізмів, пов’язаних не лише з метаболізмом глюкози [24, 35, 36].
Сполучною ланкою між ІР і кардіоваскулярними захворюваннями, за даними багатьох авторів, є ендотеліальна дисфункція (ЕД) [24–26, 35]. Опубліковані останнім часом результати клінічних та експериментальних досліджень свідчать про те, що ІР викликає порушення фізіологічних механізмів вазодилатації [24, 36].
Основні функції ендотелію такі: модулювання судинного тонусу (вазодилатація/вазоконстрикція); регуляція структурного гомеостазу судинної стінки; контроль тромботичних і фібринолітичних параметрів; управління адгезією тромбоцитів і лейкоцитів; участь у клітинних формах імунної відповіді, локального запалення [19, 32, 33].
У здорової людини фактори дилатації та констрикції перебувають у стані динамічної рівноваги [3, 12, 25]. У фізіологічних умовах введення інсуліну призводить до релаксації м’язової стінки судин, що опосередковується активізацією утворення й виділення оксиду азоту (NO) з ендотелію [26, 30, 36]. Біологічні ефекти NO як вазопротективного чинника включають гальмування проліферації і міграції ГМК судин, а також синтез ними колагену [26, 30]. Поряд із цим NO зменшує адгезію лейкоцитів до ендотелію, гальмує трансендотеліальну міграцію моноцитів, агрегацію й адгезію тромбоцитів, а також чинить антиоксидантну дію [7, 25, 32].
Дисбаланс між чинниками, які забезпечують нормальне функціонування ендотелію, являє собою ЕД, що характерна для коморбідної патології — ГХ і ЦД 2 [25, 26, 30, 31]. Здатність інсуліну посилювати ендотелійзалежну вазодилатацію (ЕЗВД) значно порушується в пацієнтів з ІР, що призводить до зниження на 40–50 % вазодилатації, індукованої NО [26, 30]. Дія інсуліну на ендотелій опосередковується його власними рецепторами і реалізується через багатоступеневу систему проведення сигналу, що призводить до підвищення синтезу NО [29, 30, 32].
У даний час встановлено, що ІР та ЕД є тісно асоційованими станами [30, 35, 36], однак чітко простежити їх причинно-наслідкові зв’язки поки не вдається. Прихильники однієї з гіпотез вважають, що ЕД вторинна щодо наявної ІР, тобто є лише наслідком порушень вуглеводного обміну, дисліпідемії, АГ та інших факторів, що характеризують стан ІР [33, 34]. Згідно із зазначеною гіпотезою, атерогенна дисліпідемія підвищує експресію молекул адгезії на поверхні ендотеліальних клітин, ініціюючи формування атероми. У свою чергу, порушення архітектоніки ендотеліальних клітин під впливом підвищеного механічного тиску на тлі АГ призводить до зміни судинної проникності, посилення секреції ендотеліну-1 та активного ремоделювання стінок судин [30, 33].
Прихильники іншої гіпотези вважають, що ЕД є первинною, тобто причиною розвитку ІР та пов’язаних із нею метаболічних і гемодинамічних порушень, а резистентність тканин до інсуліну вторинна щодо ЕД [29, 38]. Відповідно до цієї гіпотези, для взаємодії зі своїми рецепторами інсулін повинен проникнути в міжклітинний простір, минаючи ендотелій. У разі первинного дефекту ендотеліальних клітин порушується трансендотеліальний транспорт інсуліну й розвивається резистентність до нього.
Отже, наявність суперечливих гіпотез взаємовідношень ІР та ЕД обумовлює подальше ретельне дослідження цих патологічних станів.
Активно вивчаються також інші показники, що характеризують функцію ендотелію, зокрема інтерлейкіни (ІЛ). Дані епідеміологічних та генетичних досліджень свідчать про зв’язок підвищеного рівня ІЛ-6 з ІР та вказують на те, що підвищений його вміст у крові є одним із прогностичних маркерів розвитку ЦД 2 [3, 17, 30]. Установлено, що концентрація ІЛ-6 в плазмі прямо пропорційна ступеню ожиріння та втраті чутливості тканин до інсуліну, а зменшення маси тіла в пацієнтів супроводжується суттєвим зниженням концентрації ІЛ-6 як у плазмі, так і у жировій тканині [3, 6, 34].
У формуванні ЕД в умовах ІР важливу роль відводять фактору некрозу пухлини альфа (ФНП-α) [7, 30, 36]. В експериментальних роботах показано, що преінкубація ендотеліальних клітин аорти з ФНП-α практично блокує їх здатність синтезувати NО у відповідь на стимуляцію інсуліном [34]. Установлено, що ФНП-α сприяє розвитку ІР і може розглядатися як ранній маркер ЦД 2 [26, 30]. Крім того, за останніми даними, ФНП-α в культурі ендотеліальних клітин індукує їх апоптоз [19, 30].
Таким чином, враховуючи важливу роль ЕД та ІР у розвитку і прогресуванні багатьох патологічних станів, одним із завдань сучасної медицини є пошуки медикаментозного впливу на зазначені порушення.
Результати клінічного дослідження KUNGSHOLMEN показали, що ІР при ЦД 2 нормалізується при нормалізації перекисного окислення ліпідів [16, 17, 27]. Установлено, що препаратом із доведеним впливом на окислювальний стрес, є α-ліпоєва кислота (α-ЛК) [6, 28, 37]. Крім того, доведено, що α-ЛК має й інші властивості, які інтенсивно вивчаються, — вплив на ліпідний профіль, підвищення чутливості до інсуліну, збільшення рівня адипонектину [21–23].
α-ЛК являє собою натуральну дитіолову сполуку, що відіграє важливу роль в біоенергетичних реакціях у мітохондріях. α-ЛК блокує активні форми кисню, обумовлює утворення хелатних сполук іонів металу і скорочує кількість окислених форм інших антиоксидантів. Вона також активізує захисну антиоксидантну систему за рахунок модуляції генів, регульованих пероксисомальними проліфератор-активуючими рецепторами. Крім того, α-ЛК пригнічує ядерний фактор каппа-В і активує аденозинмонофосфатзалежну кіназу у скелетних м’язах — найважливіший регулятор у системі метаболізму клітинної енергії, що підсилює ступінь засвоєння глюкози й окиснення жирних кислот [14, 20, 27].
Отже, враховуючи актуальність проблеми корекції ЕД у пацієнтів із ГХ при ЦД 2, було проведено наступне дослідження.
Мета роботи полягала в оцінці вираженості ЕД у пацієнтів з ГХ і ЦД 2, а також можливості її корекції з використанням у комплексному лікуванні α-ЛК.
Клінічна характеристика хворих і методи дослідження
На базі кафедри терапії та нефрології Харківської медичної академії післядипломної освіти до і після шестимісячного лікування обстежені 84 пацієнти з ГХ у поєднанні з ЦД 2, які дали інформовану письмову згоду на участь в дослідженні та відповідали критеріям включення. Контрольну групу становили 15 практично здорових осіб, у яких ГХ і ЦД 2 виключені на підставі комплексу клініко–інструментальних обстежень.
Критерії включення в дослідження: ГХ ІІ стадії, 2-го ступеня; ЦД 2 середньої тяжкості, субкомпенсований; ХСН І–ІІ ФК; нормальна маса тіла (індекс маси тіла (ІМТ) — 18–24,9 кг/м2), надмірна маса тіла (ІМТ – 25–29,9 кг/м2), ожиріння І ступеня (ІМТ — 30–34,9 кг/м2); абдомінальне ожиріння (за критеріями IDF, 2005): окружність талії > 94 см для чоловіків та > 80 см для жінок; нормальна швидкість клубочкової фільтрації (ШКФ); нормокреатинінемія; відсутність протеїнурії (допустима лише мікроальбумінурія); вік пацієнтів 40–55 років; установлена тривалість захворювання на ГХ — 8–12 років, ЦД 2 — 3–7 років; нерегулярний прийом антигіпертензивних препаратів.
Критерії виключення із дослідження: наявність супутньої патології в пацієнтів із ГХ і ЦД 2 (гострий коронарний синдром, постінфарктний кардіосклероз, порушення ритму та провідності, ревматичні вади серця, системні захворювання сполучної тканини, онкозахворювання, симптоматична АГ, захворювання щитоподібної залози, гострі запальні процеси); ЦД 1-го типу; ГХ ІІІ стадії, 3-го ступеня; ХСН ІІІ–ІV ФК; ЦД 2 у легкій і тяжкій формах, фазах компенсації і декомпенсації; інсулінотерапія в пацієнтів із ЦД 2; ожиріння ІІ–ІІІ ступенів; знижена ШКФ; наявність протеїнурії; вік пацієнтів менше 40 та більше 55 років; ехонегативність; відмова пацієнтів від дослідження.
Стандартними біохімічними методами визначалися концентрації глюкози венозної крові натще, глікозильованого гемоглобіну (HbA1c), загального холестерину, тригліцеридів, холестерину ліпопротеїнів високої (ХС ЛПВЩ) та низької щільності (ХС ЛПНЩ).
Для вивчення функціонального стану ендотелію всім хворим проводилося визначення ступеня ЕЗВД у пробі з реактивною гіперемією. Дослідження проводили лінійним широкосмуговим датчиком 5–12 МГц у допплерівському режимі з кольоровим картуванням тричі на лівій і правій плечових артеріях із 15-хвилинною перервою між пробами за методикою D.S. Celermajer у модифікації О.В. Іванової. У нормі максимальна вазодилатація артерії повинна перевищувати 10 % від початкового діаметра. Одночасно проводилося вимірювання товщини комплексу інтима-медіа (ТІМ) сонних артерій на 2 см проксимальніше від біфуркації загальної сонної артерії. Швидкість пульсової хвилі (ШПХ) у сонних артеріях (СА) визначалася W-Track-методом (методом фазового трекінгу, запатентованим виробниками сканера). Визначення ШПХ у черевній аорті (ЧА) (від устя лівої підключичної артерії до стегнової артерії) проводили з використанням фазованого датчика з частотою 2–4 МГц.
Шляхом проведення імуноферментного аналізу визначали концентрації прозапальних цитокінів (ФНП-α, ІЛ-6).
Отримані результати оброблялися методами варіаційної статистики з використанням комп’ютерної програми Statistica.
Лікування пацієнтів розпочиналося з дієтотерапії, спрямованої на зниження артеріального тиску до цільових рівнів, нормалізацію HbA1c і глюкози крові, корекцію маси тіла, зниження рівнів тригліцеридів та ХС ЛПНЩ.
Як цукрознижуючу терапію всі пацієнти отримували комбінацію метформіну і гліклазиду, а як антигіпертензивну терапію — комбінацію інгібітора ангіотензинперетворюючого ферменту (раміприлу) і тіазидоподібного діуретика (індапаміду). Усім хворим призначалися також ацетилсаліцилова кислота у дозі 75 мг на добу та аторвастатин у дозі 20–40 мг на добу.
Усі пацієнти були поділені на дві підгрупи: у першу підгрупу (n = 41) увійшли хворі, які отримували лише базисну терапію, а у другу підгрупу (n = 43) — пацієнти, які додатково до базисної терапії отримували препарат α-ЛК (Тіогама®, Woerwag Pharma GmbH & Co. KG) у таблетках в дозі 600 мг/добу.
Результати та їх обговорення
Результати дослідження засвідчили, що показники вуглеводного й ліпідного профілів до початку лікування вірогідно не відрізнялися в обох групах пацієнтів. При цьому за вказаними показниками обидві групи хворих вірогідно (p < 0,05) відрізнялися від контрольної групи (табл. 1).
Аналіз структурно-функціонального стану магістральних судин у пацієнтів із ГХ і ЦД 2 показав зміни у стінці судин, які проявлялися збільшенням ТІМ і ШПХ у сонних артеріях і черевній аорті, а також зниженням ступеня ЕЗВД, що вірогідно (p < 0,05) відрізняло обидві групи від контрольної (табл. 2).
Зазначені зміни можна пояснити активацією медіаторів симпатоадреналової та ренін-ангіотензин-альдостеронової систем, що призводить до пошкодження ендотелію, потовщенню комплексу інтима-медіа, перебудови архітектоніки медії та адвентиції, збільшення ригідності судинної стінки, що супроводжується прискоренням пульсової хвилі [3, 7, 25].
Враховуючи важливу роль цитокінів у розвитку ЕД, в обстежених пацієнтів були досліджені рівні прозапальних цитокінів (ФНП-α, ІЛ-6) (табл. 3). Результати дослідження показали, що в пацієнтів із коморбідною патологією — ГХ і ЦД 2 рівні прозапальних цитокінів значно перевищували аналогічні показники в контрольній групі (p < 0,001).
Проведений кореляційний аналіз рівнів цитокінів із показниками структурно-функціонального стану магістральних судин показав тісні прямі кореляційні зв’язки ФНП-α і ІЛ-6 з ШПХ СА, ШПХ ЧА, прямі кореляційні зв’язки середньої сили — із ТІМ, а також обернені кореляційні зв’язки середньої сили з ЕЗВД (табл. 4).
Виявлені зміни рівнів зазначених цитокінів і дані кореляційного аналізу свідчать про важливу роль ФНП-α і ІЛ-6 у формуванні ЕД при ГХ і ЦД 2.
На наступному етапі дослідження оцінювалася динаміка показників вуглеводного й ліпідного профілів, структурно-функціонального стану магістральних судин, рівнів цитокінів під впливом проведеної терапії.
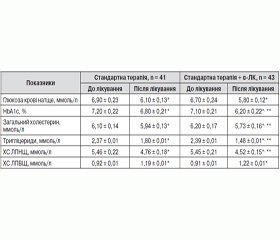
Після проведеного лікування в обох групах пацієнтів вірогідно знизилися рівні глюкози крові натще, HbA1c, загального холестерину, тригліцеридів і ХС ЛПНЩ при підвищенні значень ХС ЛПВЩ (p < 0,05). При цьому динаміка більшості зазначених показників у групі хворих, які додатково до стандартної терапії отримували α-ЛК, була вірогідно більш виражена, ніж у пацієнтів, які отримували лише стандартне лікування (табл. 5).
Аналіз показників структурно-функціонального стану магістральних судин показав, що в обох групах пацієнтів після проведеного лікування спостерігалося вірогідне зниження рівнів ШПХ СА і ШПХ ЧА при зростанні ступеня ЕЗВД (p < 0,05). При цьому позитивна динаміка зазначених показників була вірогідно більш вираженою у групі пацієнтів, які додатково до стандартної терапії отримували α-ЛК. В обох групах була відзначена тенденція до зниження ТІМ, проте динаміка була невірогідною, що можна пояснити необхідністю більш тривалого часу для зменшення товщини комплексу інтима-медіа (табл. 6).
В обох групах пацієнтів після проведеного лікування спостерігалося також вірогідне зниження рівнів прозапальних цитокінів ФНП-α та ІЛ-6 (p < 0,05). Зниження зазначених показників було вірогідно більшим у групі пацієнтів, які додатково до стандартної терапії отримували α-ЛК (табл. 7).
Можна припустити, що позитивний вплив α-ЛК на показники, які характеризують функцію ендотелію, пов’язаний із підвищенням активності ендотеліальної NO-синтази та біодоступності NO, що призводить до поліпшення порушеної ЕЗВД [25, 26, 35].
Таким чином, отримані результати дослідження свідчать про те, що у хворих з ГХ і ЦД 2 додаткове призначення α-ЛК (Тіогама®, Woerwag Pharma GmbH & Co. KG) більшою мірою впливало на метаболічний гомеостаз і стан функції ендотелію. Тому використання α-ЛК у хворих на ГХ і ЦД 2 є патогенетично обґрунтованим. Установлені ефекти α-ЛК можуть забезпечити підвищення прихильності до лікування і поліпшення якості життя пацієнтів з коморбідною патологією.
Висновки
1. Зміни судинної стінки в пацієнтів з ГХ і ЦД 2 проявляються збільшенням ТІМ і ШПХ у сонних артеріях і черевній аорті, зниженням ступеня ЕЗВД та пов’язані зі зростанням рівнів прозапальних цитокінів ФНП-α та ІЛ-6.
2. Під впливом проведеної комплексної терапії у пацієнтів з ГХ і ЦД 2 відбулося поліпшення метаболічного гомеостазу і стану ендотелію.
3. Додаткове призначення пацієнтам з ГХ і ЦД 2 α-ЛК (Тіогама®, Woerwag Pharma GmbH & Co. KG) сприяло більш вираженому впливу на структурно-функціональний стан магістральних судин, прозапальні цитокіни, що проявлялося вірогідним зменшенням ШПХ СА і ШПХ ЧА, рівнів ФНП-α і ІЛ-6, а також збільшенням ступеня ЕЗВД порівняно з групою хворих, які отримували лише стандартну терапію.
Перспективи подальших досліджень. Слід відзначити перспективність вивчення впливу α-ЛК на різні ланки ІР у пацієнтів з ГХ і ЦД 2.
1. Беловол А.Н. Новые подходы к лечению больных гипертонической болезнью в сочетании с сахарным диабетом 2 типа / А.Н. Беловол, В.В. Школьник, В.Д. Немцова // Український терапевтичний журнал. — 2012. — № 2. — С. 32–38.
2. Бойцов С.А. Структура факторов риска, поражений органов-мишеней и метаболических изменений у больных артериальной гипертензией в различных возрастных группах / С.А. Бойцов, А.М. Уринский, Р.Л. Кузнецов, Ю.М. Поздняков // Кардиология. — 2009. — № 4. — С. 19–24.
3. Братусь В.В. Ожирение, инсулинорезистентность, метаболический синдром: фундаментальные и клинические аспекты / В.В. Братусь, Т.В. Талаева, В.А. Шумаков. — К.: Четверта хвиля, 2009. — 416 с.
4. Дедов И.И. Сахарный диабет и артериальная гипертензия / И.И. Дедов, М.В. Шестакова. — М.: Мед. информационное агентство, 2006. — С. 74–75.
5. Диабет и кардиоваскулярная медицина: эпидемиологические, молекулярные аспекты и влияние окружающей среды / И. Зиммет, B. Байлес Керр, К. Уалдер и др. // Діабет і серце. — 2009. — № 1 (127), січень — лютий. — С. 49–55.
6. Журавлева Л.В. Применение альфа-липоевой кислоты в комплексном лечении хронических заболеваний желудка у пациентов с сахарным диабетом / Л.В. Журавлева, Е.М. Кривоносова // Практикуючий лікар. — 2012. – № 1. — С. 52–58.
7. Карпов Ю.А. Роль нейрогуморальных систем в развитии и прогрессировании хронической сердечной недостаточности: эндотелиальные факторы / Ю.А. Карпов // Сердечная недостаточность. — 2005. — Т. 3, № 1. — С. 22–24.
8. Майоров А.Ю. Инсулинорезистентность в патогенезе сахарного диабета 2 типа / А.Ю. Майоров // Сахарный диабет. — 2011. — № 1. — С. 35–43.
9. Маньковский Б.Н. Новое руководство по лечению сахарного диабета 2 типа — что изменилось, в чем значение для клинической практики? / Б.Н. Маньковский // Диабет. Ожирение. Метаболический синдром. — 2012. — № 1. — С. 31–36.
10. Наказ МОЗ України № 1118 від 21.12.2012 р. «Уніфікований клінічний протокол первинної і вторинної (спеціалізованої) медичної допомоги «Цукровий діабет 2 типу».
11. Недогода С.В. Ожирение и артериальная гипертония: теория и практика выбора оптимального гипотензивного препарата / С.В. Недогода. — М., 2012. — 80 с.
12. Сиренко Ю.Н. Гипертоническая болезнь и артериальные гипертензии / Ю.Н. Сиренко. — К.: Заславский А.Ю., 2011. — 287 с.
13. Alpha-lipoic acid improves vascular endothelial function in patients with type 2 diabetes: a placebo-controlled randomized trial / B.B. Heinisch, M. Francesconi, F. Mittermayer [et al.] // Eur. J. Clin. Invest. — 2010. — Vol. 40. — Р. 148–154.
14. Amelioration of lipid abnormalities by α-lipoic acid through antioxidative and anti-inflammatory effects / Y. Zhang, P. Han, N. Wu [et al.] // Obesity (Silver Spring). — 2011. — Vol. 19. — Р. 1647–1653.
15. American Diabetes Association: Standards of Medical Care in Diabetes 2011 // Diabetes Care. — 2011. — Vol. 34 (Suppl. 1). — P. 11–61.
16. Beneficial effects of alpha-lipoic acid and ascorbic acid on endothelium-dependent, nitric oxide-mediated vasodilation in diabetic patients: relation to parameters of oxidative stress / T. Heitzer, B. Finckh, S. Albers [et al.] // Free Radic. Biol. Med. — 2001. — Vol. 31. — Р. 53–61.
17. Caballero A.E. Endothelial dysfunction in obesity and insulin resistance: a road to diabetes and heart disease / A.E. Caballero // Obes. Res. — 2003. — Vol.11, № 11. — P. 1278–1289.
18. Dallaire P. Obesity-linked insulin resistance: is the nitric oxide the missing link? / P. Dallaire, A. Marette // Canad. J. Diabetes. — 2004. — Vol. 28, № 1. — P. 59–66.
19. Diagnosis and management of the metabolic syndrome: an American Heart Association / S.M. Grundy, J.I. Cleeman, S.R. Daniels [et al.] // Circulation. — 2005. — Vol. 112. — P. 2735–2752.
20. Effect of alpha-lipoic acid on blood glucose, insulin resistance and glutathione peroxidase of type 2 diabetic patients / H. Ansar, Z. Mazloom, F. Kazemi [et al.] // Saudi Med. J. — 2011. — Vol. 32. — Р. 584–588.
21. Effects of alpha-lipoic acid on body weight in obese subjects / E.H. Koh, W.J. Lee, S.A. Lee [et al.] // Am. J. Med. — 2011. — Vol. 124. — Р. 851–858.
22. Evidence that α-lipoic acid inhibits NF-B activation independent of its antioxidant function / Z. Ying, T. Kampfrath, Q. Sun [et al.] // Inflamm. Res. — 2011. — Vol. 60. — Р. 219–225.
23. Golbidi S. Сахарный диабет и альфа-липоевая кислота (обзор) / S. Golbidi, M. Badran, I. Laher // Диабет. Ожирение. Метаболический синдром. — 2012. — № 1. — С. 48–58.
24. Impact of therapy with alpha-lipoic acid (ALA) on the oxidative stress in the controlled NIDDM: a possible preventive way against the organ dysfunction? / V. Gianturco, A. Bellomo, E. D’Ottavio [et al.] // Arch. Gerontol. Geriatr. — 2009. — Suppl. 49. — Р. 129–133.
25. Inflammation in the pathophysiology of essential hypertension / F. Montecucco, A. Pende, A. Quercioli [et al.] // J. Nephrol. — 2011. — Vol. 24. — P. 23–34.
26. Interaction between endotelin and nitric oxide in the regulation of vascular tone in obesity and diabetes / K.J. Mather, A. Lteif, H.O. Steinberg. [et al.] // Diabetes. — 2004. — Vol. 53, № 8. — P. 2060–2066.
27. Kamenova P. Improvement of insulin sensitivity in patients with type 2 diabetes mellitus after oral administration of alpha-lipoic acid / P. Kamenova // Hormones (Athens). — 2006. — Vol. 5. — Р. 251–258.
28. Long-term effect of 3-week intravenous alpha-lipoic acid administration in symptomatic diabetic polyneutropathy with clinical manifestations / A.S. Ametov, M.V. Novosadova, A.N. Barinov [et al.] // H. J. Ter. Arkh. — 2010. — № 82. — Р. 61–64.
29. Lteif A. Endothelin limits insulin action in obese/insulin-resistant humans / A. Lteif, P. Vaishnava, A.D. Baron // Diabetes. — 2007. — № 56. — P. 728–734.
30. Metabolic syndrome: a comprehensive perspective based on interactions between obesity, diabetes, and inflammation / P. Dandona, A. Aljada, A. Chaudhuri [et al.] // Circulation. — 2005. — Vol. 111. — P. 1448–1454.
31. Metabolic syndrome and early-onset coronary artery disease: is the whole greater than its parts? / C. Iribarren [et al.] // J. Am. Coll. Cardiol. — 2006. — Vol. 48, № 9. — P. 1800–1807.
32. Poh Z.X. Endocrine, Metabolic & Immune Disorders / Z.X. Poh, K.P. Goh // Drug Targets. — Dec. 2009. — Vol. 9, Issue 4. — Р. 392.
33. Schafer S.A. Impaired glucagon-like peptide-1-induced insulin secretion in carriers of transcription factor 7-like 2 (TCF7L2) gene polymorphisms / S.A. Schafer, O. Tschritter, F. Machicao // Diabetologia. — 2007. — № 50. — P. 2443–2450.
34. Shimamoto K. Metabolic syndrome / K. Shimamoto, T. Miura // Nippon Rinso. — 2009. — Vol. 67 (4). — Р. 771–776.
35. Shoelson S.E. Inflammation and insulin resistance / S.E. Shoelson, J. Lee, A.B. Goldfine // J. Clin. Invest. — 2006. — Vol. 116, № 7. — Р. 1793–1801.
36. Smith D.O. Insulin resistance syndrome, prediabetes, and the prevention of type 2 diabetes mellitus / D.O. Smith, D. LeRoith // Clin. Cornerstone. — 2004. — Vol. 6, № 2. — P. 7–16.
37. The effects of lipoic acid and α-tocopherol supplementation on the lipid profile and insulin sensitivity of patients with type 2 diabetes mellitus: a randomized, doubleblind, placebo-controlled trial / A.M. de Oliveira, P.H. Rondó, L.A. Luzia [et al.] // Diabetes Res. Clin. Pract. — 2011. — Vol. 92. — Р. 253–260.
38. Wilkes J.J. Chronic endothelin-1 treatment leads to insulin resistance in vivo / J.J. Wilkes, A. Hevener, J. Olefsky // Diabetes. — 2003. — Vol. 52. — P. 1904–1909.

/35/35.jpg)
/36/36.jpg)
/36/36_2.jpg)
/37/37.jpg)