Журнал «Актуальная инфектология» 2 (3) 2014
Вернуться к номеру
Лайм-бореліоз: питання діагностики і терапії
Авторы: Шостакович-Корецька Л.Р., Будаева І.В., Чергінець А.В., Маврутенков В.В., Марченко Н.Е. - ДЗ «Дніпропетровська медична академія» МОЗ України»
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Лайм-бореліоз (ЛБ) — найбільш поширена природно-осередкова трансмісивна інфекція, що зустрічається в США, Європі, в тому числі і в Україні. Це мультисистемне захворювання з ураженням шкіри, серця, нервової системи, суглобів, схильне до тривалого перебігу. Офіційна реєстрація захворювання в Україні ведеться з 2000 року. Рівень епідеміологічної реєстрації щороку зростає: показник захворюваності на ЛБ в Україні з 2000 року за 10 років зріс у 29 разів, зокрема у Дніпропетровській області — у 12 разів. Хвороба минає декілька стадій: від появи первинної форми — мігруючої еритеми до формування хронічних форм, що можуть призвести до інвалідизації. У 25–50 % хворих за відсутності адекватного антибактеріального лікування у ранній період ЛБ визначають хронічні форми хвороби, насамперед ураження серця. У цій роботі наведений алгоритм ранньої діагностики «мінорних», клінічно безманіфестних форм ураження серця при ЛБ під час ранніх стадій хвороби з метою раціонального вибору антибактеріальної терапії. Показано, що серологічні маркери ЛБ (антитіла до борелій класів IgM та IgG) не можуть використовуватися для контролю за перебігом захворювання та ефективністю терапії.
Лайм-боррелиоз (ЛБ) — наиболее распространенная естественно-очаговая трансмиссивная инфекция, встречающаяся в США, Европе, в том числе и в Украине. Это мультисистемное заболевание с поражением кожи, сердца, нервной системы, суставов, которое склонно к продолжительному течению. Официальная регистрация заболевания в Украине ведется с 2000 года. Уровень эпидемиологической регистрации каждый год возрастает: показатель заболеваемости ЛБ в Украине с 2000 года за 10 лет возрос в 29 раз, в Днепропетровской области — в 12 раз. Болезнь проходит несколько стадий: от появления первичной формы — мигрирующей эритемы к формированию хронических форм, которые могут привести к инвалидизации. У 25–50 % больных при отсутствии адекватного антибактериального лечения в ранний период ЛБ определяются хронические формы болезни, прежде всего поражение сердца. В данной работе приведен алгоритм ранней диагностики «минорных», клинически безманифестных форм поражения сердца при ЛБ во время ранних стадий болезни с целью рационального выбора антибактериальной терапии. Показано, что серологические маркеры ЛБ (антитела к боррелиям классов IgM и IgG) не могут использоваться для контроля эффективности терапии.
Lyme borreliosis (LB) is the most commonly seen naturally occurring transmissible infection in the United States and Europe, including Ukraine. This multisystemic disease with involvement of the skin, heart, nervous system and joints typically has long-term course. Official registration of the disease in Ukraine started in 2000 year. The epidemiological morbidity increases every year: LB incidence rate increased 29 times during the decade since 2000 year in Ukraine and 12 times in Dnipropetrovsk region. The disease has several stages, from the appearance of the original form, erythema migrans, to the formation of chronic forms, which can lead to disability. In 25-50 % of patients, in the absence of adequate antibiotic treatment of early LB, chronic form of the disease is emerging, especially the one including heart disease.
The aim of the study was to find the optimal diagnostic and therapeutic algorithms for different stages of the disease on the basis of summarizing the results of the research of patients with LB.
The observation included 136 patients with LB of age 2 to 75 years, admitted to Infectious Diseases Hospital in Dnipropetrovsk. Gender analysis revealed preference of women with LB, in contrast to the world of data. The median incubation period was 16.3 days and was in the range of 3 to 50 days. The first sign of the disease in 98.5% (n = 134) patients was erythema migrans. Wrong primary diagnosis was made in 78.7% (n = 107) of cases. Patients were divided into 4 groups according to the stage of the disease. Identification of etiology was performed with detection of specific antibodies to B.burgdorferi, class IgM and IgG by enzyme immunoassay (ELISA); in unclear cases immune blotting was done.
The article describes in details particularities of clinical manifestations of different stages of LB in patients. Influence of early antibiotic prescription on the natural course of the disease is admitted. Particularities of LB course in pregnant women, who were under observation, are presented. Specific clinical, laboratory and instrumental picture of heart involvement is described at LB in details. Particularities of usage of serological confirmation are given for different stages and forms of LB. The article describes the algorithm for early diagnosis of "minor" clinically non-manifested forms of heart disease at LB during the early stages of the disease for the rational choice of antibiotic therapy. It is shown that serological markers LB (antibodies to Borrelia of IgM and IgG classes) can not be used to monitor the progression and effectiveness of the therapy. Current approaches to rational antibiotic therapy of LB are described in the article, with consideration of different ages of the patients and stages of the disease. Phenomenon of bacteriolysis is described with its management.
In conclusion, it was presented that epidemiological features of LB in Dnipropetrovsk region are characterized by urbanization of LB, which indirectly indicates an increase in the urban natural reservoir (home or street dogs, cats). Statistics showing significant percentage of false diagnoses in LB indicate a lack of awareness of professional doctors who raises the need for wider notification on LB among doctors of different specialties. To improve the diagnosis of minor forms of carditis in LB at an early stage of the disease it is advocated the necessity of wider usage of CK -MB investigation and ECG in all patients. It can allow the choice of rational antibiotic therapy. Dynamics of specific antibodies showed no dependence from the stage, severity and natural course of LB, as well as effectiveness of treatment. The results of serological tests do not allow to differentiate chronic or acute infection. For this reason, these findings can only be used for etiological confirmation of LB and no for monitoring the efficacy of LB treatment.
Статья опубликована на с. 34-38
Вступ
Лайм-бореліоз (ЛБ) — найбільш поширена природно-осередкова трансмісивна інфекція, що зустрічається в США та Європі, в тому числі і в Україні [3, 4]. Це мультисистемне захворювання з ураженням шкіри, серця, нервової системи, суглобів, що схильне до тривалого перебігу. Клінічний та серологічний діагноз за відсутності мігруючої еритеми є проблематичним, оскільки різні геномовиди сприяють виникненню різних клінічних форм хвороби.
У частки нелікованих хворих можуть виникати серйозні ускладнення, але сама хвороба не закінчується летально. За рівнем захворюваності та різноманітності несприятливих наслідків клінічного перебігу ЛБ являє собою одну з найактуальніших проблем сучасної інфектології. Частота реєстрації хвороби за останнє десятиріччя зросла у десятки разів [1, 2]. У 2000 році ЛБ набув статусу найбільш поширеного трансмісивного захворювання в США і Європі [1].
Природні осередки в Європі, в тому числі в Україні, спостерігаються в лісових ландшафтах. Основна частина України ендемічна за цим зоонозом, найбільша захворюваність на ЛБ реєструється в Західній Україні. Про перші випадки захворювання людей на ЛБ в Україні відомо з 1994 р., але офіційна реєстрація захворювання ведеться з 2000 року. Осередки ЛБ зареєстровані в Автономній Республіці Крим, Донецькій, Київській, Львівській, Черкаській, Сумській, Вінницькій, Закарпатській, Івано-Франківській, Луганській, Полтавській, Чернігівській, Дніпропетровській областях [4].
Упровадження в практику сучасних імунологічних методів (імуноферментний аналіз, імуноблотинг) сприяло покращенню діагностики ЛБ: рівень епідеміологічної реєстрації в Україні щороку збільшується, динаміка зростання вражає: так, показник захворюваності на ЛБ в Україні з 2000 року (момент початку реєстрації) упродовж наступних 10 років зріс у 29 разів, у Харківській області — у 16 разів, у Дніпропетровській області — у 12 разів (рис. 1).
Проте можна вважати, що сучасна офіційна статистика не відповідає дійсній епідеміологічній ситуації стосовно ЛБ. Одними з причин цього, як показує практика, є відсутність настороженості лікарів щодо ЛБ і значна частота помилкових діагнозів.
Хвороба минає декілька стадій: від появи першого патогномонічного симптому ЛБ — мігруючої еритеми до формування хронічних форм (кардити, неврити, енцефаліт, менінгіт, артрит, атрофічний дерматит). У 1995–2004 рр. у Львівському науково-дослідному інституті епідеміології та гігієни лабораторно було обстежено 1907 хворих на ЛБ із 20 областей України. При цьому виявлено 1108 (58,1 %) серопозитивних осіб, з яких діагноз ЛБ підтверджено у 412 (37,2 %) випадках, ураження опорно-рухового апарату — у 18,3 %, серцево-судинної системи — у 10,7 % хворих. Встановлено, що збудник ЛБ став причиною виникнення етіологічно недіагностованих у 16,7 % неврологічних та 20,7 % псевдоревматологічних випадків захворювань [4].
Наведена статистика свідчить про актуальність проблеми ЛБ, необхідність дослідження цієї ще мало відомої хвороби, що схильна до тривалого перебігу. Ще недостатньо вивчена епідеміологія ЛБ, частота формування несприятливих форм хвороби, хронічних уражень нервової системи, шкіри, опорно-рухового апарату, що зумовлює довготривалу непрацездатність та інвалідизацію. На сьогодні немає певних лабораторних критеріїв контролю активності цієї хвороби, не визначені певні курси антибіотикотерапії при різних клінічних ситуаціях ЛБ, не розроблені й не впроваджені в рутинну практику ефективні засоби профілактики. Таким чином, питань більше, ніж відповідей.
Метою роботи був пошук найбільш оптимальних діагностичних та терапевтичних алгоритмів при різних стадіях хвороби на підставі узагальнення результатів власного дослідження хворих на ЛБ.
Матеріали та методи
Під спостереженням перебували 136 хворих на ЛБ (2011–2013 рр.) віком від 2 до 75 років, які надходили до інфекційної лікарні м. Дніпропетровська (КЗ МКЛ № 21).
Вікова медіана (m) становила 46,5 року. Під час аналізу вікової структури була виявлена перевага хворих віком до 60 років — близько 63 %, тобто найбільш дієздатного населення, решта хворих була пенсійного віку (рис. 2).
Гендерний аналіз виявив перевагу реєстрації ЛБ серед жінок на відміну від світових даних: 1 : 1,5 (nчол. = 54; nжін. = 82) [1].
Аналіз географічного поширення показав, що укуси кліщами найчастіше спостерігалися у містах, населених пунктах, в паркових зонах, на дачах і турбазах.
Так, 61,02 % (n = 83) хворих були укушені кліщами у містах, 35,29 % (n = 48) — у селищах і тільки незначна решта хворих — 6,02 % (n = 5) — була укушена в природних осередках (лісові масиви Криму, Івано-Франківської області, Білорусі, Росії). Таким чином, можна стверджувати, що сучасною епідеміологічною особливістю ЛБ у Дніпропетровській області є урбанізація, що, можливо, пов’язано з формуванням природних осередків ЛБ серед тварин, які мешкають у містах, більшою мірою — вуличних, меншою — домашніх [6]. Щорічному зростанню захворюваності на ЛБ сприяє значне збільшення безпритульних собак і котів у містах [5] та відсутність оповіщення населення про небезпечність набуття цього захворювання у критичні періоди року внаслідок укусів кліщами. Тільки 17,64 % (n = 24) наших хворих мали уяву про ЛБ і активно після укусів кліщів і/або появи мігруючої еритеми звернулися до лікаря з цього приводу, а 3,6 % (n = 5) хворих самі встановили собі діагноз ЛБ після пошуку інформації в Інтернеті.
Укуси кліщами відзначали 69,85 % (n = 95) хворих, решта не мала відомості про укуси кліщів. У таких випадках можна припустити контакт хворих із безкольоровими кліщовими німфами.
Медіана інкубаційного періоду становила 16,3 доби і була в межах від 3 до 50 діб. У 77 (56,6 %) хворих інкубаційний період тривав 10–15 діб. Першою ознакою хвороби у 98,5 % (n = 134) хворих була мігруюча еритема, що стало причиною звернення до лікаря. 86 % (n = 117) хворих отримали первинну консультацію та лікування у лікарів амбулаторної служби, частіше хворі зверталися до дерматологів, терапевтів, алергологів, хірургів, інфекціоністів; помилковий первинний діагноз був встановлений в 78,7 % (n = 107) випадків. Статистика значного відсотка помилкових діагнозів свідчить про недостатню професійну інформованість лікарів і ставить питання про необхідність більш широкого професійного оповіщення медичних фахівців про ЛБ.
Захворюваність характеризувалася певною сезонністю і визначалася природним циклом розвитку кліщів та погодними умовами. Ранні форми хвороби реєструвалися в теплий період року — з кінця березня по листопад. Максимальна частота звернень спостерігалася у червні — серпні: 80 % (n = 108) хворих (рис. 3).
Хронічні форми ЛБ спостерігалися у березні – квітні з тривалістю епідеміологічного анамнезу 280 діб і більше від моменту укусу кліщами або виникнення мігруючої еритеми.
Варіабельність клініки ЛБ залежала від терміну звернення до лікаря. Сучасна класифікація ЛБ передбачає розподілення хвороби по періодах залежно від клінічних проявів. У Міжнародній статистичній класифікації хвороб 10-го перегляду (43-тя Всесвітня асамблея охорони здоров’я) ця хвороба стоїть під єдиним шифром А69.2 із назвою «хвороба Лайма» без деталізації на клінічні форми. І на цей час існує певна суперечність щодо тверджень стосовно цієї хвороби, не визначені певні діагностичні та терапевтичні алгоритми.
Згідно з клінічною класифікацією ЛБ [1], хворі були поділені на 4 групи залежно від стадії захворювання: перша клінічна стадія хвороби була встановлена у 81,6 % хворих (n = 111), термін госпіталізації: 2–15 діб (m — 10,3) від початку захворювання; друга — 14 % хворих (n = 19), термін госпіталізації: 15–33 доби (m — 22,7); третя — 2,9 % хворих (n = 4), термін захворювання становив 280,2 доби і більше; решта хворих — 1,47 % (n = 2) — мала безеритематозну форму хвороби.
Усі хворі були обстежені за стандартними методами дослідження: гемограма, загальний аналіз сечі, аланінамінотрансфераза, аспартатамінотрансфераза. Частка хворих (n = 15) з другої групи була додатково обстежена на специфічні кардіологічні маркери (креатинфосфокіназа-МВ, КФК-МВ), біохімічні показники: ревматоїдний фактор, антистрептолізин О, С-реактивний протеїн. У хворих на артропатії було проведено рентгенологічне дослідження суглобів.
Встановлення етіологічного діагнозу проводилося шляхом визначення специфічних антитіл до B.burgdorferi класу IgM та IgG методами імуноферментного аналізу (ІФА), в сумнівних випадках застосовувався імуноблотинг.
Результати дослідження
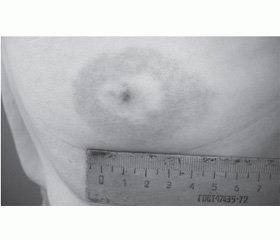
Першим клінічним симптомом у 83 % хворих першої групи (n = 113) було локальне шкірне запалення в місці укусу кліщем — мігруюча еритема (МЕ), що за своїм класичним виглядом є основним діагностичним (патогномонічним) симптомом ранньої стадії хвороби. МЕ з’являлася у хворих через 5–40 діб (у більшості — на першому тижні хвороби) після укусу кліща у вигляді макули або папули і повільно відцентровано збільшувалася у розмірах до 5–60 см (m — 17,8 см). МЕ мала характерний вигляд: центр плями був світлим, а периферійні ділянки — інтенсивно забарвлені у ліловий або червоний колір (кільцеподібна еритема). Особливістю еритеми було тривале її збереження: без лікування еритема зберігалась від 14 до 57 діб (m — 25,6 доби). При застосуванні антибактеріальної терапії термін існування МЕ скорочувався до 5–7 діб від початку терапії. У 18 % хворих (n = 15) після зникнення МЕ спостерігалося локальне лущення і гіперпігментація шкіри тривалістю до 10–14 діб. У 8,2 % (n = 7) спостерігалася сверблячка.
Локальна інфекція характеризувалася відносно задовільним станом або помірною слабкістю у 12 % (n = 10) хворих. У всіх пацієнтів були відсутні будь-які симптоми системного ураження органів у першій стадії хвороби. Під нашим спостереженням перебували 4 вагітні жінки з локалізованим ЛБ, в яких хвороба перебігала легко, без будь-яких скарг, з наявністю первинної МЕ. ЛБ не впливав на перебіг вагітності, у жодної жінки не спостерігався аборт. Подальший анамнез у цих жінок, на жаль, невідомий.
Симптоми вторинного інфікування стрептококовою флорою у вигляді целюліту/бешихи у місці укусу кліща спостерігалися у 12 % (n = 10) хворих, про це свідчило підвищення температури до 39–40 °С, яскрава гомогенна гіперемія з «язиками полум’я», локальний свербіж на місці укусу кліщем, нейтрофільоз у гемограмі.
Рання дисемінована стадія хвороби була встановлена у 13,9 % (n = 19) хворих. У цих пацієнтів провідним симптомом також була кільцеподібна еритема: поодинока (n = 5) або множинна (n = 14) вторинна еритема на інших ділянках шкіри, не пов’язаних із місцем первинної еритеми та укусу кліщем і спричинена гематогенним поширенням збудника. Порівняно з первинним локусом вторинні еритеми мали менший розмір, були без зони просвітлення у центрі й на колір менш яскравими. У більшості хворих другої групи (n = 15) еритема була єдиним клінічним симптомом захворювання, у решти спостерігалася субфебрильна температура, втомлюваність, сонливість.
Як відомо, ураження серця при ЛБ супроводжується порушенням серцевого ритму, насамперед виникненням АV-блокади. Саме цей вид аритмії з’явився у 2 наших хворих — дітей 9 і 11 років із сільської місцевості. Укус кліщем трапився у них на початку літа (травень-червень), згодом виникла типова мігруюча еритема, яку лікарі розцінили як алергійну реакцію на укус комахи; через 2–3 тижні в обох дітей еритема зникла. В однієї дитини з’явилася вторинна еритема. У серпні-вересні (через 2,5–3 місяці) в обох дітей з’явилися синкопе, з приводу чого їм обом було проведено електрокардіографічне обстеження; результат — АV-блокада ІІ–ІІІ ступеня. Обом дітям планувалося проведення операції по вживленню штучного водія ритму. Перед операцією діти були оглянуті дитячим інфекціоністом, за рекомендацією якого проведено дослідження дітей на наявність специфічних антитіл до B.burgdorferi класу IgM та IgG. Діагноз ЛБ був підтверджений, проведено відповідне лікування із застосуванням цефтріаксону тривалістю 21 доба. Динаміка захворювання була позитивною, спостерігалося повне одужання дітей. Оперативне втручання не проводилося.
АV-блокада — характерне ураження серця при ЛБ, але в наших дослідженнях ми виявили «мінорні» ознаки міокардиту, який реєструвався за збільшенням КФК-МВ у 2–4 рази відповідно до норми і наявності порушень ритму (тахікардія — збільшення ЧСС в 1,8–2,5 раза порівняно з нормою при нормальній температурі, екстрасистолія), які виявлялися аускультативно і на ЕКГ без будь-яких скарг хворого. Такий варіант ураження серця спостерігався у 9 дітей віком від 2 до 13 років: порушення на ЕКГ — 3 дитини, збільшення КФК-МВ — 4 дитини, зміни на ЕКГ + збільшення КФК-МВ — 2 дитини. Порушення серця спостерігалися у ранню дисеміновану стадію хвороби. Виявлення наведених лабораторно-інструментальних симптомів міокардиту дозволило переглянути антибіотикотерапію: терапія проводилася цефалоспоринами третьої групи впродовж 14–21 доби.
Таким чином, можна стверджувати, що при ураженні серця за ЛБ у ранній дисемінованій стадії хвороби характерним є не тільки порушення ритму (АV-блокада), але і симптоми міокардиту (збільшення в сироватці крові КФК-МВ) та «легкі» симптоми порушення ритму (тахікардія, екстрасистолія). На підставі проведених досліджень можна рекомендувати поглиблене обстеження хворих (обов’язкове проведення ЕКГ, дослідження рівня КФК-МВ у сироватці крові) у ранню дисеміновану стадію ЛБ для активного виявлення «мінорних» форм ураження серця і вибору раціональної терапії.
Третя група хворих — 2,9 % (n = 4) — була нечисленна: 3 хворих на олігоартрит колінного суглоба, 1 — хворий із невритом лицьового нерва. Зміни в гемограмі у більшості хворих були відсутні, у решти — неспецифічні: відносний лімфоцитоз (n = 4), підвищення ШОЕ у 1,5–2 рази.
Визначення специфічних антитіл до B.burgdorferi для верифікації діагнозу виявило декілька особливостей: по-перше, на ранніх стадіях хвороби не завжди виявлялися антитіла до борелій, навіть при наявності патогномонічної ознаки — мігруючої еритеми (12 % хворих (n = 10); по-друге, інфекційний процес у деяких хворих не завжди супроводжувався маніфестацією, так, у 2 хворих (1,47 %) була встановлена безеритематозна форма ЛБ за відсутності будь-яких симптомів хвороби тільки на підставі епіданамнезу (укус кліщом за місяць до обстеження) та виявлення специфічних антитіл до борелій; по-третє, динаміка хвороби супроводжувалася зникненням антитіл класу IgM при зростанні титрів IgG. Динаміка титру специфічних антитіл у жодного хворого не показала будь-якої залежності від стадії, тяжкості та характеру перебігу ЛБ, ефективності проведення терапії. Результати серологічних реакцій не дозволяли розділити перенесену, хронічну або гостру інфекцію. Таким чином, саме ці показники можуть застосовуватися тільки для етіологічної верифікації ЛБ, а не для контролю за перебігом захворювання та ефективністю терапії.
Терапія
Сучасна медицина не має єдиних загальноприйнятих стандартів етіотропного лікування ЛБ. У нашому стаціонарі дітям віком до 8 років призначалися амоксицилін або цефуроксим аксетил, дітям старше 8 років та дорослим — цефтріаксон. Антибактеріальна терапія переносилася добре і тільки у 12 % (n = 10) хворих спостерігалися симптоми бактеріолізу у вигляді підвищення температури, появи слабкості, що обумовило необхідність призначення парентеральних глюкокортикостероїдів одразу після введення антибіотиків. Призначення антибіотиків хворим із «мінорними» кардитами курсом 14–21 доби було позитивним, контроль терапії (КФК-МВ і ЕКГ) після її завершення показував норму.
Висновки
1. Епідеміологічні особливості ЛБ у Дніпропетровській області: характерна урбанізація ЛБ, що опосередковано свідчить про збільшення міського природного резервуару (домашні або вуличні собаки, коти).
2. Найбільша захворюваність на ЛБ спостерігається у дієздатного населення, тому ця проблема набуває соціального значення.
3. Статистика значного відсотка помилкових діагнозів при ЛБ свідчить про недостатню професійну інформованість лікарів, що ставить необхідність більш широкого оповіщення щодо ЛБ серед лікарів різного фаху.
4. Для покращення діагностики «мінорних» форм кардиту при ЛБ у ранню дисеміновану стадію хвороби показано проведення додаткового обстеження на КФК-МВ і ЕКГ усім хворим. Саме цей захід дозволить вибрати раціональну антибіотикотерапію.
5. Динаміка титру специфічних антитіл не показала залежності від стадії, тяжкості та характеру перебігу ЛБ, ефективності проведення терапії. Результати серологічних реакцій не дозволяли розділити перенесену, хронічну або гостру інфекцію. Саме тому ці показники можуть використовуватися тільки для етіологічної верифікації ЛБ, а не для контролю за ефективністю терапії та характером перебігу хвороби.
1. Ананьева Л.П. Лайм-боррелиоз или иксодовые клещевые боррелиозы. Этиология, клиника, диагностика // Инфекции и антимикробная терапия. — Институт ревматологии РАМН. — М., 2012. — Ресурс: www.medicusamicus.com
2. Рева Ю.А. Болезнь Лайма. Как предупредить заражение? / Інформаційне сповіщення лікаря епідеміолога відділу особливо небезпечних інфекцій Дніпропетровської обласної санепідстанції. — Ресурс: http://www.viaduk.net
3. Лобзин Ю.В., Усков А.Н., Козлов С.С. Лайм-боррелиоз (иксодовые клещевые боррелиозы) // Актуальные инфекции. — СПб.: Фолиант, 2000. — 160 с.
4. Методичні рекомендації з епідеміології, діагностики та профілактики іксодового кліщового бореліозу (хвороби Лайма) в Україні: наказ МОЗ України від 16.05.2005 № 218. — Ресурс: http://www.moz.gov.ua
4. Заволока А.А., Заволока Ан.А. Анализ проявления болезни Лайма в Харьковской области, Украина: сб. науч. статей Харьковского зоопарка. — 2010. — Вып. 5. — С. 357–361. — Ресурс: http://animals.kharkov.ua/node/416.
5. Иксодовые клещевые боррелиозы (болезнь Лайма) у собак: Автореф. дис... канд. биол. наук / Н.С. Пустовит. — М., 2003. — 25 с.

/28/28.jpg)
/29/29.jpg)