Журнал «Здоровье ребенка» 2 (53) 2014
Вернуться к номеру
Характеристика місцевих гуморальних факторів неспецифічної резистентності в дітей із повторними респіраторними захворюваннями
Авторы: Марушко Ю.В., Мовчан О.С. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У роботі проведено дослідження вмісту дефензинів-β1-3, лактоферину, лізоциму, sIgA в ротоглотковому секреті в дітей, які часто хворіють (ДЧХ), ДЧХ із хронічним компенсованим тонзилітом або атопічним дерматитом, досліджені кореляційні зв’язки між цими факторами та клініко-анамнестичними даними. Отримані дані вказують на необхідність диференційованого підходу в терапії дітей, які часто хворіють на респіраторні інфекції.
В работе проведено исследование содержания дефензинов-β1-3, лактоферрина, лизоцима, sIgA в ротоглоточном секрете у детей, которые часто болеют (ЧБД), ЧБД с хроническим компенсированным тонзиллитом или атопическим дерматитом, изучены корреляционные связи между этими факторами и клинико-анамнестическими данными. Полученные данные указывают на необходимость дифференцированного подхода в терапии детей, которые часто болеют острыми респираторными заболеваниями.
In this paper we investigated the content of defensins-β1–3, lactoferrin, lysozyme, sIgA A in oropharyngeal secretion in children with recurrent respiratory infections (RRI), with RRI and chronic compensated tonsillitis or atopic dermatitis, studied the correlation between these factors and clinical-anamnestic data. The findings suggest the need for differentiated approach to the treatment of children, who often suffer from acute respiratory diseases.
діти, респіраторні захворювання, хронічний тонзиліт, атопічний дерматит, місцевий імунітет, дефензини-β.
дети, респираторные заболевания, хронический тонзиллит, атопический дерматит, местный иммунитет, дефензины-β.
children, respiratory diseases, chronic tonsillitis, atopic dermatitis, local immunity, defensins-β.
Статья опубликована на с. 9-13
Вступ
Респіраторна патологія в дітей займає перше місце в структурі захворюваності дитячого населення [2, 4, 6, 7, 10, 11, 13, 18]. Вагому проблему становлять діти з повторними гострими респіраторними захворюваннями (ГРЗ) [4, 7, 8]. Концепція дітей, які часто хворіють (ДЧХ) на респіраторні інфекції, існує як у вітчизняній, так і в зарубіжній практиці, але підходи до оцінки частоти респіраторної патології у дитячому віці в різних країнах не збігаються. У медичній практиці Великобританії, США прийнято вважати, що зазвичай здорові діти віком від 1 до 3 років переносять до 8 епізодів ГРЗ на рік. У випадку 9 епізодів і більше говорять про рекурентні респіраторні інфекції. Згідно з рекомендаціями Всесвітньої організації охорони здоров’я в групу дітей, які часто хворіють, включаються діти, які перенесли 5 і більше епізодів ГРЗ на рік [14, 15, 19, 20].
В Україні найбільш поширеним став підхід до диспансеризації ДЧХ, сформований А.А. Барановим і В.Ю. Альбіцьким, — за віком і частотою ГРЗ: до 1 року — 4 епізоди та більше на рік, від 1 року до 3 років — 6 і більше, від 3 до 5 років — 5 і більше, старші 5 років — 4 епізоди та більше на рік [8]. Деякі автори до ДЧХ зараховують тих, у яких повторні ГРЗ перебігають тривало — більше ніж 14 днів [4, 7]. Досить широке практичне застосування мають такі критерії, як інфекційний індекс та індекс резистентності. Чимало дискусій триває щодо питань етіології, патогенезу, лікування та профілактики повторних ГРЗ у дітей. Багато робіт присвячено вивченню факторів системного імунітету в ДЧХ, але на даному етапі більшість робіт носять суперечливий характер і тому не дають можливість узагальнити терапевтичні заходи [4, 7, 8, 18].
Завдяки науковим досягненням поточного десятиріччя отримує визнання концепція відносної автономності локального імунітету слизових оболонок [1, 3, 5, 16, 17]. Але навіть до останнього часу в питаннях імунодіагностики при патологічних процесах, особливо пов’язаних з запальними процесами слизової оболонки дихальних шляхів, діагностичному визначенню факторів місцевого імунітету надається другорядне значення, у зв’язку з чим актуальним є вивчення вмісту факторів місцевого імунітету слизової оболонки верхніх дихальних шляхів у дітей, які часто хворіють [4, 5, 9].
На сьогодні недостатньо приділено уваги вивченню таких важливих факторів локального неспецифічного імунітету слизової респіраторного тракту, як антимікробні пептиди (АМП), зокрема дефензини. Система АМП, на відміну від механізмів специфічної імунної відповіді, активується одразу після інфікування та реалізує першу лінію протиінфекційного захисту організму. Дефензини представлені переважно на епітеліальних поверхнях слизових оболонок і шкіри й ефективні проти широкого кола бактерій, вірусів і грибів [1, 3, 5, 16, 17]. Окрім антимікробної функції дефензини мають імуномодулюючу дію, сприяють репарації тканин. Дефензини відіграють ключову роль в організації взаємозв’язку неспецифічних механізмів захисту й адаптивної імунної системи організму [3, 5, 16, 17]. Дефензини — це катіонні пептиди, збагачені цистеїном, структурно представлені антипаралельною b-складчатістю, що стабілізована дисульфідними зв’язками. У людини дефензини представлені двома субродинами — a та b. Існує шість основних типів b-дефензинів (human beta-defensin) — HBD1-6, що широко експресуються в респіраторному, травному, урогенітальному тракті та шкірі [1, 3, 5, 16, 17].
У теперішній час немає робіт, що комплексно оцінювали б стан місцевого імунітету з урахуванням антимікробних пептидів. Такі відомості дозволили б прогнозувати частоту та перебіг ГРЗ і розробити лікувально-реабілітаційні заходи.
Метою нашого дослідження стало визначення вмісту дефензинів-b1-3, лактоферину, лізоциму, секреторного імуноглобуліну А (sIgA) в ротоглотковому секреті (РГС) у ДЧХ, ДЧХ з хронічним компенсованим тонзилітом (ХТ) або атопічним дерматитом (АД), дослідження кореляційних зв’язків між цими факторами та клініко-анамнестичними даними.
Матеріали та методи
Під нашим спостереженням на базі дитячої поліклініки № 1 Святошинського району м. Києва знаходились 54 дитини віком від 4 до 12 років, які часто хворіють на гострі респіраторні захворювання (хлопчиків було 24, дівчат 30). Серед них 17 ДЧХ з атопічним дерматитом, 17 ДЧХ з хронічним компенсованим тонзилітом і 20 ДЧХ без атопічного дерматиту та хронічного тонзиліту. Додатково було обстежено 10 дітей 4–12 років (5 хлопчиків та 5 дівчаток), які на ГРЗ хворіли епізодично (ЕХД) і не мали атопічного дерматиту та хронічного тонзиліту.
Критерії залучення в дослідження: частота ГРЗ протягом року залежно від віку за В.Ю. Альбіцьким та А.А. Барановим (1986); вік від 4 до 12 років; наявність поінформованої згоди на участь у дослідженні батьків або законного представника дитини; відсутність стійких уроджених, спадкових або набутих патологічних станів, таких як первинний імунодефіцит, вади розвитку лор-органів та бронхолегеневої системи; хронічний компенсований тонзиліт у ДЧХ; атопічний дерматит у ДЧХ.
Критерії виключення з дослідження: відмова від участі в дослідженні на будь-якому етапі; ГРЗ або період реконвалесценції; вік менше 4 і старше 12 років; загострення хронічного тонзиліту; атопічний дерматит у стадії загострення.
Дизайн проведеного дослідження було попередньо ухвалено рішенням локальної комісії з біоетики НМУ імені О.О. Богомольця.
Усім дітям проводилося комплексне клініко-лабораторне обстеження, що включало: оцінку скарг, об’єктивного статусу, загальноклінічне лабораторне обстеження (загальний аналіз крові, сечі, дослідження калу на вміст яєць гельмінтів, ультразвукове дослідження органів черевної порожнини та лабораторно-інструментальні дослідження, необхідні для уточнення основного та супутніх захворювань, консультації суміжних спеціалістів).
Дослідження місцевого імунітету в дітей проводилося неінвазивним методом — шляхом аналізу ротоглоткового секрету (РГС). РГС збирався вранці натще без попереднього ополіскування ротової порожнини та чистки зубів у один і той же час. У нестимульованому РГС визначалися дефензини-b1–3, лактоферин (імуноферментний метод, аналізатор Stat Fax 2100, США, реактиви фірми «ВЕКТОР-БЕСТ», РФ); секреторний імуноглобулін А (метод радіальної імунодифузії, реактиви ГНЦ, «Иммунология», Москва, РФ).
Статистичну обробку результатів дослідження проведено за допомогою програмного забезпечення Microsoft Exсel 2010. Були застосовані методи описової статистики з оцінкою середнього значення показників (M), величини середньої стандартної помилки (m), t-критерію Стьюдента, критерію лінійної кореляції Пірсона. Статистично значущими вважали відмінності при p < 0,05.
Результати та їх обговорення
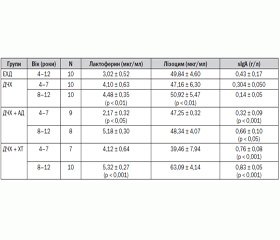
Результати оцінки частоти та тривалості ГРЗ в різних клінічних групах ДЧХ наведені в табл. 1.
За даними табл. 1, найбільша частота ГРЗ спостерігалась у ДЧХ + ХТ (4–7 років) і становила 8,7 ± 0,4 епізоду протягом року, у цій же групі зареєстрована найбільша тривалість гострого періоду ГРЗ — 8,50 ± 0,55 дня. Відзначається тенденція до більш тривалого перебігу та збільшення частоти ГРЗ у групі ДЧХ + АД порівняно з ДЧХ. Вірогідними виявились результати порівняння середньої тривалості гострого періоду ГРЗ у ДЧХ + ХТ (4–7 років) — 8,50 ± 0,55 дня відносно ДЧХ (4–7 років) — 6,90 ± 0,36 дня (p < 0,05); у ЧХД + ХТ (8–12 років) — 8,10 ± 0,33 дня по відношенню до ДЧХ (8–12 років) — 6,00 ± 0,47 дня (p < 0,01).
Результати дослідження вмісту дефензинів-b1–3 в РГС у ЕХД і ДЧХ різних клінічних груп наведено в табл. 2. Встановлено, що в ЕХД рівень дефензинів-b1–3 у РГС становив 4,04 ± 0,60 мкг/мл. У ДЧХ рівень дефензинів-b1–3 мав тенденцію до зниження — 3,05 ± 0,04 мкг/мл. У ДЧХ з атопічним дерматитом зареєстровано вірогідне зниження вмісту дефензинів-b1–3 у РГС (p < 0,05) — 1,58 ± 0,20 мкг/мл. У дітей із повторними респіраторними захворюваннями та хронічним тонзилітом уміст HBD1–3 був вірогідно високим (p < 0,05) — 6,64 ± 0,48 мкг/мл.
Аналіз дослідження вмісту дефензинів-b1-3, лактоферину, лізоциму та sIgA в РГС у ДЧХ виявив імунологічні відмінності залежно від наявності чи відсутності атопічного дерматиту та хронічного тонзиліту в обстежених (табл. 3).
Як видно з даних табл. 2, 3, у групі ДЧХ 4–7 років уміст лактоферину, лізоциму, sIgA та дефензинів-b1–3 в РГС не мав статистично значущих відмінностей порівняно з відповідними показниками в ЕХД. Імовірно, повторні ГРЗ у цих дітей пов’язані виключно з фізіологічними особливостями становлення імунної системи та початком відві–дування дошкільно-шкільних закладів. Тільки у ДЧХ 8–12 років зафіксоване статистично вагоме зниження sIgA — 0,14 ± 0,05 г/л порівняно з відповідним показником у ЕХД — 0,43 ± 0,17 г/л.
У групі ДЧХ з атопічним дерматитом 4–7 років відзначається тенденція до зниження вмісту всіх досліджуваних захисних факторів у РГС, причому рівні дефензинів-b1–3 та лактоферину були вірогідно (p < 0,05) низькими — 1,58 ± 0,20 мкг/мл (в ЕХД — 4,04 ± 0,60 мкг/мл); 2,17 ± 0,32 мкг/мл (в ЕХД — 3,02 ± 0,52 мкг/мл) відповідно. У групі ДЧХ + АД 8–12 років відзначений високий рівень лактоферину (p < 0,001) у РГС — 5,18 ± 0,30 мкг/мл порівняно з ЕХД (3,02 ± 0,52 мкг/мл). Секреторний імуноглобулін А в ДЧХ + АД 8–12 років у РГС також виявився вірогідно підвищеним (p < 0,05) і становив 0,66 ± 0,10 г/л проти 0,43 ± 0,17 г/л в ЕХД. Як зазначено вище, рівень дефензинів-1-3 в групі ДЧХ + АД був вірогідно (p < 0,05) нижчим, ніж у групі ЕХД (табл. 2).
Аналізуючи вміст гуморальних факторів неспецифічної резистентності в РГС у ДЧХ із хронічним компенсованим тонзилітом 4–7 років, слід зазначити, що рівень лізоциму мав тенденцію до зниження, рівень лактоферину був дещо підвищеним, а вміст sIgA був вірогідно високим (p < 0,001) — 0,76 ± 0,08 г/л (в ЕХД — 3,02 ± 0,52 г/л), також відзначена висока концентрація дефензинів-b1-3, p < 0,05 (табл. 2). У клінічній групі ДЧХ + ХТ 8–12 років зареєстровано підвищення вмісту всіх досліджуваних факторів локального захисту, причому вірогідно за рівнем дефензинів-b1-3 (p < 0,05), лактоферину (p < 0,001) та sIgA (p < 0,001), відповідні дані розміщені в табл. 2, 3.
У результаті проведеного кореляційного аналізу між досліджуваними факторами місцевого імунітету в групі ЕХД не виявлено вірогідних кореляційних зв’язків. У групі ДЧХ 4–7 років встановлена кореляція між такими факторами: лізоцим-sIgA, r = –0,71 (p < 0,01); лактоферин - sIgA, r = +0,55 (p < 0,01). Натомість у дітей старшого віку (8–12 років) даної клінічної групи відзначена зворотна кореляція лактоферин - дефензини-b1-3, r = –0,68 (p < 0,05). Серед часто хворіючих дітей з атопічним дерматитом 4–7 років виявлено сильну кореляцію лактоферин - дефензини-b1-3, r = +0,84 (p < 0,005), а серед дітей 8–12 років — лізоцим - sIgA, r = +0,87 (p < 0,005). У групі ДЧХ + ХТ віком 4–7 років зареєстровано лише одну вірогідну залежність — лактоферин - дефензини-b1–3, r = +0,76 (p < 0,01). Найбільш складну кореляційну сітку міжсистемних взаємодій (між факторами мукозального імунітету та клінічними даними) встановлено у ДЧХ + ХТ віком 8–12 років, а саме: лізоцим - дефензини-b1-3, r = +0,86 (p < 0,005); лізоцим - частота ГРЗ, r = –0,65 (p < 0,05); лізоцим - тривалість ГРЗ, r = +0,76 (p < 0,01); sIgA - частота ГРЗ, r = –0,63 (p < 0,05); дефензини-b1–3 - частота ГРЗ, r = +0,704 (p < 0,01); частота ГРЗ - тривалість ГРЗ, r = –0,65 (p < 0,05).
На підставі отриманих даних можна зазначити наступне. Поділ диспансерної групи ДЧХ на клінічні підгрупи (ДЧХ, ДЧХ + АД, ДЧХ + ХТ) є доцільним, адже в результаті проведеного нами дослідження встановлені їх вірогідні клініко-імунологічні відмінності. Наявність у дитини атопічного дерматиту чи хронічного тонзиліту можна вважати фактором ризику частих ГРЗ. Підтвердженням цього є результати дослідження тривалості гострого періоду ГРЗ та частоти ГРЗ у різних клінічних групах ДЧХ та імунологічного дослідження РГС. Серед пацієнтів 4–7 років найменшу частоту та тривалість ГРЗ мають ДЧХ без атопічного дерматиту та хронічного тонзиліту, у цій же групі (ДЧХ 4–7 років) не виявлено статистично значущих зрушень у системі місцевого імунітету, причому характер кореляційних зв’язків найближче відповідав такому в ЕХД. У ДЧХ 8–12 років без супутньої патології також відзначено найменшу тривалість та частоту ГРЗ у своїй віковій підгрупі, однак виявлені вірогідні зміни вмісту факторів захисту в РГС, а саме зниження вмісту sIgA (p < 0,01) та підвищення вмісту лактоферину (p < 0,01).
У групі часто хворіючих на ГРЗ пацієнтів 4–7 років з атопічним дерматитом відмічена тенденція до зниження вмісту в РГС усіх факторів місцевого імунітету, причому щодо рівня дефензинів-b1-3 вірогідно (p < 0,05) виявлено сильний прямий кореляційний зв’язок між рівнем лактоферину та дефензинів-b1-3. У ДЧХ + АД 8–12 років зареєстровані розбалансовані взаємозв’язки між досліджуваними факторами мукозального захисту — низькі рівні дефензинів-b1-3 водночас із високими рівнями лактоферину та sIgA, прямий кореляційний зв’язок — лізоцим - sIgA.
Категорія дітей, які часто хворіють на ГРЗ із хронічним тонзилітом, особливо віком 8–12 років, характеризується підвищенням умісту захисних факторів у РГС (отримані дані статистично вагомі), відзначені чисельні як прямі, так і зворотні кореляційні зв’язки. Таким чином, можна зробити висновок, що при наявності в ДЧХ хронічного тонзиліту імунна система слизової оболонки працює в режимі функціонального напруження, підтвердженням даного факту є відповідні дані дослідження захисних факторів у РГС та проведений кореляційний аналіз, при якому виявлено посилення внутрішньосистемних взаємодій даних факторів.
Висновки
1. Група дітей, які часто хворіють на ГРЗ, гетерогенна за своїми клініко-імунологічними характеристиками.
2. Вперше в практично здорових дітей у РГС визначений уміст дефензинів-b1-3, що становив 4,04 ± 0,60 мкг/мл. У ДЧХ без атопічного дерматиту та хронічного тонзиліту в негострому періоді вміст дефензинів-b1-3 мав тенденцію до зниження — 3,05 ± 0,04 мкг/мл. У ДЧХ із хронічним тонзилітом у стадії ремісії зареєстрований вірогідно високий уміст даного АМП — 6,64 ± 0,48 мкг/мл, у ДЧХ з атопічним дерматитом, навпаки, знижений — 1,58 ± 0,20 мкг/мл (p < 0,05).
3. Діти, які часто хворіють на ГРЗ на фоні атопічного дерматиту, мають ознаки дисбалансу між факторами мукозального захисту ротоглотки. У ДЧХ із хронічним тонзилітом виявлено високі показники досліджуваних факторів мукозального захисту ротоглотки, що, ймовірно, свідчить про високе мікробне навантаження навіть у період ремісії.
1. Абатуров А.Е. Катионные антимикробные пептиды системы неспецифической защиты респираторного тракта: дефензины и кателицидины / А.Е. Абатуров // Здоровье ребенка. — 2012. — № 1(36). — С. 139-144.
2. Антипкин Ю.Г. Рецидивирующий бронхит у детей: дискуссионные вопросы / Ю.Г. Антипкин, В.Ф. Лапшин, Т.Р. Уманец // Здоровье Украины. — 2008. — № 18. — С. 19-21.
3. Будихина А.С. Дефензины: свойства и функции — А.С. Будихина, Б.В. Пинегин // Иммунология, аллергология, инфектология. — 2008. — № 2. — С. 31-40.
4. Ершова И.Б. Проблема часто и длительно болеющих детей и методы оптимизации их лечения / И.Б. Ершова, Т.В. Ширина // Здоровье ребенка. — 2008. — № 2(11). — С. 59-61.
5. Мамчур В.И. Дефензины — пептиды с антимикробными и противоопухолевыми свойствами / В.И. Мамчур, А.Э. Левых // Болезни и антибиотики. — 2012. — № 2(7). — С. 27-29.
6. Майданник В.Г. Сучасні проблеми та перспективи розвитку педіатрії в Україні / В.Г. Майданник // Здоров’я України. — 2006. — № 19/1 (додатковий). — С. 6-8.
7. Романцов М.Г. Рациональная фармакотерапия часто болеющих детей. — СПб., 2008. — 76 с.
8. Часто болеющие дети / [Альбицкий В.Ю., Баранов А.А., Камаев И.А., Огнева М.Л.]. — Н. Новгород: Изд-во НГМА, 2003. — 180 с.
9. Чернишова Л.І. Захисна роль місцевого імунітету у профілактиці захворювань верхніх дихальних шляхів у дітей / Л.І. Чернишова, С.А. Якимович, Б.В. Донськой, Л.В. Глазюк // Современная педиатрия. — 2012. — № 4(44). — С. 104-107.
10. Шостакович-Корецкая Л.Р. Менеджмент бактериальных респираторных инфекций в ежедневной практике педиатра / Л.Р. Шостакович-Корецкая // Здоровье ребенка. — 2009. — № 5(20). — С. 84-87.
11. Юлиш Е.И. Метод дифференцированного похода к лечению и реабилитации часто и длительно болеющих респираторными заболеваниями детей при различном течении персистирующих инфекций / Е.И. Юлиш, И.В. Балычевцева, Б.И. Кривущев, С.Г. Гадецкая, С.Я. Ярошенко // Здоровье ребенка. — 2009. — № 5(20). — С. 20-26.
12. Юлиш Е.И. Факторы местного иммунитета при респираторных инфекциях и методы их коррекции / Е.И. Юлиш // Здоровье ребенка. — 2010. — № 5(26). — С. 63-67.
13. Юлиш Е.И. Часто болеющие дети и тактика педиатра / Е.И. Юлиш, С.Я. Ярошенко // Здоровье ребенка. — 2013. — № 6(49). — С. 70-76.
14. Aghamohammadi A. The approach to children with recurrent infections // A. Aghamohammadi, H. Abolhassani, P. Mohammadinejad, N. Rezaei // Iran J. Allergy Asthma Immunol. — 2012. — Vol. 11(2). — P. 89-109.
15. Bene M.C. Ribosomal immunotherapy for recurrent respiratory tract infections in children / M.C. Bene, G.C. Faure // Paediatr. Drugs. — 2003. — Vol. 5(4). — P. 223-228.
16. Cederlund A. Specificity in killing pathogens is mediated by distrinct repertoires of human neutrophil peptides / A. Cederlund, B. Agerberth, P. Bergman // J. Innate Immun. — 2010. — № 6. — P. 508-521.
17. Schneider J.J. Human defensins / J.J. Schneider, A. Unholzer, M. Schaller // J. Vol. Med. — 2005. — № 83(8). — P. 587-595.
18. Tregoning J.S. Respiratory viral infections in infants:causes, clinical symptoms, virology and immunology / Clin. Microbiol. Rev. — 2010. — Vol. 23. — P. 74-90.
19. Williams B.G. Estimates of world-wide distribution of child deaths from acute respiratory infections / B.G. Williams, E. Gouws, C. Boschi-Pinto, C. Bryce, C. Dye // Lancet Infect. Dis. — 2002. — № 2. — P. 25-32.
20. Zou Y. Comparison of risk factors for recurrent respiratory infections between urban and rural preschool children in Yiwu, China / Zou Y. [et al.] // World J. Pediatr. — 2012. — Vol. 8(2). — P. 145-150.

/10/10.jpg)
/11/11.jpg)