Журнал «Травма» Том 15, №2, 2014
Вернуться к номеру
К вопросу об эффективности нестероидных противовоспалительных препаратов при остеоартрозе на почве спондилоэпифизарной дисплазии
Авторы: Гужевский И.В., Герасименко С.И. - Государственное учреждение «Институт травматологии и ортопедии НАМН Украины», г. Киев
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Проведены наблюдения за клинической эффективностью использования нестероидных противовоспалительных препаратов при консервативном лечении 33 больных с остеоартрозом, развившимся на почве спондилоэпифизарной дисплазии. На основе макроскопических и микроскопических наблюдений подтверждено существенное значение воспалительных механизмов в патогенезе остеоартроза при спондилоэпифизарной дисплазии, что определяет целесообразность включения в комплекс медикаментозного лечения данной группы больных нестероидных противовоспалительных препаратов, применение которых позволяет получить клинически выраженный обезболивающий эффект.
Проведено спостереження за клінічною ефективністю використання нестероїдних протизапальних препаратів при консервативному лікуванні 33 хворих з остеоартрозом, що розвинувся на ґрунті спондилоепіфізарної дисплазії. На основі макроскопічних і мікроскопічних спостережень підтверджено істотне значення запальних механізмів у патогенезі остеоартрозу при спондилоепіфізарній дисплазії, що визначає доцільність включення в комплекс медикаментозного лікування даної групи хворих нестероїдних протизапальних препаратів, вживання яких дозволяє отримати клінічно виражений знеболюючий ефект.
There were conducted observations of the clinical efficacy of using nonsteroidal antiinflammatory drugs in the conservative treatment of 33 patients with osteoarthritis following spondyloepiphyseal dysplasia. On the basis of macroscopic and microscopic observation we confirmed the substantial significance of inflammatory mechanisms in the pathogenesis of osteoarthritis in spondyloepiphyseal dysplasia that determines the feasibility of including nonsteroidal antiinflammatory drugs in complex of medical treatment of this group of patients. The use of these drugs provides a clinically significant anesthetic effect.
остеоартроз, дисплазия, противовоспалительные препараты.
остеоартроз, дисплазія, протизапальні препарати.
osteoarthritis, dysplasia, antiinflammatory drugs.
Статья опубликована на с. 11-15
Введение
Проблема лечения больных с клиническими проявлениями остеоартроза (ОА) еще далека от полного решения и продолжает привлекать внимание представителей многих отраслей медицины [1, 3, 6, 8, 11, 12], а при прогнозировании эффективности терапии все большее значение придается учету этиологии ОА [3, 10, 12]. Исследователи признают, что наибольшие трудности представляет лечение первичного ОА, возникающего на почве наследственной предрасположенности, и в частности мутаций гена коллагена ІІ типа [5, 12, 14, 15]. К клинически значимым вариантам подобной патологии относится и спондилоэпифизарная дисплазия (СЭД), «стертые» случаи которой, не достигающие выраженности пороков развития, манифестируют в молодом возрасте развитием ОА с прогредиентным течением патологического процесса [5, 9, 14]. Учитывая генетическую суть СЭД, данное заболевание следует рассматривать как проявление врожденного нарушения метаболизма соединительной ткани в целом [2, 5, 15], что оказывает влияние как на патогенез ОА, так и на эффективность любых методов лечения пациентов рассматриваемой группы [2, 5]. В частности, при ОА на почве СЭД процесс деградации суставного хряща сопровождается выраженными воспалительными реакциями [4], в результате которых образующиеся деструктивные цитокины непосредственно влияют на синтез ферментов и запускают лизосомальные механизмы клеточных повреждений, разрушительно действуя на коллаген и протеогликаны [6, 8, 11, 13]. По нашим наблюдениям, принципы медикаментозного лечения больных с ОА на почве СЭД не отличаются от принятой на сегодняшний день тактики лечения ОА с широким использованием нестероидных противовоспалительных препаратов (НПВП) [6, 7, 12, 16], однако в доступной нам литературе мы не встретили оценки клинической эффективности применения указанных препаратов у больных с ОА на почве СЭД, что побудило нас к изучению данного вопроса.
Материал и методы
Под нашим наблюдением находился 151 взрослый больной с диагнозом ОА тазобедренных и коленных суставов, у которых после клинико-рентгенографического обследования верифицирован диагноз СЭД. Распределение больных по полу и основному диагнозу отображено в табл. 1.
При анализе данных анамнеза вышеуказанной группы больных определенной неожиданностью, несмотря на характерные для СЭД и существующие с рождения выраженные анатомические изменения (рис. 1), оказался факт достаточно позднего обращения больных к ортопеду: средний возраст первого обращения за медицинской помощью составил у лиц мужского пола 36 ± 4 года, у женщин — 37 ± 6 лет; при этом дебют ОА в возрасте до 30 лет чаще отмечался у мужчин, а после 40 лет — у женщин (рис. 2).
/12/12_3.jpg)
В связи с разнородностью больных по локализации ОА, методам лечения до обращения пациентов в клинику и невозможностью в ряде случаев адекватно выяснить особенности анамнеза из общего количества пациентов для анализа были отобраны 33 человека, которые были госпитализированы для эндопротезирования суставов с диагнозом коксартроза ІІІ–IV стадии (по классификации J.Н. Kellgren, J.S. Lawrence, 1957) на почве СЭД. Вне зависимости от пола большинство пациентов данной группы было в наиболее работоспособном возрасте (табл. 2).
Критерием отбора больных в данную группу был выясненный из анамнеза факт, что основным методом медикаментозного лечения в дебюте клинических проявлений ОА (первые 12 месяцев от появления болевого синдрома) было применение различных НПВП системного действия, среди которых чаще всего использовался нимесулид (табл. 3).
Наибольшая частота применения нимесулида, с нашей точки зрения, не случайна и обусловлена рядом факторов. В частности, представитель группы ингибиторов ЦОГ-2 Нимесил, внедренный в практику с 1980 года, обладает стимулирующим влиянием на синтез макромолекул внеклеточного матрикса суставного хряща и во многих исследованиях подтвердил свою эффективность и хорошую переносимость даже у пациентов с повышенным риском поражения желудочно-кишечного тракта [6, 7]. С учетом наибольшего количества случаев использования препарата Нимесил для дальнейшего анализа эффективности НПВП у больных с ОА на почве СЭД были отобраны 25 больных, получавших названный медикамент.
В качестве группы контроля взяты 20 больных (8 мужчин, 12 женщин) в возрасте от 40 до 69 лет, которым в связи с идиопатическим коксартрозом 1–2-й стадии на этапах амбулаторного лечения также назначался препарат Нимесил. Выраженность болевого синдрома во время ходьбы до начала приема нимесулида и через 2 недели после начала его регулярного приема оценивали по визуальной аналоговой шкале (ВАШ). Вычисление показателей проводилось с использованием пакета программ Statistica, Microsoft Excel 2000.
В 15 случаях у больных с СЭД во время эндопротезирования были взяты фрагменты сохранившегося суставного хряща (периферическая зона нижнего сегмента головки бедренной кости), что позволило провести гистологическую оценку выраженности воспалительного компонента ОА при СЭД. Для подготовки материала к световой микроскопии фрагменты хряща фиксировали в 10% формалине, декальцинировали в 5% растворе азотной кислоты, промывали, проводили по спиртам возрастающей крепости, заключали в целлоидин. Срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином, а также пикрофуксином по ван Гизону. Исследования срезов проводили под световым микроскопом Axiostar Plus, фотографировали с помощью цифровой камеры Саnon.
Результаты и их обсуждение
При сравнении интенсивности боли у пациентов обеих групп до приема нимесулида и через 2 недели после приема препарата получены близкие показатели, не имевшие статистичеcки значимых отличий (табл. 4), что свидетельствует о достаточной терапевтической эффективности использованного НПВП у больных обеих групп.
Гистологические исследования позволили выявить как универсальные изменения, характерные для ОА 3–3,5 стадии по классификации OARSI, 2000 г., так и свидетельства значительной роли воспаления в патогенезе ОА у пациентов с СЭД (рис. 3).
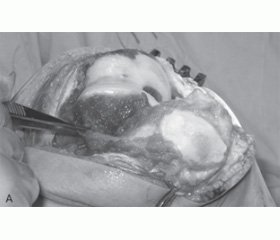
Яркие свидетельства существенной роли воспалительного компонента ОА при СЭД мы находили и во время оперативных вмешательств на коленных суставах, когда макроскопически наблюдали выраженные пролиферативные изменения синовиальной оболочки, напоминавшие изменения, характерные для ревматоидных поражений суставов (рис. 4).
Таким образом, выявленные у больных с ОА, развившимся на почве СЭД, макроскопические и микроскопические признаки воспалительных изменений в суставах объясняют эффективность применения НПВП у данных пациентов.
Выводы
1. У больных с СЭД в патогенезе ОА и его клинических проявлениях существенную роль играют воспалительные механизмы, что подтверждается имеющимися макроскопическими и микроскопическими данными.
2. Поскольку до сегодняшнего дня не разработано этиотропное медикаментозное лечение ОА при СЭД, в комплексе консервативного лечения данной группы больных оправданно использование селективных ингибиторов ЦОГ-2, что позволяет получить клинически выраженный обезболивающий эффект.
1. Арабидзе Г.Г., Желваков С.В. Остеоартрозы / Г.Г. Арабидзе, С.В. Желваков // Терапевт. — 2010. — № 6. — С. 60-65.
2. Бугаева И.В. Клинико-функциональное значение дисплазии соединительной ткани и ее влияние на течение заболеваний, вызванных воздействием факторов внешней среды: Автореф. дис… д-ра мед. наук: спец. 14.01.04 «внутренние болезни» / И. В. Бугаева. — Тюмень, 2010. — 38 c.
3. Гайко Г.В., Бруско А.Т. Сучасні підходи до профілактики та лікування остеоартрозу // Літопис травматології та ортопедії. — 2008. — № 1–2. — С. 157-160.
4. Гужевский И.В. Особенности клинического и патоморфологического проявления остеоартроза суставов
нижних конечностей у больных со спондилоэпифизарной дисплазией / И.В. Гужевский, С.И. Герасименко, Н.В. Дедух, Л.М. Панченко // Ортопедия, травматология и протезирование. — 2011. — № 3. — С. 9-14.
5. Кадурина Т.И. Дисплазия соединительной ткани / Т.И. Кадурина, В.Н. Горбунова. — СПб.: Элби-СПб, 2009. — 702 с.
6. Коваленко В.М. Остеоартроз: практична настанова / В.М. Коваленко, О.П. Борткевич. — К.: Моріон, 2010. — 608 с.
7. Корпан М.И. и др. Роль нарушений метаболизма гликоз–аминогликанов в патогенезе остеоартроза и их медикаментозная коррекция / М.И. Корпан, С. Магомедов, А.Т. Бруско и др. // Вісник ортопедії, травматології та протезування. — 2011. — № 3. — С. 74-79.
8. Майорова С.М. Сравнительная эффективность методов локальной терапии остеоартроза коленных суставов: Автореф. дис… канд. мед. наук: спец. 14.01.22 «ревматология» / С.М. Майорова. — Ярославль, 2010. — 24 с.
9. Carter E.M., Raggio C.L. Genetic and orthopedic aspects of collagen disorders / Carter E.M., Raggio C.L. // Curr. Opin. Pediatr. — 2009. — Vol. 21, № 1. — Р. 46-54. — doi: 10.1097/MOP.0b013e32832185c5.
10. Consortium and arcOGEN Collaborators. Identification of new susceptibility loci for osteoarthritis (arcOGEN): a genome-wide association study // Lancet. — 2012. — Vol. 380, № 9844. — Р. 815-823. — doi: 10.1016/S0140-6736(12)60681-3.
11. Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!) // Osteoarthritis and Cartilage. — 2013. — Vol. 21, № 1. — P. 16-21. — doi.org/10.1016/j.joca.2012.11.012.
12. Brandt K.D. Diagnosis and Nonsurgical Management of Osteoarthritis. — Fifth Edition. — USA, West Islip, NY: Professional Communications, Inc., 2010. — 368 p. Heinegård D., Saxne T. The role of the cartilage matrix in osteoarthritis / D. Heinegård, T. Saxne // Nature Reviews Rheumatology. — 2011. — № 7. — Р. 50-56. — doi:10.1038/nrrheum.2010.198.
14. Macdonald D.W. et al. Structural Variations in Articular Cartilage Matrix Are Associated with Early-Onset Osteoarthritis in the Spondyloepiphyseal Dysplasia Congenita (Sedc) Mouse / David W. Macdonald, Ryan S. Squires, Shaela A. Avery et al. // International journal of molecular sciences. — 2013. — Vol. 14, № 8. — Р. 16515-16531. — doi:10.3390/ijms140816515.
15. Warman M.L. et al. Nosology and Classification of Genetic Skeletal Disorders: 2010 Revision / M.L. Warman, V. Cormier-Daire, Ch. Hall et al. // Am. J. Med. Genet. (Part A). — 2011. — Vol. 155, № 5. — Р. 943-968. — doi: 10.1002/ajmg.a.33909.
16. Zhang W. et al. OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009 / W. Zhang, G. Nuki, R.W. Moskowitzet al. // Osteoarthritis Cartilage. — 2010. — Vol. 18, № 4. — Р. 476-499. — doi: 10.1016/j.joca.2010.01.013.

/12/12.jpg)
/12/12_2.jpg)
/13/13.jpg)
/13/13_2.jpg)
/14/14.jpg)