Журнал «Neoplasm» 1(13) 2014
Вернуться к номеру
Современные возможности лечения рака желудка
Авторы: Думанский Ю.В., Сидюк А.В., Попович А.Ю. - Донецкий национальный медицинский университет им. М. Горького; Донецкий областной противоопухолевый центр
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
В статье представлены непосредственные и функциональные результаты хирургического лечения 1146 больных раком желудка, получавших лечение в Донецком областном противоопухолевом центре с 2011 по 2013 г. Из них радикальных и паллиативных операций — 775, обходных гастроэнтеранастомозов и пробных лапаротомий — 371. Таким образом, резектабельность составила 67,6 %. Показаны варианты разработанных и используемых в клинике эзофагоэнтеро- и эзофагогастроанастомозов. Доказана надежность применяемых методик (частота несостоятельности анастомозов 0 %) и функциональность (рефлюкс-эзофагит — 8 %, рубцовый стеноз — 6 %).
The paper presents the short-term and functional results of surgical treatment of 1146 patients with gastric cancer treated at the Donetsk regional antitumor center from 2011 to 2013. There had been carried out 775radical and palliative surgeries, 371 bypass gastroenteroanastomosis and explorative laparotomy. Thus, resectability was 67.6 %. The authors had shown variants of esophagoentero- and esophagogastroanastomosis which were developed and used in the clinic. Reliability of used techniques (occurrence of anastomotic dehiscence — 0 %) and functionality (reflux esophagitis — 8 %, cicatrical stenosis — 6 %) has been proved.
У статті наведені безпосередні та функціональні результати хірургічного лікування 1146 хворих на рак шлунка, які отримували лікування в Донецькому обласному протипухлинному центрі з 2011 по 2013 р. З них радикальних і паліативних операцій — 775, обхідних гастроентеранастомозів і пробних лапаротомій — 371. Таким чином, резектабельність становила 67,6 %. Показано варіанти розроблених і використовуваних у клініці езофагоентеро- й езофагогастроанастомозів. Доведена надійність застосовуваних методик (частота неспроможності анастомозів 0 %) і функціональність (рефлюкс-езофагіт — 8 %, рубцевий стеноз — 6 %).
рак желудка, хирургическое лечение.
gastric cancer, surgical treatment.
рак шлунка, хірургічне лікування.
Статья опубликована на с. 20-24
Введение
Отдаленные результаты лечения рака желудка пропорционально зависят от стадии опухолевого процесса. Наиболее успешных результатов удалось добиться Южной Корее и Японии, т.к. в этих странах существуют программы общенационального скрининга рака желудка, что позволяет диагностировать 1-ю и 2-ю стадии заболевания у более чем 50 % больных [1, 2, 4].
Необходимо отметить, что значительную роль в достижении хороших отдаленных результатов лечения играет адекватное хирургическое лечение. В данное понятие входят необходимый объем лимфодиссекции и выполнение операции R0 [4, 7].
Для обеспечения вышеперечисленных условий требуется хирургический доступ, который позволит хирургам под визуальным контролем выполнять хирургическое вмешательство в радикальном объеме [1, 4, 5].
Несмотря на большое количество сообщений из стран Азии (Южной Кореи, Японии) о возможностях лапароскопических технологий в хирургическом лечении рака желудка, в странах Европы и Америки к использованию данных методик относятся более сдержанно. Хотя хирурги всего мира имеют единую точку зрения, что лапароскопическая хирургия является методом выбора при раннем раке желудка (который по современной классификации относится к опухолям Т1-Т2) [4].
При распространенном раке желудка для увеличения продолжительности жизни больных используются методы комбинированного и комплексного лечения. Результаты метаанализов в странах Европы, Азии и Америки показали, что включение пред- и послеоперационных методов химио- и лучевой терапии позволяет улучшить 5-летние результаты лечения на более чем 10–15 % в сравнении с чисто хирургическим лечением [3, 4].
Материалы и методы
В клинике Донецкого областного противоопухолевого центра для лечения рака желудка используются следующие оперативные доступы: срединная лапаротомия, Льюиса (срединная лапаротомия и правосторонняя торакотомия), Гэрлока (левосторонняя тораколапаротомия) и абдоминомедиастинальный. Данные доступы при различных локализациях опухолей в желудке позволяют выполнить адекватную лимф–аденэктомию и удаление опухоли в пределах здоровых тканей (R0-резекцию) [1].
Для определения хирургического доступа при выполнении оперативного вмешательства мы используем в своей практике общепризнанную в мире классификацию Зиверта [5]. Традиционно при 1-м типе выполняем операцию Льюиса с лимфаденэктомией D2 + 2F. При 2-м и 3-м типе выполняем оперативное вмешательство из левостороннего торакоабдоминального доступа по Гэрлоку с лимфаденэктомией D2 + 2S. Считаем возможным выполнение оперативного вмешательства из абдомино-медиастинального доступа при распространении опухоли на пищевод до 2 см с обязательным интраоперационным исследованием проксимального края резекции (при наличии опухолевой ткани в крае резекции выполняем торакоабдоминальный доступ) и лимфаденэктомией D2 + 2S.
При анастомозировании пищевода и тонкой кишки мы используем метод академика Г.В. Бондаря, разработанный в 70-х годах прошлого века [1, 2], который за более чем 40 лет его применения доказал свою надежность и функциональность (частота несостоятельности < 1 %) (рис. 1).
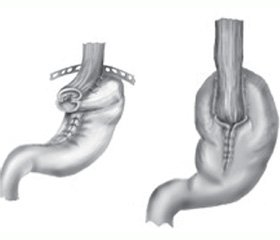
Для анастомозирования пищевода и желудка мы применяем методику, также разработанную акад. Г.В. Бондарем [1, 2]. Метод заключается в формировании инвагинационного эзофагогастроанастомоза, который отличается максимальной надежностью и за счет формирования желудочной муфты вокруг пищевода препятствует забросу содержимого желудка в пищевод (рис. 2).
В нашей клинике за более чем 40 лет работы накоплен опыт выполнения 7041 радикальной и паллиативной операции при раке желудка, из которых 4381 — гастрэктомия и 2910 — различные резекции желудка. Послеоперационная летальность после гастрэктомии составила 3,7 %, в том числе после простой гастрэктомии — 3,3 %. Частота несостоятельности пищеводного анастомоза — 0,69 %, а после радикальной гастрэктомии — 0,21 %.
Результаты и обсуждение
За анализируемый 3-летний период (2011–2013 гг.) в клинике Донецкого областного противоопухолевого центра выполнено 1146 операций по поводу рака желудка. Из них радикальных и паллиативных операций — 775, обходных гастроэнтеранастомозов и пробных лапаротомий — 371. Таким образом, резектабельность составила 67,6 %.
Распределение больных по видам выполненных оперативных вмешательств представлено в табл. 1.
Среди оперированных больных преобладали пациенты мужского пола, с локализацией опухоли в пищеводе и гистологической структурой — аденокарцинома различной степени дифференцировки (табл. 2).
Послеоперационная летальность составила 4,5 % (52 пациента).
При изучении функциональных результатов хирургического лечения рака желудка установлено, что частота рефлюкс-эзофагитов составила 8 %, рубцового стеноза анастомоза — 6 %.
Выводы
Таким образом, разработанные в Донецком областном противоопухолевом центре методы хирургического лечения рака желудка являются надежными и функциональными, с удовлетворительными показателями послеоперационных осложнений и летальности.
Current Treatments Options for Gastric Cancer
Introduction
Long-term results of gastric cancer treatment depend on tumor stage. The most successful results were achieved in South Korea and Japan, as these countries have a national screening program of gastric cancer which allows diagnosing stage 1 and 2 of the disease in more than 50 % of patients [1, 2, 4].
Also it should be noted that a significant role in achieving good long-term results of treatment has adequate surgical treatment. In this concept include the necessary lymph node dissection and resection R0 [4, 7].
To ensure the above conditions requires surgical access, which enables surgeons to perform curative surgery under visual control [1, 4, 5].
Despite the large number of messages from Asian countries (South Korea, Japan) about the possibilities of laparoscopic techniques in the surgical treatment of gastric cancer, in Europe and America using of these techniques are more subdued. Although surgeons around the world have a common view that laparoscopic surgery is the treatment of choice for early stages of gastric cancer (that corresponds to the modern classification of tumors T1-T2) [4].
The results of meta-analyzes in Europe, Asia and America have shown that the inclusion of neoadjuvant and adjuvant methods chemotherapy and radiation therapy can improve the 5-year results of treatment for more than 10–15 % in comparison with only surgical treatment [3, 4].
Materials and Methods
Donetsk regional anticancer center uses for treatment of gastric cancer following surgical accesses: midline laparotomy, Lewis (median laparotomy and right-sided thoracotomy), Garlok (left thoraco-laparotomy) and abdomino-mediastinal. Access data at different locations of tumors in the stomach allows performing an adequate lymphadenectomy and removal of the tumor within normal tissues (R0-resection) [1].
To determine the surgical approach when performing surgery in our practice we using the classification of Siewert [5]. Traditionally, when 1 type we perform Lewis procedure with lymphadenectomy D2 + 2F. At 2 and 3 type we perform thoraco-abdominal left-hand Garlock access with lymphadenectomy D2 + 2S. If tumor spreads to esophagus until 2 cm we can use abdominomediastinal access with intraoperative investigation of proximal resection margin (if we have positive tumor resection margin, we perform thoraco-abdominal access) and lymphadenectomy D2 + 2S.
Making anastomosis between esophagus and small intestine we use the method of Prof. Bondar, which was developed in the 70s of the last century [1, 2], which for more than 40 years has proved its reliability and functionality (leakage < 1 %) (fig. 1).
For anastomosis between esophagus and stomach we use a technique developed by Prof. Bondar [1, 2]. The method consists in formation of invaginated esophagogastroanastomosis which provides maximum reliability and through the formation of gastric sleeve around the esophagus prevents reflux esophagitis (fig. 2).
In our clinic we have had an experience in 7041 cases of curative and palliative surgery for gastric cancer, where in 4381 cases total gastrectomies were performed and in 2910 — subtotal gastrectomies for more than 40 years period. Postoperative mortality after gastrectomy was 3.7 %, whereas frequency of esophageal anastomotic leakage — 0.69 %.
Results and Discussion
During the analyzed 3-year period (2011–2013) we performed 1146 operations for gastric cancer. 775 curative and palliative surgery and 371 bypass and explorative laparotomy. Thus, resectability was 67.6 %.
Distribution of patients by type of surgical procedures is presented in Table 1.
The majority of operated patients were male with a tumor in the stomach and histology — adenocarcinoma of varying degrees of differentiation (Table 2).
Postoperative mortality was 4.5 % (52 patients).
In the study of the functional results, the frequency of reflux esophagitis was 8 %, anastomotic stenosis — 6 %.
Conclusions
Thus, methods of surgical treatment of gastric cancer which were developed in Donetsk regional anticancer center are reliable and functional with satisfactory results of postoperative complications and mortality.
t of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial // Lancet Oncol. — 2010. — 11(5). — 439-49.
1. Варианты хирургического лечения рака пищевода и рака желудка с переходом на пищевод / Г.В. Бондарь, Ю.В. Думанский, А.В. Сидюк и др. // Международный медицинский журнал. — 2013. — № 4. — С. 57-60.
2. Проблемы в диагностике и хирургическом лечении рака желудка / Г.В. Бондарь, Ю.В. Думанский, А.Ю. Попович, В.Г. Бондарь, А.В. Сидюк // Журнал академії медичних наук України. — 2010. — Т. 16, № 2. — С. 262-270.
3. Noh S.H., An J.Y., Kim H.I. et al. Pathologic and oncologic outcomes in locally advanced gastric cancer with neoadjuvant chemotherapy or chemoradiotherapy // Yonsei Med. J. — 2013. — 54(4). — 888-894.
4. Noh S.H., Lee J.H., Kim K.M. et al. Current management and future strategies of gastric cancer // Yonsei Med. J. — 2012. — 53(2). — 248-257.
5. Siewert J.R., Stein H.J., Feith M. Adenocarcinoma of the oesophago-gastric junction // Scandinavian Journal of Surgery. — 2006. — 95. — 260-269.
6. Shin Doosup, Park SS. Clinical importance and surgical decision-making regarding proximal resection margin for gastric cancer // World J. Gastrointest Oncol. — 2013. — 5(1). — 4-11.
7. Songun I., Putter H., Kranenbarg E.M. et al. Surgical treatmen

/22/22.jpg)
/22/22_2.jpg)
/23/23.jpg)
/23/23_2.jpg)