Журнал «Neoplasm» 1(13) 2014
Вернуться к номеру
Эпителиально-мезенхимальная трансформация как критерий прогноза почечноклеточного рака
Авторы: Думанский Ю.В., Кудряшов А.Г., Василенко И.В., Кондратюк Р.Б., Гульков Ю.К. - Донецкий областной противоопухолевый центр; Чистяков Р.С. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
Изучен операционный материал 47 больных после выполненных нефрэктомий с прослеживанием срока жизни и морфологической оценкой опухолей с применением иммуногистохимических методов в двух группах: короткой выживаемости (КВ) (3–6 месяцев) и длительной выживаемости (ДВ) (более 1,5–2 лет). Установлено, что опухоли в этих группах отличались частотой веретеноклеточной эпителиально-мезенхимальной трансформации: в группе КВ она составила 96,4 %, в группе ДВ — 42,1 %; а также ядерной атипии по Фурману: в группе КВ высокая (3–4-й степени) встретилась в 100 % случаев, в группе ДВ — в 68,4 %. Частота веретеноклеточной эпителиально-мезенхимальной трансформации при раке почки может оказаться более чувствительным прогностическим фактором, чем степень ядерного атипизма по Фурману.
Surgical material has been studied in 47 patients after nephrectomy with tracking lifetime and morphological evaluation of tumors using immunohistochemical methods in two groups: of short-term survival (STS) (3–6 months) and long-term survival (LTS) (more than 1.5–2 years). It is found that tumors in these groups differed by incidence of spindle cell epithelial-mesenchymal transformation: in STS group it was 96.4 %, in LTS group — 42.1 %; as well as Furhman’s nuclear atypia: high in STS group (3rd–4th degree) met in 100 % of cases, in LTS group — in 68.4 %. Incidence of spindle cell epithelial-mesenchymal transformation in renal cancer may be more sensitive prognostic factor than the degree of Furhman’s nuclear atypia.
Вивчено операційний матеріал 47 хворих після виконаних нефректомій із дослідженням терміну життя та морфологічною оцінкою пухлин із застосуванням імуногістохімічних методів у двох групах: короткої виживаності (КВ) (3–6 місяців) і тривалої виживаності (ДВ) (більше 1,5–2 років). Встановлено, що пухлини в цих групах відрізнялися частотою веретеноклітинної епітеліально-мезенхімальної трансформації: у групі КВ вона становила 96,4 %, у групі ДВ — 42,1 %; а також ядерної атипії за Фурманом: у групі КВ висока (3–4-го ступеня) зустрілася в 100 % випадків, у групі ДВ — у 68,4 %. Частота веретеноклітинної епітеліально-мезенхімальної трансформації при раку нирки може виявитися більш чутливим прогностичним фактором, ніж ступінь ядерного атипізму за Фурманом.
почечноклеточный рак, эпителиально-мезенхимальная трансформация, степень ядерного атипизма по Фурману.
renal cell carcinoma, epithelial-mesenchymal transformation, the degree of Furhman’s nuclear atypia.
нирковоклітинний рак, епітеліально-мезенхімальна трансформація, ступінь ядерного атипізму за Фурманом.
Статья опубликована на с. 30-37
Введение
Почечноклеточный рак (ПКР) принадлежит к числу опухолей, частота которых стойко возрастает в течение последних 20 лет [1]. В Европе заболеваемость ПКР удвоилась за период 1975–2005 гг. [7], в России показатели заболеваемости выросли за 5 лет (2003–2008 гг.) на 15,7 % у мужчин и 17,3 % у женщин [2]. В Украине заболеваемость среди мужского населения в 2012 г. составила 15,2/100 000, а среди женского населения 9,3/100 000, уровень смертности — 7,2/100 000 среди мужского и 3,6/100 000 среди женского населения. Прогноз при этом заболевании варьирует в зависимости от распространенности и агрессивности опухоли [10]. Развитие новых диагностических подходов, в частности пункционной биопсии опухолей почки [13] с последующей морфологической оценкой полученного материала, позволит установить ряд новых факторов, влияющих на прогноз, что необходимо для выработки дальнейшей тактики лечения больных почечноклеточной карциномой, особенно в наше время, которое расценивают как эпоху молекулярной революции в клинической онкологии [15].
Материал и методы
Изучен послеоперационный материал, полученный после выполнения нефрэктомий у 47 больных. Прослеживание больных в послеоперационном периоде позволило разделить их по срокам выживания (in accordance with survival time): проживших менее 3 месяцев — 11 больных, до 6 месяцев — 17, более 1,5 года — 5, свыше 2 лет после операции — 14 больных. Все они были разделены на 2 группы: короткой выживаемости (КВ), т.е. до 3–6 месяцев, — 28 случаев и длительной выживаемости (ДВ), т.е. более 1,5–2 лет, — 19 случаев. Адъювантного лечения пациенты в группе ДВ не получали, а в группе КВ получали курсы иммунотерапии по стандартным схемам. В соответствии с требованиями Этической комиссии Донецкого областного противоопухолевого центра от пациентов были получены информированные согласия. Брались для исследования участки из разных отделов опухоли (центра и периферии), после фиксации забуференным формалином и парафиновой проводки срезы толщиной 5 мкм окрашивались гематоксилином и эозином. В этих срезах оценивалась степень дифференцировки в зависимости от выраженности клеточного атипизма и ядерного атипизма по S.A. Fuhrman (1982). В 20 наблюдениях проведено иммуногистохимическое исследование с применением моноклональных антител к эпителиальным маркерам — панцитокератину АЕ1/АЕ3 (clone AE1/AE3), цитокератину 18 (clone DC 10), Е-кадгерину (clone NCH-38); мезенхимальным маркерам — виментину (clone V9) и a-гладкомышечному актину (clone 1A4). Все моноклональные антитела и система визуализации фирмы DAKO Cytomation (Denmark).
Результаты и обсуждение
Во всех 19 случаях ДВ больных обнаруживался светлоклеточный рак, в 6 наблюдениях — с наличием папиллярных структур (31,6 %). Следует отметить, что в каждом случае отмечены очаги разной степени дифференцировки, двух или даже трех, например, высокой, умеренной и низкой. Подсчитывали частоту каждой из них в случаях разных сроков продолжительности жизни после нефрэктомии. В 14 случаях из 19 был высокодифференцированный рак (73,7 %), но в 7 случаях из них он сочетался с очагами умеренно- и низкодифференцированного. В 12 случаях — умереннодифференцированный рак, в 1 из них была только эта степень дифференцировки, в 7 он сочетался с очагами высокодифференцированного рака и в 4 случаях — с очагами высоко- и низкодифференцированного. В 8 наблюдениях (42,1 %) — низкодифференцированный рак, без сочетания с другими формами — в 4 случаях, в 4 наблюдениях он сочетался с очагами умеренной и высокой дифференцировки.
Среди 28 больных с КВ высокодифференцированный светлоклеточный рак встретился в 13 (46,4 %) случаях, но во всех этих наблюдениях он сочетался с очагами умеренной дифференцировки (5 случаев) и в 8 случаях — с очагами умеренной и низкой дифференцировки опухоли. В 23 случаях — умереннодифференцированный рак, из них в 5 случаях — без признаков других форм, в 5 случаях он сочетался с высокодифференцированным раком, в 5 случаях — с низкодифференцированным и в 8 случаях были очаги высоко- и низкодифференцированного рака. В 18 случаях (64,3 %) — низкодифференцированный почечноклеточный рак, в 5 случаях он не сочетался с более дифференцированными формами, а в 5 случаях наряду с ним был умереннодифференцированный рак и в 8 случаях — умеренно- и высокодифференцированный. Таким образом, среди случаев длительной выживаемости несколько чаще (73,7 %) в сравнении со случаями короткой выживаемости (46,4 %) встречался высокодифференцированный почечноклеточный рак, а среди случаев КВ чаще был низкодифференцированный (64,3 %) в сравнении со случаями ДВ (42,1 %).
Нами была определена частота низкой (1–2-й) и высокой (3–4-й) степени ядерной атипии по Фурману в группах с разной выживаемостью. В случаях опухолей с КВ больных 1–2-я степень ядерной атипии встретилась в 13 случаях (46,4 %), 3–4-я степень — во всех случаях (100 %). В случаях длительной выживаемости в 17 из 19 случаев (89,5 %) была низкая степень ядерной атипии, что значительно выше, чем в группе короткой выживаемости. Хотя высокая степень ядерной атипии встречалась нередко (12 случаев, 63,2 %), она была значительно реже, чем в группе КВ (100 %).
Опухолевые клетки при светлоклеточном раке обнаруживают светлую цитоплазму вследствие потери липидов и гликогена по время приготовления препаратов. Однако слабодифференцированные, высокой степени атипии клетки могут приобретать эозинофильную и гранулярную цитоплазму [24]. В нашем материале это наблюдалось в 21 (75 %) случае КВ и в 6 случаях (55 %) ДВ больных. Особой формой дифференцировки опухолевых клеток является рабдоидная, которая характеризуется центральным эозинофильным включением в цитоплазме, положительным на виментин, и эксцентрически расположенным ядром [12, 19]. Такие опухоли редко встречаются, составляя 4,3 % по данным X. Leroy et al. [12], и характеризуются агрессивным течением. В нашем материале такая структура клеток встречалась на небольших участках в 6 случаях (21,4 %) в группе КВ и в 3 случаях (15,8 %) — в группе ДВ, т.е. без существенного различия.
В группе КВ больных очень часто встречались очаги веретеноклеточного рака — 96,4 %, вдвое чаще, чем в группе ДВ (42,1 %). Веретеноклеточная (так называемая саркоматоидная) карцинома относится к агрессивным формам, градируется как 4-я степень по Фурману, с высокой стадией и частыми метастазами [24]. В настоящее время такая почечноклеточная карцинома рассматривается как пример эпителиально-мезенхимальной трансформации (ЭМТ) [5].
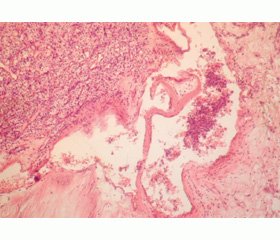
ЭМТ характеризуется целым рядом морфологических признаков [16–18, 21], которые мы наблюдали в нашем материале: потерей эпителиального фенотипа с обособлением опухолевых клеток и потерей полярности из-за снижения до исчезновения мембранной экспрессии Е-кадгерина, изменением формы клеток, приобретением веретенообразной, отростчатой формы и способности к движению за счет снижения и исчезновения экспрессии эпителиальных маркеров цитокератинов (рис. 1) и приобретения фенотипа фибробластов (экспрессии виментина) (рис. 2) и миофибробластов (экспрессия a-гладкомышечного актина) (рис. 3).
Такие изменения наблюдались в нашем материале в виде очаговой ЭМТ чаще на границе опухоли с окружающей тканью (рис. 4) или распространенной, захватывающей большую часть опухоли.
Однако и светлоклеточный рак может иметь признаки мезенхимального фенотипа (рис. 5). Так, по данным В. Lhermitte и L. de Levаl [13], в светлоклеточном раке более чем в 75 % случаев была резко выражена экспрессия виментина, тогда как экспрессия панцитокератина была умеренно выраженной более чем в 75 % случаев и высоковыраженной — в светлоклеточном папиллярном раке. Это связано с особенностями гистогенеза почки, ее мезенхимальным происхождением.
Частота веретеноклеточной эпителиально-мезенхимальной трансформации была различной в зависимости от длительности выживаемости больных после операции: при ДВ она составила 42,1 %, при КВ — 96,4 %. Причем интересно, что различия наблюдались даже в пределах каждой группы при, казалось бы, относительно небольшой разнице в сроках. Так, в группе КВ различия были незначительны: при продолжительности жизни до 3 месяцев после операции ЭМТ встретилась в 90,9 % случаев, при таковой до 6 месяцев — в 100 %. В группе ДВ больных при сроке более 1,5 года частота ЭМТ составила 80 %, при сроке более 2 лет — 28,6 %.
Следует отметить связь развития веретеноклеточной ЭМТ с высокой степенью ядерной атипии по Фурману, что видно в гистологических препаратах, т.е. высокая (3–4-я) степень ядерного атипизма в очагах ЭМТ и почти полное совпадение их частоты в группе КВ (96,4 и 100 %) и относительно близкие показатели частоты в группе ДВ (42,1 и 68,4 %). Это позволяет предполагать, что в развитии ЭМТ значительную роль играют стадия прогрессии опухоли и ее биологические особенности.
С учетом того, что, по данным литературы [23], ЭМТ повышает инвазивность опухоли, мы сопоставили частоту инвазии сосудов по наличию опухолевых клеток в их просвете в гистологических препаратах (рис. 6) и лимфатических узлах с частотой ЭМТ. В группе КВ их частота составила 53,6 %, в группе ДВ — только 21,1 %. Таким образом, имеется связь между частотой ЭМТ и инвазивностью опухоли.
Одним из факторов прогноза почечноклеточного рака считают оценку некроза в опухоли [11]. Однако отмечают важность не наличия некроза, а его протяженности, с плохим прогнозом связывают наличие крупных некрозов [11]. Поэтому в нашем материале мы отдельно подсчитывали частоту мелких и крупных некрозов. Частота крупных полей некроза у пациентов с КВ после операции составила 64,3 %, мелкие некрозы в этой группе наблюдались у 35,4 %. У больных с ДВ после операции частота крупных некрозов составила 42,1 %, мелких — 21 %, т.е. встречались со значительно меньшей частотой, чем в группе КВ, особенно это касается крупных полей некроза. Развитие крупных полей некроза обычно связано с сосудистым фактором. Хотя ЭМТ и усиливает ангиогенез в опухоли, активируя VEGF и PDGF [21], но, возможно, в недостаточной степени. Нельзя исключить, что инвазия опухолевыми клетками сосудов также может создавать препятствия для кровотока и быть причиной крупных некрозов.
Обсуждение
В течение последних 20 лет наметилась стойкая тенденция к увеличению числа заболеваемости ПКР. ПКР — гетерогенная группа гистологических подтипов, из которых светлоклеточный рак является наиболее частым, составляя более 70 % всех случаев, папиллярный — 10–15 %, хромофобный — 5 % [4, 24].
Потеря функции опухолевого супрессора VHL, которая лежит в основе развития светлоклеточного рака, ведет ко многим особенностям ЭМТ, в частности, потере экспрессии Е-кадгерина [9]. В светлоклеточном раке почки установлено также снижение 4 факторов транскрипции (GATA3, TFCP2L1, TFAP2B, DMRT2), которые важны для нормального развития почек, что ведет к отсутствию эпителиальной дифференцировки, мезенхимальной адипогенной трансдифференцировке и появлению плюрипотентных клеток, подобных мезенхимальным стволовым клеткам [22].
Однако, обладая особенностями мезенхимальной дифференцировки, светлоклеточный рак не обнаруживает таких признаков ЭМТ, как изменение формы опухолевых клеток, приобретение характерной для мезенхимального фенотипа вытянутой, фибробластоподобной формы. Такая перестройка цитоскелета способствует увеличению подвижности клеток, их инвазивности [21].
Фибробластоподобная форма опухолевых клеток, напоминающих лейомиосаркому, фибросаркому, ангиосаркому и другие саркомы, характерна для так называемой саркоматоидной дифференцировки, которая может присутствовать в любом подтипе почечноклеточного рака и характеризуется высокой степенью атипизма и большей инвазивностью [3, 14].
Сопоставление в одной опухоли двух различных клеточных популяций: эпителиальных (раковый компонент) и мезенхимальных клеток (саркоматоидный компонент) позволило J. Conant et al. [5] установить, что экспрессия фактора транскрипции Snail, ответственного за ЭМТ во многих опухолях [16, 17], встречается уже в эпителиальном компоненте ПКР и необходимо рассматривать ее как раннюю, вовлекающую в инициацию ЭМТ, стадию опухоли.
В нашем материале во всех случаях был светлоклеточный рак, в том числе с очагами высокодифференцированного и наличием 1–2-й ядерной степени в 50 % случаев в группе с КВ и 70 % случаев высокодифференцированного рака в группе с ДВ, наличием 1–2-й ядерной степени по Фурману в 89,5 %. Высокая ядерная степень по Фурману была в 100 % случаев КВ и 68,4 % случаев ДВ. Она расценивается как наиболее важный прогностический фактор, предсказатель рецидива и метастазов после удаления опухолей почки даже Т1а стадии [20]. На этом фоне очаги веретеноклеточной опухоли (саркоматоидный компонент) встретились в 96,4 % опухолей в группе КВ и 42,1 % в группе пациентов с ДВ.
Таким образом, частота развития веретеноклеточного (саркоматоидного) компонента в нашем материале связана с частотой высокой ядерной степени по Фурману и влияет на длительность выживания больных с почечноклеточным раком после нефрэктомии.
Выявление этой формы ЭМТ в почках при морфологическом исследовании опухоли имеет важное значение, т.к. его присутствие влияет на частоту инвазии сосудов (53,6 % в группе с КВ и 21,1 % в группе с ДВ), а следовательно, и на прогноз.
Кроме того, установлено, что в почечноклеточном раке наличие саркоматоидной опухоли (веретеноклеточной формы ЭМТ) негативно влияет на эффективность используемой терапии. Как правило, такие формы либо резистентны, либо низкочувствительны к таргетной терапии, в частности, антиангиогенной [8, 15].
Учитывая принципиальную обратимость ЭМТ в опухоли, необходим поиск других мишеней терапии, связанных с генетическими изменениями в опухолевых клетках. Такой поиск сегодня ведется при раке как почки, так и других органов (легкого, желудка). Так, при раке почки ингибитор рецептора 1 трансформирующего фактора роста (TGFbR1) SB431542 в комбинации с ингибитором ROCK киназы (Rho киназы) Y27623 или с ингибитором p38MAPK SB2035 препятствуют нарушению цитоскелета и экспрессии мезенхимальных генов, восстанавливают Е-кадгерин [6], т.е. необходимо воздействие на несколько мишеней для обратимости ЭМТ.
Epithelial mesenchymal transformation as a criterion of renal-cell carcinoma prognosis
Introduction
Renal cell carcinoma (RCC) belongs to tumors the occurrence of which has been increasing for the last 20 years [1]. For the period of 1975–2005 the RCC disease incidence doubled in Europe [7]. In Russia the morbidity rate increased by 15.7 % in males and by 17.3 % in females for 5 years (2003–2008) [2]. This disease prognosis varies depending on the occurrence and aggressivity of the tumor [10]. In 2012 in Ukraine the renal carcinoma morbidity rate made up 15.2 per 100 000 of male population and 9.3 per 100 000 of female population. Death rate was 7.2 per 100 000 in males and 3.6 per 100 000 in females. Development of new diagnostic approaches and that of puncture biopsy of renal tumors in particular [13] followed by a morphologic assessment of the material obtained will allow to establish a number of new factors influencing the prognosis to devise further tactics of treating patients with renal cell carcinoma especially in the present time which is considered to be the epoch of a molecular revolution in clinical oncology [15].
Material and Methods
The nephrectomy material of 47 cases was studied. Following up the patients allowed to divide them in accordance with survival time, viz. 11 patients lived less than 3 months, 17 patients lived up to 6 months, 5 patients — more than 17 months, 14 patients lived more than 24 months following the operation. They all were subdivided into two groups. The short-term survival group (3–6 months) had 28 patients and the long-term survival group (more than 17–24 months) consisted of 19 patients. The long-term survival group patients received no adjuvant therapy, and the short-term survival group patient received standard immunotherapy. Informed consents were obtained from the patients according to the Ethical Commission requirements of the Donetsk Regional Anticancer Center. Diffe–rent parts of the tumor, viz. the center and periphery, were tested. 5 μm sections were stained with hemotoxilin and eosin following the buffered formalin fixation and paraffin preparation. In these sections the degree of differentiation depending on the expression of cell atypia and nuclear atypia according to S.A. Furhman was assessed (1982). 20 patients were tested immunohistochemically using monoclonal antibodies with the epithelial markers: pancytokeratin AE1/AE3 (clone AE1/AE3), cytokeratin 18 (clone DC10), Е-cadherin; with the mesenchimal markers, viz. vimentin (clone VY) and a-smoth muscle actin (clone 1A4). All the monoclonal antibodies and visualization system are from DAKO Сytomation (Denmark).
Results
All the 19 long-term survival patients demonstrated renal cell carcinoma. There were papillary structures in 6 patients (31.6 %). It should be noted that in each case there were foci of various degree of differentiation that is of two and even three degrees: high, moderate and low. The frequency of each of them in cases of different survival terms following nephrectomy was calculated. High differentiated carcinoma was in 14 of 19 patients (73.7 %), but in 7 cases it was combined with the foci of moderate and low differentiated carcinoma. Moderate differentiated carcinoma was in 12 patients, one of them had only this degree of differentiation, in 7 patients it was associated with foci of high differentiated carcinoma and in 4 patients — with foci of high and low differentiated carcinoma. In 8 cases (42.1 %) it was low differentiate carcinoma not combined with other factors in 4 patients, and in 4 cases it was combined with foci of moderate and high differentiation.
Of 28 short-term survival patients, 13 patients (46.4 %) had high differentiated cell carcinoma, but in all these cases it was combined with foci of moderate differentiation (5 cases) and in 8 cases with foci of moderate and low diffe–rentiation. Moderate differentiated cell carcinoma was in 23 cases, 5 cases of them were without the signs of other forms, in 5 cases it was combined with high differentiated cell carcinoma, in 5 cases — with low differentiated carcinoma, and in 8 cases — with the foci of high- and low-differentiated cancer. Low differentiated renal cell carcinoma was in 18 patients (64.3 %), in 5 patients it was not combined with more differentiated forms. In 5 patients it was with moderate differentiated carcinoma and in 8 patients with moderate and high differentiated carcinoma. Thus, high differentiated renal cell carcinoma occurred more often (73.7 %) in long-term survival patients in comparison with the short-term survival patients (46.4 %). The short-term survival patients had low differentiated carcinoma (64.3 %) more often as compared with the cases of long-term survival (42.1 %).
We determined the rate of a low (1–2) and high degree (3–4) of Fuhrman’s nuclear atypia in groups of different survival. Degree 1–2 of nuclear atypia occurred in 13 patients (46.4 %) in the short-term survival cases, degree 3–4 in all the cases (100 %). A low degree of nuclear atypia was seen more often, viz. in 17 of 19 (89.5 %) patients in the long-term survival cases which was fairly higher than in the short-term survival group. Although a nuclear atypia high degree was not infrequently seen (12 cases, 63.2 %), it was rather rare than in the short-term survival group (100 %).
The tumor cells in renal cell carcinoma demonstrate a clear cytoplasma due to the loss of lipids and glycogen during the preparation of specimens. However the cells of a high degree atypia and poorly differentiated can acquire an eosinofilic and granular cytoplasma [24]. In our material it was seen in 21 (75 %) cases of the short-term survival and in 6 (55 %) cases of the long-term survival. A rhabdoid type is a particular type of cancer cell differentiation. It is characterized by a central eosinofilic inclusion in the cytoplasma, being positive to vimentin, and an eccentrically located nucleus [12, 19]. Such tumors occur rarely making up 4.3 % according to the statistics of X. Leroy et al. [12]. They are characterized by an aggressive course. In the current study such a cell structure occurred at small sites in 6 cases (21.4 %) of the short-term survival group and in 3 cases (15.8 %) of the long-term survival group. i.e. without significant distinctions.
The foci of spindle-cell cancer (96.4 %) occurred very often in the group of the short-term survival patients, viz. twice as much the group of long-term survival (42.1 %). Spindle-cell or so called sarcomatoid carcinoma belongs to aggressive types, it is graded as degree 4 according to Fuhrman with a high stage and frequent metastases [24]. Nowadays such a renal cell carcinoma is considered to be an example of epithelial-mesenchymal transition (EMT) [5].
EMT was characterized by a number of morphological features [16–18, 21] that we observed in our study. They were a loss of epithelial phenotype with the isolation of cancerous cells and a loss of polarity because of a decrease in membrane expression of E-cadherin up to its disappearance, a change of the form of cells; taking of a spindle-, process-like form and acquiring the capacity for motion due to a decrease and disappearance of the expression of the epithelial markers of cytokeratins (Fig. 1), and acquiring the phenotype of fibroblasts (vimentin expression) (Fig. 2) and myofibroblasts (expression of a-smooth muscular actin) (Fig. 3). In our study such changes were observed as focal EMT more often at the border of the tumor on the surrounding tissue or on the greater part of the extensive tumor.
However renal cell carcinoma can have the signs of the mesenchymal phenotype. Thus according to the data of В. Lhermitte, de L. Leval [13] the vimentin expression was sharply increased in more than 75 % of cases in renal cell carcinoma while the pancytokeratin expression was mode–rate in more than 75 % of cases and was highly increased in renal cell papillary carcinoma. This deals with the kidney histogenesis peculiarities, its mesenchymal origin.
The rate of spindle-cell epithelial-mesenchymal transition was different depending on the patients’ survival length following the operation, viz. the long-term survival made up 42.1 %, short-term survival — 96.4 %. It is worth mentioning that there were differences even within each group, though the term-rate difference was relatively small. Thus, in the short-term survival group the diffe–rences were minor: in case of survival up to 3 months following the operation, EMT occurred in 90.8 % of cases, in case of survival up to 6 months — 100 %. In the long-term survival group of more than 17 month duration the EMT rate made up 80 %, and at terms of more than 24 months it made up 28.6 %.
The relation of spindle-cell EMT development with a high degree of Fuhrman’s nuclear atypia should be noted. It was seen in the histologic preparations, i.e. a high degree (3–4) of nuclear atypia in the EMT foci and almost complete coincidence of their rate in the short-term survival group (96.4 % and 100 %) and relatively similar indices of rate in the long-term survival group (42.1 % and 68.4 %).
In our study such changes were seen in the form of focal EMT more often at the tumor boundary on the adjacent tissue (Fig. 4) or in the form of extensive transformation occupying the bulk of tumor.
However clear-cell carcinoma can have signs of mesenchymal type as well (Fig. 5). Thus, according to the data of В. Lhermitte and de Leval [13] sharply increased expression of vimentin was in more than 75 % of cases in clear-cell carcinoma while pancytokeratin expression was moderately expressed in more than 75 % and highly expressed in clear-cell papillary carcinoma. It deals with the kidney histogenesis features and its mesenchymal origin.
The rate of spindle-cell epithelial-mesenchymal transition (transformation) was different depending on the duration of the patients’ survival following the operation: in case of a long-term survival the rate made up 42.1 %, in case of a short-term survival — 96.4 %. Interestingly, the differences were observed even within each group in case of a relatively slight difference in terms. Differencies were minor in the short-term survival group: in life expectancy up to 3 months following the operation, EMT occurred in 90.9 % of cases, in life expectancy up to 6 months — 100 %. In the group of long-term survival patients at term of more than 17 months the rate of EMT made up 80 %, and at term of more than 24 months — 28.6 %.
The relation between the development of spindle-cell EMT and a high degree of Furman’s nuclear atypia should be noted. It can be seen in the histologic preparations, viz. a high degree (3–4) of nuclear atypia in EMT foci and almost a complete coincidence of their rates in the short-term survival group (96.4 % and 100 %) and relatively close rate indices in the long-term survival group (42.1 % and 68.4 %). This allows to suggest that the tumor progression stage and its biological features play an important role in the development of EMT.
According to the literature [23] EMT enhances the tumor invasiveness. Taking this fact into consideration we compared the rate of vessels invasion by the presence of tumor cells in their lumen in the histologic preparations (Fig. 6) and the lymph nodes with the rate of EMT. In the short-term survival group their rate made up 53.6 %, and in the long-term survival group — only 21.1 %. Thus, there is a relation between in the EMT rate and tumor invasiveness.
One of the factors of the renal cell carcinoma prognosis is considered to be necrosis in tumor [11]. However it is not the presence of necrosis but its expansion that is thought to be important. A bad prognosis is connected with the presence of macro necroses [11]. That is why in our study we calculated separately the rate of micro and macro necroses. The rate of necrosis large areas in patients with a short-term survival after the operation made up 64.3 %, micro necroses in this group were observed in 35.4 %. In the patients with a long-term survival the rate of macro necroses made up 42.1 %, and that of micro necroses — 21 %, i.e. they occurred in a considerably lesser rate than in the short-term survival group. It especially concerned large areas of necrosis. The development of necrosis large areas is usually dealt with a vascular factor. Though EMT enhances angiogenesis in tumor activating VERG and PDGF [21], it is probably not sufficient. One cannot exclude that tumor cells invasion of vessels may be a hindrance to blood flow and be responsible for macro necroses.
Discussion
For the last 20 years there has been a pronounced tendency towards an increase in the number of renal cell carcinoma (RCC). RCC is a heterogeneous group of histologic subtypes of which clear cell carcinoma is the most frequent making up more than 70 % of all cases; papillary renal cancer makes up 10–15 %, chromophobic — 5 % [4, 24].
A loss of the tumor suppressor function which underlies the development of renal cell carcinoma results in many features of EMT, and a loss of E-cadherin expression, in particular [9]. A decrease in transcription four factors (GATAZ, TFCP2L1, TFAP2B, DMRT2) in renal cell carcinoma has been ascertained. They are important for a normal development of the kidneys that leads to the absence of epithelial differentiation, mesenchymal adipogenic transdifferentiation and the onset of pluripotent cells which are similar to mesenchymal stem cells [22].
However possessing the features of mesenchymal differentiation, renal cell carcinoma does not demonstrate such signs of EMT as altering the forms of tumor cells and acquiring a stretched fibroblastoid form characteristic of a mesenchymal phenotype. Such a reconstruction of the cytoskeleton contributes to an increase in cells mobility and their invasiveness [21].
The fibroblastoid form of the tumor cells resembling leiomyosarcoma, fibrosarcoma, angiosarcoma and other sarcomas is characteristic of the so-called carcinomatoid differentiation which can be present at any subtype of RCC and is characterized by a high degree of atypia and gross invasiveness [3, 14].
The comparison of two different cell populations in one tumor, viz. epithelial (cancer component) and mesenchymal cells allowed J. Conant et al. [5] to determine that the expression of Snail transcription factor which was responsible for EMT in many tumors [16, 17] occurred in epithelial component of RCC and to consider it to be an early stage of tumor involving EMT initiation.
In all cases of our study there was RCC with foci of highly differentiated carcinoma and the presence of nuclear degree 1–2 in 50 % of cases in the short-term survival group and 70 % of highly differentiated carcinoma cases in the long-term survival group, and the presence of Fuhrman’s nuclear degree 1–2 in 89.5 %. A high Fuhrman’s nuclear degree occurred in 100 % of the short-term survival cases and in 68.4 % of the long-term survival cases. It was considered to be the most important prognostic factor, the predictor of a relapse and metastases following the removal of kidney tumors even those of stage T1a [20]. Against this background the foci of spindle-cell carcinomas (sarcomatoid component) occurred in 96.4 % of tumors in the short-term survival group, and 42.1 % in the group of long-term survival patients.
Thus, the rate of spindle-cell (sarcomatoid) component development in our study was connected with the frequency of Fuhrman’s high nuclear degree and impacted on the survival duration of patients with RCC following nephrectomy.
Detection of this form of EMT in the kidneys in a tumor morphologic study is of great importance as its presence influences the rate of vascular invasion (53.6 % in the short-term survival group and 21.1 % in the long-term survival group) and, therefore, its prognosis.
Besides it has been ascertained that in RCC the presence of a sarcomatoid tumor (spindle-cell form of EMT) negatively influences the efficacy of the therapy employed. As a rule such forms are either resistant or low sensitive to targeted therapy, and anti-angiogenic therapy in particular [8, 15].
Taking into account the EMT principle rever–sibility in the tumor, a search for other therapy targets connected with genetic changes in the tumor cells is necessary. Nowadays such a study is being conducted both in case of renal tumors and other localizations of malignant neoplasms, viz. the lung, stomach. In a renal tumor the receptor 1 inhibitor of the transforming factor of growth (TGFbR1) SB431542 in combination with the ROCK kinase inhibitor (Rho kinase) Y27623 or P38MARK SB2035 inhibitor hinder the cytoskeleton integrity impairment and the expression of mesenchymal genes. They restore E-cadherin [6]. It suggest that a simultaneous impact is necessary on several targets for the EMT reversibility.
1. Москвина Л.В., Андреева Ю.Ю., Мальков П.Г. Прогностические факторы почечноклеточного рака // Архив патологии. — 2011. — 73(6). — 47-52.
2. Тимофеев И.В., Аксель Е.М. Почечно-клеточный рак в России в 2008 году // The journal malignant tumours (Русскоязычное издание журнала «Злокачественные опухоли»). — 2011. — 1. — 6-10.
3. Bertini R., Roscigno M., Freschi M. et al. Renal Sinus Fat Invasion in pT3a Clear Cell Renal Cell Carcinoma Affects Outcomes of Patients Without Nodal Involvement or Distant Metastases // J. Urol. — 2009 Mar 13 [Epub ahead of print].
4. Chowdhury S., Choueiri T.K. Recent advances in the systemic treatment of metastatic papillary renal cancer // Expert Rev. Anticancer Ther. — 2009. — 9. — 373-9.
5. Conant J.L., Peng Z., Evans M.F. et al. Sarcomatoid Renal cells carcinoma in an example of epithelial-mesenchymal transition // J. Clin. Pathol. — 2011. — 20. — 8-16.
6. Das S., Becker B.N., Hoffmann F.M., Mertz J.E. Complete reversal of epithelial to mesenchymal transition requires inhibition of both ZEB expression and the Rho pathway // BMC Cell Biol. — 2009 Dec 21. — 10. — 94.
7. Ferlay J., Autier P., Boniol M. et al. Estimates of the cancer incidence and mortality in Europe // Ann. Oncol. — 2006. — 18. — 581-92.
8. Golshayan A.R., George S., Heng D.Y. et al. Metastatic sarcomatoid renal cell carcinoma treated with vascular endothelial growth factor-targeted therapy // J. Clin. Oncol. — 2009. — 27. — 235-41.
9. Harten S.K., Shukla D., Barod R. et al. Regulation of renal epithelial tight junctions by von Hippel-Lindau tumor supressor gene involves occludin and claudin and is independent of E-kadherin // Mol. Biol. Cell. — 2009. — 20. — 1083-101.
10. Kallio J. Prognostic factors in renal cell carcinoma. Academic dissertation // Acta Universitatis Tamperensis. — 2004. — Vol. 5. — 43-51.
11. Klatte T., Seligson D.B., LaRochelle J. et al. Molecular signatures of localized clear cell renal cell carcinoma to predict disease-free survival after nephrectomy // Cancer Epidemiol. Biomarkers Prev. — 2009. — 18. — 894-900.
12. Leroy X., Zini L., Buob D. et al. Renal cell carcinoma with rhabdoid features: an aggressive neoplasm with overexpression of p53 // Arch. Pathol. Lab. Med. — 2007. — 131. — 102-6.
13. Lhermitte B., de Leval L. Interpretation of needle biopsies of the kidney for investigation of renal masses // Virchows Arch. — 2012. — 461. — 13-26.
14. Margulis V., McDonald M., Tamboli P. et al. Predictors of oncological outcome after resection of locally recurrent renal cell сarcinoma // J. Urol. — 2009 Mar 13 [Epub ahead of print].
15. Milella M., Felici A. Biology of Metastatic Renal Cell Carcinoma // J. Cancer. — 2011. — 2. — 369-373.
16. Nieto M.A. The snail superfamily of zinc-finger transcription factors // Nat. Rev. Mol. Cell Biol. — 2002 Mar. — 3(3). — 155-66.
17. Nieto M.A. Epithelial-Mesenchymal Transitions in development and disease: old views and new perspectives // Int. J. Dev. Biol. — 2009. — 53. — 1541-7.
18. Radisky D.C. Epithelial-mesenchymal transition // J. Cell Science. — 2005. — 118. — 4325-6.
19. Salamanca J., Nevado M., Martínez-González M.A. et al. Undifferentiated carcinoma of the jejunum with extensive rhabdoid features. Case report and review of the literature // APMIS. — 2008. — 116. — 941-6.
20. Suzuki K., Mizuno R., Mikami S. et al. Prognostic significance of high nuclear grade in patients with pathologic T1a renal cell carcinoma // Jpn. J. Clin. Oncol. — 2012. — 42. — 831-5.
21. Thierry J.P., Acloque H., Huang R.Y., Nieto M.A. Epithelial-mesenchymal transition ns in development and dise–ase // Cell. — 2009. — 139. — 871-90.
22. Tun H.W., Marlow L.A., von Roemeling C.A. et al. Pathway signature and cellular differentiation in clear cell renal cell carcinoma // PLoS One. — 2010. — 8. — 96-106.
23. Weinberg R.A. Mechanisms of malignant progression // Carcinogenesis. — 2009. — 29. — 1092-5.
24. Zhou M. Molecular targets in renal tumors: pathological assessment. Renal cell carcinoma // Humanа Press. — 2009. — 35-48.

/33/33.jpg)
/34/34.jpg)
/35/35.jpg)