Журнал «Neoplasm» 1(13) 2014
Вернуться к номеру
Альтернатива таксансодержащей химиотерапии в лечении распространенного первичного и рецидивного рака яичников
Авторы: Бондарь В.Г., Лисовская Н.Ю., Никитина О.А., Кайряк О.В., Аль-Баргути А.A., Лифарь Ю.Ю. - Донецкий областной противоопухолевый центр
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
Показатели статистики для распространенного рака яичников малоутешительны. В свете новых данных об этиологии рака яичников актуальным является поиск новых платиносодержащих схем химиотерапии. В работе проанализирована эффективность и токсичность лечения у 76 женщин с раком яичников стадий IIIС и IVС, получавших комбинированное лечение в Донецком областном противоопухолевом центре с 2008 по 2013 год. Базовая схема лечения в исследуемой группе больных (55 пациенток) — внутривенно цисплатин в суммарной дозе 75 мг/м2 (или карбоплатин AUC 5) и этопозид 120 мг/м2 с 1-го по 3-й дни, циклофосфамид эндолимфатически в дозе 200 мг/м2 в течение 4 дней. В контрольной группе (21 пациентка) — стандартная химиотерапия препаратами платины в сочетании с паклитакселом. На основании проведенного исследования сформулированы следующие выводы: альтернативная схема платиновой химиотерапии не уступает по клинической эффективности стандартной. При этом сравнение токсичности химиотерапии по количеству случаев тяжелых лейкопений свидетельствует о том, что предложенная схема лечения обладает лучшей переносимостью и при одинаковом среднем количестве курсов достигается более стойкий клинический эффект. Немаловажным с учетом длительности терапии является экономическое преимущество предложенной схемы лечения: ориентировочная стоимость одного цикла лечения оказывается в 2,5 раза ниже, чем стоимость курса стандартной химиотерапии.
Statistical data for advanced ovarian cancer is not really satisfactory. Taking into consideration new facts about etiology of ovarian cancer the search of new platinum-based chemotherapy schedules is quite urgent. The work analyzed the effectiveness and toxicity of therapy in 76 women with ovarian cancer stages IIIC and IVC, who received combination treatment in Donetsk regional antitumor centre from 2008 to 2013. The basic treatment regimen in study group of patients (55 women) — intravenous infusion of cisplatin in total dose 75 mg/m2 (or carboplastin AUC 5) and etoposide 120 mg/m2 from 1st to 3rd days, endolymphatic infusion of cyclophosphamide 200 mg/m2 for 4 days. In the control group (21 women) — standard chemotherapy with platinum agents in combination with paclitaxel. Based on this study following conclusions were made: alternative scheme of platinum-based chemotherapy is not inferior to standard one by clinical efficacy. In this, comparison of the toxicity of chemotherapy in the number of cases of severe leukopenia indicates that the proposed treatment scheme has better tolerance and at the same average number of courses we can achieve a more stable clinical effect. Important, in view of the duration of therapy, is the economic advantage of the proposed treatment regimen: the estimated cost of one cycle of treatment is 2.5 times lower than the cost of standard chemotherapy.
Показники статистики для поширеного раку яєчників маловтішні. У світлі нових даних про етіологію раку яєчників актуальним є пошук нових платиновмісних схем хіміотерапії. У роботі проаналізовано ефективність і токсичність лікування в 76 жінок із раком яєчників стадій IIIС і IVС, які отримували комбіноване лікування в Донецькому обласному протипухлинному центрі з 2008 по 2013 рік. Базова схема лікування в досліджуваній групі хворих (55 пацієнток) — внутрішньовенно цисплатин у сумарній дозі 75 мг/м2 (або карбоплатин AUC 5) і етопозид 120 мг/м2 із 1-го по 3-й дні, циклофосфамід ендолімфатично в дозі 200 мг/м2 протягом 4 днів. У контрольній групі (21 пацієнтка) — стандартна хіміотерапія препаратами платини в поєднанні з паклітакселом. На підставі проведеного дослідження сформульовано такі висновки: альтернативна схема платинової хіміотерапії не поступається за клінічною ефективністю стандартній. При цьому порівняння токсичності хіміотерапії за кількістю випадків важких лейкопеній свідчить про те, що запропонована схема лікування має кращу переносимість і при однаковій середній кількості курсів досягається більш стійкий клінічний ефект. Важливою із урахуванням тривалості терапії є економічна перевага запропонованої схеми лікування: орієнтовна вартість одного циклу лікування виявляється в 2,5 рази нижчою за вартість курсу стандартної хіміотерапії.
рак яичников, платиносодержащая химиотерапия, таксаны, этопозид.
ovarian cancer, platinum-based chemotherapy, taxanes, etoposide.
рак яєчників, платиновмісна хіміотерапія, таксани, етопозид.
Статья опубликована на с. 54-62
Введение
Злокачественные опухоли репродуктивной системы (рак молочной железы и гинекологические опухоли) являются наиболее распространенными в структуре онкологической заболеваемости женщин, и их суммарная доля превышает 35 %. При этом рак яичников составляет всего 4–6 % среди злокачественных опухолей у женщин и занимает седьмое место по частоте встречаемости. Однако при раке яичников показатели выживаемости наименее утешительны, что связано с поздней диагностикой заболевания. В большинстве индустриальных стран мира летальность больных раком яичников на первом году после установления диагноза составляет 35 %. По сводным данным популяционных раковых регистров стран Европы, однолетняя выживаемость для всей популяции больных раком яичников составляет 63 %, трехлетняя — 41 %, пятилетняя — 35 % [5]. Это означает, что, несмотря на исчезновение всех признаков заболевания, у подавляющего большинства больных в первые 2–3 года после окончания химиотерапии первой линии возникает прогрессия заболевания, в связи с чем они нуждаются в проведении химиотерапии второй линии. За последнее десятилетие отмеченное в Европе увеличение 5-летней выживаемости больных злокачественными опухолями яичников на 3 % (с 32 до 35 %), а в США — на 4 % (с 35 до 39 %) объясняется не столько улучшением диагностики, сколько эффективным применением платиновой химиотерапии в лечении диссеминированных форм рака яичников. Препараты платины применяются для лечения рака яичников в схемах полихимиотерапии в сочетании с другими химиопрепаратами, такими как паклитаксел, доцетаксел, топотекан, эндоксан, этопозид, гемцитабин. Золотым стандартом для проведения первой линии химиотерапии распространенного рака яичников считается сочетание паклитаксела с производными платины (цисплатин или карбоплатин) [16]. Однако по экономическим причинам использование этой схемы полихимиотерапии невозможно во всех случаях впервые диагностированного рака яичников. Стандарты оказания специализированной помощи онкологическим пациентам допускают применение и других платиносодержащих комбинаций, чаще всего — комбинации препаратов платины с циклофосфамидом [4]. Хотя известно, что при применении у больных с IIIС стадией рака яичников схемы СР (циклофосфан + цисплатин) после первичной циторедукции частота объективных ответов на лечение составила 65 % (полных регрессий — 31 %, частичных — 34 %), в то время как при применении схемы ТР (цисплатин + паклитаксел) частота объективных эффектов составила 73 % (полных регрессий — 51 %, частичных — 22 %), а по данным отдельных авторов, доходит до 80 % [5, 19]. То есть, учитывая полученные еще в конце 90-х годов прошлого столетия данные рандомизированных исследований о достоверно большей эффективности сочетания паклитаксела с препаратами платины в сравнении с сочетанием циклофосфамида с ними же, использование комбинаций платины только с циклофосфамидом ведет к заведомому снижению эффективности лечения и допустимо лишь при невозможности применения таксансодержащих схем по причине возможной токсичности у больных пожилого возраста и с выраженной сопутствующей патологией. Что касается химиотерапии второй линии распространенного рака яичников, то на сегодняшний день существует лишь несколько рандомизированных исследований, сравнивающих активность различных цитостатиков при проведении химиотерапии второй линии [15]. Одно из них было посвящено сравнению паклитаксела (114 больных) в дозе 175 мг/м2 и топотекана (112 больных) в дозе 1,5 мг/м2 в течение 5 дней каждые 3 недели у больных с прогрессированием после лечения цисплатиносодержащими комбинациями [8]. Частота полных регрессий при использовании топотекана была достоверно выше (20,5 и 13,2 % соответственно), однако время до прогрессирования и продолжительность жизни были одинаковыми для обоих препаратов. Частота нейтропении 4-й степени составила 7,9 и 2,3 % для топотекана и паклитаксела соответственно, что ставит под сомнение биоэквивалентность дозировок изученных препаратов. Авторы сделали вывод, что эффективность топотекана не уступает эффективности паклитаксела при проведении химиотерапии второй линии. Следует отметить, что при распространенном раке яичников использование различных лечебных приемов (внутрибрюшинная химиотерапия, гипертермическая внутрибрюшинная химиоперфузия, высокодозная химиотерапия, увеличение количества циклов адъювантной химиотерапии, облучение всей брюшной полости и малого таза) не позволяет достоверно увеличить период ремиссии [3, 5, 7].
Таким образом, актуальным и многообещающим является поиск новых платиносодержащих схем химиотерапии и способов введения химиопрепаратов [2], которые могли бы быть достойной альтернативой сочетанию таксанов и препаратов платины. Прежде чем обратиться к предложенной нами платиносодержащей комбинации, хотелось бы привести новые данные об этиологии рака яичников, которые являются своего рода обоснованием для ее использования. К настоящему времени опубликованы экспериментальные и клинические данные, подтверждающие тот факт, что около 80 % всех опухолей яичников, а именно серозные и муцинозные папиллярные опухоли, исходят анатомически из фимбриального эпителия [9–14, 18]. То есть фактически они являются не истинно яичниковыми опухолями, а опухолями фаллопиевой трубы и относятся к раку яичников так называемого 2-го типа. К опухолям 2-го типа относят высокодифференцированную серозную карциному, смешанную мезодермальную опухоль. Эта категория опухолей характеризуется генетической нестабильностью. В отличие от них опухоли 1-го типа растут медленно, теряя дифференцировку в процессе роста, но длительное время считаются пограничными и отличаются хорошим прогнозом. К этому типу относят низкодифференцированные опухоли и опухоли Бреннера. Опухоли этого типа отличаются генетической стабильностью [13]. В работах школы Kurman опубликованы данные о возможности развития серозных раков яичника из трубного эпителия, а эндометриоидных — из эндометрия [11, 12]. По их данным, полученным с помощью методов протеомного анализа, из культуры клеток секреторного эпителия маточной трубы удалось получить белки-маркеры рака яичников. Группа канадских исследователей в ходе клинических исследований и на мышиной модели в эксперименте также показали возможный механизм развития рака яичников из трубного эпителия [9]. Действительно, согласно определению ВОЗ, серозным раком яичника называется рак, гистогенетически связанный с покровом яичника и отражающий дифференцировку опухолевых клеток в сторону выстилки маточной трубы. На самых ранних стадиях морфогенеза серозного рака образуется однослойная выстилка, имеющая аналогию с трубным эпителием [11].
Одной из наиболее действенных схем химиотерапии, используемых для лечения рака фаллопиевой трубы, является комбинация препаратов платины с этопозидом [1]; эта же схема химиотерапии применяется при герминогенных опухолях яичников [6]. Учитывая вышеизложенное, мы решили использовать эту комбинацию химиопрепаратов в сочетании с эндолимфатическим введением циклофосфамида для лечения распространенного рака яичников.
Целью работы явилась сравнительная оценка эффективности таксансодержащей и альтернативной этопозидсодержащей платиновой химиотерапии в лечении первичного и рецидивного распространенного рака яичников.
Материалы и методы
Проанализирована эффективность и токсичность лечения у 76 женщин с распространенным первичным и рецидивным раком яичников (стадия процесса IIIС и IVС), получавших комбинированное лечение в Донецком областном противоопухолевом центре с 2008 по 2013 год. Анализировались результаты лечения пациенток не старше 75 лет. Все пациентки были разделены на две группы в зависимости от вида проводимой им полихимиотерапии. В исследуемую группу вошли 55 больных, которые получали химиотерапию препаратами платины с этопозидом в сочетании с эндолимфатическим введением низкой дозы циклофосфамида. Базовая схема лечения в этой группе больных — внутривенно цисплатин в суммарной дозе 75 мг/м2 (или карбоплатин AUC 5) и этопозид 120 мг/м2 с 1-го по 3-й дни; циклофосфамид вводили эндолимфатически в дозе 200 мг/м2 в течение 4 дней. В контрольную группу были включены больные (21), получавшие стандартную химиотерапию препаратами платины в сочетании с паклитакселом (цисплатин в суммарной дозе 75 мг/м2 (или карбоплатин AUC 5) и паклитаксел 175 мг/м2 в 1-й день). Проведен ретроспективный анализ историй болезни пациенток по следующим параметрам: возраст, стадия опухолевого процесса на момент установления диагноза, наличие морфологического подтверждения, гистологическая форма опухоли. Проанализирована клиническая эффективность лечения согласно рекомендациям ВОЗ: перед началом лечения и впоследствии каждые 6 недель проводилась оценка опухоли по критериям RECIST. Оценка токсичности химиотерапии произведена по шкале NCIC-CTC (версия 4). Помимо непосредственной клинической эффективности проведено сравнение исследуемой и контрольной групп по стойкости достигнутого эффекта — длительности безрецидивного периода и продолжительности частичной регрессии. Фактическую продолжительность жизни в изучаемых группах не оценивали по той причине, что пациентки в случае прогрессии заболевания получали еще третью и более линии терапии и многие из них живы к моменту анализа результатов исследования.
Результаты
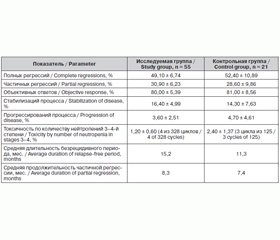
Средний возраст пациенток в исследуемой группе составил 51,5 года, в контрольной — 53,7 года. Во всех случаях до начала лечения диагноз был подтвержден морфологически. Среди гистологических форм опухолей в обеих группах преобладал папиллярный серозный или муцинозный рак — 70,8 % в исследуемой группе и 61,9 % в контрольной; у 21,9 % больных исследуемой группы и у 28,6 % пациенток контрольной диагностирован недифференцированный рак; эндометриоидные формы опухолей диагностированы у 7,3 % больных основной и у 9,5 % контрольной группы. Следует отметить, что распространение опухоли на фаллопиеву трубу зарегистрировано лишь в 12,7 % случаев в исследуемой группе и в 14,3 % случаев в контрольной, что может свидетельствовать о том, что маточные трубы при установленном опухолевом процессе в яичниках не являются объектом пристального изучения для морфологов. III исходная стадия процесса была у пациентов исследуемой группы в 81,9 % случаев, контрольной — в 85,7 % случаев; IV стадия — у 18,1 и 14,3 % пациентов соответственно. На момент начала терапии у всех пациенток был распространенный опухолевый процесс III или IV стадии (T3c N0-1 M0-1). При этом первую линию терапии получали 65,5 % больных исследуемой и 76,2 % контрольной группы; вторую линию терапии в связи с прогрессированием болезни получали соответственно 34,5 и 23,8 % пациенток в изучаемых группах. Всего пациенткам проведено от 3 до 12 курсов химиотерапии (в среднем 6 курсов): в исследуемой группе — 328 курсов химиотерапии, в контрольной группе — 125 курсов химиотерапии. Клиническая характеристика сравниваемых групп представлена в табл. 1.
Таким образом, по основным клиническим признакам (средний возраст больных, стадия процесса, гистологическая форма опухолей) исследуемая и контрольная группа достоверно не различались, что позволило провести их сравнение по параметрам клинической эффективности лечения. Сравнительный анализ клинической эффективности и токсичности химиотерапии в исследуемой и контрольной группах представлен в табл. 2.
Клиническая эффективность химиотерапии, оцененная по количеству объективных ответов на лечение, составила в исследуемой группе 80 % (полных регрессий — 49,1 %, частичных регрессий — 30,9 %), в 16,4 % случаев отмечена стабилизация процесса и в 3,6 % — прогрессирование. В контрольной группе аналогичные показатели составили: объективных ответов на лечение — 81 % (полных регрессий — 52,4 %, частичных регрессий — 28,6 %), в 14,3 % случаев отмечена стабилизация процесса и в 4,7 % — прогрессирование. Для пациенток, получавших первым этапом лечения неоадъювантную химиотерапию с последующей операцией, клиническую оценку эффективности химиотерапии проводили на дооперационном этапе. У одной из пациенток исследуемой группы зарегистрирована полная морфологическая регрессия, подтвержденная данными послеоперационного гистологического исследования. То есть использование альтернативной этопозидсодержащей платиновой химиотерапии в лечении первичного и рецидивного распространенного рака яичников позволило добиться объективного эффекта у 80 % больных, что сравнимо по эффективности со стандартной таксансодержащей химиотерапией (81 % объективных ответов на лечение в контрольной группе), а также сопоставимо с имеющимися в литературе данными об эффективности комбинации препаратов платины с паклитакселом [5, 16]. Гематологическая токсичность 3–4-й степени, требующая назначения гемопоэтических колониестимулирующих факторов, отмечена в 1,2 % случаев (4 цикла из 328) в исследуемой группе и в 2,4 % случаев в контрольной группе (3 цикла из 125). Более низкая токсичность этопозидсодержащей платиновой терапии, очевидно, связана с более низкой гематологической токсичностью этопозида по сравнению с паклитакселом [17].
Средняя длительность безрецидивного периода в случае достигнутой полной регрессии у пациентов исследуемой группы составила 15,2 месяца, в контрольной группе этот показатель составил 11,3 месяца. Продолжительность частичной регрессии у пациентов с достигнутым частичным ответом в исследуемой группе составил 8,3 месяца, аналогичный показатель в контрольной группе — 7,4 месяца. Сравнительная оценка длительности достигнутого эффекта показала, что при применении этопозидсодержащей платиновой химиотерапии длительность полной регрессии была значительно больше, чем таковая в результате использования стандартной таксансодержащей схемы лечения. Более продолжительный клинический эффект, достигнутый путем применения исследуемой схемы химимиотерапии при одинаковом среднем количестве курсов, наиболее вероятно свидетельствует о более стойком туморостатическом действии этой комбинации цитостатиков, что, в свою очередь, связано с их механизмом действия. Препараты платины (одинаковый компонент обеих изучаемых схем химиотерапии) являются алкилирующими агентами, избирательно воздействующими на ДНК в независимости от фазы клеточного цикла. Хотя этопозид так же, как и таксаны, относится к препаратам растительного происхождения, он не действует на клетки в фазе митоза — его объектом является ДНК в синтетической фазе. Причем этопозид воздействует на пространственную структуру ДНК, ингибируя активность фермента топоизомеразы II, и тем самым нарушает процесс репликации, препятствуя синтезу и восстановлению ДНК. Кроме того, для этопозида известен терапевтический синергизм при сочетании его с цисплатином и циклофосфамидом, что в совокупности с указанными выше свойствами объясняет повышение во многих случаях эффективности цитостатика при использовании в клинике в программах комбинированной химиотерапии [6]. Если учесть более низкую токсичность этопозидсодержащей химиотерапии в сравнении с таксансодержащей, оцененную по количеству тяжелых лейкопенических реакций, можно предположить также более щадящее действие предложенной схемы лечения на состояние костномозговых резервов пациенток в ходе проведения им многокурсовой химиотерапии. Хотя различия между группами по показателям стойкости эффекта и выраженности побочных реакций недостоверны, можно отметить тенденцию к улучшению этих показателей в исследуемой группе.
Нельзя не принимать во внимание экономическую сторону альтернативного использования этопозидсодержащей схемы химиотерапии, поскольку ориентировочная стоимость одного цикла лечения оказывается в 2,5 раза меньше, чем курса таксансодержащей химиотерапии. Экономические преимущества становятся еще более ощутимыми при сравнении стоимости полного курса лечения, включающего шесть циклов химиотерапии.
Выводы
Таким образом, на основании проведенного исследования можно сформулировать следующие выводы:
1. Альтернативная этопозидсодержащая схема платиновой химиотерапии распространенного рака яичников не уступает по клинической эффективности стандартной таксансодержащей схеме в лечении этой локализации рака. При этом сравнение токсичности химиотерапии по количеству тяжелых лейкопений свидетельствует о том, что предложенная схема лечения при сопоставимой эффективности обладает лучшей переносимостью.
2. При применении этопозидсодержащей схемы платиновой химимиотерапии для лечения распространенного рака яичников при одинаковом среднем количестве курсов достигается более стойкий клинический эффект, что отражают значительно большая продолжительность безрецидивного периода у больных с достигнутой полной регрессией заболевания.
3. Немаловажным является экономическое преимущество использования этопозидсодержащей платиновой химиотерапии по сравнению со стандартной таксансодержащей, поскольку терапия распространенного рака яичника чаще всего является длительной.
Предварительная оценка эффективности альтернативной таксансодержащей схемы лечения распространенного рака яичников с использованием комбинации этопозида с препаратами платины и эндолимфатическим введением низкой дозы циклофосфамида показала хорошие результаты, однако требует проведения рандомизированного исследования для достоверной оценки возможности ее применения в широкой клинической практике.
Alterative for Taxane-Based Chemotherapy in the Treatment of Advanced Primary and Recurrent Ovarian Cancer
Introduction
Gynecological malignancies of reproductive system such as mammary gland cancer and gynecological tumors are generally spread among women suffering from female disorders, whose total quantity exceeds 35 %. Ovarian cancer averages from 4 to 6 % among female malignant tumors and ranks the seventh place in their frequency. However, survival outcomes among women with ovarian cancer are very rare what is connected with late diagnostics of a disease. Lethality among patients with ovarian cancer in the first year after being diagnosed averages 35 % in many industrial countries. According to summary data of population cancer registers in European countries the one-year survivability among all patients with ovarian cancer for the whole population averages 63 %, three-year survivability — 41 %, and five-year — 35 % [5]. Despite of the fact, that after the first-line chemotherapy all symptoms of ovarian cancer disappeared, an overwhelming majority of patients suffers from disease progression in two or three years and requires the second-line chemotherapy. It should be noted that five-year survivability among patients with ovarian cancer has grown from 32 to 35 % in Europe and from 35 to 39 % in the USA over the last ten years. It is connected with an effective use of platinum chemotherapy in treatment of disseminating types of ovarian cancer rather than with better diagnostics of a disease. Platinum agents are used to treat ovarian cancer with polychemotherapeutic schedules in combination with other ones such as paclitaxel, docetaxel, topotecan, endoxan, etoposide, gemcitabine. Gold standard for the first-line chemotherapy of advanced ovarian cancer is a combination of paclitaxel with derivatives of platinum agents (cisplatin or carboplatin) [16]. However, for some economic reasons, the usage of this poly-chemothe–rapeutic schedule is impossible in all the cases when ovarian cancer is first diagnosed. To aid patients with ovarian cancer it is permitted to use other platinum-based regimens, where the combination of platinum with cyclophosphamide is more common among them [4]. It is known that, when patients with stage III ovarian cancer, who have the primary cytoreduction, use the CP schedule (cyclophosphamide plus cisplatin), the frequency of objective reactions to the treatment accounts 65 %, complete regressions — 31 %, incomplete — 34 %, at the same time the TP schedule (cisplatin plus paclitaxel) gives 73, 51 and 22 %, respectively, and according to other authors this effectiveness grows up to 80 % [5, 19]. According to randomized trials data of 1990s a combination of platinum agents with paclitaxel is more effective than with cyclophosphamide. So it is a known fact that an effectiveness of a treatment will decrease under using combinations of platinum agents with cyclophosphamide. It is only recommended for patients who have possible age-related toxicity and evident concomitant diseases, as in those cases taxane-based schedules are unacceptable. As for second-line chemotherapy of advanced ovarian cancer today there are only a few randomized trials. They compare activity of various cytostatic agents [15]. In one of these trials paclitaxel dosed 175 mg/m2 (114 patients) was compared with topotecan dosed 1.5 mg/m2 (112 patients) during 5 days every 21 days for patients with disease progression under a treatment with cisplatin-based combinations [8]. When women were treated with topotecan the frequency of complete regressions was higher, 20.5 and 13.2 % respectively, yet periods before disease progressions and life spans were the same in both cases. A frequency of neutropenia stage IV averages 7.9 and 2.3 % for topotecan and paclitaxel, respectively; so there are some reasons to doubt bioequivalence of their dose-dense. So the authors concluded that in second-line chemotherapy an effectiveness of topotecan is not worse than of paclitaxel. It should be noted that the variety of treatment options for patients with advanced epithelial ovarian cancer, such as intraperitoneal chemotherapy, hyperthermic intraperitoneal chemoperfusion, irradiation of peritoneal cavity and a pelvis, does not allow the period of remission to increase [3, 5, 7].
So it is crucial to search for new platinum-based regimens and new methods of chemotherapy drug infusion [2] to compete with a combination of taxanes and platinum agents. Before addressing to the suggested combination it is necessary to demonstrate new findings about etiology of ovarian cancer to ground the usage of it. Today experimental and clinical findings are published. They confirm that 80 % of all ovarian tumors, as serous and mucinous papillary ones, anatomically come from fimbrial epithelium [9–14, 18]. Actually they are not authentic ovarian tumors but the fallopian tubes tumors and relate to so called type II. Among type II tumors there is highly-differentiated serous carcinoma and mixed mesodermal tumor. This group of tumors is genetically unstable. Tumors type I as opposed to tumors type II grow slowly and lose differentiation in this process. They are considered to stay in border-line condition for a long time and have good prognosis. Low-differentiated tumors and Brenner’s tumors are of type I. Tumors of this type are genetically unstable [13]. In researching works of the Kurman school the data about a possibility of developing of serous ovarian cancer from tubal epithelium and endometrioid cancer from endometrium is published [11, 12]. They made proteomic analysis and got the following results. They were succeeded to get protein-markers of ovarian cancer from cell culture of secretory epithelium in a uterine tube.
The group of Canadian researches having a clinical study and using an experimental mouse showed possible ovarian cancer behavior, growing from tubal epithelium. According to WHO a serous ovarian cancer is that one which is histogenetically related to ovarian integument and showing tumor cells differentiation to the uterine tube lining. The single layer lining analogical to tubal epithelium forms on the earliest stages of morphogenesis of serous cancer [11].
One of the most effective chemotherapy schedules in treatment of the fallopian tubes cancer is a combination of platinum agents with etoposide [1]. The same chemotherapy schedule is used to treat germ cell ovarian tumors [6]. Subject to the foregoing, we decided to use this combination of chemotherapy drugs with endolymphatic infusion of cyclophosphamide to treat an advanced ovarian cancer.
The object of the research is the comparative analysis of effectiveness taxane-based and alternative etoposide-based platinum chemotherapy in the treatment of primary and recurrent advanced ovarian cancer.
Materials and Methods
Studies done in Donetsk regional antitumor center from 2008 to 2013 include the analysis of effectiveness and toxicity of treatment in 76 female patients who received systemic therapy as having advanced primary and recurrent ovarian cancer (disease stages IIIC and IVC). The results of treatment of women under 75 were under the study. All the patients were divided into two groups depending on using the type of polychemotherapy. In group of patient under study there were 55 women who received chemotherapy with platinum agents and etoposide combined with endolymphatic introduction of low-dose cyclophosphamide. The basic treatment schedule for patients in this group is cisplatin intravenously totally dosed 75 mg/m2 (or carboplatin AUC 5) and etoposide dosed 120 mg/m2 from 1st to 3rd days, and endolymphatic introduction of cyclophosphamide dosed 200 mg/m2 in the course of 4 days. In control group there were 21 patients who received standard chemotherapy with platinum agents combined with paclitaxel (cisplatin totally dosed 75 mg/m2 (or carboplatin AUC 5) and paclitaxel 175 mg/m2 on day1. The retrospective analysis of medical reports was done according to following parameters as age, stage of tumor process for the moment a disease being diagnosed, morphologic confirmation and histological tumor type. Clinical effectiveness of treatment was analyzed in accordance with WHO recommendations, so tumors were assessed under RECIST criteria before the treatment and every 6 weeks during it. Toxicity assessment of chemotherapy was done under NCIC-CTC scale (version 4). Besides direct clinical effectiveness study and control groups were compared to see the stability of the effects being achieved those as duration of relapse-free and partial regression terms. Actual patients’ life spans in both groups were not under the study because in cases of disease progression they received third-line and more chemotherapy, and many of them are alive for the moment study results being analyzed.
Results
Average patients’ age was about 51.5 and 53.7 in study and control groups, respectively. In all cases before the treatment diagnosis was confirmed. As for histological tumor types papillary serous cancer and mucinous cancer were prevalent in both groups, 70.8 % in study group and 61.9 % in control group. Undifferentiated cancer was diagnosed in 21.9 % of patients in group of patient under study and 28.6 % in control group. Endometrioid tumors were diagnosed in 7.3 % of patients in study group and 9.5 % in control group. It should be noted that tumor spreading to the fallopian tubes was only recorded in 12.7 % of cases in study group and 14.3 % in control group, what might concern that uterine tubes with tumor process in ovary being diagnosed are not under morphologists’ attention. Initial stage of tumor process was stage III in 81.9 % of cases among the patients in group of patient under study and in 85.7 % of cases in control group, stage IV in 18.1 % and 14.3 % among the patients, respectively. At the beginning of therapy all the patients had advanced tumor process: stage III or stage IV (T3c N0-1 M0-1). Herewith 65.5 % of patients in study group and 76.2 % in control group received first-line therapy, 34.5 % and 23.8 % of patients in both groups, respectively, received second-line therapy because of disease progression. In whole the patients received from 3 to 12 courses of chemotherapy (on average 6 courses): 328 courses of chemotherapy in study group and 125 courses in control group. For clinical characteristics of both groups see Table 1.
So in accordance of main clinical features (the average age of patients, stage of tumor process and histological tumor structures) study and control groups were not different. This fact enabled to compare the parameters of clinical treatment effectiveness in both groups. For comparative analysis of clinical effectiveness and toxicity of chemotherapy in both groups see Table 2.
Clinical effectiveness of chemotherapy assessed on number of objective reactions to treatment accounted 80 % in group of patient under study (complete regressions — 49.1 %, partial regressions — 30.9 %), in 16.4 % of cases stabilization of process and in 3.6 % of cases disease progression was registered. Similar data in control group were the following: objective reactions to treatment accounted 81 % (complete regressions — 52.4 %, partial regressions — 28.6 %), in 14.3 % of cases stabilization of process and in 4.7 % of cases disease progression was registered. The clinical analysis of chemotherapy effectiveness in the patients received neoadjuvant chemotherapy on the first stage of treatment with further surgery was done before they were operated. One of the patients in study group had complete morphologic regression and it was confirmed with the data of post operational histological study. So 80 % of patients achieved objective effects by application of alternative etoposide-based platinum chemotherapy in treatment of primary and recurrent advanced ovarian cancer, what is compared in its effectiveness with standard taxane-based chemotherapy (81 % objective reactions to treatment in control group), and it is also comparable with available in other literature sources facts about effectiveness of combinations platinum agents with paclitaxel [5, 16]. Hematologic toxicity grade 3–4, requiring application of hemopoietic colony-stimulating factors, was recorded in 1.2 % of cases (4 of 328 cycles) in study group and in 2.4 % of cases (3 of 125 cycles) in control group. Less toxicity of etoposide-based containing platinum therapy obviously depends on less hematologic toxicity of etoposide in comparison to paclitaxel [17].
An average duration of relapse-free period with achieved complete regression among patients was 15.2 months in group of patient under study and 11.3 months in control group. The duration of partial regressions with achieved partial reactions to the treatment was 8.3 months in study group and 7.4 months in control group. Comparative analysis of durations showed that complete regression was much more effective under etoposide-based platinum chemotherapy than under standard taxane-based treatment schedule. Testing chemotherapy schedule gives more long clinical effectiveness having similar number of courses. This probably indicates of more stable tumor static effect under this combination of cytostatics and their features, respectively. Platinum agents (the similar components in both studying chemotherapy schedules) are alkylating agents which have selective influence on DNA in any of cell cycle phases. Etoposide like taxanes is a phytogenous agent and it also influences DNA but in synthetic phase, not in mitosis phase. It should be noted that etoposide influences space DNA structure inhibiting topoisomerase II, breaking replication process, so preventing synthesis and rebuilding of DNA. Moreover therapeutic synergism is known for etoposide in combination with cisplatin plus cyclophosphamide. This makes reasonable the growth of effectiveness of cytostatic in number of cases using in combined chemotherapy schedules in clinics [6]. Toxicity of etoposide-based chemotherapy is less than taxane-based. This conclusion was made assessing the amount of serious leukopenic reactions. Considering that we can suppose that suggested therapy schedule will not be very harmful for patients’ bone-marrow reserves after several courses of chemotherapy. Though the differences in stability of effects rate and intensity of side reactions are not reliable, we can note the tendency of better results in study group.
It is impossible not to take into account an economic side of using etoposide-based chemotherapy, because tentative price of one cycle treatment is 2.5 times cheaper than taxane-based chemotherapy.
Conclusions
1. Alternative etoposide-based schedule of platinum chemotherapy in treatment of advanced ovarian cancer is not inferior in clinical effectiveness than standard taxane-based schedule in treatment of this cancer localization. If we compare toxicity of chemotherapy assessing an amount of serious leukopenia we concern suggested therapy schedule is more tolerant.
2. Application of etoposide-based schedule of platinum chemotherapy in treatment of advanced ovarian cancer gives more stable clinical effectiveness on average getting the same amount of courses. We can observe this in increasing of free-relapsing period in patients with complete disease regression.
3. There is of no small importance that application of etoposide-based schedule of platinum chemotherapy as compared with standard taxane-based schedule has the advantage of cheapness, as therapy of ovarian cancer is often long-term.
Tentative assessment of effectiveness of alternative taxane-based therapy schedule of advanced ovarian cancer using combination of etoposide and platinum agents and endolymphatic introduction of low-dosed cyclophosphamide has showed good results. However randomized trials are required to assess the chances of its application in general clinical practice.
1. Красиленко Д.Н., Воробьева Л.И. и соавт. Результаты применения различных схем адъювантной химиотерапии в комплексном лечении больных с первичным раком фаллопиевой трубы // Онкология. — 2003. — Т. 5.1. — С. 46–48.
2. Лисовская Н.Ю., Гандера В.Ф., Кайряк О.В., Никитина О.А. Эндолимфатическая химиотерапия распространенного рака яичников // Архив эксперим. и клинич. медицины. — 2005. — Т. 14, № 2. — С. 183–186.
3. Осинский Д.С., Бежар А., Черный В.А. и др. Внутрибрюшная химиогипертермическая перфузия и циторедуктивная операция в лечении больных карциноматозом брюшной полости // Онкология. — 2003. — Т. 5, № 1. — С. 55–62.
4. Стандарти діагностики і лікування онкологічних хворих. Затверджено наказом Міністерства охорони здоров’я України «Про затвердження протоколів надання медичної допомоги за спеціальністю онкологія» від 17.09.2007 № 554.
5. Урманчеева А.Ф. Лекарственная терапия рецидивирующего рака яичников (обзор литературы) // Сибирский онкологический журнал. — 2010. — № 3 (39). — С. 28–33.
6. Чу Э., Де Вита-младший В. Химиотерапия злокачественных новообразований: Перевод с англ. — М.: Практика, 2008. — 448 с.
7. Fagotti A., Vizzielli G., Tortorella L., Costantini B., Petrillo M. et al. Hipec role in ovarian cancer // International Journal of Gynecological Cancer. — 2013 October. — Vol. 23, Issue 8, Supplement 1. — P. 16.
8. Hoskins P., Vergote I., Cervantes A. et al. Advanced ovarian cancer: phase III randomized study of sequential cisplatin-topotecan and carboplatin-paclitaxel vs. carboplatin-paclitaxel // J. Natl. Cancer. Inst. — 2010. — 102. — Р. 1547–56.
9. Huntsman D. Ovarian cancer origins — latest insights and implications pathogenesis of other ovarian carcinomas (type-1) and implications for ovarian cancer control // International Journal of Gynecological Cancer. — 2013 October. — Vol. 23, Issue 8, Supplement 1. — P. 45.
10. Kim J., Coffey D.M., Creighton C.J., Zhifeng Yu, Hawkins S.M., Matzuk M.M. High-grade serous ovarian cancer arises from fallopian tube in a mouse model // Proceedings of the National Academy of Sciences. — 2012. — Vol. 109, № 10. — Р. 3921–3926.
11. Kuhn E., Shih I.M., Ayhan A., Kurman R.J. Ovarian Brenner tumour: A morphologic and immunohistochemical analysis suggesting an origin from fallopian tube epithelium // European journal of cancer. — 2013. — 49 (18). — Р. 3839–49.
12. Kurman R.J., Shih I.M. The origin and pathogenesis of epithelial ovarian cancer: A prоposed unifying theory // Am. J. Surg. Pathol. — 2010. — № 34. — Р. 433–443.
13. Leary A., Pautier P., Tazi Y., Morice P., Duvillard P., Gouy S. et al. The molecular biology of epithelial ovarian cancer // Bull. Cancer. — 2012. — 99 (12). — P. 1161–73.
14. Levanon K., Crum C., Drapkin R. New Insights into the Pathogenesis of Serous Ovarian Cancer and its Clinical Impact // J. of Clinical Oncology. — 2008. — Vol. 26, № 32. — Р. 5284–5293.
15. Lorusso D. Ovarian cancer state-of-the art and new options in the treatment of relapse within a year after 1-st line // International Journal of Gynecological Cancer. — 2013 October. — Vol. 23, Issue 8, Supplement 1. — P. 21.
16. Marth C., Zeimet A.G. Ovarian cancer 1–st line treatment (surgery and systemic therapy) — state of the art // International Journal of Gynecological Cancer. — 2013 October. — Vol. 23, Issue 8, Supplement 1. — P. 2013.
17. Nilufer J.S., Zhi D., Yalan W. Taxanes: Promising Antiсancer Drugs // Asian Pacific Journal of Cancer Prevention. — 2011. — Vol. 12. — P. 837–851.
18. Tone A.A., Salvador S., Finlayson S.J., Tinker A.V. et al. The Role of the Fallopian Tube in Ovarian Cancer // Clinical Advances in Hematology and Oncology. — 2012 May. — Volume 10, Issue 5. — P. 296–306.
19. Schink C. Management of advanced ovarian cancer // The American perspective. — 1998.

/58/58.jpg)
/59/59.jpg)