Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Новый маркер раннего ремоделирования сердца у больных острым инфарктом миокарда с элевацией сегмента ST
Авторы: Пархоменко А.Н., Лутай Я.М., Степура А.А., Иркин О.И. - Отдел реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины, г. Киев
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний, Кардиология
Разделы: Клинические исследования
Версия для печати
В исследовании проведена оценка показателей деформации миокарда левого желудочка (ЛЖ) для выявления больных с высоким риском развития ранней постинфарктной дилатации ЛЖ. Обследовано 76 больных с первым острым Q-инфарктом миокарда в первые 24 часа от развития симптоматики заболевания. Показатели продольной, радиальной и циркулярной деформации ЛЖ оценивали с помощью спекл-трекинг-эхокардиографии. Раннюю постинфарктную дилатацию полости ЛЖ (увеличение конечно-диастолического объема на 15 % и более) диагностировали у 21 (27,6 %) пациента. Эта категория больных уже в первые сутки заболевания имела нарушение циркулярной функции ЛЖ, однако по показателям продольной и радиальной деформации не отличалась от пациентов без патологического ремоделирования. Значение циркулярной деформации > –11,0 % с чувствительностью 78,3 % и специфичностью 73,1 % было предиктором раннего патологического ремоделирования ЛЖ. По показателям продольной деформации ЛЖ выявляли больных с высокой вероятностью развития острой сердечной недостаточности в госпитальном периоде заболевания.
У дослідженні проведена оцінка показників деформації міокарда лiвого шлуночка (ЛШ) для виявлення хворих із високим ризиком розвитку ранньої післяінфарктної дилатації ЛШ. Обстежені 76 хворих із першим гострим Q-інфарктом міокарда в перші 24 години від розвитку симптоматики захворювання. Показники поздовжньої, радіальної та циркулярної деформації ЛШ оцінювали за допомогою методики спекл-трекінг-ехокардіографії. Ранню постінфарктну дилатацію порожнини ЛШ (збільшення кінцево-діастолічного об’єму на 15 % та більше) діагностували у 21 (27,6 %) пацієнта. Ця категорія хворих уже в першу добу захворювання мала порушення циркулярної функцiї ЛШ, утім за показниками поздовжньої та радіальної деформацiї не відрізнялася від пацiєнтiв без патологічного ремоделювання. Значення циркулярної деформації > –11,0 % з чутливістю 78,3 % та специфічністю 73,1 % було предиктором раннього патологічного ремоделювання ЛШ. За показниками поздовжньої деформації ЛШ виявляли хворих із високою ймовірністю розвитку гострої серцевої недостатності в госпітальному періоді захворювання.
The study evaluated the parameters of myocardial deformation of the left ventricle (LV) to identify patients at high risk of early post-infarction LV dilation. We examined 76 patients with a first acute Q myocardial infarction within the first 24 hours of developing symptoms of the disease. Indicators of longitudinal, radial and circular LV deformation were evaluated using speckle-tracking echocardiography. Early post-infarction LV cavity dilation (increase in end-diastolic volume by 15 % or more) was diagnosed in 21 (27.6 %) patients. This category of patients already in the first day of the disease had a violation of the circular LV function, but in terms of the longitudinal and radial strain did not differ from patients without pathological remodeling. The value of the circular deformation > –11.0 % with a sensitivity of 78.3 % and specificity of 73.1% was a predictor of early pathologic LV remodeling. Using LV longitudinal strain parameters we identified patients with a high probability of acute heart failure in the hospital period of the disease.
спекл-трекинг-эхокардиография, деформация ЛЖ, острый инфаркт миокарда, ранняя постинфарктная дилатация ЛЖ, острая сердечная недостаточность.
спекл-трекінг-ехокардіографія, деформація ЛШ, гострий інфаркт міокарда, рання постінфарктна дилатація ЛШ, гостра серцева недостатність.
speckle-tracking echocardiography, left ventricular deformation, acute myocardial infarction, strain, early post-stroke dilatation of the left ventricle, acute heart failure.
Статья опубликована на с. 11-18
Спекл-трекинг-эхокардиография — это новая методика визуализации, которая позволяет отследить движение каждой точки миокарда во время систолы и дает представление о глобальной и сегментарной кинетике миокарда [1–3]. Известно, что разные точки миокарда движутся с различной скоростью и в различных направлениях. При этом они изменяют свое положение не только в пространстве, но и относительно друг друга. Данный феномен получил название деформации миокарда (от англ. strain). Деформация, как и кинетика, в настоящее время может быть оценена количественно. Величина деформации — показатель, который характеризует степень удлинения/укорочения сегмента миокарда в систолу по отношению к его конечно-диастолическому размеру. Он выражается в процентах и определяется по формуле: (КДРс – КСРс) / КДРс x 100 %, где КДРс — конечно-диастолический размер сегмента миокарда, КСРс — конечно-систолический размер сегмента миокарда. Скорость деформации отражает скорость изменений деформации во времени (измеряется в с–1) [4, 5].
При двухмерной эхокардиографии показатели деформации определяются в продольной (от верхушки до основания), радиальной (по радиусу к центру) и циркулярной (вдоль по периметру окружности) плоскостях. При сокращении происходит утолщение миокарда по радиусу, однако его размеры в продольном направлении и вдоль окружности уменьшаются (рис. 1), поэтому радиальная деформация в норме имеет положительное, а продольная и циркулярная — отрицательное значение [5–8]. Дополнительной характеристикой процесса сокращения сердца являются показатели вращения миокарда (торсия). Во время систолы за счет сокращения спиральных мышечных волокон верхушка сердца совершает вращательное движение по часовой стрелке, а основание — против часовой стрелки. За счет упругоэластических свойств в раннюю диастолу происходит раскручивание миокарда, что обеспечивает «присасывающий» эффект во время фазы пассивного наполнения левого желудочка (ЛЖ). Скручивание (twisting) и раскручивание (untwisting) миокарда играют важную роль в обеспечении нормальной диастолической функции ЛЖ [9–11].
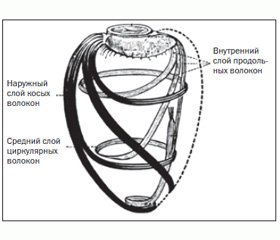
Сложная геометрия движения стенок миокарда (в нескольких плоскостях) во время систолы обеспечивается за счет различного направления мышечных волокон (рис. 2).
/12/12.jpg)
Всего в желудочках различают 3 слоя мышц: поверхностный (наружный) и глубокий (внутренний) — общие для обоих желудочков, а средний (круговой) слой — отдельный для каждого желудочка [12]. Волокна поверхностного слоя имеют диагональное направление, начинаются от фиброзных колец и спускаются к верхушке сердца, загибаются и переходят в глубокий продольный слой. Средний циркулярный слой является продолжением волокон как наружного, так и глубокого слоя.
Проведенные исследования показали, что нарушения продольной функции ЛЖ происходят на ранних этапах повреждения сердца, еще до развития систолической дисфункции ЛЖ и появления клинической симптоматики. В то же время циркулярная функция остается относительно сохраненной в течение длительного времени и компенсирует сократительную способность ЛЖ [13–16]. В литературе имеются единичные публикации относительно диагностического и прогностического значения показателей деформации миокарда у больных с острым инфарктом миокарда (ОИМ) в ранние сроки заболевания.
Целью настоящего исследования было изучение параметров продольной, радиальной и циркулярной деформации ЛЖ для оценки развития ранней постинфарктной дилатации и острой сердечной недостаточности у больных ОИМ с зубцом Q.
Материалы и методы
Критериями включения больных в исследование были: первый Q-инфаркт миокарда, синусовый ритм сердца, первые 24 часа от развития симптоматики заболевания, согласие больного на участие в исследовании. В обследование не включали больных со значимыми нарушениями сердечного ритма, клапанными поражениями сердца, другими ранее перенесенными заболеваниями сердечной мышцы (кардиомиопатии, миокардит, амилоидоз и др.). Все пациенты подписывали информированное согласие.
Всего обследовано 90 больных ОИМ, которые поступили в отдел реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии имени акад. Н.Д. Стражеско» с января по декабрь 2011 года и отвечали критериям включения. После проведения первого ультразвукового исследования 14 (15,6 %) пациентов были исключены из последующего анализа ввиду плохой эхокардиографической визуализации хотя бы в одной из трех стандартных апикальных позиций или в позиции по короткой оси на уровне папиллярных мышц, что затрудняло бы последующую оценку показателей деформации ЛЖ. Таким образом, окончательный анализ проводился у 76 больных с острым первым Q-инфарктом миокарда. Основные клинико-анамнестические характеристики включенных в исследование больных представлены в табл. 1.
Обращает на себя внимание большое количество молодых мужчин с передней локализацией инфаркта миокарда, включенных в исследование, что характеризует категорию пациентов, которых госпитализируют в наш центр для проведения реперфузионной терапии. Реперфузионная терапия проведена примерно у 75 % больных, а основным методом реваскуляризации была первичная ангиопластика со стентированием. Пожилой возраст, женский пол и курение были основными факторами, которые затрудняли визуализацию при проведении эхокардиографии и поэтому достоверно чаще встречались у больных, исключенных из исследования. Сопутствующая медикаментозная терапия проводилась в соответствии с существующими рекомендациями: ингибиторы АПФ получали 92,1 % пациентов, бета-блокаторы — 98,7 %, статины — 100 %, антитромбоцитарные препараты (аспирин с клопидогрелем) — 100 %, антикоагулянты — 100 %. Антагонисты альдостерона применялись у 40 (47,4 %) больных по стандартным показаниям.
Всем больным проводилось эхокардиографическое исследование на ультразвуковом сканере Imagic Agile (Kontron Medical, Франция) в первые сутки (в среднем через 14,6 ± 1,4 ч от развития первых симптомов ОИМ или в течение примерно 10 часов от госпитализации в стационар) и на 7–10-е (в среднем — на 8-е) сутки госпитального периода. Эхокардиографию выполняли по стандартной методике, включающей 2D-режим, М-режим и допплерографию. Объемы ЛЖ и фракция выброса (ФВ) ЛЖ рассчитывались по методу Симпсона в 2 плоскостях [17, 18]. Изучение диастолических свойств миокарда проводилось на основании характеристик трансмитрального кровотока при наполнении ЛЖ и тканевого допплеровского сканирования. Оценивались соотношение максимальной скорости волны раннего диастолического наполнения и максимальная скорость волны позднего диастолического наполнения (Е/А), время замедления раннедиастолического трансмитрального кровотока (DT), а также скорость раннего диастолического движения латерального края кольца митрального клапана (Е’), соотношение Е/Е’.
Основные эхокардиографические показатели представлены в табл. 2.
В динамике наблюдения отмечено ожидаемое увеличение конечно-диастолического объема (КДО) ЛЖ, умеренное увеличение ФВ и улучшение диастолических свойств ЛЖ к 8-м суткам заболевания.
Эхокардиографические петли, записанные параллельно с ЭКГ на 1-е сутки, сохраняли в электронном виде и в последующем анализировали при помощи специально разработанного программного обеспечения (Imagic Desk, Version 6.01, Kontron Medical, Франция). Проводилась оценка глобальной продольной деформации (GLS); глобальной продольной скорости деформации (GLSR); циркулярной деформации (CS); циркулярной скорости деформации (CSR); глобальной радиальной деформации (GRS); глобальной радиальной скорости деформации (GRSR). Продольную и радиальную деформацию определяли в стандартных верхушечных 2-, 3- и 4-камерных позициях. Показатели циркулярной деформации оценивали в позиции по короткой оси на уровне папиллярных мышц [3, 6, 7].
Статистический анализ результатов проводили с использованием электронных таблиц Microsoft Excel 2010 и статистических программ SPSS (версия 12, США). При этом достоверность отличий определяли на основе t-критерия Стьюдента. Для сравнения показателей относительных долей в группах использовали парный критерий Вилкоксона. Значение p < 0,05 считали достоверным. Результаты представлены в виде M ± m.
Результаты
Все показатели деформации достоверно коррелировали с величиной ФВ ЛЖ (рис. 3).
При этом наибольший коэффициент корреляции был отмечен для продольных составляющих деформации, что указывало на их значимость в обеспечении глобальной сократимости миокарда.
Для оценки характеристик сократимости в зависимости от локализации поражения миокарда была проведена сравнительная оценка показателей деформации в 1-е сутки заболевания у пациентов с преимущественно передней и задней локализацией ОИМ. Результаты представлены в табл. 3.
Пациенты с передним поражением ЛЖ характеризовались значительно более низкими уровнями продольной деформации и скоростью деформации, в то время как радиальная и циркулярная составляющие деформации миокарда в зависимости от локализации инфаркта не отличались.
Основной целью нашего исследования был поиск возможных предикторов развития ранней постинфарктной дилатации (ПИД) ЛЖ на основе анализа исходных (на 1-е сутки заболевания) показателей деформации миокарда. Ранняя ПИД определялась как увеличение конечно-диастолического индекса (КДИ) на 15 % и более к 8-м суткам заболевания по сравнению с исходными значениями. Несмотря на относительно ранние сроки поступления пациентов, высокий процент реваскуляризации, а также назначение современной медикаментозной терапии, ранняя ПИД ЛЖ была отмечена у 21 (27,6 %) больного. Ретроспективный анализ полученных данных показал, что развитие ранней ПИД регистрировалось у больных с исходно нарушенной циркулярной функцией ЛЖ. Показатели продольной и радиальной деформации ЛЖ в 1-е сутки у больных с развитием и без развития ранней ПИД не отличались (табл. 4).
Полученные данные позволили рассчитать, что значение циркулярной деформации более –11 % в 1-е сутки ОИМ является предиктором развития ранней ПИД ЛЖ (специфичность 73,1 % и чувствительность 78,3 %; р < 0,001). В качестве маркера раннего ремоделирования ЛЖ также может использоваться значение циркулярной скорости деформации более –0,7 с–1, однако специфичность этого показателя оказалась более низкой — 60,1 % (чувствительность 78,5 %; р < 0,01).
Развитие острой левожелудочковой недостаточности (ОЛЖН) Killip II–III в течение госпитального периода заболевания наблюдалось у 14 (18,4 %) пациентов. Эта категория больных уже в первые сутки ОИМ характеризовалась значительным снижением всех основных показателей деформации ЛЖ, однако наиболее статистически значимые изменения были обнаружены для показателей продольной деформации ЛЖ (рис. 4).
Прогностически неблагоприятными в плане развития ОЛЖН были значения глобальной продольной деформации более –8,4 % (специфичность 80,6 % и чувствительность 75,0 %; р < 0,01) и/или значения глобальной продольной скорости деформации, превышающие –0,43 с–1 (специфичность 80,6 % и чувствительность 87,5 %; р < 0,01).
Обсуждение
В настоящей работе у больных с острым Q-инфарктом миокарда исследовались характеристики продольной, циркулярной и радиальной деформации ЛЖ, оцененные с помощью спекл-трекинг-эхокардиографии. При этом обнаружено, что показатели циркулярной деформации являются маркерами ранней ПИД ЛЖ, в то время как показатели продольной деформации имеют наибольшую чувствительность и специфичность для выявления больных с высоким риском развития острой сердечной недостаточности в течение госпитального периода заболевания.
Выбранная методика оценки деформации ЛЖ — спекл-трекинг-эхокардиография имеет ряд преимуществ перед использовавшимся ранее тканевым допплеровским исследованием [19]. Основными преимуществами являются отсутствие зависимости от угла исследования (между направлением луча и направлением движения миокарда) и меньшая чувствительность к качеству эхокардиографической картинки, что позволяет существенно расширить возможности данной методики [20, 21].
Ранее было продемонстрировано, что показатели продольной и циркулярной деформации ЛЖ коррелируют с распространенностью и глубиной поражения сердца при ОИМ [22, 23]. Продольная деформация и скорость деформации являются высокочувствительными индикаторами доклинической дисфункции ЛЖ [14, 24] и коррелируют со степенью фиброза миокарда [25, 26]. У пациентов с ишемической болезнью сердца субэндокардиальные продольные мышечные волокна наиболее чувствительны к нарушению перфузии и первыми страдают в условиях ишемии, что является причиной раннего нарушения продольной деформации [13–15]. Сокращение сердца по короткой оси осуществляется в основном за счет сокращения циркулярных мышечных волокон [16], которые позволяют поддерживать глобальную функцию миокарда как при начальных, так и при более существенных нарушениях продольной составляющей.
Изучение показателей деформации миокарда в качестве маркеров развития постинфарктной дилатации ЛЖ было проведено в нескольких исследованиях.
В 2010 году опубликованы результаты ретроспективного анализа эхокардиографического субисследования, проведенного в рамках проекта VALIANT, посвященного изучению эффективности и безопасности валсартана у пациентов с ОИМ [27]. Всего в субисследование было включено 603 больных, однако качественная ультразвуковая картинка, позволяющая оценить продольную деформацию, была получена у 380 больных, а циркулярную деформацию — у 420 больных. Исходное обследование проводилось в среднем на 5,0 ± 2,5 дня после развития ОИМ, а оценка дилатации (увеличение КДО на 15 % и более от исходного размера) — через 20 месяцев лечения. Исходные показатели продольной деформации ЛЖ имели прогностическое значение и ассоциировались с развитием смерти, госпитализации по поводу сердечной недостаточности в течение всего периода наблюдения, однако с их помощью не удалось выявить больных с постинфарктным ремоделированием ЛЖ. В то же время циркулярная скорость деформации являлась независимым фактором, определяющим развитие дилатации ЛЖ в течение 20 месяцев после инфаркта миокарда (относительный риск 1,3; 95% доверительный интервал 1,1–1,4; p < 0,001).
В другом исследовании независимым предиктором постинфарктной дилатации ЛЖ было значение продольной деформации более –11,6 % (чувствительность 78 %, специфичность 73 %). В это исследование было включено 82 больных с ОИМ, спекл-трекинг-эхокардиография проводилась в первые 72 часа от развития симптоматики заболевания, а оценка постинфарктной дилатации — через 4 месяца наблюдения [28].
Похожие результаты у больных с ОИМ без элевации ST, которым проводилась реваскуляризация миокарда, были получены в работе A. D’Andrea и соавт. [29]. В этом исследовании оценка показателей продольной деформации ЛЖ проводилась на 3–14-й день от развития ОИМ, а постинфарктной дилатации ЛЖ — через 6 месяцев наблюдения. Значение GLS ≥ –12 % было независимым фактором риска неблагоприятного ремоделирования ЛЖ (чувствительность 84,8 % и специфичность 87,8 %).
В исследовании Y.H. Park и соавт. [30] у больных с передней локализацией ОИМ, которым проводилось первичное чрескожное коронарное вмешательство, было выявлено, что показатели продольной деформации определяют развитие ремоделирования ЛЖ и сердечно-сосудистых осложнений в течение 18 месяцев наблюдения. В этих двух работах показатели циркулярной деформации не оценивались.
В исследованиях больных с сердечной недостаточностью ранее было также показано, что изменения показателей циркулярной деформации сердца коррелируют с успешным обратным ремоделированием ЛЖ после проведения ресинхронизирующей терапии [13, 14].
В нашем исследовании обнаружено, что проведение спекл-трекинг-эхокардиографии уже в первые часы ОИМ (в среднем через 14,6 часа от развития первых симптомов заболевания) позволяет выявить категорию больных с высоким риском развития ранней постинфарктной дилатации, которые нуждаются в более агрессивном лечении. Анализ доступной литературы показал, что наше исследование является первым, в котором оценивалось значение показателей продольной, циркулярной и радиальной деформации для развития ранней постинфарктной дилатации ЛЖ. В отличие от предшествующих исследований мы включали больных только с первым ОИМ, независимо от преимущественной локализации поражения, пола и возраста больного. Предполагается, что увеличение сферичности ЛЖ в процессе его ремоделирования является результатом неспособности миокарда преодолевать повышенное давление на стенку ЛЖ по короткой оси [31, 32]. Именно циркулярная составляющая играет ключевую роль в поддержании правильной геометрии ЛЖ и определяет его устойчивость к нагрузкам на ранних стадиях сердечной недостаточности. Ухудшение циркулярной функции способствует дальнейшему увеличению полости ЛЖ и прогрессированию симптомов сердечной недостаточности. В нашем исследовании именно циркулярная деформация ЛЖ явилась определяющей в развитии раннего постинфарктного ремоделирования в условиях современного лечения ОИМ, которое определяет необходимость поиска новых методов профилактики будущей хронической сердечной недостаточности.
Заключение
Таким образом, определение показателей циркулярной деформации ЛЖ в первые часы после госпитализации больных с ОИМ может быть использовано для выявления пациентов с высоким риском развития ранней постинфарктной дилатации ЛЖ, а показатели продольной деформации — для идентификации группы больных с высокой вероятностью возникновения острой сердечной недостаточности в госпитальном периоде заболевания.
1. Amundsen B.H., Helle-Valle T., Edvardsen T. et al. Noninvasive myocardial strain measurement by speckle tracking echocardiography: validation against sonomicrometry and tagged magnetic resonance imaging // J. Am. Coll. Cardiol. — 2006. — Vol. 47. — P. 789–793.
2. Brown J., Jenkins C., Marwick T. Use of myocardial strain to assess global left ventricular function: a comparison with cardiac magnetic resonance and 3-dimensional echocardiography // Am. Heart J. — 2009. — Vol. 157. — P. 102e1–102e5.
3. Blessberger H., Binder T. Non-invasive imaging: two dimensional speckle tracking echocardiography — basic principles // Heart. — 2010. — Vol. 96. — P.716–722.
4. D’Hooge J., Heimdal A., Jamal F. et al. Regional strain and strain rate measurements by cardiac ultrasound: principles, implementation and limitations // Eur. J. Echocardiogr. — 2000. — Vol. 1(3). — P. 154–70.
5. Voigt J.U., Flachskampf F.A. Strain and strain rate. New and clinically relevant echo parameters of regional myocardial function // Z. Kardiol. — 2004. — Vol. 93. — P. 249–58.
6. Hurlburt H.M., Aurigemma G.P., Hill J.C. et al. Direct ultrasound measurement of longitudinal, circumferential, and radial strain using 2-dimensional strain imaging in normal adults // Echocardiography. — 2007. — Vol. 24. — P. 723–31.
7. Dandel M., Lehmkuhl H., Knosalla C. et al. Strain and strain rate imaging by echocardiography: basic concepts and clinical applicability // Curr. Cardiol. Rev. — 2009. — Vol. 5. — P. 133–148.
8. Marwick T.H., Leano R.L., Brown J. et al. Myocardial strain measurement with 2-dimensional speckle-tracking echocardiography: definition of normal range // JACC Cardiovasc. Imaging. — 2009. — Vol. 2. — P. 80–4.
9. Takeuchi M., Otsuji Y., Lang R.M. Evaluation of left ventricular function using left ventricular twist and torsion parameters // Curr. Cardiol. Rep. — 2009. — Vol. 11. — P. 225–230.
10. Notomi Y., Lysyansky P., Setser R.M. et al. Measurement of ventricular torsion by two-dimensional ultrasound speckle tracking imaging // J. Am. Coll. Cardiol. — 2005. — Vol. 45. — P. 2034–2041.
11. Notomi Y., Popovic Z.B., Yamada H. et al. Ventricular untwisting: a temporal link between left ventricular relaxation and suction // Am. J. Physiol. Heart Circ. Physiol. — 2008. — Vol. 294. — P. 505–513.
12. Greenbaum R.A., Ho S.Y., Gibson D.G. et al. Left ventricular fibre architecture in man // Br. Heart J. — 1981. — Vol. 45. — P. 248–263.
13. Yu C.M., Lin H., Yang H. et al. Progression of systolic abnormalities in patients with isolated diastolic heart failure and diastolic dysfunction // Circulation. — 2002. — Vol. 105. — P. 1195–1201.
14. Wang J., Khoury D.S., Yue Y. et al. Preserved left ventricular twist and circumferential deformation, but depressed longitudinal and radial deformation in patients with diastolic heart failure // Eur. Heart J. — 2008. — Vol. 29. — P. 1283–1289.
15. Hashimoto I., Li X., Hejmadi Bhat A. et al. Myocardial strain rate is a superior method for evaluation of left ventricular subendocardial function compared with tissue Doppler imaging // J. Am. Coll. Cardiol. — 2003. — Vol. 42. — P. 1574–1583.
16. Mizuguchi Y., Oishi Y., Miyoshi H. et al. The functional role of longitudinal, circumferential, and radial myocardial deformation for regulating the early impairment of left ventricular contraction and relaxation in patients with cardiovascular risk factors: a study with two-dimensional strain imaging // J. Am. Soc. Echocardiogr. — 2008. — Vol. 21. — P. 1138–1144.
17. Lang R.M., Bierig M., Devereux R.B. et al. Recommendations for chamber quantification // Eur. J. Echocardiography. — 2006. — Vol. 7. — P. 79–108.
18. Шиллep H., Оcипoв M.A. Kлиническaя эxoкapдиoгpaфия. — 2-e изд. — М.: Пpaктикa, 2005. — С. 62–73.
19. Urheim S., Edvardsen T., Torp H. et al. Myocardial strain by Doppler echocardiography: validation of a new method to quantify regional myocardial function // Circulation. — 2000. — Vol. 102. — P. 1158–64.
20. Langeland S., D’hooge J., Wouters P.F. et al. Experimental validation of a new ultrasound method for the simultaneous assessment of radial and longitudinal myocardial deformation independent of insonation angle // Circulation. — 2005. — Vol. 112. — P. 2157–2162.
21. Hashimoto I., Li X., Hejmadi Bhat A. et al. Myocardial strain rate is a superior method for evaluation of left ventricular subendocardial function compared with tissue Doppler imaging // J. Am. Coll. Cardiol. — 2003. — Vol. 42. — P. 1574–1583.
22. Zhang Y., Chan A.K., Yu C.M. et al. Strain rate imaging differentiates transmural from non–transmural myocardial infarction a validation study using delayed-enhancement magnetic resonance imaging // J. Am. Coll. Cardiol. — 2005. — Vol. 46. — P. 864–871.
23. Chan J., Hanekom L., Wong C. et al. Differentiation of subendocardial and transmural infarction using two-dimensional strain rate imaging to assess short-axis and long-axis myocardial function // J. Am. Coll. Cardiol. — 2006. — Vol. 48. — P. 2026–2033.
24. Zhang Q., Fung J.W., Yip G.W. et al. Improvement of left ventricular myocardial short–axis, but not long-axis function or torsion after cardiac resynchronisation therapy: an assessment by two-dimensional speckle tracking // Heart. — 2008. — Vol. 94. — P. 1464–1471.
25. Park T.H., Nagueh S.F., Khoury D.S. et al. Impact of myocardial structure and function postinfarction on diastolic strain measurements: implications for assessment of myocardial viability // Am. J. Physiol. Heart Circ. Physiol. — 2006. — Vol. 290. — P. 724–731.
26. Stanton T., Leano R., Marwick T.H. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring // Circ. Cardiovasc. Imaging. — 2009. — Vol. 2. — P. 356–364.
27. Hung C.L., Verma A., Uno H. et al. Longitudinal and Circumferential Strain Rate, Left Ventricular Remodeling, and Prognosis After Myocardial Infarction // JACC. — 2010. — Vol. 56, № 22. — P. 1812–22.
28. Zaliaduonyte-Peksiene D., Vaskelyte J.J., Mizariene V. et al. Does Longitudinal Strain Predict Left Ventricular Remodeling after Myocardial Infarction? // Echocardiography. — 2012. — Vol. 29. — P. 419–427.
29. D’Andrea A., Cocchia R., Caso P. et al. Global longitudinal speckle-tracking strain is predictive of left ventricular remodeling after coronary angioplasty in patients with recent non–ST elevation myocardial infarction // International Journal of Cardiology. — 2011. — Vol. 153 (2). — P. 185–191.
30. Park Y.H., Kang S.J., Song J.K. et al. Prognostic value of longitudinal strain after primary reperfusion therapy in patients with anterior-wall acute myocardial infarction // J. Am. Soc. Echocardiogr. — 208. — Vol. 21. — P. 262–267.
31. Pfeffer M.A., Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implications // Circulation. — 1990. — Vol. 81. — P. 1161–1172.
32. Rohde L.E., Aikawa M., Cheng G.C. et al. Echocardiography-derived left ventricular end-systolic regional wall stress and matrix remodeling after experimental myocardial infarction // J. Am. Coll. Cardiol. — 1999. — Vol. 33. — P. 835–842.

/12/12_2.jpg)
/13/13.jpg)
/15/15.jpg)
/14/14.jpg)
/16/16.jpg)