Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Эффективность и безопасность комбинированной гиполипидемической терапии эзетимибом и аторвастатином у пациентов с острым инфарктом миокарда
Авторы: Лутай Я.М., Иркин О.И., Степура А.А., Белый Д.А., Пархоменко А.Н. - ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины, отдел реанимации и интенсивной терапии
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Клинические исследования
Версия для печати
Статины уменьшают уровень холестерина (ХС) в основном за счет влияния на его синтез в печени. Но на показатели липидного спектра крови также влияют скорость и полнота абсорбции ХС в тонком кишечнике. Эзетимиб — один из первых препаратов, которые блокируют этот процесс. Цель работы — исследование безопасности и эффективности низкодозовой комбинированной гиполипидемической терапии по сравнению с агрессивной терапией статинами у больных острым инфарктом миокарда.
Обследовано 70 больных с диагнозом острого инфаркта миокарда, поступивших в первые 24 часа (в среднем 5,2 ± 1,0 ч) от развития симптоматики заболевания. Пациенты были рандомизированы на две группы: первая группа — 35 больных, получавших низкодозовую комбинацию аторвастатина 10 мг и эзетимиба 10 мг (А10/Е10), вторая группа — 35 больных, получавших аторвастатин в дозе 40 мг (А40) на фоне базисной терапии.
Комбинированная терапия по гиполипидемической эффективности была подобна монотерапии аторвастатином, но оба режима позволяли достичь рекомендованного снижения ХС ЛПНП менее 2,6 ммоль/л только примерно у 75 % больных, а менее 1,8 ммоль/л — только у трети пациентов. Отмечено более существенное снижение триглицеридов в сыворотке крови пациентов, принимавших комбинированную терапию (35 % А10/Е10 против 19,5 % А40, р < 0,05). Комбинация А10/Е10 имела сходный с А40 противовоспалительный эффект и преимущества перед монотерапией А40 относительно влияния на функцию эндотелия. Применение А10/Е10 ассоциировалось с тенденцией к улучшению эндотелиальной функции уже через 7 дней терапии, а на 90-е сутки лечения прирост диаметра плечевой артерии в этой группе больных был достоверно выше, чем при монотерапии аторвастатином (12,19 ± 1,09 А10/Е10 против 9,25 ± 1,160 А40, р < 0,05). Группы не отличались по частоте развития основных осложнений госпитального и раннего постгоспитального периодов заболевания.
Статини зменшують рівень холестерину (ХС) в основному за рахунок впливу на його синтез у печінці. Але на показники ліпідного спектра крові також впливають швидкість та повнота абсорбції ХС у тонкому кишечнику. Езетиміб — один із перших препаратів, що блокують цей процес. Мета роботи — дослідження безпечності та ефективності низькодозової комбінованої гіполіпідемічної терапії порівняно з агресивною терапією статинами у хворих на гострий інфаркт міокарда.
Обстежено 70 хворих із діагнозом гострого інфаркту міокарда, які надійшли в перші 24 години (у середньому 5,2 ± 1,0 год) від розвитку симптоматики захворювання. Пацієнти були рандомізовані на дві групи: 1-ша група — 35 хворих, які отримували низькодозову комбінацію аторвастатину 10 мг і езетимібу 10 мг (А10/Е10), 2-га група — 35 хворих, які отримували аторвастатин у дозі 40 мг (А40) на фоні базисної терапії.
Комбінована терапія за гіполіпідемічною ефективністю була подібна до монотерапії аторвастатином, але обидва режими дозволяли досягнути рекомендованого зниження ХС ліпопротеїдів низької щільності менш ніж 2,6 ммоль/л тільки приблизно у 75 % хворих, а менш ніж 1,8 ммоль/л — тільки у третини пацієнтів. Відмічено більш суттєве зниження тригліцеридів у сироватці крові пацієнтів, які приймали комбіновану терапію (35 % А10/Е10 проти 19,5 % А40, р < 0,05). Комбінація А10/Е10 мала подібний з А40 протизапальний ефект та переваги перед монотерапією А40 щодо впливу на функцію ендотелію. Застосування А10/Е10 асоціювалося з тенденцією до покращення ендотеліальної функції вже через 7 днів терапії, а на 90-ту добу лікування приріст діаметра плечової артерії у цій групі хворих був вірогідно вищий, ніж при монотерапії аторвастатином (12,19 ± 1,09 А10/Е10 проти 9,250 ± 1,160 А40, р < 0,05). Групи не відрізнялися за частотою розвитку основних ускладнень госпітального та раннього постгоспітального періодів захворювання.
Statins reduce cholesterol levels, mainly due to the impact on its synthesis in the liver. But the rate and completeness of absorption of cholesterol in the intestine are also affect the lipid spectrum of blood. Ezetimibe is one of the first drugs that block this process. The objective of this work — to examine the safety and efficacy of low-dose combined lipid-lowering therapy compared with aggressive statin therapy in patients with acute myocardial infarction.
A total of 70 patients with acute myocardial infarction admitted to hospital within the first 24 hours (mean 5.2 ± 1.0 h) after symptoms onset. Patients were randomized into two groups: first one — 35 patients receiving low-dose combination of atorvastatin 10 mg and ezetimibe 10 mg (A10/E10), second one — 35 patients treated with atorvastatin 40 mg (A40) on the background of basic therapy.
Combined therapy was similar to atorvastatin monotherapy by lipid-lowering efficacy, but both regimens made it possible to achieve the recommended reduction of low-density lipoprotein cholesterol level less than 2.6 mmol/l only in approximately 75 % of patients, and less than 1.8 mmol/l — only in 1/3 of patients. More significant decrease in serum triglyceride level was noted in patients treated with combined therapy (35 % A10/E10 vs 19.5 % A40, respectively; p < 0.05). A10/E10 combination has anti-inflammatory effect similar to that of A40 and advantages over A40 monotherapy in the effect on the endothelium function. A10/E10 application was associated with a trend to endothelial function improvement already after 7 days of treatment, and after 90 days of treatment increase in brachial artery diameter in this group of patients was significantly higher than in atorvastatin monotherapy (12.19 ± 1.09 A10/E10 vs 9.25 ± 1.16 A40; p < 0.05). Groups did not differ in the incidence of major complications in hospital and early posthospital periods of the disease.
острый инфаркт миокарда, гиполипидемическая терапия, аторвастатин, эзетимиб, эндотелиальная дисфункция.
гострий інфаркт міокарда, гіполіпідемічна терапія, аторвастатин, езетиміб, ендотеліальна дисфункція.
acute myocardial infarction, lipid-lowering therapy, atorvastatin, ezetimibe, endothelial dysfunction.
Статья опубликована на с. 19-27
Благоприятное влияние ингибиторов 3-гидрокси-3-метилглютарил-коэнзим А (ГМГ-КoA)-редуктазы (статинов) на заболеваемость и смертность от сердечно-сосудистых причин у больных с ишемической болезнью сердца (ИБС) доказано в целом ряде клинических исследований [1–4]. Этот эффект связывают как непосредственно с гиполипидемическими, так и с дополнительными (плейотропными) свойствами статинов, среди которых большое значение уделяется их антитромботическому, противовоспалительному и нормализующему функцию эндотелия действиям [5–8]. Экспериментальные исследования показали, что статины также существенно уменьшают повреждение миокарда в условиях ишемии-реперфузии, обладают кардиопротекторными свойствами и предупреждают развитие синдрома невосстановленного кровотока (no-reflow) [9]. Особое значение указанные свойства приобретают после острого коронарного синдрома (ОКС), когда сохраняется большая вероятность повторных ишемических событий.
В настоящее время завершено несколько крупных многоцентровых исследований (MIRACLE, PROVE-IT, ARMYDA ACS, PTT, PACT и др.), которые подтвердили эффективность раннего назначения ингибиторов ГМГ-КoA-редуктазы у больных с ОКС [10–14]. Основываясь на данных этих исследований, разработаны основные положения по применению гиполипидемической терапии, которые вошли в рекомендации Европейского общества кардиологов и Ассоциации кардиологов Украины. Применение ингибиторов ГМГ-КoA-редуктазы рекомендовано у всех пациентов с ОКС (без противопоказаний) независимо от уровня ХС. Начинать терапию следует в течение первых 1–4 дней от развития ОКС, а целью терапии является снижение ХС липопротеинов низкой плотности (ХС ЛПНП) менее 2,6 ммоль/л (предпочтительно менее 1,8 ммоль/л). Менее интенсивная терапия статинами должна проводиться у пациентов с высоким риском побочных явлений (пожилые пациенты, поражение почек, печени и т.д.) [15–17].
Внедрение данных рекомендаций позволило существенным образом увеличить частоту раннего назначения статинов у больных с ОКС. Так, по данным Европейского регистра ACS Snapshot, в университетских клиниках Украины частота назначения статинов в ранние сроки острого инфаркта миокарда (ОИМ) составляет 93,1 % (госпитальный период) и у 92,8 % больных статины рекомендуются при выписке [18]. В то же время в целом в Украине назначение статинов при ОКС остается низким (достоверные статистические данные отсутствуют), также зачастую приходится сталкиваться с необоснованной отменой или снижением дозировки этих препаратов после выписки пациента из стационара. Недопустимо низким остается достижение целевых уровней ХС ЛПНП у больных с ОИМ. В некоторой степени невозможность достижения целевых уровней липидов обусловлена недостаточной эффективностью статинов или невозможностью применения высоких доз в связи с развитием побочных эффектов. В исследовании Foley et al. назначение начальной дозы статинов позволяло достичь рекомендуемых уровней ХС ЛПНП только у 48 % пациентов высокого риска с исходной гиперлипидемией [19], а увеличение дозы статинов позволяло корригировать уровень липидов до рекомендуемых значений только у 18 % из оставшихся больных [20]. В исследовании ACCESS у больных с ИБС и исходной гиперлипидемией применение аторвастатина в максимально переносимых дозах позволяло достичь целевых уровней только у 72 % пациентов [21]. Во многом это связано с тем, что наиболее эффективной является начальная доза статинов, а ее удвоение позволяет добиться дополнительного снижения уровня ХС ЛПНП не более чем на 6 % (так называемое «правило шестерки») [22]. Статины уменьшают уровень ХС в основном за счет влияния на его синтез в печени. В то же время немаловажными факторами, влияющими на показатели липидного спектра крови, являются скорость и полнота всасывания экзогенного и выделившегося с желчью ХС в тонком кишечнике [23]. Эзетимиб — один из первых препаратов, влияющих на этот процесс. За счет избирательной блокады ацил-коэнзим А-холестерин-ацилтрансферазы этот препарат позволяет заблокировать белок — переносчик ХС (белок Ниманна — Пика I) в ворсинках тонкого кишечника. Нарушение всасывания ХС уменьшает его доставку в печень, способствует истощению депо ХС в гепатоцитах, повышает экспрессию рецепторов к ЛПНП на клетках печени, что приводит к снижению уровня ХС ЛПНП [24, 25]. Эзетимиб способен снизить всасывание ХС на 40–50 % [26], что сопровождается снижением уровня ХС ЛПНП приблизительно на 15–18 % [27]. Терапия статинами приводит к вторичному повышению всасывания ХС (по механизму обратной связи), поэтому эффективность эзетимиба на фоне терапии статинами сопровождается даже более выраженным эффектом и способствует снижению ХС ЛПНП на 18–25 % [28]. В то же время данные по клинической эффективности комбинированной гиполипидемической терапии довольно противоречивы, также остается открытым вопрос о наличии дополнительных (плейотропных) эффектов у эзетимиба, что особенно важно при терапии пациентов с ОКС.
Целью нашей работы было изучение безопасности и эффективности (выраженность гиполипидемического, противовоспалительного эффектов, влияние на функцию эндотелия) низкодозовой комбинированной гиполипидемической терапии (аторвастатин 10 мг/эзетимиб 10 мг) по сравнению с агрессивной терапией статинами (аторвастатин 40 мг) у больных с ОИМ.
Материалы и методы
Обследованы 70 больных (57 мужчин и 13 женщин) в возрасте 35–80 лет (в среднем 57,4 ± 0,9 года), госпитализированных в отделение реанимации и интенсивной терапии ДУ ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» с диагнозом острого инфаркта миокарда. Включали пациентов, поступивших в течение первых 24 часов (в среднем 5,2 ± 1,0 ч) от развития симптоматики заболевания. Острый ИМ диагностировали на основании данных клинических, электрокардиографических и биохимических обследований в соответствии с рекомендациями Европейского общества кардиологов и Ассоциации кардиологов Украины. 46 (65,7 %) пациентов имели элевацию сегмента ST на ЭКГ при поступлении, передняя локализация ИМ диагностирована у 32 (45,7 %) больных. В исследование не включали пациентов с острыми интеркуррентными воспалительными заболеваниями, сердечной недостаточностью IIБ–ІІІ стадии, инсультом, а также тяжелыми сопутствующими заболеваниями (онкологические заболевания, системные заболевания соединительной ткани, неконтролируемый сахарный диабет, выраженная почечная, печеночная недостаточность). Тромболитическая терапия проведена у 8 (11,4 %) больных, первичная ангиопластика (больные с элевацией ST) со стентированием инфарктзависимой коронарной артерии — у 35 (50,0 %) больных. Базисная терапия назначалась в соответствии с существующими рекомендациями: аспирин, клопидогрель, фондапарин или низкомолекулярный гепарин, b-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов к ангиотензину II типа, по показаниям — ингибиторы альдостерона, нитраты, мочегонные и антиаритмическая терапия. Случайным методом (метод конвертов) пациенты были распределены на две группы. В 1-ю группу вошли 35 больных, которые в качестве гиполипидемической терапии получали низкодозовую комбинацию аторвастатина 10 мг и эзетимиба 10 мг (А10/Э10), во 2-ю группу — 35 пациентов, которые получали аторвастатин в дозе 40 мг один раз в сутки (А40). Исходные характеристики больных представлены в табл. 1.
До поступления в стационар статины получали 9 (12,9 %) пациентов.
Обследование пациентов проводилось на 1, 7, 30 и 90-е сутки. Определяли уровень общего ХС, ХС липопротеидов высокой плотности (ЛПВП), триглицеридов (ТГ) с последующим расчетом уровня ХС ЛПНП и ХС липопротеидов очень низкой плотности (ЛПОНП). Противовоспалительный эффект оценивали на основании динамики маркеров воспаления С-реактивного белка (СРБ) и фибриногена. Проба с реактивной гиперемией использовалась для оценки функции эндотелия.
Уровень общего ХС, ХС ЛПВП и ТГ определяли ферментативным методом [29, 30]; концентрацию СРБ — иммунотурбидиметрическим методом с использованием диагностического набора фирмы BioSystems на многофункциональном биохимическом анализаторе Cobas Fara [31, 32].
Тест с реактивной гиперемией проводился системой для ультразвуковой диагностики Imagic Agile (компания KONTRON Medical) при помощи линейного сосудистого датчика LA523K (4–13 MHz). На 1-е сутки острого ИМ минимум за 60 минут перед проведением пробы с реактивной гиперемией пациенту отменяли внутривенное введение нитропрепаратов, пролонгированные нитраты не использовались. При проведении пробы на 7-е и 90-е сутки пациенту за сутки отменялись нитропрепараты (исключая короткодействующие нитраты для купирования приступов стенокардии). Проба проводилась утром, натощак, после 10-минутного отдыха в положении лежа. После измерения исходного диаметра плечевой артерии (среднее значение 4 измерений с расстоянием 1 см между точками) пациенту на плечо выше участка измерения накладывалась манжета от манометра и создавалось давление в 200 мм рт.ст., которое удерживалось в течение 5 минут. Через 80 секунд после декомпрессии проводилось повторное измерение диаметра артерии и рассчитывался показатель эндотелийзависимой вазодилатации как процент прироста диаметра артерии от исходного размера [33].
Контроль безопасности терапии проводили путем определения уровня аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и креатинфосфокиназы (КФК) в сыворотке крови. Критерием снижения дозы/отмены гиполипидемических препаратов являлось превышение уровня указанных ферментов в 3 раза и более верхней границы нормы.
Статистический анализ результатов проводили с использованием электронных таблиц Microsoft® Excel 2010 и статистических программ SPSS (версия 12, США). При этом достоверность отличий определяли на основе t-критерия Стьюдента. Для сравнения показателей относительных долей в группах использовали парный критерий Вилкоксона. Значение p < 0,05 считали достоверным. Результаты представлены в виде M ± m.
Результаты
Оба режима гиполипидемической терапии хорошо переносились. Однако уровень АЛТ на 7-е сутки во 2-й группе (А40) был достоверно выше, чем в первой (А10/Э10) (рис. 1).
У 2 пациентов 2-й группы на протяжении исследования доза аторвастатина была снижена до 20 мг в связи с повышением АЛТ и/или АСТ более чем в 3 раза от верхней границы нормы. У одного из этих пациентов возникла необходимость последующего снижения дозы аторвастатина до 10 мг для стабилизации уровня печеночных ферментов. В группе комбинированной терапии повышение уровня печеночных ферментов выше допустимых значений не наблюдалось. Повышение уровня КФК или АЛТ выше 5 раз от верхней границы нормы не отмечалось, миалгии не регистрировались ни в одной из групп.
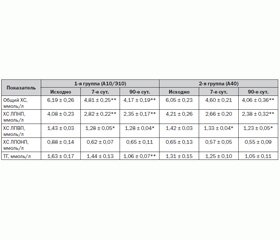
Динамика уровня липидов крови представлена в табл. 2.
По влиянию на уровень общего ХС, ХС ЛПНП, ХС ЛПВП и ХС ЛПОНП на 7, 30 и 90-е сутки отличий между группами не выявлено. Отмечено более существенное снижение содержания ТГ в сыворотке крови пациентов, принимавших комбинированную гиполипидемическую терапию, к 90-м суткам лечения. Динамика показателей липидного спектра крови в процентах по отношению к исходным значениям изображена на рис. 1. Несколько неожиданно в обеих группах зарегистрировано снижение уровня ХС ЛПВП в пределах 9–10 %.
Тестируемые режимы гиполипидемической терапии позволили через 90 дней лечения достичь рекомендуемого уровня ХС ЛПНП (менее 2,6 ммоль/л) у 26 (74,3 %) и 27 (77,1 %) больных в первой и второй группах соответственно. В то же время более жесткие критерии снижения ХС ЛПНП (менее 1,8 ммоль/л) были выполнены лишь у трети больных (12 (34,2 %) пациентов из первой и 10 (28,6 %) пациентов из второй группы).
Уровень СРБ достоверно снижался в динамике наблюдения в обеих группах. Отличий между группами по уровням СРБ и фибриногена при поступлении, на 7, 30 и 90-е сутки терапии не отмечалось (табл. 3).
Первоначальное повышение уровня СРБ на 5–7-е сутки, вероятно, связано с системным ответом на резорбционно-некротический процесс после перенесенного инфаркта миокарда (2/3 больных с Q-инфарктом миокарда). Уровень фибриногена в динамике наблюдения достоверно не менялся.
Большое значение в развитии и прогрессировании атеротромботических осложнений после ОКС имеет нарушение функции сосудистой стенки, в первую очередь — сосудистого эндотелия. Увеличение прироста диаметра плечевой артерии в ответ на пробу с реактивной гиперемией в динамике наблюдения было отмечено в обеих исследуемых группах (рис. 2). Прием комбинированной терапии ассоциировался с тенденцией к улучшению функции эндотелия уже к 7-м суткам терапии. На 90-е сутки лечения прирост диаметра плечевой артерии был также достоверно выше при комбинированной терапии, чем при монотерапии аторвастатином.
Обе группы были сравнимы по частоте развития основных осложнений внутригоспитального и раннего постгоспитального периодов заболевания (табл. 4).
Обсуждение
Основной проблемой при назначении статинов у больных с ОКС является опасение врачей относительно безопасности их применения, в частности, возможное влияние на функцию печени. Было показано, что повышение уровня трансаминаз (АЛТ и АСТ) наблюдается при лечении всеми дозами всех разрешенных к применению статинов и является дозозависимым классовым эффектом этой группы препаратов [34]. У большинства больных в ранние сроки ОИМ отмечается преходящее повышение уровня печеночных ферментов крови, что, вероятно, связано с транзиторными нарушениями микроциркуляции в печени в условиях обширного повреждения миокарда, а также проведением агрессивной антитромботической, антиишемической, сопутствующей терапии [35]. В нашем исследовании низкодозовая комбинированная гиполипидемическая терапия характеризовалась более благоприятным профилем безопасности и переносимости по сравнению с агрессивной монотерапией аторвастатином, в том числе при оценке уровня печеночных ферментов крови.
Выявленная нами гиполипидемическая эффективность низкодозовой комбинации была сравнима с таковой у 40 мг аторвастатина, а также соотносится с результатами проведенных ранее исследований, в которых назначение А10/Э10 сопровождалось 45–55% снижением уровня ХС ЛПНП [27, 36, 37]. Снижение ХС ЛПНП в нашем исследовании было несколько меньше (43 % — А10/Э10 и 44 % — А40), что, вероятно, обусловлено приемом частью пациентов (9 (12,6 %)) статинов на догоспитальном этапе. Комбинированная терапия более существенно, чем А40, снижала содержание ТГ в сыворотке крови. Несколько неожиданно в обеих группах было зарегистрировано снижение уровня ХС ЛПВП в пределах 9–10 %, что требует дальнейшего изучения.
Большое значение в развитии и прогрессировании атеросклероза и атеротромбоза играет системное воспаление. Ранее было показано, что монотерапия эзетимибом не приводила к существенному снижению уровня СРБ, а его добавление к терапии статинами сопровождалось дополнительным достоверным снижением данного маркера воспаления на 10 %. В нашем исследовании в группе комбинированной терапии снижение уровня СРБ составило 26 %, что соответствует данным литературы [27]. Противовоспалительный эффект комбинированной терапии достоверно не отличался от эффекта А40.
Одним из наиболее используемых в настоящее время методов неинвазивной оценки функции эндотелия является проба с эндотелийзависимой вазодилатацией в ответ на пробу с реактивной гиперемией на плечевой артерии. Считается, что эндотелийзависимая вазодилатация, измеренная этим методом, отражает функцию эндотелия в коронарных артериях [40, 41]. В настоящее время имеются результаты нескольких небольших исследований, в которых изучалось влияние комбинированной гиполипидемической терапии, включавшей статины и эзетимиб, на функцию эндотелия. В исследовании Bulut et al. у больных с метаболическим синдромом переход с терапии А40 на комбинацию А10/Э10 приводил к дополнительному снижению уровня ХС ЛПНП и улучшению эндотелиальной функции [42]. Olijhoek et al. выявили, что у этой же категории пациентов комбинация Э10 и симвастатина 10 мг лучше, чем симвастатин в дозе 80 мг, предотвращает развитие дисфункции эндотелия в ответ на жировую нагрузку [43]. В то же время в 2 исследованиях у больных с сердечной недостаточностью только монотерапия статинами (в отличие от монотерапии эзетимибом) сопровождалась дополнительным улучшением функции эндотелия, а комбинированная терапия не изучалась [44, 45]. При стабильной ИБС по влиянию на функцию эндотелия комбинированная гиполипидемическая терапия была сравнима с монотерапией статинами в высоких дозах, хотя между результатами разных исследований имеются отличия [36, 46, 47]. Эти отличия могут быть обусловлены как методологией проведения исследований, так и использованием различных статинов в комбинации с эзетимибом. В июле 2012 года были опубликованы результаты метаанализа всех рандомизированных исследований, посвященных изучению влияния низкодозовой комбинации статина и эзетимиба по сравнению с монотерапией статинами на функцию эндотелия (проба с реактивной гиперемией) [48]. В базах данных MEDLINE и EMBASE выбранным критериям соответствовали 6 исследований, в которые было включено 213 пациентов. Не было обнаружено каких-либо существенных отличий между двумя режимами гиполипидемической терапии по степени улучшения эндотелиальной функции (0,22 %; 95% CI 0,85–1,29 %, p = 0,68).
Таким образом, монотерапия эзетимибом менее эффективна, а низкодозовая комбинация эзетимиба и статина как минимум столь же эффективна, а у некоторых категорий пациентов даже превосходит монотерапию статинами по влиянию на функцию эндотелия. В нашем исследовании комбинация А10/Э10 приводила к более значимому улучшению функции эндотелия через 90 дней лечения по сравнению с терапией аторвастатином (А40).
До сих пор неизвестно, связано ли влияние эзетимиба на эндотелий только с его гиполипидемическим действием или нет. Трудно предположить прямое действие препарата на эндотелий, так как только очень небольшая его часть всасывается и попадает в системный кровоток. В то же время механизмы, лежащие в основе реализации этого эффекта, могут быть связаны с влиянием комбинации эзетимиба и статина на метаболизм NO (ключевого фактора в реализации функции эндотелия), функцию эндотелиальной NO-синтетазы (eNOS), количество и активность эндотелиальных клеток-предшественниц, выраженность системного воспаления и/или оксидативного стресса. В исследованиях у больных с почечной дисфункцией и дислипидемией эзетимиб значительно уменьшал уровень асимметричного диметиларгинина (эндогенный ингибитор NO-синтетазы), причем этот эффект напрямую не зависел от снижения ХС [49]. В то же время большинство исследователей сходятся во мнении, что влияние эзетимиба на активность eNOS незначительное и опосредуется его гиполипидемическими свойствами [50, 51]. В отличие от статинов монотерапия эзетимибом не повышает количество эндотелиальных клеток-предшественников [45], в то же время низкодозовая комбинация статина и эзетимиба приводит к увеличению их количества в периферическом кровотоке в той же степени, что и высокие дозы статинов [52]. Целый ряд экспериментальных и клинических исследований свидетельствует о дополнительных антиоксидантных свойствах эзетимиба и его комбинации со статинами, что может объяснить его влияние на функцию эндотелия [49, 53–55]. Безусловную роль в уменьшении эндотелиальной дисфункции играет и найденный у комбинации статина и эзетимиба противовоспалительный эффект.
Накопленные экспериментальные и клинические данные свидетельствуют о высокой гиполипидемической эффективности комбинированной терапии, а также о наличии у комбинации эзетимиба и статина дополнительных противовоспалительных, антиоксидантных и нормализующих функцию эндотелия свойств. Однако будет ли такая комбинация эффективна для предупреждения сердечно-сосудистых осложнений у больных с острым коронарным синдромом — неизвестно. В 2011 году был проведен ретроспективный анализ Национальной страховой базы данных Тайваня за 2 года (2006–2007). Выявлен 1001 пациент, которые в течение минимум 1 года после выписки по поводу ОКС принимали комбинацию статина и эзетимиба. Для сравнения на основании анализа той же базы была создана группа контроля — 1001 пациент, которые были идентичны по основным клинико-анамнестическим характеристикам и исходному уровню липидов исследуемой группе, однако принимали в течение 1 года монотерапию статинами. Комбинированная терапия ассоциировалась со значительно меньшей вероятностью повторных госпитализаций по поводу ОКС (OR 0,62 [0,53–0,73]), а также необходимости в проведении реваскуляризационных процедур [56].
К настоящему времени закончено несколько многоцентровых исследований, в которых изучалось влияние комбинированной терапии на клинические конечные точки. В исследовании SEAS у 1873 пациентов с бессимптомным аортальным стенозом назначение симвастатина и эзетимиба в течение 52,2 месяца не предотвращало прогрессирование клапанного порока и не предупреждало развитие сердечно-сосудистых осложнений [57]. В то же время у пациентов с хронической болезнью почек (9270 больных) без предшествующего ИМ или коронарной реваскуляризации в исследовании SHARP комбинированная гиполипидемическая терапия (симвастатин 20 мг/эзетимиб 10 мг) приводила к 17% снижению основных атеросклеротических событий (смерть, нефатальный ИМ, негеморрагический инсульт, артериальная реваскуляризация) по сравнению с плацебо. Эффект терапии в основном был обусловлен предупреждением развития инсультов и реваскуляризаций без существенного влияния на уровень сердечно-сосудистой смертности и нефатального ИМ [58]. В 2013 году ожидаются результаты исследования IMPROVE-IT, в которое было включено более 18 000 больных с ОКС. Это исследование позволит определить место комбинированной терапии (эзетимиб и статин) у данной категории больных [59].
Выводы
— Низкодозовая комбинированная липидо-снижающая терапия (аторвастатин 10 мг/эзетимиб 10 мг) по гиполипидемической эффективности сравнима с агрессивной монотерапией аторвастатином 40 мг. В то же время оба тестируемых режима позволили достичь рекомендуемого снижения ХС ЛПНП менее 2,6 ммоль/л только примерно у 75 % больных, а менее 1,8 ммоль/л — менее чем у трети пациентов.
— Комбинация А10/Э10 обладала сравнимым с А40 противовоспалительным эффектом и имела преимущества перед монотерапией аторвастатином по влиянию на функцию эндотелия.
— Учитывая более благоприятный профиль безопасности и переносимости, низкодозовая гиполипидемическая терапия может использоваться в качестве альтернативы монотерапии статинами у пациентов с развитием и/или высоким риском развития побочных явлений.
— Клиническая эффективность комбинированной гиполипидемической терапии требует дальнейшего изучения в многоцентровых рандомизированных клинических исследованиях.
1. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian simvastatin survival study (4S) // Lancet. — 1994. — 344. — 1383–1389.
2. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 20 536 high-risk individuals: a randomised placebo-controlled trial // Lancet. — 2002. — 360. — 7–22.
3. Sever P.S., Dahlöf B., Poulter N.R. et al. ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial // Lancet. — 2003. — 361. — 1149–1158.
4. Ridker P.M., Rifai N., Pfeffer M.A. et al. The cholesterol and recurrent events (CARE) investigators. Long-term effects of pravastatin on plasma concentration of C-reactive protein // Circulation. — 1999. — Vol. 100. — P. 230–235.
5. Anderson T.J., Meredith I.T., Yeung A.C. et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium-dependent coronary vasomotion // New Engl. J. Med. — 1995. — Vol. 332. — P. 488–493.
6. Dangas G., Smith D.A., Unger A.H. et al. Pravastatin: an antithrombotic effect independent of the cholesterol-lowering effect // Thromb. Haemost. — 2000. — Vol. 83. — P. 688–692.
7. Dupuis J., Tardif J.C., Cernacek P., Theroux P. Cholesterol reduction improves endothelial function after acute coronary syndromes. The RECIFE (reduction of cholesterol in ischemia and function of the endothelium) trial // Circulation. — 1999. — Vol. 99. — P. 3227–3333.
8. Ridker P.M., Rifai N., Miles J.S. et al. Lovastatin 20–40 mg/day lowers high sensitivity C-reactive protein levels in AFCAPS/TexCAPS (Abstr.) // Circulation. — 2000. — Vol. 102. (Suppl.). — P. 833.
9. Lefer A.M., Campbell B., Shin Y.K. et al. Simvastatin preserves the ischemic-reperfused myocardium in normocholesterolemic rat hearts // Circulation. — 1999. — Vol. 100. — P. 178–184.
10. Schwartz G.G., Olsson A.G., Ezekowitz M.D. et al. for the Myocardial Ischaemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators. Effects of atorvastatin on early recurrent ischaemic events in acute coronary syndromes. The MIRACL study: a randomized controlled trial // J. Am. Med. Assoc. — 2001. — 285. — 1711–1718.
11. Cannon C.P., Braunwald E., McCabe C.H. et al. for the Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes // N. Eng. J. Med. — 2004. — 350. — 1495–1504.
12. Patti G., Pasceri V., Colonna G., Miglionico M., Fischetti D., Sardella G., Montinaro A., Di Sciascio G. Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention: results of the ARMYDA-ACS randomized trial // J. Am. Coll Cardiol. — 2007. — 49. — 1272–1278.
13. Kayikcioglu M., Turkoglu C., Kultursay H. et al. Combined use of pravastatin and thrombolytic agents in acute myocardial infarction. Pravastatin Turkish trial // Circulation. — 1999. — Vol. 100 (Suppl. I). — P. 1–303.
14. Thompson P.L., Meredith I., Amerena J. et al. Effect of pravastatin compared with placebo initiated within 24 hours of onset of acute myocardial infarction or unstable angina: the Pravastatin in Acute Coronary Treatment (PACT) trial // Am. Heart J. — 2004. — 148. — e2.
15. Hamm C.W., Bassand J.P., Agewall S. et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation // EHJ. — 2011. — 32. — 2999–3054.
16. Reiner Z., Catapano A.L., De Backer G. et al. ESC/EAS Guidelines for the management of dyslipidaemias // EHJ. — 2011. — 32. — 1769–1818.
17. Van de Werf F., Bax J., Betriu A. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation // EHJ. — 2008. — 29. — 2909–2945.
18. Пархоменко А.Н., Лутай Я.М., Даншан Н. Регистр острого инфаркта миокарда — характеристика пациентов, организация медицинской помощи в первые сутки и внутригоспитальная терапия // Укр. мед. часопис. — 2011. — № 1–2. — С. 20–24.
19. Foley K.A., Simpson R.J. Jr, Crouse J.R. 3rd et al. Effectiveness of statin titration on low-density lipoprotein cholesterol goal attainment in patients at high risk of atherogenic events // Am. J. Cardiol. — 2003. — 92. — 79–81.
20. Dembowski E., Davidson M.H. Statin and ezetimibe combination therapy in cardiovascular disease // Curr. Opin. Endocrinol. Diabetes Obes. — 2009. — 16. — 183–8.
21. Ballantyne C.M., Andrews T.C., Hsia J.A. et al. // Am. J. Cardiol. — 2001. — 88. — 265–269.
22. Jones P.H., Davidson M.H., Stein E.A. et al. Comparison of the efficacy and safety of rosuvastatin vs. atorvastatin, simvastatin, and pravastatin across doses (STELLAR* Trial) // Am. J. Cardiol. — 2003. — 92. — 152–60.
23. Dujovne C.A., Ettinger M.P., McNeer J.F. et al. Efficacy and safety of a potent new selective cholesterol absorption inhibitor, ezetimibe, in patients with primary hypercholesterolemia // Am. J. Cardiol. — 2002. — 90. — 1092–7.
24. Knopp R.H., Gitter H., Truitt T. et al. Effects of ezetimibe, a new cholesterol absorption inhibitor, on plasma lipids in patients with primary hypercholesterolemia // Eur. Heart J. — 2003. — 24. — 729–41.
25. Altmann S.W., Davis H.R. Jr, Zhu L.J. et al. Niemann-Pick C1 Like 1 protein is critical for intestinal cholesterol absorption // Science. — 2004. — 303. — 1201–4.
26. Sudhop T., Lutjohann D., Kodal A. et al. Inhibition of intestinal cholesterol absorption by ezetimibe in humans // Circulation. — 2002. — 106. — 1943–8.
27. Ballantyne C.M., Houri J., Notarbartolo A. et al. Effect of ezetimibe coadministered with atorvastatin in 628 patients with primary hypercholesterolemia: a prospective, randomized, double-blind trial // Circulation. — 2003. — 107. — 2409–15.
28. Genest J. Combination of statin and ezetimibe for the treatment of dyslipidemias and the prevention of coronary artery disease // Can. J. Cardiol. — 2006. — 22. — 863–8.
29. Fossati P., Prencipe L. Serum triglycerides determined colorimetrically with an enzyme that produces hydrogen peroxide // Clin. Chem. — 1982. — № 28. — P. 2077–2080.
30. Allain C.C., Poon L.S., Chan C.S.G. et al. Enzymatic determination of total serum cholesterol // Clin. Chem. — 1974. — № 20. — P. 470–475.
31. Price C.P., Trull A.K., Berry D. Development and validation of a particle-enhanced turbidimetric immunoassay for C-reactive protein // J. Immunol. Methods. — 1987. — 99. — 205–211.
32. Otsuji S., Shibata H., Umeda M. Turbodimeric immunoassay of serum C-reactive protein // Clin. Chem. — 1982. — 28. — 2121–4.
33. Corretti M., Anderson T., Benjamin E. et al. Guidelines for the Ultrasound Assessment of Endothelial-Dependent Flow-Mediated Vasodilatation of the Brahial Artery // J. Am. Coll. Cardiol. — 2002. — Vol. 39. — P. 257–265.
34. Амосова Е.Н. Cтатины — от эффективности к безопасности: фокус на розувастатин // Серце і судини. — 2008. — № 1. — С. 94–97.
35. Пархоменко А.Н., Брыль Ж.В., Иркин О.И., Гурьева О.С., Шумаков А.В. Раннее назначение симвастатина у больных с острым инфарктом миокарда: влияние на клиническое течение и размер поражения. Часть 1 // Украинский кардиологический журнал. — 2006. — № 4. — С. 7–13.
36. Ostad M.A., Eggeling S., Tschentscher P. et al. Flow-mediated dilation in patients with coronary artery disease is enhanced by high dose atorvastatin compared to combined low dose atorvastatin and ezetimibe: results of the CEZAR study // Atherosclerosis. — 2009. — 205. — 227–32.
37. Лутай М.И., Голикова И.П. Возможности комбинированной гиполипидемической терапии: опыт клинического применения комбинации аторвастатина и эзетимиба // Здоровье Украины. — 2012.
38. Pearson T.A., Ballantyne C.M., Veltri E. et al. Pooled analyses of effects on C-reactive protein and low density lipoprotein cholesterol in placebo-controlled trials of ezetimibe monotherapy or ezetimibe added to baseline statin therapy // Am. J. Cardiol. — 2009. — 103. — 369–74.
39. Deanfield J., Donald A., Ferri C. et al. Endothelial function and dysfunction. Part I: methodological issues for assessment in the different vascular beds: a statement by the Working Group on Endothelin and Endothelial Factors of the European Society of Hypertension // J. Hypertens. — 2005. — 23. — 7–17.
40. Lerman A., Zeiher A.M. Endothelial function: cardiac events // Circulation. — 2005. — 111. — 363–8.
41. Lind L., Fors N., Hall J., Marttala K., Stenborg A. A comparison of three different methods to evaluate endothelium-dependent vasodilation in the elderly: the Prospective Investigation of the Vasculature in Uppsala Seniors (PIVUS) study // Arterioscler. Thromb. Vasc. Biol. — 2005. — 25. — 2368–75.
42. Bulut D., Hanefeld C., Bulut-Streich N. et al. Endothelial function in the forearm circulation of patients with the metabolic syndrome-effect of different lipid-lowering regimens // Cardiology. — 2005. — 104. — 176–80.
43. Olijhoek J.K., Hajer G.R., van der Graaf Y. et al. The effects of low-dose simvastatin and ezetimibe compared to high-dose simvastatin alone on post-fat load endothelial function in patients with metabolic syndrome: a randomized double-blind crossover trial // J. Cardiovasc. Pharmacol. — 2008. — 52. — 145–50.
44. Gounari P., Tousoulis D., Antoniades C. et al. Rosuvastatin but not ezetimibe improves endothelial function in patients with heart failure, by mechanisms independent of lipid lowering // Int. J. Cardiol. — 2009. — 142. — 87–91.
45. Landmesser U., Bahlmann F., Mueller M. et al. Simvastatin vs ezetimibe: pleiotropic and lipid-lowering effects on endothelial function in humans // Circulation. — 2005. — 111. — 2356–63.
46. Fichtlscherer S., Schmidt-Lucke C., Bojunga S. et al. Differential effects of short-term lipid lowering with ezetimibe and statins on endothelial function in patients with CAD: clinical evidence for 'pleiotropic' functions of statin therapy // Eur. Heart J. — 2006. — 27. — 1182–90.
47. Курята А.В., Фролова Е.А. Липидный спектр и функция эндотелия сосудов у пациентов с хронической болезнью почек III стадии. Эффективность применения комбинированной терапии эзетимиб/аторвастатин // Укр. мед. часопис. — 2011. — № 11–12. — С. 71–73.
48. Ye Y., Zhao X., Zhai G., Guo L., Tian Z., Zhang S. Effect of High-Dose Statin Versus Low-Dose Statin Plus Ezetimibe on Endothelial Function: A Meta-analysis of Randomized Trials // J. Cardiovasc. Pharmacol. Ther. — 2012 Jun 18.
49. Nakamura T., Sato E., Fujiwara N. et al. Ezetimibe decreases serum levels of asymmetric dimethylarginine (ADMA) and ameliorates renal injury in non-diabetic chronic kidney disease patients in a cholesterol-independent manner // Pharmacol. Res. — 2009. — 60. — 525–8.
50. Kuhlencordt P.J., Padmapriya P., Rutzel S. et al. Ezetimibe potently reduces vascular inflammation and arteriosclerosis in eNOS-deficient ApoE ko mice // Atherosclerosis. — 2009. — 202. — 48–57.
51. Nakagami H., Osako M.K., Takami Y. et al. Vascular protective effects of ezetimibe in ApoE-deficient mice // Atherosclerosis. — 2009. — 203. — 51–8.
52. Westerweel P.E., Visseren F.L., Hajer G.R. et al. Endothelial progenitor cell levels in obese men with the metabolic syndrome and the effect of simvastatin monotherapy vs simvastatin/ezetimibe combination therapy // Eur. Heart J. — 2008. — 29. — 2808–17.
53. Hussein O., Minasian L., Itzkovich Y., Shestatski K., Solomon L., Zidan J. Ezetimibe’s effect on platelet aggregation and LDL tendency to peroxidation in hypercholesterolaemia as monotherapy or in addition to simvastatin // Br. J. Clin. Pharmacol. — 2008. — 65. — 637–65.
54. Maki-Petaja K.M., Booth A.D., Hall F.C. et al. Ezetimibe and simvastatin reduce inflammation, disease activity, and aortic stiffness and improve endothelial function in rheumatoid arthritis // J. Am. Coll. Cardiol. — 2007. — 50. — 852–8.
55. Undas A., Machnik A., Potaczek D.P. et al. Ezetimibe combined with simvastatin compared with simvastatin alone results in a greater suppression of oxidative stress and enhanced fibrinolysis in patients after acute coronary events // J. Cardiovasc. Pharmacol. — 2011 Aug. — 58(2). — 167–72.
56. Lin C.F., Gau C.S., Wu F.L. et al. Impact of ezetimibe coadministered with statins on cardiovascular events following acute coronary syndrome: a 3-year population-based retrospective cohort study in Taiwan // Clin. Ther. — 2011 Sep. — 33(9). — 1120–31. Epub 2011 Aug 27.
57. Rossebø A.B., Pedersen T.R., Boman K. et al., for the SEAS Investigators Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis // N. Engl. J. Med. — 2008. — 359. — 1343–1356.
58. SHARP Collaborative Group. Study of Heart and Renal Protection (SHARP): Randomized trial to assess the effects of lowering low-density lipoprotein cholesterol among 9,438 patients with chronic kidney disease // American Heart Journal. — 2010. — 160(5). — 785–794.e10.
59. Califf R.M., Lokhnygina Y., Cannon C.P. et al. An update on the IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE–IT) design // American Heart Journal. — 2010. — 159(5). — 705–709.

/21/21.jpg)
/22/22.jpg)
/22/22_2.jpg)
/23/23.jpg)
/24/24.jpg)