Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Диагностика тяжести ишемического инсульта методом определения уровня маркеров повреждения центральной нервной системы
Авторы: Черний В.И., Городник Г.А., Куглер С.Е. - Донецкий национальный медицинский университет им. М. Горького, кафедра анестезиологии, ИТ, МНС и кардиохирургии УНИПО
Рубрики: Медицина неотложных состояний, Неврология
Разделы: Клинические исследования
Версия для печати
В статье представлены данные клинического, неврологического и иммунологического обследования 116 пациентов в возрасте от 36 до 69 лет в острейшем периоде ишемического инсульта. Изучена концентрация маркеров повреждения нервной ткани (NSE, GFAP). Разработана собственная тест-система мозгового антигена для определения повреждения серого и белого вещества головного мозга. При помощи методов иммунохимического анализа доказано, что включение нейропротективного комплекса в терапию острейшего периода ишемического инсульта значительно улучшает функциональное состояние нейронального и глиального комплекса, препятствует разрушению гематоэнцефалического барьера.
У статті подано дані клінічного, неврологічного та імунологічного обстеження 116 пацієнтів віком від 36 до 69 років у найгострішому періоді ішемічного інсульту. Вивчено концентрацію маркерів пошкодження нервової тканини (NSE, GFAP). Розроблено власну тест-систему мозкового антигену для визначення пошкодження сірої та білої речовини головного мозку. За допомогою методів імунохімічного аналізу доведено, що включення нейропротективного комплексу в терапію найгострішого періоду ішемічного інсульту значно покращує функціональний стан нейронального та гліального комплексу, перешкоджає руйнуванню гематоенцефалічного бар’єру.
The article presents the data of clinical, neurological and immunological examination of 116 patients aged 36 to 69 years with acute ischemic stroke. We studied the concentration of nervous tissue damage markers (NSE, GFAP). We developed our own test system of brain antigen to determine damage in gray and white matter of the brain. Using the methods of immunochemical analysis we proved that the inclusion of neuroprotective complex in the treatment of acute ischemic stroke significantly improves the functional state of the neuronal and glial complex, prevents destruction of the blood-brain barrier.
ишемический инсульт, нейронспецифические белки, мозговой антиген, инфузионная терапия, диагностика, нейропротекция.
ішемічний інсульт, нейронспецифічні білки, мозковий антиген, інфузійна терапія, діагностика, нейропротекція.
ischemic stroke, neuron-specific proteins, brain antigen, infusion therapy, diagnosis, neuroprotection.
Статья опубликована на с. 80-82
Ключевым вопросом в лечении инсульта является понимание важности изучения степени поражения мозговой ткани и гематоэнцефалического барьера (ГЭБ). Известные изменения в зоне пенумбры, сформированные преимущественно под патологическим воздействием глутаматного каскада, и есть главная цель в терапии ишемического инсульта. Доказана общность патогенетических изменений как при ишемическом инсульте, так и при нарушениях мозгового кровообращения по геморрагическому типу и травмах мозга [8, 9]. Обозначена чрезвычайно важная роль глиальных клеток в патофизиологии инсульта [9]. Были получены убедительные доказательства обратимости деструктивных процессов, происходящих на клеточном уровне [9].
В последнее время все больше внимания привлекает диагностика инсульта, включающая определение уровня нейронспецифических белков, отражающих степень постишемических повреждений мозга. На сегодняшний день наиболее изученными маркерами повреждения центральной нервной системы и головного мозга являются нейронспецифическая энолаза (NSE) и глиофибриллярный кислый протеин (GFAP). NSE — это общий маркер всех дифференцированных нейронов, определение этого белка в сыворотке крови дает информацию о степени повреждений нейронов и нарушениях общей целостности ГЭБ [4]. GFAP является специфическим белком филаментов астроцитов; рост антител к нему сопровождает процессы патологического разрастания астроглиальных клеток (глиоз) [12]. Одной из ключевых функций астроцитов является их участие в организации и регуляции проницаемости барьерной системы мозга (гематоэнцефалического и ликвороэнцефалического барьеров) [12]. В качестве маркера поражения астроцитов он широко применяется в диагностических целях и в экспериментальных работах при исследовании функций нервной системы в норме и при патологии [14].
Как известно, мозговая ткань, отделенная ГЭБ, принадлежит к классу скрытых аутоантигенов [10]. На фоне разрушения ГЭБ, в результате ответа на ишемию, толерантность к образцам мозговой ткани не возникает, и их попадание в кровоток может приводить к иммунному ответу, что влечет за собой развитие прямой цитотоксичности [6]. Авторы статьи считают, что перспективным методом в диагностике поражения мозговой ткани является изучение титров антител как к серому, так и к белому веществу. Возможность определения титра антител к мозговой ткани может коррелировать с изучением таких нейронспецифических белков, как нейронспецифическая энолаза (антитела к серому веществу) и глиофибриллярный кислый фибрин (белое вещество). Создание антигенного комлекса с последующим определением титра антител к серому и белому веществу головного мозга в острейшем периоде ишемического инсульта может быть реальной альтернативой использованию дорогостоящих и малодоступных маркеров повреждения ЦНС.
Цель исследования: улучшение диагностики функционального состояния головного мозга пациентов, находящихся в острейшем периоде ишемического инсульта, путем определения степени тяжести поражения различных участков ткани головного мозга при помощи уровней нейронспецифических белков и титра антител к серому и белому веществу головного мозга.
Материалы и методы
В исследование, проведенное на базе ДОКТМО (г. Донецк), были включены 116 пациентов с диагнозом «острое нарушение мозгового кровообращения по ишемическому типу в острейшем периоде» (72 мужчины и 44 женщины). Возраст пациентов — от 36 до 69 лет. Объем исследования у пострадавших: клиническая оценка состояния больных, оценка по шкале комы Глазго и NIHSS, компьютерная томография головного мозга. Пациенты поступали в стационар не ранее чем через 7 часов от начала заболевания. Неврологический статус по шкале NIHSS и уровень сознания по ШКГ оценивали на 1, 7, 10 и 14-е сутки от момента поступления.
С целью определения степени тяжести поражения различных участков ткани головного мозга были определены уровни нейронспецифических белков (нейронспецифическая энолаза и глиофибриллярный кислый белок) методом иммунохимического анализа в острейшем периоде ишемического инсульта (на 1, 7 и 14-е сутки заболевания). Для определения антител непосредственно к серому и белому веществу мозговой ткани была разработана тест-система (ООО «УкрМед-Дон», г. Донецк). Определялись 2 класса антител к мозговой ткани (серому и белому веществу головного мозга) — IgG и IgM. Результаты учитывались на анализаторе ChemWell 2910 (США) и выражались в единицах оптической плотности (OD).
Интенсивная терапия у пациентов проводилась согласно приказам MЗ Украины № 487 и 602 на базе отделения нейрореанимации ДОКТМО для больных с тяжелой степенью неврологического дефицита (оценка по шкале NIHSS более 13 баллов) и в отделении неврологии ДОКТМО для больных со средней степенью тяжести неврологического дефицита (оценка по шкале NIHSS менее 13 баллов). Пациенты методом случайных чисел были рандомизированы на 4 группы. Во всех случаях получено письменное информированное согласие пациента. Больные 1-й (тяжелая степень, 28 чел.) и 3-й (средняя степень, 27 чел.) групп получали лечение с применением комплекса нейропротекции. Больные 2-й (тяжелая степень, 32 чел.) и 4-й (средняя степень, 29 чел.) групп получали лечение согласно приказам. В комплекс первичной нейропротекции входили препараты, направленные на восстановление реологических свойств крови, микроциркуляции, эндотелиальной функции, функционального состояния нейроглии и гематоэнцефалического барьера: L-лизина эсцинат, латрен, реосорбилакт, препараты гидроксиэтилкрахмала. Вторичная нейропротекция — препараты, влияющие на регенераторно-репаративные процессы в нейроцитах и клетках глии: тиоцетам, актовегин, цереброкурин, глиатилин, цитиколин [5].
Статистическая обработка данных проводилась с использованием методов описательной статистики в лицензионной программе MedStat. Результаты, полученные при p < 0,05, считались статистически значимыми.
Результаты и их обсуждение
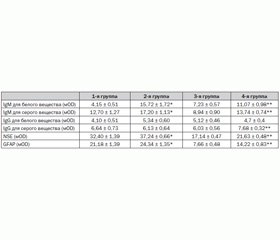
В 4 группах были сравнены результаты лечения на 14-е сутки — попарное сравнение (между группами с нейропротекцией и без нее) по IgM, IgG, нейронспецифической энолазе (NSE), глиальному кислому фибрину (GFAP). По всем 4 показателям в четырех группах при поступлении в клинику не было статистически значимой разницы (табл. 1).
Были определены титры антител к IgM для серого и белого вещества: в группе 1 уровень IgМ был статистически достоверно ниже, чем в группе 2, на 14-е сутки лечения. Были также определены титры антител к IgM для серого и белого вещества у пациентов со средней степенью тяжести инсульта: в группе 3 уровень IgМ был статистически достоверно ниже, чем в группе 4. Также были определены показатели IgG для серого и белого вещества. В группе 1 уровень IgG не был статистически достоверно ниже, чем в группе 2. Однако по значениям средних величин уровень IgG в группе 1 был ниже, чем в группе 2. По IgG для белого вещества: в группе 3 уровень IgG также не был статистически достоверно ниже, чем в группе 4. По IgG для серого вещества: в группе 3 уровень IgG был статистически достоверно ниже, чем в группе 4.
При помощи методов иммунохимического анализа были определены уровни маркера NSE. В группе 1 и 3 уровень антител на 14-е сутки лечения был статистически достоверно ниже, чем в группе 2 и 4 (p = 0,004). Более низкие уровни NSE в группах 1 и 3 свидетельствуют о меньшей выраженности нейродегенеративных процессов в результате применения нейропротективного комплекса.
Полученные нами данные в группе пациентов, получавших комплекс нейропротекции, свидетельствуют о меньшем повреждении ГЭБ и мозговой ткани и напрямую связаны с эффективностью выбранного комплекса нейропротекции. Неинформативность иммуноглобулина класса G при средней степени тяжести инсульта связана с проявлением его максимальной активности к 3-й неделе заболевания.
Выводы
1. Анализ динамики уровня маркеров поражения головного мозга показал, что в группах пациентов (1-я и 3-я), у которых применялся комплекс нейропротекции, на 14-е сутки лечения иммунный ответ на повреждение головного мозга был статистически значимо ниже, чем в группах пациентов (2-я и 4-я), где лечение проводилось согласно приказу МЗУ, также улучшалось состояние астроцитарного и нейронального комплекса, функционирование ГЭБ.
2. Разработанная нами тест-система мозгового антигена может быть использована для диагностики состояния белого и серого вещества головного мозга и степени проницаемости ГЭБ, что дает более точную информацию о степени тяжести ишемического инсульта, а определение уровня нейронспецифических белков NSE и GFAP позволяет получить точную информацию о функциональном состоянии мозговой ткани в текущий момент лечения острейшего периода ишемического инсульта.
1. Аванесян Р.А. Нейрофункциональные методы терапии (биологическая обратная связь) в комплексном лечении невралгии тройничного нерва: Автореф. дис… канд. мед. наук. — М., 2009. — С. 18.
2. Алферова В., Гехт Б., Полетаев А.Б., Абросимова А.А., Беликова Л.П., Чумакова А.А., Николаева Т.Я., Гусев Е.И. Нейротропные естественные аутоантитела класса IgG в сыворотке крови больных с ишемическим инсультом // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2008. — Т. 108, № 1. — С. 56–60.
3. Нейротрофические факторы и антитела к ним: участие в развитии нейроиммунных реакций при различных нарушениях нервной системы / М.А. Грудень, В.В. Шерстнев, Н.М. Ефремова и др. // Нейроиммунология: Материалы X конференции. — СПб., 2007. — С. 57.
4. Повреждение головного мозга при тяжелой травме: значимость клинических шкал и нейрональных маркеров / Т.Г. Гришанова, А.В. Будаев, Е.В. Григорьев // Медицина неотложных состояний. — 2011. — № 1/2. — С. 86–90.
5. Черний Т.В., Натрус Л.В., Шлопов В.Г., Волос Л.И., Зяблицев С.В., Якубенко Е.Д. Разработка стратегии нейропротекции в эксперименте на модели черепно-мозговой травмы // Нейронауки: теоретичні та клінічні аспекти. — 2012. — Т. 8, № 2.
6. Engelhardt B., Sorokin L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction // Semin. Immunopathol. — 2009 Nov. — 31(4). — Р. 497–511. — doi: 10.1007/s00281–009–0177–0. Epub. 25 Sep 2009.
7. Fellin T. et al. Endogenous nonneuronal modulators of synaptic transmission control cortical slow oscillations in vivo // Proc. Natl Acad. Sci. USA. — 2009. — 106. — 15037–15042. PMID 19706442.
8. Goldstein L.B., Bushnell C.D., Adams R.J., Appel L.J., Braun L.T., Chaturvedi S., Creager M.A. Guidelines for the Primary Prevention of Stroke. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association // Stroke. — 2 Dec 2010.
9. Guidelines for the Early Management of Adults With Ischemic Stroke. A Guideline From the American Heart Association/American Stroke Association Stroke Council, in Research Interdisciplinary Working Groups, 2007.
10. Neuron–glia interactions: Glia make waves — Leonie Welberg; Nature Reviews Neuroscience, advance online publication, Published online 9 September 2009. — doi:10.1038/nrn2724.
11. Ribotta M.G., Menet V., Privat A. Glial scar and axonal regeneration in the CNS. Lessons from GFAP and vimentin transgenic mice // Acta Neurochir. Suppl. — 2004. — 89. — Р. 87–92.
12. Stadler K. Peroxynitrite-Driven Mechanisms in Diabetes and Insulin Resistance — the Latest Advances // Curr. Med. Chem. — 29 Nov 2010.
13. Yarygin K.N., Skvortsova V.I. Mechanisms of positive effects of transplantation of human placental mesenchymal stem cells on recovery of rats after experimental ischemic stroke // Bull. Exp. Biol. Med. — Dec 2009. —148(6). — Р. 862–8.
14. Zhu H., Dahlstrom A. Glial fibrillary acidic protein-expressing cells in the neurogenic regions in normal and injured adultbrains // J. Neurosci. Res. — 2007. — 85. — Р. 2783–2792.

/81/81.jpg)