Международный эндокринологический журнал 3 (59) 2014
Вернуться к номеру
Особливості імунологічних та метаболічних змін у пацієнтів із поєднаною ендокринною патологією на тлі недостатнього забезпечення вітаміном D3
Авторы: Комісаренко Ю.І., Курченко А.І., Антоненко О.В. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Семейная медицина/Терапия, Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета. Дослідження рівня фонової концентрації цитокінів у хворих із поєднаною ендокринною патологією — цукровим діабетом (ЦД) 1-го або 2-го типу та автоімунним тиреоїдитом (АІТ) на тлі недостатнього забезпечення вітаміном D3.
Методи. Обстежені пацієнти з ЦД 1-го і 2-го типу в поєднанні з автоімунним тиреоїдитом мали знижений рівень вітаміну D3 і становили дві групи (1-ша — 28 і 2-га — 30 пацієнтів). У всіх пацієнтів АІТ супроводжувався гіпотиреозом. Визначався рівень цитокінів Th1-профілю (IFN-γ, TNF-a, ІL-2, ІL-6, ІL-12), Th2-профілю (ІL-4, ІL-5), а також ІL-10 і ІL-17. Кількість вітаміну D3 оцінювалася за рівнем 25(OH)D3.
Результати. У пацієнтів із поєднаною ендокринною патологією — ЦД і АІТ (з гіпотиреозом) на тлі вираженого дефіциту вітаміну D3 визначалося вірогідне збільшення фонової концентрації цитокінів Th1-профілю (IFN-γ, TNF-α, IL-2, IL-6, IL-12) і зменшення концентрації цитокінів Th2-профілю (IL-4, IL-5), а також IL-10 і IL-17.
Висновки. Наявність двох ендокринних захворювань і вираженого дефіциту вітаміну D3 призводить до виникнення дисбалансу в імунному статусі пацієнтів, підтримує автоімунний запальний процес і створює умови для прогресування або передчасного виникнення ускладнень. Подальші дослідження, можливо, підтвердять необхідність додаткового використання препаратів вітаміну D3 у профілактиці та лікуванні полігландулярної патології з метою корекції метаболічних та імунологічних зрушень.
Цель. Исследование уровня фоновой концентрации цитокинов у больных с сочетанной эндокринной патологией — сахарным диабетом (СД) 1-го или 2-го типа и аутоиммунным тиреоидитом (АИТ) на фоне недостаточного обеспечения витамином D3.
Методы. Обследованные пациенты с СД 1-го и 2-го типа в сочетании с АИТ имели пониженный уровень витамина D3 и составили две группы (1-я —28, 2-я — 30 пациентов). У всех пациентов АИТ сопровождался гипотиреозом. Определялся уровень цитокинов Th1-профиля (IFN-γ, TNF-α, IL-2, IL-6, IL-12), Th2-профиля (IL-4, IL-5), а также IL-10 и IL-17. Количество витамина D3 оценивалось по уровню 25(OH)D3.
Результаты. У пациентов с сочетанной эндокринной патологией — СД и АИТ (с гипотиреозом) на фоне выраженного дефицита витамина D3 определялось достоверное увеличение фоновой концентрации цитокинов Th1-профиля (IFN-γ, TNF-α, IL-2, IL-6, IL-12) и уменьшение концентрации цитокинов Th2-профиля (IL-4, IL-5), а также IL-10 и IL-17.
Выводы. Наличие двух эндокринных заболеваний и выраженного дефицита витамина D3 ведет к возникновению дисбаланса в иммунном статусе пациентов, поддерживает аутоиммунный воспалительный процесс и создает условия для прогрессирования или преждевременного возникновения осложнений. Дальнейшие исследования, возможно, подтвердят необходимость дополнительного использования препаратов витамина D3 в профилактике и лечении полигландулярной патологии с целью коррекции метаболических и иммунологических сдвигов.
Aim. To study the cytokines background concentration in patients with combined endocrine pathology — diabetes mellitus (DM) type 1 or 2 and autoimmune thyroiditis secondary to vitamin D3 deficiency.
Methods. The examined patients with DM type 1 and type 2 combined with autoimmune thyroiditis had reduced levels of D3 vitamin. They were divided into two groups of 28 and 30 patients respectively. All patients with autoimmune thyroiditis had hypothyroidism. The levels of Th1-cytokine profile (IFN-γ, TNF-α, IL-2, IL-6, IL-12), Th2-profile (IL-4, IL-5) and IL-10 and IL-17 were determined. The amount of vitamin D3 was assessed by the level of 25(OH)D.
Results. The patients with combined endocrine disorders — DM and autoimmune thyroiditis (with hypothyroidism) secondary to vitamin D3 deficiency had a significant increase in the background concentration of Th1-cytokine profile (IFN-γ, TNF-α, IL-2, IL-6, IL-12) and a reduced cytokine concentrations of Th2-cytokine profile (IL-4, IL-5) as well as IL-10 and IL-17.
Conclusions. The presence of two endocrine diseases and florid vitamin D3 deficiency leads to an imbalance in the immune status of patients, supports an autoimmune inflammatory process and contributes to the progression or advanced development of complications. Further research may confirm the need for the use of vitamin D3 for the prevention and treatment of multiple endocrinopathy to correct metabolic and immunological changes.
цукровий діабет 1-го і 2-го типу, автоімунний тиреоїдит, дефіцит вітаміну D3, цитокіни Th1-профілю (IFN-γ, TNF-α, ІL-2, ІL-6, ІL-12), Th2-профілю (ІL-4, ІL-5), ІL-10 та ІL-17.
сахарный диабет 1-го и 2-го типов, аутоиммунный тиреоидит, дефицит витамина D3, цитокины Th1-профиля (IFN-γ, TNF-α, IL-2, IL-6, IL-12), Th2-профиля (IL-4, IL-5), IL-10 и IL-17.
diabetes mellitus type 1 and type 2, autoimmune thyroiditis, vitamin D3, Th1-cytokine profile (IFN-γ, TNF-α, IL-2, IL-6, IL-12), Th2-cytokine profile (IL-4, IL-5), IL-10 and IL-17.
Статья опубликована на с. 22-26
Поєднання ендокринних захворювань (ПЕЗ) — це первинне ураження двох або більше ендокринних залоз, що часто пов’язано з різними неендокринними захворюваннями. ПЕЗ — патологія двох ендокринних залоз, зокрема острівцевого апарату підшлункової залози (цукровий діабет) і захворювань щитоподібної залози (ЩЗ). Ця форма полігландулярного синдрому є найбільш поширеною в практиці лікарів-ендокринологів [1, 2].
За останні 20 років спостерігається постійне зростання частоти ПЕЗ. Несприятлива епідемічна тенденція щодо поліендокринопатій є дуже актуальною для нашої країни, особливо з урахуванням наслідків Чорнобильської катастрофи. У перше десятиліття після аварії переважними були поєднання цукрового діабету (ЦД) із дифузним токсичним зобом, а згодом значно зросло поєднання ЦД з тиреоїдитами, в осіб старшого віку — з вузлоутворенням у ЩЗ.
ЦД 1-го і 2-го типу, як і автоімунний тиреоїдит (АІТ), останнім часом є найбільш поширеним захворюванням в ендокринологічній практиці, а в регіонах «чорнобильського сліду» має постійну тенденцію до прогресування.
У клініці виділяють I, II і III типи автоімунного полігландулярного синдрому (АПС): АПС Ι (кандидоз шкіри та слизових оболонок, автоімунний гіпопаратиреоз, надниркова недостатність), АПС ΙΙ (хвороба Аддісона у поєднанні з ЦД 1-го типу чи автоімунною тиреоїдною патологією), АПС ΙΙΙ (автоімунна тиреоїдна патологія у поєднанні з іншими автоімунними захворюваннями, крім хвороби Аддісона чи ЦД 1-го типу).
За провідними механізмами розвитку імуноендокринну патологію можна розподілити на дві групи. Одну становлять ендокринопатії, обумовлені автоімунною деструкцією гормонсекретуючих клітин. Друга представлена дисрегуляторними синдромами, коли автоімунний процес супроводжується стимуляцією або, навпаки, блокадою ендокринної функції. Рідкісним варіантом патогенезу, характерним переважно для вторинних імуноендокринних синдромів, є пряма гормоноподібна дія медіаторів імунних реакцій, які в надлишку секретуються імунокомпетентними клітинами при їх подразненні чи ураженні [3, 4].
АПС характеризується наявністю автоімунного тиреоїдного захворювання у комбінації з іншим автоімунним порушенням, у тому числі ендокринопатією. Даний тип синдрому може складатися принаймні з трьох клінічних комбінацій: перший варіант — поєднання автоімунної тиреопатії з ЦД; другий варіант — наявність автоімунних шлункових порушень (поява антитіл до парієтальних клітин) та автоімунної тиреоїдної патології; третій варіант — будь-яке інше органоспецифічне автоімунне захворювання, наприклад міастенія з автоімунною тиреоїдною патологією.
Іншою загальною та досить поширеною проблемою, що має виражені клінічні наслідки, є дефіцит вітаміну D. За даними W.P.T. James, у світі нараховується 1 млрд людей, які мають дефіцит та недостатність вітаміну D3 [5].
В останні роки сучасні наукові уявлення про біологічну роль вітаміну D3 в організмі поповнились новими відомостями, що значною мірою дозволило переглянути погляди на значення цього вітаміну в біології і медицині.
Таким чином, традиційна характеристика вітаміну D3 як гормону-регулятора мінерального обміну доповнилась новими даними, що дозволили суттєво змінити погляд на фізіологічну роль цього вітаміну [6]. Відкриття рецепторів до гормонально активних форм вітаміну D3 та їх синтез у клітинах нетрадиційних для цього вітаміну органів та тканин передбачає більш широкий спектр фізіологічного ефекту вітаміну [7].
Розглядається два механізми впливу вітаміну D3 на фізіологічні процеси: на рівні геному і негеномні ефекти. На рівні геному метаболіти вітаміну D3 проявляють фізіологічний ефект шляхом, близьким до дії стероїдних гормонів [8]. Другий механізм дії вітаміну D3 проявляється через мембрану.
Встановлено, що вітамін D3 бере участь у проліферації і диференціації клітин багатьох органів і тканин, у процесі модуляції імунної відповіді, функціональної активності серцево-судинної системи, шлунково-кишкового тракту, клітин м’язової тканини [9]. Враховуючи, що вітамін D3 також бере участь у регуляції багатьох фізіологічних процесів в організмі, його препарати широко застосовуються для профілактики та лікування не тільки порушень мінерального обміну. Так, отримані позитивні ефекти від лікування холекальциферолом та його активними метаболітами імунодефіцитних станів, анемії, ЦД, різних патологічних станів печінки, шлунково-кишкового тракту, серцево-судинної системи, туберкульозу, злоякісних пухлин молочних залоз і кишечника та ін.
Метою нашого дослідження було визначення рівня фонової концентрації цитокінів у хворих із поєднаною патологією — цукровим діабетом 1-го або 2-го типу та АІТ на тлі недостатнього забезпечення вітаміном D3.
Матеріали та методи
Нами були проаналізовані дані досліджень хворих із поєднаною ендокринною патологією — ЦД 1-го і 2-го типу та АІТ віком ≥ 20 років. Пацієнти перебували на лікуванні в стаціонарних відділеннях Київського міського центру ендокринології та обміну речовин.
Обстежені пацієнти з ЦД 1-го і 2-го типу в поєднанні з АІТ мали знижений рівень вітаміну D3 і становили дві групи (1-ша — 28 і 2-га — 30 пацієнтів). У всіх пацієнтів АІТ супроводжувався гіпотиреозом. У всіх хворих визначався рівень цитокінів Th1-профілю (IFN-γ, TNF-α, ІL-2, ІL-6, ІL-12), Th2-профілю (ІL-4, ІL-5), а також ІL-10 і ІL-17.
Рівень 25(ОН)D3 оцінювався за допомогою імуноферментного методу кількісного визначення — Kit 25-OH D IDS OCTEIA (Immunodiagnostik, Bensheim and Biomedica, Відень, Австрія).
Аналіз отриманих результатів проводився з використанням методів варіаційної статистики з розрахунком частотних характеристик показників (Р), середніх величин (середньої арифметичної — Х) та оцінкою їх варіабельності (середнє квадратичне відхилення — σ).
Оцінка статистичної значущості відмінностей між порівнюваними групами за досліджуваними показниками проводилася з використанням критерію Вілкоксона — Манна — Уїтні.
Статистична значимість результатів оцінювалася при завданому граничному рівні похибки першого роду (α) не вище 5 % (p < 0,05).
Результати та їх обговорення
У всіх пацієнтів із цукровим діабетом у поєднанні з АІТ спостерігався виражений дефіцит вітаміну D3 (табл. 1).
Про достатню забезпеченість організму вітаміном D3 можна стверджувати, якщо рівень 25(ОН)D3 досягає 100 нмоль/л. При значенні показника нижче 75 нмоль/л мова йде про гіповітаміноз, унаслідок чого знижуються захисні функції організму і відбувається загострення хронічних хвороб. Дефіцит вітаміну D3 визначається при рівні 25(ОН)D3 нижче 50 нмоль/л. Крім цього, рівень метаболічних маркерів свідчив про те, що в обстежених хворих із поєднаною ендокринною патологією вуглеводний і жировий обмін перебуває в декомпенсованому стані.
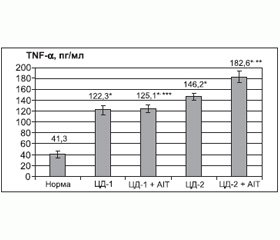
Як свідчать дані, наведені на рис. 1–9, у хворих із поєднаною ендокринною патологією (ЦД 1-го типу та АІТ) і зниженим рівнем у крові вітаміну D3 визначалося вірогідне збільшення фонової концентрації цитокінів Th1-профілю (IFN-γ, TNF-α, IL-2, IL-6, IL-12) і вірогідне зменшення концентрації цитокінів Th2-профілю (IL-4, IL-5), IL-10 (р = 0,1) і IL-17. При порівнянні з відповідними показниками ЦД 2-го типу відзначалася аналогічна тенденція, а за деякими даними — IFN-γ (р = 0,0001), IL-17 (р = 0,0001) і вірогідно більш виражена порівняно з нормою.
Як свідчать дані, наведені на рис. 1–9, у хворих із поєднаною ендокринною патологією (ЦД та АІТ) і зниженим рівнем у крові вітаміну D3 визначалося вірогідне збільшення фонової концентрації цитокінів Th1-профілю (IFN-γ , TNF-a, IL-2, IL-6, IL-12) і вірогідне зменшення концентрації цитокінів Th2-профілю (IL-4, IL-5), IL-10 і IL-17. При цьому вищевказані показники повністю корелювали з аналогічними при ЦД 2-го типу, а в більшості випадків (крім ІL-12, ІL-4 (р > 0,05)) демонстрували значне збільшення розриву з нормою.
Висновки
У хворих із поєднаною ендокринною патологією (ЦД та АІТ) на тлі вираженого дефіциту вітаміну D3 визначалося вірогідне збільшення фонової концентрації цитокінів Th1-профілю (IFN-γ , TNF-a, IL-2, IL-6, IL-12) і зменшення концентрації цитокінів Th2-профілю (IL-4, IL-5), а також IL-10 і IL-17. Це свідчить про наявність дисбалансу в імунному статусі пацієнтів, підтримує автоімунний запальний процес і створює умови для прогресування захворювання. Отримані результати дослідження автоімунного поліендокринного синдрому свідчать, що патологія, яка виникає другою, може значно погіршити перебіг усього захворювання загалом і сприяти ранній появі ускладнень. З огляду на те, що у пацієнтів відзначався виражений дефіцит вітаміну D3, препарати цього вітаміну можуть бути використані в профілактиці та лікуванні полігландулярної патології з метою корекції метаболічних та імунологічних зрушень.
1. Боднар П.М., Комісаренко Ю.І., Конах В.М., Матюшенко В.В. Автоімунний полігландулярний синдром // Лікування та діагностика. — 2001. — № 2. — С. 31–36.
2. Боднар П.М., Комісаренко Ю.І. Автоімунні поліендокринопатії // Мистецтво лікування. — 2004. — № 3. — С. 62–64.
3. Burek C.L. Autoimmune thyroiditis research at Johns Hopkins University // Immunol. Res. — 2010. — Vol. 47. — P. 207–215.
4. Harrison’s Endocrinology / J. Larry Jameson. — Mc Grew-Hill, USA, 2006. — 563 p.
5. James W.P.T. 22nd Marabou Symposium: The changing faces of vitamin D / W.P.T. James // Nutr. Rev. — 2008. — Vol. 66. — P. 286–290.
6. Panda D.K. Targeted ablation of the 25-hydroxyvitamin D1 alpha-hydroxylase enzyme: evidence for skeletal reproductive and immune dysfunction / D.K. Panda, D. Miao, M.L. Tremblay [et al.] // Proc. Natl. Acad. Sci. USA. — 2001. — Vol. 98, № 13. — P. 7498–7503.
7. Rojas-Rivera J. The expanding spectrum of biological actions of vitamin D / J. Rojas-Rivera, C. De La Piedra, A. Ramos [et al.] // Nephrol. Dial. Transplant. — 2010. — Vol. 25(9). — P. 2850–2865.
8. Yamamoto H. The caudal-related homeo-domain protein Cdx-2 regulates vitamin D receptor gene expression in the small intestine / H. Yamamoto [et al.] // J. Bone Miner. Res. — 1999. — Vol. 14, № 2. — P. 240–247.
9. Maiyar A.C. Vitamin D / A.C. Maiyar, A.W. Norman // Enciclopedia of human biology. — London: Acad. Press, 1991. — Vol. 7. — P. 859–871.

/24/24.jpg)
/24/24_2.jpg)
/24/24_3.jpg)
/25/25.jpg)