Международный эндокринологический журнал 3 (59) 2014
Вернуться к номеру
Ефективність терапії альфа-ліпоєвою кислотою при синдромі діабетичної стопи
Авторы: Паньків І.В. - Коломийська центральна районна лікарня
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Стаття присвячена підвищенню ефективності лікування хворих на цукровий діабет із синдромом діабетичної стопи (СДС) шляхом застосування комплексного лікування із включенням α-ліпоєвої кислоти. Оцінена клінічна ефективність препарату α-ліпоєвої кислоти на тлі базової терапії СДС. З’ясовано позитивний вплив α-ліпоєвої кислоти на збільшення частоти повного регресу запального процесу. Доведено, що α-ліпоєву кислоту можна рекомендувати для лікування хворих на цукровий діабет із наявністю СДС, ускладненого виразково-некротичним процесом.
Статья посвящена повышению эффективности лечения больных сахарным диабетом с синдромом диабетической стопы (СДС) путем применения комплексного лечения с включением α-липоевой кислоты. Оценена клиническая эффективность препарата α-липоевой кислоты на фоне базовой терапии СДС. Показано положительное влияние α-липоевой кислоты на увеличение частоты полного регресса воспалительного процесса. Доказано, что α-липоевую кислоту можно рекомендовать для лечения больных сахарным диабетом с наличием СДС, осложненного язвенно-некротическим процессом.
The article deals with increasing the effectiveness of treatment of patients with diabetes mellitus with diabetic foot syndrome (DFS) by applying the integrated treatment with α-lipoic acid. We evaluated the clinical efficacy of the α-lipoic acid preparation on the background of basic therapy for DFS. The positive effect of α-lipoic acid on the increasing frequency of complete regression of the inflammatory process is shown. It is proved that α-lipoic acid can be recommended for the treatment of diabetic patients with DFS, complicated by ulcerative necrotizing process.
цукровий діабет, синдром діабетичної стопи, лікування, α-ліпоєва кислота.
сахарный диабет, синдром диабетической стопы, лечение, α-липоевая кислота.
diabetes mellitus, diabetic foot syndrome, treatment, α-lipoic acid.
Статья опубликована на с. 45-51
Вступ
За даними Всесвітньої організації охорони здоров’я (ВООЗ), у 215 країнах світу нараховується 376 млн хворих на цукровий діабет (ЦД) [12]. Проблема вдосконалення діагностики та диференційованих підходів до лікування ЦД та його ускладнень залишається однією з найбільш актуальних у сучасній медицині. Тенденція до постійного зростання захворюваності, особливо серед осіб працездатного віку, переважно прогресуючий перебіг, часті ускладнення, значні інвалідизація та смертність зумовлюють велике соціально-економічне значення цієї проблеми [5, 13].
Синдром діабетичної стопи (CДC) на сьогодні розглядається як одне з найтяжчих із всіх пізніх ускладнень ЦД. Діабетичні виразки стопи, гангрена й ампутації завдають значної шкоди здоров’ю, знижують якість життя хворих і супроводжуються вагомими економічними витратами [6]. У розвинутих країнах виразково-некротичні процеси спостерігаються в 5–10 % хворих на ЦД. Серед нетравматичних ампутацій нижніх кінцівок 50 % припадає саме на цих хворих [4]. Пізня діагностика, неадекватне лікування, а також відсутність чіткої системи міждисциплінарної допомоги призводять до високого числа необґрунтованих ампутацій у хворих на ЦД [1, 3].
Комбінація різних факторів ризику, насамперед периферичної нейропатії, макроангіопатії і деформацій кісток стопи, призводить до підвищення ризику утворення виразок, частота яких, за даними епідеміологічних досліджень, становить 4–10 %, щорічна захворюваність — 2–3 % серед популяції хворих на ЦД [2].
Упродовж останніх двох десятиліть накопичений значний клінічний і науковий досвід, що дозволив із нових позицій висвітлити патофізіологічні механізми формування СДС і здійснювати патогенетично обґрунтоване лікування і профілактику. Визначена провідна роль нейропатії в розвитку більшості виразкових дефектів стоп, які характеризуються хронічним перебігом, схильністю до рецидивування й порушеним загоюванням унаслідок супутньої нейропатичної мікроциркуляторної дисфункції і багатьох інших причин [11].
Однак на сьогодні далеко не завжди досягаються цільові показники при лікуванні ЦД, у багатьох лікувальних закладах не здійснюється навчання хворих заходів профілактики СДС, не проводиться скринінг хворих на ЦД із високим ризиком виникнення СДС, відсутня організація для пацієнтів групи високого ризику профілактичного подіатричного догляду в кабінетах діабетичної стопи.
Компенсація вуглеводного обміну вважається вкрай необхідною, проте недостатньою для успішного лікування нейропатичної виразки у хворих на ЦД із СДС.
До одного із сучасних напрямків консервативного лікування СДС належить антиоксидантна терапія, і в першу чергу призначення α-ліпоєвої кислоти [9]. α-ліпоєва кислота — природний метаболіт за своєю природою — бере участь у багатьох фізіологічних процесах, пов’язаних з обміном речовин, є ефективним засобом метаболічної фармакотерапії [15]. Вона має широкий спектр біологічних та фармакологічних ефектів. Це обумовлено її участю як коферменту в реакціях окислювального декарбоксилювання піровиноградної та кетоглутарової кислот, що відбуваються в матриксі мітохондрій. Ці властивості сприяють ліквідації метаболічного кетоацидозу. Шляхом утворення коензиму А α-ліпоєва кислота забезпечує перенесення ацетату й жирних кислот із цитозоля в матрикс мітохондрій для подальшого окислення. Крім того, α-ліпоєва кислота справляє гепатопротекторну дію, сприяє накопиченню глікогену в гепатоцитах, що супроводжується зменшенням вираженості жирової дистрофії гепатоцитів, активізацією метаболічної функції печінки й жовчовиділення [17].
Справляючи гіполіпідемічну дію, α-ліпоєва кислота пришвидшує окислення жирних кислот. Надходження α-ліпоєвої кислоти в організм призводить до збільшення захоплення глюкози периферичними тканинами, а її поєднане введення з інсуліном сприяє збільшенню вмісту на мембранах клітин білків — транспортерів глюкози.
α-ліпоєва кислота має виражену нейропротекторну дію, стимулює ріст нервових закінчень, посилює ендоневральний кровотік шляхом запобігання інгібуванню NO-синтетази, відновлює нервову провідність, у тому числі й у вегетативній нервовій системі. Таким чином здійснюється профілактика ішемічного ураження нервової тканини [18].
В основі нейропротекторної дії α-ліпоєвої кислоти лежить той факт, що вона сприяє нормалізації порушеного обміну в нервових клітинах і позитивно впливає на аксональний транспорт. Препарати α-ліпоєвої кислоти пришвидшують процес проведення імпульсу по нерву і нормалізують рівні глутатіону [16]. Відомо, що при оксидативному стресі відбувається активація фактора транскрипції NF-kB, який стимулює вироблення ендотеліну-1 і тканинного ендотеліального фактора — важливих складових патогенезу діабетичної нейропатії [18]. α-ліпоєва кислота запобігає обумовленій вільними радикалами активації фактора транскрипції NF-kB і тим самим відіграє важливу роль у запобіганні розвитку діабетичної нейропатії, справляючи захисний вплив на ендотеліальну дисфункцію. При цьому збільшується рівень поглинання глюкози в ендоневрії шляхом підвищення активності супероксиддисмутази й супероксидкаталази [17].
Проведені численні клінічні дослідження довели високу ефективність α-ліпоєвої кислоти при лікуванні діабетичних уражень нервової системи — діабетичної дистальної полінейропатії, енцефалопатії, СДС, діабетичної автономної нейропатії серця та шлунково-кишкового тракту, а також еректильної дисфункції. Терапевтичний успіх препаратів α-ліпоєвої кислоти при діабетичних ураженнях нервової системи обумовлений насамперед патогенетичною спрямованістю їх дії та здатністю активно накопичуватися в периферичній нервовій тканині [16]. Отже, α-ліпоєва кислота впливає на енергетичний метаболізм і редукцію окисного стресу, що зумовлює патогенетичну обґрунтованість для використання її препаратів, насамперед з метою зменшення вираженості неврологічного дефіциту.
Установлено, що α-ліпоєва кислота викликає феномен дозозалежного розростання відростків культивованих клітин нейробластоми. Зміни в текучості мембрани, що опосередковані сульфгідрильними групами α-ліпоєвої кислоти, вважаються причиною цього ефекту. Призначення α-ліпоєвої кислоти стимулює регенерацію нервових закінчень при частковій денервації, а також при експериментальній нейропатії, індукованій гексакарбоном. Іншим механізмом є здатність α-ліпоєвої кислоти діяти як радикальний зв’язувач (очищувач). На користь цього припущення свідчать такі результати експериментальних та клінічних досліджень: антиоксидантна (очисна, зв’язуюча) активність у хворих на ЦД 2-го типу пригнічена; збільшується вміст вільних радикалів з одночасним порушенням показників гемостазу, пов’язаним з ушкодженням ендотелію, спостерігається у хворих на ЦД 2-го типу з наявністю мікроальбумінурії; глутатіон, пробукол, α-токоферол і α-ліпоєва кислота запобігають пригніченню моторної та сенсорної нервової провідності, порушенню мікроциркуляції в нервовій тканині при експериментальній діабетичній нейропатії [14].
Мета роботи — встановити ефективність альфа-ліпоєвої кислоти на вміст реактантів гострої фази, інтенсивність ліпопероксидації і ступінь нейропатичної симптоматики при СДС.
Матеріали та методи дослідження
Для встановлення ефективності альфа-ліпоєвої кислоти в комплексному лікуванні СДС нами обстежено 37 хворих на ЦД 2-го типу віком від 53 до 64 років із наявністю запальної нейропатичної виразки I–II ступенів за Вагнером і терміном виникнення менше 0,5 міс. При цьому вивчалися демографічні дані (стать, вік, тривалість основного захворювання), анамнез, клінічні прояви та перебіг захворювання, стан компенсації вуглеводного та ліпідного обміну, визначався ступінь тяжкості нейропатії, її клінічні прояви, наявність виразково-некротичних уражень, їх походження (спонтанне або травматичне), наявність супутньої макроангіопатії нижніх кінцівок, стан кісток стопи, наявність проявів мікроангіопатії (зокрема, діабетичної ретинопатії і нефропатії). Хворі були розподілені на дві групи, рівноцінні за статевими, віковими та патологічними ознаками. Пацієнти першої групи (n = 16) отримували базову терапію згідно з принципами консервативного лікування СДС (компенсація ЦД, антибіотикотерапія, розвантаження стопи і місцеве лікування) [7, 10], а пацієнтам другої групи (n = 21), крім базової терапії, додатково було призначено α-ліпоєву кислоту — Еспа-ліпон® 600 (виробництва «Еспарма ГмбХ», Німеччина) внутрішньовенно краплинно у вигляді розчину для інфузій (600 мг α-ліпоєвої кислоти відповідає 24 мл препарату, розведеного в 250 мл фізіологічного розчину), один раз на добу, упродовж 15 днів. У подальшому хворі продовжували пероральний прийом Еспа-ліпону® у дозі 600 мг на добу впродовж 2,5 місяця. Теоретичним обґрунтуванням для його призначення вважали властивість a-ліпоєвої кислоти посилювати ефективність терапії СДС, здатність препарату пригнічувати синтез прозапальних цитокінів.
Діагноз діабетичної полінейропатії встановлювали за допомогою стандартного неврологічного огляду. Поріг тактильної чутливості оцінювали за допомогою 10 г монофіламенту Semmes-Weinstein, поріг вібраційної чутливості (ПВЧ) — за допомогою біотезіометра (Biothesiometer, США). Для оцінки ступеня сенсорного дефіциту використовували шкалу NDS (Young M. et al., 1993). Суб’єктивну симптоматику стану нервів нижніх кінцівок оцінювали за шкалою NSS.
Площу рани та її зміни на тлі лікування оцінювали кількісно за допомогою міліметрової сітки. Значення поєднання різних факторів у найближчому прогнозі ураження вивчали за допомогою Техаської класифікації виразкових дефектів (табл. 1).
Класифікація складається з двох частин:
— класифікація діабетичних виразок, що враховує ступінь (по горизонталі) і стадію (по вертикалі) виразкового дефекту;
— класифікація діабетичної стопи, що оцінює ризик виникнення виразки й ризик ампутації.
Перед початком стаціонарного лікування проводилось детальне клінічне, лабораторне та інструментальне обстеження всіх хворих.
Поряд із загальноприйнятими клініко-лабораторними методиками обстеження визначалися глікемічний і глюкозуричний профілі, проводилась електрокардіографія, ультразвукова допплерографія судин нижніх кінцівок.
Стан ліпідного обміну оцінювали за показниками загального холестерину (ЗХС) і фракцій холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ), холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ) і холестерину ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ), тригліцеридів (ТГ), вільних жирних кислот (ВЖК), коефіцієнта атерогенності (КА).
Рівень ВЖК крові визначався колориметричним методом. Для оцінки активності перекисного окиснення ліпідів та антиоксидантної системи захисту використовували показники малонового діальдегіду (МДА) (тест із тіобарбітуровою кислотою за методикою Р.А. Тимирбулатова, Е.М. Селезнева, 1981).
Використовуючи показники індексу маси тіла (ІМТ), ступінь ожиріння оцінювали відповідно до рекомендацій ВООЗ (1997) та Міжнародної діабетичної федерації (2005).
Із метою діагностики ускладнень ЦД і супутніх захворювань проводилися консультації офтальмолога, невропатолога, хірурга, при потребі — інших спеціалістів.
Клінічна діагностика діабетичної полінейропатії включала дослідження чутливості, визначення сухожильних і періостальних рефлексів, огляд пацієнта для визначення сили м’язів і наявності гіпотрофії. Визначення порогу вібраційної чутливості здійснювали за допомогою камертона С128 (фірми Boehringer Mannheim, Німеччина) на плеснофаланговому суглобі великого пальця стопи триразово. Поріг чутливості визначався як середня величина тричі повтореного тесту. Визначення порогу тактильної чутливості здійснювали за допомогою приладу Tactile circumferencial discriminator (фірми Wyetch-Ayerst International Inc., Німеччина) у двох стандартних точках рук і ніг. Визначення порогу температурної чутливості проводили за допомогою інструменту Tip-therm (фірми Neue Medizintechnik GmbH) для встановлення температурної чутливості. Інструмент має холодний і теплий кінці, які почергово прикладали до симетричних ділянок кінцівок. Дослідження проводили в стандартних точках рук і ніг. Оцінку больового синдрому здійснювали за допомогою шкал болю за Mc Gill. Больовий синдром визначали за суб’єктивною шкалою оцінки больових відчуттів (0 — повна відсутність болю, 20 — дуже сильний біль).
Як маркери гострої фази вивчали вміст у периферичній крові фібриногену та С-реактивного білка (СРБ), а також активність реакції фібринолізу. Уміст СРБ у плазмі крові вимірювали турбодиметричним методом. Інтенсивність окислювальної модифікації білків у сироватці крові визначали за методом О.Ю. Дубініної та співавт. у модифікації І.Ф. Мещишена. Вміст у крові відновленого глутатіону визначали титраційним методом за О.В. Травіною.
Статистичний аналіз результатів досліджень проводили з використанням електронних таблиць Microsoft® Office Excel (build 11.5612.5703) та програми для статистичного обчислення Statistica v.6.0 (StatSoft, 2001, США). Для перевірки гіпотези про рівність середніх використовували критерій Стьюдента — Фішера для нормально розподілених вибірок і критерії Вілкоксона та Вілкоксона — Манна — Уїтні для вибірок, розподіл яких відрізнявся від нормального; для порівняння якісних параметрів використовували точний критерій Фішера. Статистичну залежність між величинами перевіряли за допомогою кореляційного та регресійного аналізів.
Результати дослідження та їх обговорення
Оцінку переносимості та клінічної ефективності терапії у всіх хворих проводили на 7–15–30-й день та через 3 місяці від початку лікування. Ефективність визначали за зменшенням больового синдрому, використовуючи аналогову 10-бальну шкалу, покращенням вібраційної чутливості, а за умов наявності виразково-некротичного процесу — за зникненням супутнього целюліту та набряку тканин, очищенням рани від гнійного вмісту, швидкістю загоєння рани, відновленням структури кісток.
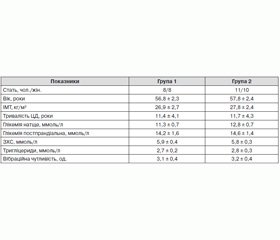
Клініко-лабораторна характеристика хворих перед початком лікування наведена у табл. 2.
На час обстеження хворі перебували у стані декомпенсації ЦД, про що свідчив рівень HbA1c в першій групі 11,3 ± 1,4 %, в другій групі — 11,2 ± 1,4 %, рівень глікемії натще відповідно — 11,3 ± 0,7 ммоль/л і 12,8 ± 0,7 ммоль/л, глікемії постпрандіальної відповідно — 14,2 ± 1,6 і 14,6 ± 1,4 ммоль/л. У всіх хворих зареєстровані виражені клінічні прояви нейропатії: біль у спокої, судоми та слабкість у ногах, зменшення вібраційної, тактильної, больової, температурної чутливості. Встановлено підвищений умісту ЗХС та ТГ. Вібраційна чутливість у хворих була зниженою до 3,1 ± 0,4 од. (норма понад 8,0 од.).
Через 15 днів від початку лікування досягнуто покращення показників вуглеводного обміну на тлі комплексної терапії в обох групах. При цьому рівень глікемії натще знизився серед хворих другої групи до 7,4 ± 0,3 ммоль/л проти 8,7 ± 0,4 ммоль/л (р < 0,05) у пацієнтів першої групи.
Рівень постпрандіальної глікемії знизився у хворих другої групи до 9,1 ± 0,3 ммоль/л проти 10,7 ± 0,4 ммоль/л (р < 0,05) у пацієнтів першої групи.
Частота нормалізації і поліпшення спочатку патологічних показників ліпідного обміну була досить високою й відзначалася серед всіх обстежених, однак у хворих другої групи відсоток нормалізації і поліпшення вмісту ЗХС і ТГ був помітно вищим, ніж серед пацієнтів першої групи, і діапазон цих значень становив відповідно від 64,8 до 92,4 % і від 57,5 до 82,0 %. Коефіцієнти атерогенності зменшувалися у всіх обстежених, наближаючись до контрольних цифр, а у хворих другої групи ці зміни були вірогідними — 4,4 ± 0,3 ум.од. і 2,7 ± 0,2 ум.од., р < 0,001 (табл. 3). Під впливом комплексної терапії у 68,9 % хворих другої групи спостерігалася позитивна динаміка білкових фракцій і коефіцієнта альбумін/глобулін (р < 0,05).
Рівень МДА у крові зменшився в 1,6 раза і був на 26,2 % нижчим від показників осіб першої групи (р < 0,05). Пригнічення процесів ліпопероксидації відбувалося за збільшення активності супероксиддисмутази і глутатіонпероксидази — на 51,3 та 27,4 % відповідно. Вміст у крові відновленого глутатіону дещо зменшувався, але залишався на 68,0 % більшим, ніж у першій групі (р < 0,05) (табл. 4).
У хворих, у яких спостерігалося цілковите загоєння виразки при застосуванні базової терапії, відчутне зниження вмісту СРБ зареєстровано вже на 15-й день лікувального процесу (з 5,6 ± 0,3 мг/мл до 4,2 ± 0,2 мг/мл, р < 0,05). У подальшому зменшення концентрації СРБ відбувалося поступово, і на 30-й день дослідження вона набула значення 3,6 ± 0,2 мг/л (р < 0,02). Подібний характер змін умісту даного реактанту гострої фази встановлено також у хворих, які отримували α-ліпоєву кислоту. Проте α-ліпоєва кислота викликала більш значуще пригнічення синтезу СРБ, особливо через 15 днів після початку лікування діабетичної виразки — 3,6 ± 0,1 мг/л, що вірогідно відрізняється від аналогічного показника у хворих першої групи (р < 0,01).
Під дією α-ліпоєвої кислоти відбувалося й відчутне поліпшення в пацієнтів вібраційної чутливості нервових волокон, що проявилося на 15-ту добу спостереження: на тлі базової терапії вона становила 5,1 ± 0,2 од., а на тлі прийому α-ліпоєвої кислоти — 6,8 ± 0,3 од. (р < 0,001).
Наведені результати досліджень підтвердили, що ефективне лікування запальної реакції, притаманної діабетичній нейропатичній виразці, супроводжується закономірним зниженням у крові вмісту реактантів гострої фази. Призначення α-ліпоєвої кислоти на тлі базової терапії збільшувало частоту повної регресії запального процесу за наявності діабетичної нейропатичної виразки. Так, у першій групі цілковите загоєння виразки відзначено у семи із 16 осіб (43,8 %), тоді як у групі α-ліпоєвої кислоти — у 16 з 21 пацієнта, тобто в 76,2 % випадків (р < 0,05).
Виходячи з вищезазначених біологічних властивостей α-ліпоєвої кислоти та отриманих даних, можна дійти висновку, що репарацію запального процесу за наявності нейропатичної виразки слід пов’язати з корекцією метаболічних порушень, а саме включаючи досягнення нормоглікемії, зменшення вираженості оксидативного стресу, поліпшення ліпідного обміну, відновлення функції нервових волокон тощо.
Результати проведених нами досліджень свідчать, що призначення α-ліпоєвої кислоти привело до помітного скорочення часу загоєння виразково-некротичних дефектів, зменшення скарг на біль у нижніх кінцівках. Визначена позитивна динаміка сприяла значному покращенню самопочуття хворих та якості їх життя, дозволила зменшити загрозу ампутації. Побічних ефектів при застосуванні α-ліпоєвої кислоти не спостерігалося.
Нормалізація показників гострофазової відповіді організму задовго до повної регресії запалення (за 15 днів) свідчить про ефективність проведеної терапії виразкового процесу. Визначення на етапах лікування динаміки вмісту СРБ та пригнічення фібринолізу можна вважати прогностичними маркерами ефекту терапії нейропатичної виразки. Призначення α-ліпоєвої кислоти на тлі базової терапії суттєво збільшує частоту повної регресії запального процесу та пришвидшує темпи загоєння нейропатичної виразки. Даний ефект супроводжується вдвічі швидшим зниженням вмісту білків гострої фази у периферичній крові, зниженням інтенсивності оксидативного стресу та пригніченням синтезу СРБ з одночасним поліпшенням фібринолітичної активності плазми крові, а також значним поліпшенням чутливості.
Враховуючи ефективність і добру переносимість препарату хворими, α-ліпоєву кислоту (Еспа-ліпон®) можна рекомендувати для лікування хворих на ЦД з діабетичною полінейропатією за наявності СДС, ускладненого виразково-некротичним процесом.
Висновки
1. Призначення α-ліпоєвої кислоти (упродовж трьох місяців) на тлі базової терапії збільшує частоту повного регресу запального процесу та пришвидшує темпи загоєння нейропатичної виразки. Даний ефект супроводжується вдвічі швидшим зниженням умісту білка гострої фази в периферичній крові, зниженням інтенсивності оксидативного стресу та зменшенням рівня С-реактивного білка з одночасним поліпшенням фібринолітичної активності плазми крові, а також значним поліпшенням вібраційної чутливості.
2. Визначення на етапах лікування динаміки вмісту С-реактивного білка та пригнічення фібринолізу можна вважати прогностичними маркерами ефекту терапії нейропатичної виразки.
Враховуючи той факт, що в попередніх дослідженнях [19, 20] був продемонстрований дозозалежний ефект α-ліпоєвої кислоти на СДС і скорочення терміну загоєння нейропатичної виразки при застосуванні більших дозувань α-ліпоєвої кислоти — 900–1200 мг/день, планується продовжити нашу роботу в цьому напрямку і розширити групу досліджуваних пацієнтів (3-тя група — 900 мг/добу; 4-та група — 1200 мг/добу α-ліпоєвої кислоти).
1. Анциферов М.Б. Синдром диабетической стопы [Текст] / Анциферов М.Б., Галстян Г.Р., Токмакова А.Ю. [и др.] // Сахарный диабет. — 2001. — № 2. — С. 2–8.
2. Гольбрайх В.А. Перспективы лечения больных с синдромом диабетической стопы. [Текст] / Гольбрайх В.А., Старков С.В. // Вестник хирургии имени И.И. Грекова. — 2003. — Т. 162, № 4. — С. 113–116.
3. Горобейко М.Б. Класифікація діабетичної стопи, затверджена Міжнародною робочою групою з діабетичної стопи IDF та ВООЗ. [Текст] / Горобейко М.Б., Гирявенко О.Я. // Клінічна ендокринологія та ендокринна хірургія. — 2004. — № 1. — С. 83–86.
4. Гурьева И.В. Диабетическая периферическая сенсомоторная нейропатия. [Текст] / Гурьева И.В., Комелягина Е.Ю., Кузина И.В. // Патогенез, клиника и диагностика. — М., 2000. — 23 с.
5. Ефимов А.С. Клиническая диабетология [Текст] // Ефимов А.С., Скробонская Н.А. — К.: Здоров’я, 1998. — 319 с.
6. Ляпіс М.О. Синдром стопи діабетика [Текст] / Ляпіс М.О., Герасимчук П.О. — Тернопіль: Укрмедкнига, 2001. — 276 с.
7. Международная рабочая группа по диабетической стопе. Международное соглашение по диабетической стопе. — Москва: Берег, 2000. — 96 с.
8. Мохорт Т.В. Альфа-липоевая кислота: полифакторное влияние и обоснование возможностей использования при сахарном диабете / Т.В. Мохорт // Медицинские новости. — 2011. — № 3. — С. 67–71.
9. Недосугова Л.В. Альфа-липоевая кислота (Эспа-липон) в комплексном лечении диабетической нейропатии // Міжнародний ендокринологічний журнал. — 2007. — № 2 (8).
10. Паньків В.І. Класифікація, діагностика, сучасні підходи до лікування діабетичної полінейропатії // Міжнародний ендокринологічний журнал. — 2008. — № 6 (18). — С. 64–68.
11. Сергієнко О.О., Єфімов А.С., Єфімов Д.А., Кривко Ю.Я. Діабетичні нейропатії / АМН України, ЛНМУ ім. Данила Галицького, Інститут ендокринології та ОР ім. В.П. Комісаренка АМН України. — Львів: Атлас; К., 2004. — 212 с., іл.
12. IDF Diabetes Atlas 2013. — http: // www.idf.org / diabetesatlas / 6e / Update 2013.
13. Green M.F. Diabetic foot: Evaluation and management [Text] / M.F. Green, Z. Aliabadi, B.T. Green // South Med. J. — 2002. — Vol. 95, № 1. — P. 95–101.
14. Heinisch B.B. Alpha-lipoic acid improves vascular endothelial function in patients with type 2 diabetes: a placebo-controlled randomized trial / B.B. Heinisch, M. Francesconi, F. Mittermayer et al. // European Journal of Clinical Investigation. — 2010. — Vol. 40. — P. 148–154.
15. Porasuphatana S. Glycemic and oxidative status of patients with type 2 diabetes mellitus following oral administration of alpha lipoic acid: a randomized double-blinded placebo controlled study / S. Porasuphatana, S. Suddee, A. Nartnampong et al. // Asia Pacific Journal of Clinical Nutrition. — 2012. — Vol. 21, Suppl. 1. — P. 12–21.
16. Tesfaye S. Advances in the epidemiology, pathogenesis and management of diabetic peripheral neuropathy / S. Tesfaye, D. Selvarajah // Diabetes. Metab. Res. Rev. — 2012. — Vol. 1. — P. 8–14.
17. Vinik A.I. Neuropathy: the crystal ball for cardiovascular disease? / A.I. Vinik, R.E. Maser, D Ziegler // Diab. Care. — 2010. — Vol. 33, № 7. — P. 1688–1690.
18. Yagihashi S. Mechanism of diabetic neuropathy: where are we now and where to go? / S. Yagihashi, H. Mizukami, K. Sugimoto // J. Diab. Invest. — 2011. — Vol. 2, № 1. — P. 18–32.
19. Ларін О.С., Савран О.В. та ін. Порівняльна оцінка результатів лікування діабетичної полінейропатії ніг у хворих на цукровий діабет з використанням різних доз препарату еспа-ліпон // Ліки. — 2002. — № 5–6. — С. 98–103.
20. Ларін О.С., Савран О.В. та ін. Результати лікування діабетичної полінейропатії нижніх кінцівок у хворих на цукровий діабет // Клінічна ендокринологія та ендокринна хірургія. — 2003. — № 2(3). — С. 31–35.

/47/47.jpg)
/48/48.jpg)
/49/49.jpg)