Международный эндокринологический журнал 3 (59) 2014
Вернуться к номеру
Функциональное состояние системы «гипофиз — гонады» у мужчин с неактивными аденомами гипофиза и дефицитом гормона роста у взрослых
Авторы: Урманова Ю.М., Шакирова М.Ю., Алиева Д.А. - Республиканский специализированный научно-практический медицинский центр эндокринологии МЗ РУз; Ташкентский педиатрический медицинский институт, кафедра эндокринологии, детской эндокринологии, Республика Узбекистан
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Был обследован 71 взрослый больной с дефицитом гормона роста, обусловленным функционально-неактивными образованиями хиазмально-селлярной области. Больные были распределены на две группы: первая группа — мужчины в возрасте от 18 до 49 лет и вторая группа — 49 лет и выше. Исследование гормонального профиля пациентов первой группы показало, что у них преобладали низкие значения средних величин ЛГ, ФСГ, свободного и общего тестостерона (гипогонадотропный гипогонадизм) на фоне умеренной гиперпролактинемии. У больных второй группы были выявлены аналогичные нарушения со стороны гипофизарно-гонадной оси. У больных старшей возрастной группы также преобладали низкие значения средних величин ЛГ, ФСГ, общего тестостерона (гипогонадотропный гипогонадизм) на фоне умеренной гиперпролактинемии. При этом средние значения этих гормонов были достоверно ниже, чем в первой группе.
Був обстежений 71 дорослий хворий із дефіцитом гормону росту, обумовленим функціонально-неактивними утвореннями хіазмально-селярної області. Хворі були розподілені на дві групи: перша група — чоловіки віком від 18 до 49 років і друга група — 49 років і вище. Дослідження гормонального профілю пацієнтів першої групи показало, що в них переважали низькі значення середніх величин ЛГ, ФСГ, вільного й загального тестостерону (гіпогонадотропний гіпогонадизм) на тлі помірної гіперпролактинемії. У хворих другої групи були виявлені аналогічні порушення з боку гіпофізарно-гонадної осі. У хворих старшої вікової групи також переважали низькі значення середніх величин ЛГ, ФСГ, загального тестостерону (гіпогонадотропний гіпогонадизм) на тлі помірної гіперпролактинемії. При цьому середні значення цих гормонів були вірогідно нижче, ніж у першій групі.
We examined 71 adult patients with growth hormone deficiency caused by non-functional masses of chiasmosellar area. Patients were divided into two groups: the first one — men aged 18 to 49 years and the second one — 49 years and above. Investigation of the hormonal profile of the first group patients showed that in them low indices of the mean values of luteinizing hormone (LH), follicle-stimulating hormone (FSH), free and total testosterone (hypogonadotropic hypogonadism) dominated on the background of moderate hyperprolactinemia. In the patients of the second group we found similar violations of the pituitary-gonadal axis. In patients of older age group the low indices of the mean values of LH, FSH, total testosterone (hypogonadotropic hypogonadism) also dominated on the background of moderate hyperprolactinemia. At that, the average values of these hormones were significantly lower than in the first group.
Статья опубликована на с. 56-61
Актуальность
Аденомы гипофиза по морфологическим данным — это доброкачественные и медленно прогрессирующие опухоли, но их рост сопровождается эндокринными, неврологическими нарушениями, повышенным артериальным давлением, что и является причиной обращения пациентов за медицинской помощью.
Если частота аденом гипофиза в среднем составляет 20 % всех интракраниальных образований и выявляются эти опухоли у 2 человек на 100 000 населения, то в целом инвалидизация от различных аденом гипофиза достигает 33,1 % случаев [3]. При этом одним из первых проявлений роста опухоли селлярной области является выпадение соматотропной функции гипофиза [1].
Среди объемных образований гипоталамо-гипофизарной области на долю неактивных аденом гипофиза (НАГ) приходится от 25 до 43 % от всех гипофизарных опухолей [2].
Коварство заболевания заключается в том, что оно протекает без видимых клинических проявлений, нарушения секреции гипофизарных гормонов. Поэтому остро стоит задача раннего установления диагноза заболевания.
Достаточно отметить, что более 25–30 % больных НАГ становятся инвалидами и затраты на их лечение, по данным ВОЗ (2004), составляют в экономически развитых странах мира от 24 до 40 млрд долларов США. Все это определяет не только медицинскую, но и социально-экономическую значимость проблемы [4, 5, 17].
В общей популяции частота НАГ составляет 50 случаев на 1 млн населения [6, 17]. Более того, на сегодняшний день появились больные с инциденталомами гипофиза, которые еще называют болезнью современных технологий. Они выявляются в 5–17 случаях на 1 млн. Это лица со случайно обнаруженными образованиями гипофиза, которые не имеют определенных клинических нарушений, но нуждаются в динамическом наблюдении до 5 лет, т.к. инциденталомы могут быть родоначальниками как гормонально-активных, так и неактивных образований.
Известно, что соматотропный гормон (СТГ) имеет множество положительных эффектов помимо стимуляции линейного роста. Это поддержание нормального телосложения и метаболизма на протяжении всей взрослой жизни. Поэтому проблема дефицита СТГ у взрослых привлекает внимание различных специалистов — эндокринологов, нейрохирургов, кардиологов и др. Следует учитывать, что уровни секреции СТГ и ИФР-1 (инсулиноподобного фактора роста 1) достигают максимума в среднем и позднем пубертате и в последующем снижаются. Снижение происходит быстро до середины третьего десятилетия [1, 2].
Гипо- и пангипопитуитаризм — это состояние дефицита тропных гормонов гипофиза, которое часто развивается на фоне объемных образований хиазмально-селлярной области, при этом среди последних чаще встречаются НАГ.
Длительные наблюдения за пациентами c различными аденомами гипофиза показывают, что дефицит гормонов гипофиза обычно развивается в определенной последовательности. В первую очередь при аденомах гипофиза выпадает или снижается секреция СТГ, а затем по мере роста опухоли — и других тропных гормонов: ЛГ, ФСГ, ТТГ и в последнюю очередь — АКТГ. Все это определяет развитие пангипопитуитаризма при НАГ и метаболических осложнений.
Данное обстоятельство можно объяснить с точки зрения особенностей роста объемного образования в селлярной области (рис. 1).
НАГ гипофиза клинически не сопровождаются гиперсекреторными синдромами, но могут проявляться гипофизарной недостаточностью различной степени выраженности вследствие сдавления опухолью нормальной гипофизарной ткани или ножки гипофиза.
Поэтому лабораторная диагностика НАГ гипофиза должна включать определение в крови содержания пролактина, ЛГ, ФСГ, СТГ, АКТГ, ТТГ, свободного тироксина, тестостерона у мужчин и эстрадиола у женщин [14, 15].
Более чем у 50 % больных с гормонально-неактивной аденомой гипофиза выявляется гиперпролактинемия (обычно < 3000 мМЕ/л). У половины больных можно обнаружить нарушение гонадотропной функции, которое проявляется отсутствием или извращением реакции гонадотропинов в ответ на введение ГРГ. При этом только у 4–23 % пациентов может быть выявлено повышение в крови концентрации ЛГ, ФСГ, тестостерона и др. [16].
Примерно 40–60 % больных с гормонально-неактивной аденомой гипофиза имеют признаки гипогонадотропного гипогонадизма, проявляющегося у женщин аменореей, снижением в крови концентрации эстрадиола, нормальными или субнормальными уровнями ЛГ, ФСГ, а у мужчин — отсутствием либидо и потенции, снижением концентрации тестостерона в крови при субнормальных или нормальных уровнях ЛГ и ФСГ. Помимо этого, могут быть выявлены вторичный гипокортицизм в виде снижения или отсутствия реакции кортизола на инсулиновую гипогликемию, снижение уровня свободного кортизола в моче и центральный гипотиреоз, который диагностируется по отсутствию или задержке реакции ТТГ на ТРГ. У 80 % пациентов снижена концентрация СТГ в крови [12, 13].
Цель исследования — изучить функциональное состояние системы «гипофиз — гонады» у мужчин различных возрастных групп с неактивными аденомами гипофиза и дефицитом гормона роста у взрослых.
Материал и методы исследования
За период с 2010 по 2013 г. нами был обследован 71 взрослый больной с дефицитом гормона роста (ДГР), обусловленным функционально-неактивными образованиями хиазмально-селлярной области. Средний возраст мужчин составил 32,2 года. Давность заболевания колебалась в пределах от 2 мес. до 25 лет.
Оперативное лечение (трансназальная селективная гипофизэктомия) было выполнено 8 (32,4 %) больным на базе отделения нейрохирургии РНЦЭМП МЗ РУз, одному — бифронтальная краниотомия.
Методы исследования включали в себя: общеклинические (исследование эндокринного, неврологического статусов, антропометрия — рост, вес, ОТ, ОБ, ИМТ, оценка ДГР по вопроснику); инструментальные (периметрия на все цвета, глазное дно, острота зрения, ЭКГ, денситометрия, КТ/МРТ турецкого седла и надпочечников, УЗИ половых органов и др.); гормональные исследования крови (СТГ, ИФР-1, ЛГ, ФСГ, ТТГ, АКТГ, пролактин, тестостерон, эстрадиол, прогестерон, кортизол, Т3, Т4). Исследования проведены в лаборатории гормональных исследований РСНПМЦ эндокринологии МЗ Руз (зав. лаб. — к.м.н. А.М. Абдурахманова) радиоиммунным методом, с использованием наборов фирмы Immunotech, Республика Чехия. Кроме того, выполнялись биохимические исследования крови (ЛПНП, ЛПВП, холестерин, триглицериды, кальций и др.).
Для оценки качества жизни пациентов был использован вопросник, разработанный специально в рамках проекта KIMS (Wallymahmed M.E., Foy P., MacFarlane I.A. The quality of life of adults with growth hormone deficiency: Comparison with diabetic patients and control subjects // Clin. Endocrinol. (Oxf.) 1999; 51: 333–338) для пациентов с дефицитом ГР — QoL-AGHDA (Quality of Life — Assessment of Growth Hormone — Deficiency in Adults) и содержащий 25 вопросов (перевод с англ.). Наличие положительных ответов, в сумме дающих более 11 баллов, расценивается как признак вероятности ДГР у взрослых.
В настоящее время разработан достаточно простой и удобный опросник для определения андрогенного статуса у мужчин, который позволяет заподозрить андрогенный дефицит, — «Опросник симптомов старения мужчины» (AMS — Aging Males’ Symptoms), результаты которого оцениваются по балльной шкале (1 — нет, 2 — слабые, 3 — умеренные, 4 — выраженные, 5 — очень выраженные). Вопросы анкеты (17 вопросов) позволяют выявить психологические, соматические и сексуальные проблемы пациента.
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel и Statistica_6. Достоверность различий количественных показателей (n > 12) определялась по методу Вилкоксона для несвязанных диапазонов, для определения достоверности малых выборок (n < 12) использовался непараметрический критерий рандомизации компонент Фишера для независимых выборок, для качественных значений использовался точный критерий Фишера — Ирвина. Различия между группами считали статистически значимыми при Р < 0,05. Вычислялись средние значения (М), стандартные отклонения средних (m).
Достоверность различий между группами оценивалась по величине доверительного интервала и критерию Стьюдента (р). Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
Распределение больных по возрасту показано в табл. 1, в которой они разделены на две группы: первая группа — мужчины в возрасте от 18 до 49 лет и вторая группа — 49 лет и выше.
/58/58.jpg)
В зависимости от размеров аденомы гипофиза встречались следующие изменения гипофиза, выявленные на КТ/МРТ: микроаденомы (< 10 мм) — 46 больных (64,7 %), мезоаденомы (11–20 мм) — 14 больных (19,7 %), макроаденомы (до 30 мм) — 9 больных (12,7 %), гигантские — (более 30 мм) — 2 больных (2,8 %).
Распределение больных по топографо-анатомической классификации стороны роста аденомы гипофиза Б.А. Кадашева (2007) показало, что наиболее часто наблюдались аденомы гипофиза с эндоселлярным ростом — 21 (29,5 %), эндосупраселлярным ростом — 8 больных (11,3 %) и с супрапараселлярным ростом — 6 больных (8,4 %), с инфрапараселлярным ростом — 1 (1,4 %), супраселлярным ростом — 6 (8,4 %), с латероселлярным ростом — 25 (35,2 %), с тотальным вариантом роста — 4 больных (5,6 %).
Исследование гормонального профиля пациентов первой группы показало, что у них преобладали низкие значения средних величин ЛГ, ФСГ, общего тестостерона (гипогонадотропный гипогонадизм) на фоне умеренной гиперпролактинемии. Уровни свободного тироксина и кортизола были в пределах нормы (табл. 2).
У больных второй группы были выявлены аналогичные нарушения со стороны гипофизарно-гонадной оси (табл. 3). У больных старшей возрастной группы также преобладали низкие значения средних величин ЛГ, ФСГ, общего тестостерона (гипогонадотропный гипогонадизм) на фоне умеренной гиперпролактинемии. При этом средние значения этих гормонов были ниже, чем в первой группе. Уровни свободного тироксина и кортизола были в пределах нормы
В табл. 3 приведены средние значения гормонов плазмы больных второй группы.
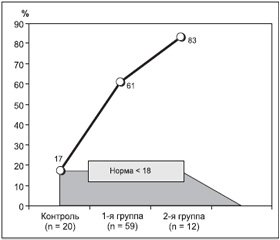
Исследование качества жизни на основе опросника андрогенного статуса у мужчин AMS 71 больного в двух группах выявило, что в первой и второй группах средний балл был достоверно ниже нормы по сравнению с нормативными данными (в норме < 18 б.). Эти данные представлены в табл. 4 и на рис. 2.
Таким образом, исследование качества жизни на основе опросника андрогенного статуса у мужчин AMS 71 больного в двух группах выявило, что у больных с объемными образованиями средний балл был достоверно выше нормы (р < 0,01), что коррелирует с достоверно пониженными базальными значениями СТГ, ИФР-1, ЛГ, ФСГ и тестерона. Эти данные представлены в табл. 5.
Нами была изучена частота нейроэндокринных нарушений у обследованных больных. Было выявлено, что наиболее часто встречался гипопитуитаризм трех тропных гормонов (СТГ, ЛГ, ФСГ) — у 22 (30,5 %) больных, в то время как пангипопитуитаризм встречался у 6 (8,3 %) пациентов. Кроме того, гипопитуитаризм вследствие недостаточности четырех тропных гормонов (СТГ, ЛГ, ФСГ, ТТГ) наблюдался у троих (4,2 %) больных.
Таким образом, исследование эндокринного статуса выявило разнообразие клинических проявлений нейроэндокринных нарушений. По нашим данным, ДГР у взрослых больных с различными образованиями селлярной области был выявлен в 91,6 % случаев (66 больных из 71 обследованного).
На рис. 3 дана схема гипоталамо-гипофизарно-гонадной регуляции в норме (А) и при гипогонадотропном гипогонадизме (Б). Схема иллюстрирует нарушения гипофизарно-гонадной оси по типу гипогонадотропного гипогонадизма у обследованных пациентов.
Выводы
Исследование гормонального профиля пациентов первой группы c НАГ показало, что у больных преобладали низкие значения средних величин ЛГ, ФСГ, общего тестостерона (гипогонадотропный гипогонадизм) на фоне умеренной гиперпролактинемии.
У больных второй группы с НАГ были выявлены аналогичные нарушения со стороны гипофизарно-гонадной оси. У больных старшей возрастной группы также преобладали низкие значения средних величин ЛГ, ФСГ, общего тестостерона (гипогонадотропный гипогонадизм) на фоне умеренной гиперпролактинемии. При этом средние значения этих гормонов были ниже, чем в первой группе.
ДГР у взрослых больных с НАГ был выявлен в 91,6 % случаев (66 больных из 71 обследованного).
1. Дедов И.И., Тюльпаков А.Н., Петеркова В.А. Соматотропная недостаточность. — М., 1998. — 250 с.
2. Марова Е.И. Нейроэндокринология. Клинические очерки. — М., 1999. — С. 380–401.
3. Шахворост Н.П. Совершенствование организации медицинской помощи больным с аденомами гипофиза: Автореф. дис... к.м.н. по шифру 14.00.33. — М., 2009. — 30 с.
4. Besser M., Thorner M.O., Reichlin S. et al. Slide atlas of clinical endocrinology. Second edition. — UK, 1994. — Р. 3–16.
5. Abs R., Mattsson A.F., Bengtsson B.A., Feldt-Rasmussen U. et al. Isolated growth hormone (GH) deficiency in adult patients: baseline clinical characteristics and responses to GH replacement in comparison with hypopituitary patients. A sub-analysis of the KIMS database // Growth Horm IGF Res. — 2005. — 15 (5). — 349–59.
6. Bertella L., Mori I., Grugni G., Pignatti R. et al. Quality of life and psychological well-being in GH-treated, adult PWS patients: a longitudinal study // J. Intellect Disabil. Res. — 2007. — (Pt. 4). — 302–11.
7. Bohdanowicz-Pawlak A., Szymczak J. Risk factors of cardiovascular disease in GH-deficient adults with hypopituitarism: a preliminary report // Med. Sci Monit. — 2006. — 12 (2). — P. 75–80.
8. Gasco V., Corneli G., Rovere S., Croce C. Diagnosis of adult GH deficiency // Pituitary. — 2008. — 11.
9. Franco C., Bengtsson B.A. The GH/IGF-1 Axis in Obesity: Physiological and Pathological Aspects / Johannsson G. // Metab. Syndr. Relat. Disord. — 2006. — 4 (1). — 51–6.
10. Faust M., Strasburger C.J. Growth hormone therapy in adults. Attempt to assess a decade of use // Internist. — 2008. — 49 (5). — 527–537.
11. Irie M., Itoh Y., Miyashita Y., Tsushima T. Complications in adults with growth hormone deficiency — a survey study in Japan // Endocr. J. — 2004. — 51 (5). — 479–85.
12. Kaushal K., Shalet S.M. Defining growth hormone status in adults with hypopituitarism // Horm Res. — 2007. — 68 (4). — 185–94.
13. Ken K.Y. Ho. Consensus Statement. Consensus guidelines for diagnosis and treatment of adults with growth hormone deficiency: summary statement of the Growth Hormone Research Workshop on adult growth hormone deficiency // Journal of Clinical Endocrinology and Metabolism. — 1998. — 83. — 379–381.
14. Ken K.Y. Ho. Consensus quidelines for the diagnosis and treatment of adults with GH-deficiency 11: a statement of the GH Research Society in association with the European Society for Pediatric Endocrinology, Lawson Wilkins Society, European Society of Endocrinology, Japan Endocrine Society, and Endocrine Society of Australia // European Journal of Endocrinology. — 2007. — 157. — 695–700.
15. Kendall-Taylor P., Jönsson P.J., Abs R. The clinical, metabolic and endocrine features and the quality of life in adults with childhood-onset craniopharyngioma compared with adult-onset craniopharyngioma // Eur. J. Endocrinol. — 2005. — 152 (4). — 557–67.
16. Komninos J., Vlassopoulou V., Protopapa D. et al. Tumors metastatic to the pituitary gland: case report and literature review // J. Clin. Endocrinol. Metab. — 2004. — 89 (2). — 574–80.
17. Tomlinson J.W., Holden N., Hills R.K., Wheatley K. Association between premature mortality and hypopituitarism. West Midlands Prospective Hypopituitary Study Group // Lancet. — 2001. — 10, 357 (9254). — 425–31.

/57/57.jpg)
/59/59.jpg)
/59/59_2.jpg)
/60/60.jpg)
/60/60_2.jpg)