Журнал «Медицина неотложных состояний» 4 (59) 2014
Вернуться к номеру
Прояви ендотоксемії та математичне моделювання процесу розпізнавання етіопатогенетичного чинника захворювання
Авторы: Рубльов Б.B., Шкуліпа О.В. - Київський національний університет ім. Т.Г. Шевченка; Проданчук М.Г. - ДУ «Науковий центр превентивної токсикології, харчової та хімічної безпеки імені академіка Л.І. Медведя МОЗ України»; Шейман Б.С. - Національна дитяча спеціалізована лікарня «ОХМАТДИТ» МОЗ України, м. Київ
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У роботі продемонстрована побудова математичної моделі для розпізнавання етіопатогенетичних чинників ендотоксемії в пацієнтів із різними захворюваннями. Запропоновано математичну модель на основі методів математичної статистики. Проведена оцінка щодо можливості її застосування для розпізнавання етіопатогенетичних чинників ендотоксемії та вказані існуючі недоліки.
В работе продемонстрировано построение математической модели для распознавания этиопатогенетических факторов эндотоксемии у пациентов с различными заболеваниями. Предложена математическая модель на основании методов математической статистики. Проведена оценка возможности ее применения для распознавания этиопатогенетических факторов эндотоксемии и указаны существующие недостатки.
This paper shows the construction of mathematical model for recognition of etiopathogenetic endotoxemia factors in patients with various diseases. A mathematical model based on the methods of mathematical statistics is proposed. An assessment of the possibility of its application for recognition of etiopathogenetic endotoxemia factors was carried out and existing deficiencies were indicated.
хвороби, ендотоксемія, етіопатогенез, діагностика, математична модель, дискримінантний аналіз.
болезни, эндотоксемия, этиопатогенез, диагностика, математическая модель, дискриминантный анализ.
diseases, endotoxemia, etiopathogenesis, diagnosis, mathematical model, discriminant analysis.
Статья опубликована на с. 68-72
Вступ
Відомо, що перебіг більшості з відомих на сучасному етапі захворювань супроводжується розвитком ендотоксемії (накопичення у кров’яному руслі автоагресивних речовин ендо- або екзогенного походження, характерною ознакою яких є наявність в них пошкоджуючої активності щодо біологічних мішеней організму). Токсемія обумовлює формування процесу токсикозу, клінічною маніфестацією якого є інтоксикаційний синдром. Про негативний вплив токсикозу на перебіг та результат захворювання в медичній літературі існує багато повідомлень. Відомо, що токсикоз супроводжує перебіг більше ніж 95 % з усіх відомих дотепер захворювань та є провідною патогенетичною ланкою. Саме тому лікувальні заходи, що скеровані на протидію пошкоджуючій активності токсинів, увійшли в різні лікувальні протоколи багатьох хвороб та отримали назву «заходи детоксикаційної терапії», а розробка нових ефективних технологій детоксикації (знешкодження токсинів) є актуальним завданням сучасної медицини в цілому та клінічної токсикології зокрема.
Досягнення науки за останнє десятиріччя в галузі токсикогеноміки, токсикопротеоміки та токсикометабономіки дозволяють розглянути алгоритм формування й реалізації токсикозу як послідовне виникнення ряду взаємозалежних процесів — від етапу проникнення етіологічного чинника (безпосередня причина захворювання) в організм людини, експресії генів (токсикогеноміка) з наступним синтезом та накопиченням біологічно активних речовин у кров’яному руслі (транскриптоміка), змін у білках крові з утворенням токсичних протеомів (токсинів) і до пошкодження біологічної мішені організму, порушення функціонального стану органу або системи у вигляді метаболічних змін (токсикометабономіка).
Широкому медичному загалу добре відомі етіологічні чинники, що існують в оточуючому людину середовищі та за певних умов можуть виступати в ролі збудників різних захворювань. Серед них бактерії, віруси, паразити, хімічні речовини тощо. Саме вони є причиною виникнення змін у генах людини, що надалі реалізується у вигляді захворювання (пошкодження органів та систем) із накопиченням у кров’яному руслі токсичних протеомів (токсинів) та метаболітів із виникненням токсикозу [1].
Ми зробили гіпотетичне припущення про те, що існування взаємозв’язків між етіологічним чинником захворювання, експресією генів, токсичними протеомами крові (токсинами) та метаболічними змінами в ушкоджених органах та системах повинно віддзеркалюватися на характеристиках ендотоксинів, зокрема на їх пошкоджуючій активності, розмірах часток і молекул, місцях їх переважного накопичення в кров’яному руслі (альбумінах, глобулінах, клітинних мембранах або у вільній циркуляції). Виходячи з зазначеного вище, ми припустили, що характеристики токсинів повинні мати специфічні відмінності, притаманні для кожного з етіологічних чинників, що викликав їх утворення. А визначення специфічних властивостей токсичних протеомів повинно привести до підвищення ефективності заходів діагностики з верифікації етіологічного чинника захворювання, оперативного призначення етіотропної терапії, що неминуче вплине на ефективність лікування пацієнта в цілому. Саме визначенню специфічних відмінностей у параметрах ендотоксемії, що виникає в хворих, та їх значущості у встановленні етіопатогенетичної причини захворювання й була присвячена наукова робота.
Метою наукової роботи є вивчення функцій прогнозування шляхом побудови математичної моделі на основі оцінки дискримінант для визначення етіопатогенетичного чинника токсемії в пацієнтів із різними захворюваннями.
Матеріали та методи дослідження
Для побудови математичної моделі були використані токсикометричні характеристики ендотоксемії, що супроводжувала перебіг різних захворювань у 548 пацієнтів. З них у 500 випадках (основна група) за допомогою традиційних загальновизнаних методів дослідження були встановлені етіопатогенетичні чинники ендотоксемії, що супроводжує аномалії печінки (34), аномалії нирок (30), автоімунні/автоалергічні реакції (158), гнійно-септичні захворювання (114), вірусні та паразитарні захворювання (85), деструкції тканин різного походження (19), локальні гіперпластичні процеси в тканинах (новоутворення) (14), системні запальні реакції — SIRS (23), гострі отруєння екзогенного походження (23). Контрольну групу становили 48 пацієнтів, у яких не було встановлено етіопатогенетичні чинники виникнення хвороби та ендотоксикозу.
Суттю задачі побудови математичної моделі було визначити для заданих параметрів токсемії у хворого x = (x1, …, xn) етіопатогенетичний фактор, що є безпосередньою причиною виникнення хвороби в пацієнта. У роботі були використані позначення: g — кількість класів етіопатогенетичних чинників; p — число дискримінантних змінних; nk — кількість спостережень в k-й етіології; n — загальна кількість спостережень; xikm — величина змінної i для m-го спостереження в k-й етіології; xik — середня величина змінної i в k-й етіології.
Опис математичної моделі
Модель складається з незалежних підбібліотек, що враховують індивідуальні (характерні для кожного етіопатогенетичного чинника ендотоксемії) особливості таких параметрів токсемії (рис. 1).
Ідея побудови математичної моделі дослідження полягає в тому, що на кожному рівні її структури попарно порівнювали однотипні параметри токсемії різного етіопатогенетичного походження та знаходили дискримінантні функції, за допомогою яких саме й розділяють етіопатогенетичні чинники [2].
Для визначення невідомого етіопатогенетичного чинника токсемії g значення x = (x1, …, xn) підставляється у визначення дискримінантної функції. Кожен параметр ендотоксемії у хворого з невідомим етіопатогенетичним чинником у процесі порівняння з таким у бібліотеках із відомими етіопатогенетичними чинниками ендотоксемії буде віднесено до бібліотеки, значення дискримінантної функції в якої виявляється найбільшим. Отриманому параметру ендотоксемії присвоюється 1 бал. Після проходження всіх бібліотек за найбільшою кількістю балів (сума балів усіх параметрів токсемії у хворого, що були визначені в бібліотеках) буде встановлено вірогідний етіопатогенетичний чинник ендотоксемії (захворювання) у хворого.
Алгоритм розпізнавання етіопатогенетичного чинника токсемії за допомогою дискримінантного аналізу
На першому етапі дослідження проводили кореляційний аналіз для визначення тих параметрів токсемії з Rn, n = 29, що роблять найбільший внесок у розділення тих чи інших етіопатогенетичних чинників. Далі здійснювали перевірку нормальності розподілу даних за допомогою критерію Колмогорова [3]. Після отримання результатів нормальності розподілу даних нами було використано метод дискримінантного аналізу [4, 5].
Основною метою дискримінантного аналізу є знаходження такої лінійної комбінації змінних (дискримінантних змінних), яка б оптимально розділила етіопатогенетичні чинники токсемій, що досліджуються.
Лінійна функція dkm = b0 + b1x1km + … + bpxpkm, де m = 1, ..., n; k = 1, ..., g, називається канонічною дискримінантною функцією з невідомими коефіцієнтами bі (де xpkm — значення дискримінантної змінної для Хі m-го об’єкта в групі k).
З геометричної точки зору дискримінантні функції визначають гіперповерхню в p-вимірному просторі. У випадку p = 2 гіперповерхня фактично являє собою пряму.
Коефіцієнти bі першої канонічної дискримінантної функції вибираються таким чином, щоб центроїди різних груп якомога більше відрізнялись один від одного. Коефіцієнти другої функції вибираються аналогічно, але з додатковою умовою, щоб значення другої функції були некорельовані із значенням першої. Аналогічним чином визначаються й інші функції. Зазначене вище обумовлює те, що будь-яка канонічна дискримінантна функція dg має нульову міжгрупову кореляцію з d1, …, dg – 1. Якщо кількість етіопатогенетичних чинників (класів) дорівнює g, то число канонічних дискримінантних функції буде g – 1. Проте використання канонічної дискримінантної функції через складності у проведенні обчислень не завжди є зручним. Саме тому ми в подальшому використали прості класифікуючі функції. Функції, що визначаються співвідношенням (1), називаються простими класифікуючими функціями, тому що вони припускають рівність коваріаційних матриць і не потребують інших властивостей.
dik = bk0 + bk1xi1 + … + bkpxip + lnqk, (1)
де k = 1, …, g; bk = (bk1, …, bkp) і bk0 — коефіцієнти k-ї класифікуючої функції i-го об’єкта;
bk = xk∑,
де ∑ — коваріаційна матриця, xk = xk1, …, xkp; k = 1, …, g
Коефіцієнти dki в даному випадку інтерпретуються як параметри, що характеризують нахил гіперплощини з координатними осями, а bk0 називається порогом і відповідає відстані від гіперплощини до початку координат.
При використанні простих класифікуючих функцій хi = (xi1, …, xip) буде належати до етіопатогенетичного класу, у якого значення d виявиться більшим.
Важливим етапом дискримінантного аналізу є встановлення змінних, що входять у дискримінантну функцію. У нашому дослідженні ми використовували метод покрокового дискримінантного аналізу, у якому змінні вводяться послідовно, виходячи із їх здатності розділяти дискримінантні етіопатогенетичні класи. Тобто при покроковому аналізі з включенням змінних на кожному кроці переглядаються всі змінні й встановлюється одна з них, що робить найбільший внесок у розділення етіопатогенетичних класів. Ця змінна включається в модель і переходить на наступний крок.
Реалізація математичної моделі у процесі розпізнавання етіопатогенетичного чинника токсемії
Реалізація починається з проведення кореляційного аналізу та перевірки на нормальність, після якого залишаються xik = (xi1k, …, xisk), де is — нормально розподілені та корельовані параметри (фактори). Після цього проводиться попарне порівняння двох етіопатогенетичних класів токсемії: gl та ga, l = 1, …, 9; f = 1, …, 9.
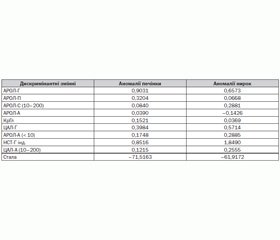
Наводимо приклад знаходження дискримінантних функцій із рівнем значущості p = 0,05 та визначення приналежності етіопатогенетичного чинника токсемії до класу «Аномалії нирок» або «Аномалії печінки».
Перший крок — визначення дискримінантних функцій (табл. 1).
Після визначення дискримінантних функцій проводимо побудову дискримінантних розподільчих функцій таким чином:
di1 = bk0 + bk1xi1 + … + bkpxip = –71,52 + 0,90 · xi1 + + 0,32 · xi2 + 0,08 · xi3 + 0,04 · xi3 + 0,15 · xi5 + + 0,39 · xi6 + 0,17 · xi7 + 0,85 · xi8 + 0,12 · xi9;
di2 = –61,92 + 0,66 · xi1 + 0,07· x21 + 0,29 · xi3 – – 0,14 · xi4 + 0,04 · xi5 + 0,57 · x6 + 0,29 · xi7 + 1,85 · xi8 + + 0,26 · xi9.
Другий крок — встановлені дискримінантні функції використовуємо для визначення приналежності токсемії у хворого (що досліджується) до одного з етіопатогенетичних класів.
Наводимо приклад (табл. 2).
Відповідно до отриманих даних вираховуємо значення дискримінантних функцій:
d1 = b10 + b11xi1 + … + b1pxip = 36,769246;
d2 = b20 + b21xi1 + … + b2pxip = 44,26615.
Здійснення першого та другого кроків досліджень дозволяє встановити вірогідний етіопатогенетичний чинник токсемії у хворого — «Аномалії нирок».
Третій крок — здійснення перевірки встановлених дискримінантних функцій, для чого ми використали класифікаційну матрицю. Тобто застосували дискримінантні функції до тих даних, за якими вони були побудовані (табл. 3).
Четвертий крок — проводиться попарне порівняння параметрів токсемії при різних етіопатогенетичних чинниках залежно від їх властивостей, тобто поділ на підбібліотеки (рис. 2).
На підставі отриманих результатів аналізу в кожному конкретному випадку параметри ендотоксемії у хворого буде віднесено до одного з двох етіопатогенетичних чинників її виникнення.
П’ятий крок — формування резюме. Етіопатогенетична причина токсемії, що за своїми параметрами в сумі набирає максимальну кількість балів за всіма етапами (підбібліотекам) дослідження, встановлюється як провідна; наступна за нею — як фонова. За отриманими результатами дослідження призначається відповідна етіотропна терапія.
Висновки
Отримані нами результати дослідження дозволяють стверджувати, що використання дискримінантних функцій у математичних моделях дозволяє здійснювати процес розпізнавання вірогідних етіопатогенетичних чинників ендотоксемії у хворих. Проте недоліком такої моделі розпізнавання є те, що на кожному кроці ми визначаємо в хворого той чи інший чинник, тобто якщо в хворого етіопатогенетичний чинник ga, а проводиться порівняння g1 та g2, то хворий буде віднесений до однієї з двох груп.
Надалі ми плануємо провести дослідження моделі з розділення етіопатогенетичних чинників за так званою методикою неприйняття рішень та розглянути можливість побудови моделі без поділу на підбібліотеки через складність обчислень та громіздкості системи.
Окремо слід зауважити, що застосування математичної моделі для розпізнавання етіологічних чинників захворювання в цілому та ендотоксемії зокрема є принципово новим підходом у діагностиці, який скеровано на оптимізацію та прискорення призначення етіотропної терапії та підвищення ефективності лікування в цілому.
1. Проданчук М.Г., Шейман Б.С., Осадча О.І., Волошина Н.О. Спосіб вибору методу детоксикаційної терапії. Патент України на винахід № 74280 G01N33/48, A61B10/00; 15.11.2005, Бюл. № 11, 2005 р. — С. 1-24.
2. Проданчук М.Г., Шейман Б.С., Осадча О.І., Волошина Н.О. Спосіб діагностики етіологічного чинника токсемії. Патент України на винахід № 76227 G01N 33/48, A61B10/00; 17.07.2006, Бюл. № 7, 2006 р. — С. 1-16.
3. Тюрин Ю.Н., Макаров А.А. Статистический анализ данных на компьютере. — М.: ИНФРА-М, 1998. — 528 с.
4. Amiya Nayak, Ivan Stojmenovic Handbook of applied algorithm. Solving scientific, engineering and practical problem. – Willey interscience, 2008. — 541 p.
5. Barbara G. Tabachnick, Linda S. Fidell. Using multivariate statistics. — 4th ed. — 2006. – 1008 p.

/69/69.jpg)
/71/71.jpg)
/72/72.jpg)