Журнал «Здоровье ребенка» 4 (55) 2014
Вернуться к номеру
Особливості перебігу хронічного гастродуоденіту, морфологічних змін та стану гастропротекції у дітей на фоні дефіциту цинку
Авторы: Марушко Ю.В., Асонов А.О. - Кафедра педіатрії № 3 НМУ імені О.О. Богомольця, м. Київ; Гічка С.Г. - Кафедра патологічної анатомії, гістології та судової медицини Київського медичного університету УАНМ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Вступ. Однією з актуальних проблем сучасної педіатрії є захворювання травного тракту. За останні роки доведена негативна роль дефіциту цинку у формуванні захворювань органів травлення.
Мета роботи — дослідити особливості клінічного перебігу хронічного гастродуоденіту та стану гастропротекції при дефіциті цинку в організмі дітей для обґрунтування лікувально-реабілітаційних заходів.
Матеріали та методи. Згідно з протоколом діагностики та лікування захворювань органів травлення у дітей обстежені 189 дітей віком від 6 до 17 років із діагнозом хронічного гастродуоденіту в періоді загострення.
Проведено дослідження вмісту цинку у волоссі методом рентген-флюоресцентної спектрометрії, умісту цинку в сироватці крові 72 дітей — спектральним атомно-абсорбційним методом. Оцінка цитопротективних властивостей слизового бар’єра шлунка проводилась шляхом визначення рівня фукози шлункового слизу 44 пацієнтів.
Результати. Залежно від рівня цинку у волоссі діти з гастродуоденітом були розподілені на 2 групи спостереження: І група (основна) — 86 дітей із хронічним гастродуоденітом, які мали дефіцит цинку у волоссі, ІІ група — 100 дітей із хронічним гастродуоденітом із нормальним умістом цинку у волоссі
В основній групі вірогідно частіше спостерігається синдром хронічної неспецифічної інтоксикації (у 86,1 %), ніж у пацієнтів групи порівняння (70,0 %; р < 0,05).
За результатами морфологічного дослідження слизової оболонки шлунка та дванадцятипалої кишки в дітей із зниженим вмістом цинку у волоссі та хронічним гастродуоденітом частіше спостерігається хронічний атрофічний гастрит (у 44,4 %) та хронічний атрофічний гастродуоденіт (у 44,4 %), ніж у дітей із нормальним умістом даного мікроелемента (11,8 та 11,8 % відповідно; р < 0,05).
У дітей із зниженим умістом цинку спостерігається вірогідно більш виражене зниження концентрації фукози шлункового слизу (2,68 ± 0,17 ммоль/л) порівняно з групою пацієнтів із нормальним умістом даного мікроелемента (3,56 ± 0,15 ммоль/л; р < 0,05).
Висновки. Отримані дані вказують на можливість удосконалення лікування дітей, хворих на хронічний гастродуоденіт з урахуванням обміну цинку.
Введение. Одной из актуальных проблем современной педиатрии являются заболевания пищеварительного тракта. За последние годы доказана отрицательная роль дефицита цинка в формировании заболеваний органов пищеварения.
Цель работы — исследовать особенности клинического течения хронического гастродуоденита и состояния гастропротекции при дефиците цинка в организме детей для обоснования лечебно-реабилитационных мероприятий.
Материалы и методы. Согласно протоколу диагностики и лечения заболеваний органов пищеварения у детей обследованы 189 детей в возрасте от 6 до 17 лет с диагнозом хронического гастродуоденита в период обострения.
Проведено исследование содержания цинка в волосах методом рентген-флюоресцентной спектрометрии, содержания цинка в сыворотке крови 72 детей — спектральным атомно-абсорбционным методом. Оценка цитопротективных свойств слизистого барьера желудка проводилась путем определения уровня фукозы желудочной слизи 44 пациентов.
Результаты. В зависимости от уровня цинка в волосах дети с гастродуоденитом были разделены на 2 группы наблюдения: I группа (основная) — 86 детей с хроническим гастродуоденитом, имевших дефицит цинка в волосах, II группа — 100 детей с хроническим гастродуоденитом с нормальным содержанием цинка в волосах.
В основной группе достоверно чаще наблюдается синдром хронической неспецифической интоксикации (в 86,1 %), чем у пациентов группы сравнения (70,0 %, р < 0,05).
По результатам морфологического исследования слизистой оболочки желудка и двенадцатиперстной кишки у детей с пониженным содержанием цинка в волосах и хроническим гастродуоденитом чаще наблюдается хронический атрофический гастрит (в 44,4 %) и хронический атрофический гастродуоденит (в 44,4 %), чем у детей с нормальным содержанием данного микроэлемента (11,8 и 11,8 % соответственно, р < 0,05).
У детей с пониженным содержанием цинка наблюдается достоверно более выраженное снижение концентрации фукозы желудочной слизи (2,68 ± 0,17 ммоль/л) по сравнению с группой пациентов с нормальным содержанием данного микроэлемента (3,56 ± 0,15 ммоль/л,
р < 0,05).
Выводы. Полученные данные указывают на возможность усовершенствования лечения детей, больных хроническим гастродуоденитом, с учетом обмена цинка.
Introduction. One of the urgent problems of modern pediatrics are diseases of the digestive tract. Over the past years there was proved negative role of zinc deficiency in the formation of digestive diseases.
Objective of the study — to explore the features of clinical course of chronic gastroduodenitis and gastroprotection state in zinc deficiency in children’s organisms to justify the treatment and rehabilitation measures.
Materials and Methods. According to the protocol of diagnosis and treatment of digestive diseases in children, we examined 189 children aged 6 to 17 years with a diagnosis of chronic gastroduodenitis during exacerbation.
A study of zinc level in hair has been carried out by X-ray fluorescence spectrometry, the zinc content in the blood serum of 72 children — by spectral atomic absorption method. Evaluation of cytoprotective properties of gastric mucosal barrier was carried out by determining the level of fucose in gastric mucin of 44 patients.
Results. Depending on the level of zinc in the hair, children with gastroduodenitis were divided into 2 groups: I group (study one) — 86 children with chronic gastroduodenitis who had zinc deficiency in hair, II group — 100 children with chronic gastroduodenitis with normal zinc content in hair.
In the study group syndrome of chronic nonspecific intoxication was significantly more common (86.1 %) than in those of the comparison group (70.0 %, p < 0.05).
According to the results of morphological study of the gastric mucosa and duodenum in children with low zinc content in hair and chronic gastroduodenitis, chronic atrophic gastritis (44.4 %) and chronic atrophic gastroduodenitis (44.4 %) were more prevalent than in children with normal content of this microelement (11.8 and 11.8 %, respectively, p < 0.05).
In children with reduced zinc content we observed a significantly greater decrease in the concentration of fucose in gastric mucin (2.68 ± 0.17 mmol/l) compared with patients with normal content if this microelement (3.56 ± 0.15 mmol/l, p < 0.05).
Conclusions. These findings point to the possibility of improving the treatment of children with chronic gastroduodenitis, considering the exchange of zinc.
цинк, діти, патологія травного каналу.
цинк, дети, патология желудочно-кишечного тракта.
zinc, children, gastrointestinal pathology.
Статья опубликована на с. 7-12
Вступ
Однією з актуальних проблем сучасної педіатрії є захворювання травного тракту. Останні роки характеризуються стрімким зростанням поширення гастроентерологічної патології серед дітей. За поширенням захворювання органів травлення займають друге місце після захворювань органів дихання. У структурі гастроентерологічних захворювань у дітей переважають хвороби органів гастродуоденальної зони. Поширеність хронічного гастродуоденіту серед дитячого населення 200–220 ‰, а в екологічно несприятливих регіонах — 300–400 ‰ [1]. На цей час у формуванні хронічних запальних захворювань гастродуоденальної зони (гастриту, гастродуоденіту) вагоме значення має дисбаланс між факторами агресії та захисту слизової оболонки шлунка та дванадцятипалої кишки [2, 3].
Есенціальні мікроелементи значно впливають на стан шлункової секреції, продукцію факторів захисту слизової оболонки шлунка і дванадцятипалої кишки, зворотну дифузію водневих іонів, фізіологічну активність гормонів і вітамінів, тканинне дихання [4–8].
На сьогодні продовжується вивчення впливу, частоти, питомої ваги окремих факторів у розвитку хронічного гастродуоденіту (ХГД), зокрема недостатність слизового шару, що має значну питому вагу серед факторів гастропротекції.
Вивчення біохімічного складу надепітеліального слизового шару є важливим для розуміння патогенезу цілого ряду захворювань шлунково-кишкового тракту [3, 9]. Відомо, що під час запалення відбувається активізація матриксних металопротеїназ, що здатні розщепляти майже всі компоненти в позаклітинному матриксі сполучної тканини, протеогліканів зокрема. За даними літератури, за умов зниженого вмісту цинку в організмі відбувається вивільнення гідролітичних ферментів, що призводить до пошкодження мембранних структур клітин різноманітних органів та тканин, у тому числі слизової оболонки шлунка [10].
Комплексного визначення факторів агресії та захисту слизової шлунка у здорових та дітей із гастродуоденальною патологією з урахуванням вмісту цинку в організмі не проводилося.
Мета роботи — дослідити особливості клінічного перебігу хронічного гастродуоденіту та стану гастропротекції при дефіциті цинку в організмі дітей для обґрунтування лікувально-реабілітаційних заходів.
Матеріали і методи
Для вирішення поставлених завдань у дослідження були включені 189 дітей із хронічним гастродуоденітом віком від 6 до 17 років, які перебували на стаціонарному лікуванні в дитячій клінічній лікарні № 8 м. Києва.
У своїй роботі ми спиралися на протокол діагностики та лікування захворювань органів травлення в дітей (Наказ МОЗ від 29.01.2013 № 59) [1].
Основним критерієм для включення дітей у дослідження були клінічні прояви хронічного гастродуоденіту (ХГД) з урахуванням скарг, анамнезу та необхідність проведення діагностичної фіброезофагодуоденоскопії (ФЕГДС); згода батьків на участь у дослідженні.
Критерії виключення у дослідження: прийом протягом 4 тижнів до включення в дослідження антибіотиків, метронідазолу, препаратів вісмуту, інгібіторів протонної помпи, блокаторів Н2-гістамінових рецепторів, вітамінно-мінеральних комплексів, цитопротекторів, препаратів заліза та цинку, підвищений уміст цинку у волоссі.
Дослідження виконано з дотриманням основних положень Гельсінської декларації про етичні принципи проведення біомедичних досліджень за участю людини (1964–2000), Конвенції Ради Європи про права людини та біомедицини (1997). Матеріали клінічного дослідження розглянуті та затверджені комісією з питань етики НМУ імені О.О. Богомольця (протокол № 75 від 13.12.2013 р.).
Обсяг проведених досліджень включав комплексне обстеження: ретельне вивчення анамнезу захворювання та життя; фізикальне обстеження, проведення загальноклінічних лабораторних досліджень, що включали загальний аналіз крові, загальний білок сироватки крові, загальний білірубін та його фракції, аланінамінотрансферазу, аспартатамінотрансферазу, загальний аналіз сечі, копрограму та дослідження калу на приховану кров; інструментальні методи дослідження. Результати обстеження заносили до індивідуальних карт хворого, що були спеціально розроблені на кафедрі педіатрії № 3 Національного медичного університету імені О.О. Богомольця.
При надходженні на лікування дітям із ХГД та їх батькам ми пропонували заповнити анкету. Питання в анкеті стосувалися дитини та її сім’ї, анамнезу захворювання та анамнезу життя. Значна увага приділялась анамнезу захворювання: коли почалося захворювання, скільки загострень було за останній рік, яке проводилося лікування, чи було проведено антихелікобактерну терапію.
Верифікація діагнозу проводилась на підставі комплексного клінічного та лабораторно-інструментального обстеження.
При проведенні фіброезофагогастродуоденоскопії використовувалися гнучкі фіброскопи GIF-PQ20 та GIF-PQ140 фірми Olympus, Японія. Дослідження проводили за загальноприйнятими рекомендаціями. Оцінка ендоскопічних змін проводилась згідно з класифікацією А.В. Мазурина (1984), що затверджена для користування в педіатрії.
Для аналізу біохімічного складу нативного слизу використовували аспірати шлункового секрету. Оцінка цитопротективних властивостей слизового бар’єра шлунка проводилась шляхом визначення рівня фукози шлункового слизу за методом Dishe (1948) у 44 дітей (клініко-біохімічна лабораторія ДУ «Інститут педіатрії, акушерства і гінекології НАМН України»). За даними Сальникова А.В., уміст фукози у складі глікопротеїнів надепітеліального слизового шару в потенційно здорових осіб становить 10,7 ± 2,2 ммоль/л [11].
Із метою дослідження кислотоутворюючої функції шлунка застосовувалася базальна топографічна рН-метрія з використанням рН-мікрозонда –«ИКЖ-2» за методом В.М. Чорнобрового (1991).
Проведено морфологічне дослідження біоптатів слизової оболонки шлунка та дванадцятипалої кишки 35 дітей у лабораторії кафедри патологічної анатомії Київського медичного університету УАНМ. Біопсійний матеріал поміщали у 10% розчин нейтрального забуференого формаліну (pH 7,4) та фіксували протягом 24 годин. Після дегідратації шматочки заливали в парафін за стандартною методикою. Гістологічні препарати товщиною 4–5 мкм забарвлювали гематоксиліном та еозином, а також за методикою Гімзе. Гістологічні препарати вивчалися з використанням мікроскопа Olympus BX 51, цифрової камери Olympus C 5050 Z та програмного забезпечення Olympus DP-Soft.
Для ідентифікації хелікобактеріозу використовували гістологічний метод, а також неінвазивну специфічну експрес-діагностику за складом видихуваного повітря за допомогою тест-системи «Хелік» з індикаторною трубкою (ООО «АМА», Росія).
Визначення вмісту цинку сироватки крові проводилось 72 пацієнтам спектральним атомно-абсорбційним методом (Kelner R., 2004) у «Лабораторії Др. Редгера, MDI» (Ліцензія МОЗ України № 603260 от 23.09.2011). За дефіцит цинку прийнято зниження його рівня в крові людини нижче 12,8 мкмоль/л (за даними Aggett et al., 1979; Щеплягіна, 2001).
Усім пацієнтам проводили дослідження вмісту цинку, заліза, міді та інших мікроелементів у волоссі методом рентген-флюоресцентної спектрометрії на апараті ElvaX-med. За даними, що отримані нами в численних дослідженнях за допомогою рентген-флюоресцентної спектрометрії, нижній пороговий уміст цинку у волоссі встановлений на рівні 100 мкг/г. При його рівні, меншому за нижній поріг, констатували дефіцит цинку (Патент на корисну модель № 6821 «Спосіб діагностики дефіциту цинку у дітей» від 10.04.2012).
Статистична обробка отриманих даних проведена за загальноприйнятими методами варіаційної статистики. Визначалися базові статистичні показники — середня арифметична величина (М), середня похибка середньої величини (m), р — досягнутий рівень статистичної значимості, n — обсяг аналізованої групи. Оцінку вірогідностей відмінностей у порівнюваних обстежуваних групах проводили стандартними параметричними й непараметричними методами за допомогою критеріїв Стьюдента, Вілкоксона. Для порівняння частотних показників у вибірках застосовувався критерій Пірсона x2, критерій Фішера та поправка Йейтса на безперервність (вибір методу оцінки базувався на розмірі вибірки, що досліджувалася). Різниця між групами вважалася статистично значимою при вірогідності помилки (a) нульової гіпотези не більше ніж 5 % (р < 0,05).
Результати дослідження
Нами було проведено визначення вмісту цинку у прикореневій зоні волосся дітей із хронічним гастродуоденітом. Результати дослідження наведені в табл. 1.
Аналіз отриманих результатів показав, що дефіцит цинку встановлено у волоссі 45,5 % обстежуваних дітей.
Нами було проведено визначення вмісту цинку сироватки крові 72 дітей із ХГД. Результати дослідження наведені в табл. 2.
Як видно з табл. 2, у 54,2 % дітей із хронічним гастродуоденітом спостерігається зниження рівня цинку в сироватці крові.
Дефіцит цинку, виявлений у волоссі, у переважній більшості випадків підтверджувався результатами дослідження цинку сироватки крові (95,83 %). Сироватка крові відображає елементний статус, короткочасний за експозицією та значний за ступенем відхилення. Волосся відображає елементний статус, що формується протягом тривалого часу (місяці, роки) і більш придатне для клінічної оцінки [4, 5].
Залежно від рівня цинку у волоссі діти з гастродуоденітом були розподілені на 2 групи спостереження: І група (основна) — 86 дітей із хронічним гастродуоденітом, які мали дефіцит цинку у волоссі (81,26 ± 1,55 мкг/г); ІІ група (порівняння) — 100 дітей із хронічним гастродуоденітом та нормальним умістом цинку у волоссі (131,94 ± 2,66 мкг/г). За віковим, статевим складом обидві групи вірогідно не відрізнялись між собою.
Аналізуючи дані анамнезу, ми відмічали, що випадки загострення ХГД вірогідно частіше (р < 0,05) спостерігаються у групі пацієнтів із дефіцитом цинку (2,52 ± 0,1), ніж у дітей групи порівняння (1,64 ± 0,07).
Аналіз клінічного обстеження пацієнтів свідчить про наявність у двох групах дітей з ХГД у період загострення больового абдомінального; диспептичного синдрому та синдрому хронічної неспецифічної інтоксикації.
В основній групі вірогідно частіше (у 86,1 %) спостерігається синдром хронічної неспецифічної інтоксикації, ніж у пацієнтів групи порівняння (70,0 %; р < 0,05). Больовий та диспептичний синдроми зустрічалися дещо частіше, але вірогідної різниці нами не було встановлено.
Усім хворим за згодою батьків була проведена ФЕГДС. За даними ендоскопічного обстеження поверхневий гастродуоденіт був діагностований у І групі в 66 (76,7 %) випадках, а у групі порівняння — у 87 (87,0 %) дітей відповідно. Гіпертрофічні зміни слизової оболонки шлунка (СОШ) та дванадцятипалої кишки (СО ДПК) спостерігались у 7 (8,2 %) дітей з основної групи та у 7 (7,0 %) обстежених із групи порівняння; ерозивні процеси в шлунку та ДПК виявлені в 11 (12,8 %) дітей І групи та в 4 (4,0 %; р < 0,05) дітей ІІ групи; субатрофія — у 2 (2,3 %) дітей з основної групи та у 2 (2,0 %) дітей із групи порівняння.
За результатами проведеного морфологічного дослідження біоптатів СОШ та СО ДПК встановлено певні особливості перебігу хронічного гастриту та дуоденіту в умовах дефіциту цинку.
При морфологічному дослідженні СОШ серед дітей основної групи в стадії загострення діагностували вірогідно частіше хронічний атрофічний гастрит (ХАГ) — у 8 (44,4 %) пацієнтів, ніж у групі порівняння, де ХАГ діагностовано у 2 (11,8 %; р < 0,05) пацієнтів. Також при дослідженні СО ДПК дітей основної групи в стадії загострення вірогідно частіше діагностували хронічний атрофічний дуоденіт (ХАД) — у 8 (44,4 %) пацієнтів, ніж у групі порівняння, де ХАД діагностовано тільки у 2 (11,8 %; р < 0,05) пацієнтів.
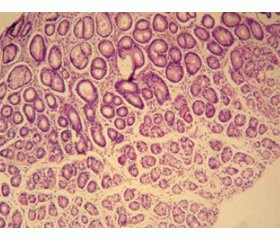
Нами було встановлено більш виражені процеси альтерації в епітелії залоз СОШ у пацієнтів із дефіцитом цинку, більш виражені процеси субатрофії залоз у слизовій оболонці в пацієнтів із дефіцитом цинку (рис. 1).
У переважній більшості випадків хронічного гастриту на тлі дефіциту цинку в біоптатах виявлені ознаки повної або неповної кишкової метаплазії поверхневого покривного епітелію та епітелію залоз (рис. 2).
Також нами спостерігалися в біоптатах більш виражені процеси субатрофії в слизовій оболонці цибулини дванадцятипалої кишки та СОШ у групі пацієнтів із дефіцитом цинку.
Аналіз результатів проведеного обстеження дітей на хелікобактеріоз виявив, що в дітей із ХГД має місце збільшення частоти Н.pylori-асоційованих ХГД із віком дитини. Інфікування Helicobacter pylori верифіковано нами в 62 (72,1 %) із 86 хворих І групи та в 61 (61,0 %) із 100 дітей ІІ групи. Вірогідної різниці за наявністю інфікування Н.рylori не встановлено.
Під час ендоскопічного дослідження у 54 (62,8 %) дітей з основної групи та в 42 (42,0 %; р < 0,05) дітей із групи порівняння виявлено супутні порушення моторно-евакуаторної функції шлунка та ДПК у вигляді гастроезофагеального рефлюксу та дуоденогастрального рефлюксу.
Дослідження шлункової секреції показало, що в обох групах більшість дітей мали нормальну кислотоутворюючу функцію шлунка (45,35 та 43,0 % відповідно). Вірогідних відмінностей у рівні базальної кислотності між обстежуваними групами не виявлено.
За результатами дослідження слизу шлункового секрету була встановлена вірогідна різниця в показниках фукози слизового бар’єра шлунка у групах порівняння (табл. 3).
Як видно із даних табл. 3, у дітей із зниженим умістом цинку спостерігається вірогідно більш виражене зниження концентрації фукози шлункового слизу (2,68 ± 0,17 ммоль/л) порівняно з ІІ групою (3,56 ± 0,15 ммоль/л; р < 0,05).
Таким чином, отримані дані про особливість перебігу хронічного гастродуоденіту в дітей на фоні дефіциту цинку необхідно враховувати при розробці лікувальних та профілактичних заходів цим дітям. Такий підхід покращить результати терапевтичних заходів.
Висновки
1. Перебіг хронічного гастродуоденіту в дітей при зменшенні вмісту цинку характеризується більш частими загостреннями (2,52 ± 0,10), ніж у дітей групи порівняння (1,64 ± 0,07; р < 0,05). Синдром хронічної неспецифічної інтоксикації в дітей із хронічним гастродуоденітом спостерігається частіше при дефіциті цинку у волоссі (у 86,1 %), ніж у пацієнтів із нормальним умістом даного мікроелемента (70,0 %; р < 0,05).
2. За результатами морфологічного дослідження слизової оболонки шлунка та дванадцятипалої кишки в дітей із зниженим умістом цинку у волоссі та хронічним гастродуоденітом частіше спостерігається хронічний атрофічний гастрит (у 44,4 %) та хронічний атрофічний гастродуоденіт (у 44,4 %), ніж у дітей із нормальним умістом даного мікроелемента (11,8 та 11,8 % відповідно; р < 0,05).
3. У дітей із зниженим умістом цинку у волоссі та хронічним гастродуоденітом спостерігається більш виражене зниження вмісту фукози слизового бар’єра шлунка (2,68 ± 0,17 ммоль/л) порівняно з групою пацієнтів із нормальним умістом даного мікроелемента (3,56 ± 0,15 ммоль/л; р < 0,05).
1. Наказ МОЗ від 29.01.2013 № 59 Про затвердження протоколів діагностики та лікування захворювань органів травлення у дітей. — [Електронний ресурс]. — Режим доступу до Наказу: http://www.moz.gov.ua/ua/portal/dn_20130129_0059.html
2. Рылова Н.В. Особенности формирования заболеваний верхнего отдела пищеварительного тракта у детей (медико-экологические аспекты): Автореф. дис… д-ра мед. наук: спец. 14.01.10: педиатрия / Н.В. Рылова. — Москва, 2009. — 317 с.
3. Cammorlinga-Ponce M. Intensity of inflammation, density of colozation and interleukin-8 response in the gastric mucosa of children infected with Helicobacter pylori / M. Cammorlinga-Ponce // Helicobacter. — 2007. — Vol. 8, № 5. — Р. 38-39.
4. Скальный А.В. Химические элементы в физиологии и экологии человека / А.В. Скальный. — М., 2004. — 216 с.
5. Марушко Ю.В. Клінічне значення дефіциту цинку в патології травного каналу у дітей / Ю.В. Марушко, О.Л. Таринська, А.О. Асонов // Вісник наукових праць співробітників НМАПО ім. Шупика. — 2010. — Випуск 19, книга 3. — С. 796-802.
6. Prasad А.S. Zinc: Mechanisms of Host Defense / А.S. Prasad // J. Nutr. — 2007. — № 137. — Р. 1345-1349.
7. Dovhanj J. Helicobacter Pylori, Zinc and Iron in Oxidative Stress-Induced Injury of Gastric Mucosa / J. Dovhanj // Mini-Reviews in Medicinal Chemistry. — 2009. — № 9. — P. 26-30.
8. Кононов А.В. Цитопротекция слизистой оболочки желудка: молекулярно-клеточные механизмы / А.В. Кононов // Рос. журн. гастроэнтерол., гепатол., колонопроктол. — 2006. — Т. 16, № 3. — С. 12-16.
9. Каракешишева М.Б. Роль компонентов желудочной слизи и клеточного состава воспалительного инфильтрата слизистой оболочки желудка в оценке риска развития рака желудка у больных с дисплазией II–III степени / М.Б. Каракешишева // Сибирский онкологический журнал. — 2007. — № 4. — C. 57-61.
10. Nagase H. Matrix metalloproteinases in Zinc Metalloproteases in Health and Disease / Hooper N.M., ed. — Taylor&Francis, London, UK, 1996. — 153-204.
11. Сальников А.В. Морфофункциональное состояние слизистой оболочки желудка и надэпителиального слизистого слоя при Helicobacter pylori инфекции: Автореф. дис… канд. мед. наук: 14.01.10: педиатрия / А.В. Сальников. — Томск, 1999. — 126 с.

/9/9.jpg)
/10/10.jpg)
/11/11.jpg)