Журнал «Здоровье ребенка» 4 (55) 2014
Вернуться к номеру
Особливості лікування хронічних гастритів, асоційованих із герпесвірусами, у дітей
Авторы: Абатуров О.Є. - Державний заклад «Дніпропетровська медична академія Міністерства охорони здоров’я України»; Леоненко Н.Й. - Державна установа «Інститут гастроентерології НАМН України», м. Дніпропетровськ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті наведені дані щодо клінічних проявів та особливостей лікування хронічних гастритів, асоційованих із вірусними інфекціями, у дітей.
В статье приведены данные о клинических проявлениях и особенностях лечения хронических гастритов, ассоциированных с вирусными инфекциями, у детей.
The article presents data on the clinical manifestations and peculiarities of treatment for chronic gastritis associated with viral infections in children.
гастродуоденальна патологія, вірусні інфекції, діти, противірусні препарати.
гастродуоденальная патология, вирусные инфекции, дети, противовирусные препараты.
gastroduodenal pathology, viral infections, children, antivirals.
Статья опубликована на с. 13-15
Вступ
Активне вивчення Helicobacter pylori виявило численні факти його участі в патогенезі захворювань шлунка. Сучасні епідеміологічні дослідження свідчать про високу поширеність хелікобактерної інфекції як серед дітей, так і серед дорослих. Поряд зі значенням Helicobacter pylori у розвитку патології гастродуоденальної зони як конкуруючий етіологічний фактор сьогодні розглядається специфічна внутрішньоклітинна інфекція. В ураженні шлунка та дванадцятипалої кишки інфекційному фактору, зокрема вірусам сімейства герпесу, надається виняткова роль. Накопичуються дані про можливу роль цитомегаловірусної інфекції, вірусу Епштейна — Барр (EBV) у розвитку гастриту в дітей. Одним із найбільш поширених представників сімейства герпесвірусів є вірус EBV. За структурою геному та біологічними властивостями це гамма-герпесвірус, за класифікацією герпесвірусів, патогенних для людини, EBV — герпесвірус IV типу або HHV-4 (human Herpesvirus type 4) [1].
Ускладнення етіологічноі структури захворювань гастродуоденальної зони у дітей та виявлення нових патогенів спричинило зміну у підходах до терапії. Тому актуальною на сьогодні залишається проблема оптимального диференціального підходу до первинної діагностики, що вимагає розробки нових ефективних методів лікування даної патології [2, 3]. У роботах, присвячених вивченню проблем лікування хронічної вірусної інфекції Епштейна — Барр, більше уваги приділяється інтерферону a, у ряді випадків з індукторами інтерферону. Інтерферон застосовується для створення противірусного стану природних кілерів, підвищення рівня фагоцитарної активності моноцитів, підвищення кількості лімфоцитів, що сприяє формуванню повноцінної імунної відповіді і прокращує прогноз захворювання. Одним із перспективних напрямків розвитку сучасної фармакології є розробка ліпосомальних препаратів, що мають ряд безсумнівних переваг: захист клітин організму від токсичної дії лікарських засобів, пролонгування дії введеного в організм лікарського засобу, сприяння прояву націленої специфічності за рахунок селективного проникнення з крові у тканини, зміна фармакокінетики, підвищення фармакологічної ефективності препаратів, дозвіл створення водорозчинної форми ряду лікарських субстанцій, підвищення їх біодоступності [4–6]. Ці характеристики препарату спонукали до вивчення його ефективності при лікуванні дітей з хронічним гастритом, асоційованим із внутрішньоклітинною вірусною інфекцією.
Мета дослідження — вивчити клінічну ефективність використання рекомбінантного інтерферону a2b у дітей з хронічним гастритом, асоційованим із внутрішньоклітинною вірусною інфекцією.
Матеріали та методи дослідження
Під спостереженням перебували 50 дітей віком від 6 до 17 років із хронічним гастритом, асоційованим із внутрішньоклітинною вірусною інфекцією, в стадії загострення, які знаходились на обстеженні та лікуванні в міському дитячому гастроентерологічному відділенні ДЗ «МДКЛ № 1 ДОР» м. Дніпропетровська.
Діти, які були під наглядом, розподілені методом випадкового розподілу на 2 групи. Основну (I) групу становили 26 дітей, у яких лікування проводилось згідно з уніфікованими клінічними протоколами медичної допомоги дітям із захворюваннями органів травлення: при гіперацидному хронічному гастриті блокатори Н2-рецепторів гістамину або інгібітори Н+ К+ АТФази, антациди, прокінетики, цитопротектори. До комплексної терапії нами включено ліпосомальний препарат рекомбінантного a-інтерферону (ліпоферон, «Вектор-Медіка», Росія) по 500 МЕ на добу впродовж 14 діб. До групи порівняння (II) увійшло 24 хворих, які отримували симптоматичну терапію.
Усім хворим дітям разом із з’ясуванням скарг і анамнезу захворювання, фізикальним оглядом, лабораторним обстеженням (загальноклінічні дослідження крові, сечі та калу, біохімічна гепатограма) проведено ендоскопічне дослідження стравоходу, шлунка, дванадцятипалої кишки (Pentax FG-15W, Японія), визначення кислото- та секретоутворюючої функції, ультразвукове дослідження органів черевної порожнини, визначення специфічних імуноглобулінів IgM, IgG до CMV, антитіл IgM до капсидного антигену (VCA) EBV, IgG до раннього антигену (EA) EBV, IgG до ядерного антигену (EBNA) EBV. Дезрибонуклеїнову кислоту (ДНК) вірусів CMV та EBV визначали у біоптаті слизової оболонки шлунка та шлунковому соці методом полімеразної ланцюгової реакції (тест-системи «АмпліСенс», Росія).
Критерієм наявності EBV-асоційованої інфекції або свідоцтвом контакту з EBV у минулому були специфічні серологічні маркери. При цьому в гострій фазі захворювання або під час загострення хронічного процесу в сироватці крові з’являються специфічні IgM-антитіла до вірусного капсидного антигену (IgM-VCA-EBV), що зникають, як правило, через чотири — шість тижнів. У гострій фазі також визначаються поверхневі ранні IgG-антитіла (IgG-EA-EBV), які є маркерами активної реплікації вірусу і при одужанні зникають. Через два-три місяці після гострої EBV-інфекції в сироватці крові виявляються IgG-антитіла до ядерного антигену (IgG-EBNA-EBV); їх продукція зберігається протягом усього життя.
Як критерій ефективності лікування розглядались терміни купірування больового і диспептичного синдромів, динаміка загального стану, середній ліжко-день та частота рецидиву захворювання впродовж року після закінчення лікування.
Тривалість лікування становила 2 тижні з контролем ефективності на 7-й і 14-й день від початку терапії. Контроль наявності герпесвірусних інфекцій проводили через 6 місяців та рік потому після закінчення лікування.
Статистична обробка отриманих даних була проведена за допомогою статистичних програм Statgraf, Matstat. Вірогідність розходжень оцінювалася за допомогою t-критерію Стьюдента (дані з нормальним розподілом) та критерію Манна — Уїтні (при розподілі, відмінному від нормального).
На проведення обстеження було отримано добровільну інформовану письмову згоду батьків пацієнтів.
Результати досліджень та їх обговорення
У І групі дітей хлопчики становили 60,0 %, у ІІ групі — 57,1 %; дівчатка — відповідно 40,0 і 32,9 %. Середній вік хворих — 12 років.
У клінічній картині більшості хворих до початку лікування домінували больовий, диспептичний та астеновегетативний синдроми. Основні клінічні симптоми наведені у табл. 1.
Клінічні особливості перебігу гастродуоденальної патології, асоційованої з вірусом Епштейна — Барр та цитомегаловірусом у дітей характеризувалися сезонністю загострень захворювання (весна — осінь) на тлі або після гострої вірусної респіраторної інфекції, стійкими астеновегетативними порушеннями. Приєднання герпесвірусних інфекцій у хворих вірогідно погіршує прогноз гастродуоденальних захворювань. Аналіз скарг пацієнтів показав, що найчастіше в обстежених спостерігався больовий синдром (до 100 %). Найбільш типова локалізація болю відмічалась в епігастральній та пілородуоденальній зонах з однаковою частотою у дітей різних вікових груп. Больовий синдром найчастіше поєднувався з диспептичним і астеновегетативним синдромами. Диспептичний синдром характеризувався розладом апетиту, нудотою, блювотою, печією, метеоризмом. Практично в усіх хворих дітей визначався чіткий зв’язок больового синдрому з прийомом їжі. Астеновегетативний синдром проявлявся вегетативною нестабільністю, дратівливістю, швидкою стомлюваністю, головним болем.
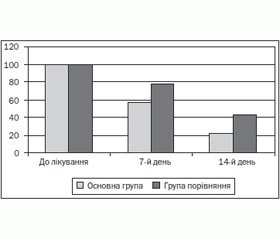
Динаміка вираженості основних клінічних симптомів на 7-й та 14-й день лікування наведені на рис. 1 (больовий синдром), рис. 2 (диспептичний синдром), рис. 3 (астеновегетативний синдром).
При порівнянні динаміки клінічних проявів на 7-му та 14-ту добу від початку лікування було встановлено, що на тлі комбінованої терапії з включенням ліпосомального препарату рекомбінантного a-інтерферону відбувався швидший регресс інтенсивності основних синдромів захворювання, внаслідок чого середній ліжко-день становив 12,5 проти 15,5 дня у групі порівняння, частота рецидиву протягом першого року після проведеного лікування була значно нижчою на відміну від хворих із групи порівняння: 2,4 проти 35,6 %.
/15/15_2.jpg)
Ефективність успішної ерадикації вірусної інфекції контролювали через 6 місяців та 1 рік після закінчення противірусної терапії шляхом визначення ДНК вірусу Епштейна — Барр та ДНК цитомегаловірусу у шлунковому соку та біоптаті слизової оболонки шлунка. У дітей основної групи через рік після закінчення лікування не було виявлено ДНК вірусу Епштейна — Барр та ДНК цитомегаловірусу.
Висновки
1. Виявлення ДНК вірусу Епштейна — Барр і ДНК цитомегаловірусу в шлунковому соку та/або в слизовій оболонці шлунка свідчить про активну реплікацію вірусів у шлунку та є показанням до включення у схему лікування противірусного препарату.
2. Доведена безпечність та ефективність застосування перорального ліпосомального рекомбінантного інтерферону альфа-2b за рахунок більш швидкого зменшення больового, диспептичного і астеновегетативного синдромів, внаслідок чого зменшується перебування хворого на ліжку та знижується частота рецидивів.
1. О причинах вариабельности Helicobacter pylori-ассоциированных гастродуоденальных заболеваний у детей [Электронный ресурс] / Е.А. Корниенко, П.В. Антонов, О.Н. Нажиганов [и др.] // РМЖ. Детская гастроэнтерология и нутрициология. — 2003. — Т. 11, № 13. — Режим доступа: http://www.rmj.ru/articles_681.htm
2. Абатуров О.Є., Герасименко О.Н. Медикаментозна регуляція активності механізмів неспецифічного захисту слизової оболонки травного тракту у дітей, хворих на хронічний Helicobacter pylori-асоційований гастродуоденіт // Современная педиатрия. — 2011. — № 4. — С. 130-133.
3. Современный алгоритм обследования и лечения гастродуоденальной патологии у детей и подростков // Гастроентерологія: Міжвідомчий збірник. — Вип. 37. — Дніпропетровськ, 2006. — С. 440-445.
4. Ершова И.Б., Косенко В.С., Осычнюк Л.М., Осипова Т.Ф., Мочалова А.А. Липосомные формы интерферонов в педиатрической практике при лечении ОРВИ у детей // Здоровье ребенка. — 2009. — № 2(17).
5. Медикаментозное преодоление анатомических и клеточных барьеров с помощью липосом / Под ред. Л.М. Кузяковой, В.И. Ефременко. — Ставрополь, 2000. — С. 170.
6. Бажутин Н.Б., Золин В.В., Колокольцов А.А., Таргонский С.Н. Перспективы применения липосомальных препаратов в медицинской практике // Здоров’я України. — 2007. — № 3. — С. 71.

/14/14.jpg)
/15/15.jpg)