Журнал «Здоровье ребенка» 5 (56) 2014
Вернуться к номеру
Особливості ліпідного обміну в дітей із метаболічним синдромом
Авторы: Громнацька Н.М., Ткаченко С.К. - Львівський національний медичний університет імені Данила Галицького
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Вивчені особливості ліпідного спектра крові в дітей із метаболічним синдромом. Під спостереженням були 139 дітей віком від 9 до 18 років, які сформували дві групи: 1-ша група — 85 дітей із метаболічним синдромом на тлі абдомінального ожиріння, 2-га група — 54 дитини з нормальною масою тіла. Проведена антропометрія, визначені рівні загального холестерину, холестерину ліпопротеїдів високої щільності, холестерину ліпопротеїдів низької щільності, холестерину ліпопротеїдів дуже низької щільності, тригліцеридів, виміряний артеріальний тиск. Виявлено, що ознаками дисліпідемії були вірогідно підвищені рівні загального холестерину, холестерину ліпопротеїдів низької щільності, холестерину ліпопротеїдів дуже низької щільності, тригліцеридів і співвідношеня холестерин-не-ліпопротеїдів високої щільності, загальний холестерин/холестерин ліпопротеїдів високої щільності, індекс атерогенності, які слід використовувати як маркери в діагностиці метаболічного синдрому в дітей. Відносне підвищення холестерину ліпопротеїдів високої щільності, імовірно, слід вважати компенсаторною реакцією у відповідь на збільшення проатерогенних фракцій холестерину з метою їх нормалізації.
Изучены особенности липидного спектра крови у детей с метаболическим синдромом. Под наблюдением были 139 детей в возрасте от 9 до 18 лет, которые сформировали две группы: 1-я группа — 85 детей с метаболическим синдромом на фоне абдоминального ожирения, 2-я группа — 54 ребенка с нормальной массой тела. Проведена антропометрия, определены уровни общего холестерина, холестерина липопротеидов высокой плотности, холестерина липопротеидов низкой плотности, холестерина липопротеидов очень низкой плотности, триглицеридов, измерено артериальное давление. Выявлено, что признаками дислипидемии достоверно были повышенные уровни общего холестерина, холестерина липопротеидов низкой плотности, холестерина липопротеидов очень низкой плотности, триглицеридов и соотношения холестерин-не-липопротеидов высокой плотности, общий холестерин/холестерин липопротеидов высокой плотности, индекс атерогенности, которые следует использовать в качестве маркеров в диагностике метаболического синдрома у детей. Относительное повышение фракций холестерина липопротеидов высокой плотности, возможно, следует считать компенсаторной реакцией в ответ на повышение проатерогенных фракций холестерина с целью их нормализации.
Peculiarities of blood lipids in children with metabolic syndrome were studied. We observed 139 children aged 9 to 18 years, who formed two groups: 1st group — 85 children with metabolic syndrome on the background of abdominal obesity, 2nd group — 54 children with normal body weight. We have carried out anthropometry, defined levels of total cholesterol, high-density lipoprotein cholesterol, low-density lipoprotein cholesterol, very low-density lipoprotein cholesterol, triglycerides, blood pressure measured. It is found that signs of dyslipidemia were significantly elevated levels of total cholesterol, low-density lipoprotein cholesterol, very low-density lipoprotein cholesterol, triglycerides and ratio of non-high-density lipoprotein cholesterol, total cholesterol/high-density lipoprotein cholesterol, atherogenic index, which should be used as markers in the diagnosis of metabolic syndrome in children. Relative increase of high-density lipoprotein cholesterol fractions, possibly, must be considered as compensatory reaction in response to an increase of proatherogenic cholesterol fractions with a view to their normalization.
ліпідний обмін, метаболічний синдром, діти.
липидный обмен, метаболический синдром, дети.
lipid metabolism, metabolic syndrome, children.
Статья опубликована на с. 15-20
Вступ
Дисліпідемія є одним з основних критеріїв метаболічного синдрому в дітей [15, 19]. Компоненти ліпідного обміну відіграють суттєву роль у процесах метаболічної адаптації організму в нормі і при багатьох патологічних станах, що сприяє вторинним зсувам в ліпідному спектрі крові [9, 13].
Порушення обміну ліпопротеїдів, розвиток дис- та гіперліпідемій відіграють важливу роль у патогенезі атеросклеротичного процесу та пов’язаних із ним серцево-судинних захворювань, часто фатальних: раптова коронарна смерть, інфаркт міокарда, інсульт [15, 19, 25]. Атерогенна дисліпідемія є найбільш ранньою ознакою метаболічного синдрому (МС) та однією з основних причин кардіоваскулярної патології [22].
Екcперти National Cholesterol Education Programm (NCEP) рекомендують цілеспрямований скринінг дисліпідемій у дітей і підлітків при наявності в їх родинах ранніх серцево-судинних захворювань або підвищеного рівня холестерину. Керуючись запропонованими критеріями, можна думати, що скринінговим обстеженням на дисліпідемію має бути охоплено до 40 % дітей [17].
Дослідження Bogalusa Heart Study, проведене серед дітей і підлітків, та вивчення автопсій показали, що атеросклероз починається в дитинстві [20], розвивається протягом підліткового періоду та молодості і приводить до кардіоваскулярної патології в зрілому та старечому віці [25].
Дані досліджень Pathobiological Determinants of Аtherosclerosis in Youth and Bogalusa Heart Study показали, що ступінь тяжкості атеросклерозу коронарних артерій міцно корелює з віком, артеріальною гіпертензією, індексом маси тіла, ожирінням, гіперглікемією, дисліпідемією: рівнем холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ), холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) та тригліцеридів (ТГ) і з часом набирає прогностичної загрози [26, 29].
Дані щодо змін ліпідного спектра крові в дітей із МС неоднозначні. Вважають, що МС у дітей притаманні підвищення рівня загального холестерину (ЗХС), ТГ, ХС ЛПНЩ [3].
За даними літератури, для МС характерна ліпідна тріада, що представлена високими значеннями ТГ та дрібних часток ХС ЛПНЩ та низькими значеннями ХС ЛПВЩ, що збільшують ризик серцево-судинних захворювань навіть при відсутності порушень вуглеводного обміну та артеріальної гіпертензії [6]. Установлено, що в дітей із МС спостерігалося підвищення рівня ЗХС (56,7 %), ТГ (48,64 %), b-ліпопротеїдів (18,9 %) [5].
Виявили, що дівчатам із МС (на тлі, як генералізованого ожиріння, так і надлишкової маси тіла) і хлопцям із генералізованим ожирінням притаманне підвищення всіх показників ліпідного обміну: ЗХС, ТГ, ХС ЛПНЩ та зниження ХС ЛПВЩ [2].
Установлено, що в дітей із МС концентрація ЗХС підвищувалась у 94,8 % випадків, ТГ — у 77,8 %, ХС ЛПНЩ — у 35,5 %, між тим ТГ у дітей з ожирінням вірогідно перевищували рівень ТГ у дітей із надлишковою масою тіла та нормальною масою тіла [1]. Особи з підвищеним рівнем тригліцеридів схильні до розвитку МС [8].
Стверджують, що МС на тлі абдомінального ожиріння притаманна атерогенна метаболічна тріада, до якої відносять гіперінсулінемію, підвищення рівня аполіпопротеїну В (сурогатним аналогом якого є ХС-не-ЛПВЩ) та фракції дрібних часток ХС ЛПНЩ. Дані Quebec Cardiovascular Study показали, що наявність такої тріади значно підвищує ризик серцево-судинних захворювань [11].
Особливе значення в ліпідному спектрі крові надається ХС-не-ЛПВЩ, що вважають більш інформативним предиктором розвитку серцево-судинних ускладнень, ніж ХС ЛПНЩ. Рівні –ХС-не-ЛПВЩ та ХС ЛПНЩ можуть оцінюватись разом для визначення ризику серцево-судинної патології в дітей із підвищеною концентрацією ТГ [21].
Стверджують, що для хворих із МС найбільш характерним є гіпертригліцеридемія, підвищення ХС ЛПНЩ, зниження ХС ЛПВЩ, у той час як гіперхолестеринемія є непостійною ознакою порушень ліпідного обміну і тому не включена до критеріїв МС, згідно з консенсусом IDF (2007) [12, 31].
За даними літератури, для дисліпідемії при МС характерна гіпертригліцеридемія та гіперхолестеринемія. Високий уміст ТГ, які входять до складу ХС ЛПДНЩ, при МС пояснюють підвищеною продукцією або зниженим розпадом ХС ЛПДНЩ унаслідок високої концентрації вільних жирних кислот і глюкози в крові [9].
Відмічають, що в дітей з ожирінням незалежно від наявності інсулінорезистентності спостерігалося вірогідне збільшення рівнів ТГ, ХС ЛПДНЩ, коефіцієнта атерогенності. Із приєднанням інсулінорезистентності до ожиріння в дітей додатково спостерігалося зниження ХС ЛПВЩ як у контрольній групі, так і в групі з ожирінням без інсулінорезистентності [14]. Стверджують, що дітям із генералізованим ожирінням притаманне вірогідне підвищення ХС ЛПНЩ, ЗХС — у 15,8 % та ТГ — у 7 % випадків, чого не спостерігалось у дітей з абдомінальним ожирінням [7].
У зв’язку з відсутністю одностайності щодо ознак дисліпідемії при МС у дітей вивчення характеру формування ліпідного спектра є актуальним.
Мета дослідження — вивчити особливості ліпідного обміну в дітей із МС на тлі абдомінального ожиріння.
Матеріали і методи
Проведене дослідження є проспективним популяційним динамічним з метою перевірки гіпотези. Вибірку проведено серед дітей і підлітків, які зверталися за медичною допомогою з приводу соматичної патології та проходили щорічні профілактичні та диспансерні огляди. Від батьків дітей та самих дітей отримано інформовану згоду на участь у дослідженні згідно з протоколом, схваленим комісією з етики Львівського національного медичного університету імені Данила Галицького.
Під спостереженням були 139 дітей віком від 9 до 18 років, які сформували 2 групи: 1-ша група — 85 дітей із МС на тлі абдомінального ожиріння, 2-га група — 54 дитини з нормальною масою тіла. Групи не відрізнялися за віковою та статевою ознаками. Вік дітей 1-ї групи становив 15,0 (12,0–16,0), 2-ї — 15,0 (12,0–17,0) року (р = 0,844).
Діагностику МС проводили згідно з рекомендаціями IDF (2007) [31]. Верифікацію МС проводили за наявністю абдомінального ожиріння, артеріальної гіпертензії, інсулінорезистентності, гіперглікемії, підвищених значень ТГ та знижених значень ХС ЛПВЩ. Пороговою точкою діагностики абдомінального ожиріння в дітей віком від 9 до 16 років були значення окружності талії > 90-го перцентиля розподілу згідно з віком та статтю, для дітей віком понад 16 років — для дівчат > 80 см, для хлопців — > 94 cм. Пороговими точками артеріальної гіпертензії були значення артеріального тиску 130/85 мм рт.ст., гіпертригліцеридемії 1,7 ммоль/л, гіперглікемії натще 5,6 ммоль/л, низьких значень ХС ЛПВЩ 1,03 ммоль/л та для дівчат віком понад 16 років 1,29 ммоль/л.
Обстеження дітей включало клінічний огляд, антропометричні виміри (маса тіла, зріст, окружність талії, індекс маси тіла), які проводили загальноприйнятими методами. Визначення офісних показників артеріального тиску проводили аускультативним методом Короткова за допомогою анероїдного сфігмоманометра тричі з інтервалом 5 хвилин. За показник артеріального тиску брали середні значення трьох вимірів.
Визначення вмісту ЗХС та ТГ у сироватці крові проводили колориметричним ферментним аналізом із контрольною сироваткою фірми Roсhe на автоматичному біохімічному аналізаторі Cobas Integra 400 Plus. Для визначення ХС ЛПВЩ використовували пероксидазний колориметричний ферментний метод з набором Cholesterol (Roсhe Diagnostics, Швейцарія; Human, Німеччина). ХС ЛПНЩ вираховували за формулою W.T. Friedewald et al.:
ХС ЛПНЩ = ЗХС – ХС ЛПВЩ – ТГ/2,18 (ммоль/л).
ХС ЛПДНЩ підраховували на основі емпіричних результатів вирахуванням із ТГ за формулою:
ХС ЛПДНЩ = ТГ/2,18 (ммоль/л).
ХС-не-ЛПВЩ є сумою ліпопротеїдів дуже низької щільності, проміжної щільності та низької щільності, тобто ХС-не-ЛПВЩ включає ХС всіх ліпопротеїдів, що містять апо-В-частки, тому він вважається сурогатним маркером вмісту апо-В. Концентрацію ХС-не-ЛПВЩ та апо-В вважають більш вірогідними предикторами серцево-судинних ускладнень, ніж тільки ХС ЛПНЩ [30].
Концентрацію ХС-не-ЛПВЩ розраховували за формулою:
ХС-не-ЛПВЩ = ЗХС – ХС ЛПВЩ (ммоль/л).
Індекс атерогенності (ІА) розраховували за формулою:
ІА = (ЗХС – ХСЛПВЩ)/ХС ЛПВЩ.
Вираховували співвідношення ЗХС/ХС ЛПВЩ, що є аналогом ІА, запропонованого А.Н. Климовим.
Референтні значення ліпідного профілю крові в дітей регламентовані NCEP та American Association of Clinical Endocrinologist’ Guidelines (2012) [23]. У нормі в дітей і підлітків віком від 1 до 19 років рівні ЗХС та ХС ЛПНЩ не перевищують 75-й перцентиль розподілу, що для ЗХС становить 4,25 ммоль/л, для ХС ЛПНЩ — 2,75 ммоль/л. Граничними вважають рівні в межах 75–95-го перцентиля: 4,25–4,99 ммоль/л для ЗХС та 2,75–3,24 ммоль/л для ХС ЛПНЩ. Підвищеним рівнем є значення, більші за 5,0 ммоль/л для ЗХС та 3,25 ммоль/л для ХС ЛПНЩ.
У визначенні нормальних значень ХС ЛПДНЩ ми спиралися на емпіричний підрахунок ХС ЛПНЩ за рівнем ТГ. За нормальні значення ХС ЛПДНЩ взяті показники, менші 1,7/2,18 = 0,78 ммоль/л. Високим рівнем ХС-не-ЛПВЩ вважався показник 4,13 ммоль/л [21]. Пороговою точкою співвідношення ЗХС/ХС ЛПВЩ, що розглядають як предиктор розвитку гострих коронарних ускладнень [24], що щільно корелює з інсулінорезистентністю, були 4,5 ум.од.
Статистичний аналіз отриманого матеріалу проводили за допомогою інтегрованих систем для комплексного статистичного аналізу та обробки даних Statistica 10.0 (StatSoft Inc, США). Нормальність розподілу встановлювали за критерієм Shapiro-Wilk Test. Параметричними вважалиcь показники при р > 0,05, непараметричними — при р < 0,05. Непараметричний характер розподілу був характерний для ЗХС, ХС ЛПДНЩ, співвідношення ТГ/ХС ЛПВЩ, ТГ, ХС-не-ЛПВЩ, ЗХС/ХС ЛПВЩ, ЗХС/ХС-не-ЛПВЩ, ІА. Параметричний характер розподілу мали ХС ЛПВЩ та ХС ЛПНЩ. При непараметричному характері розподілу показників парне міжгрупове порівняння кількісних показників проводили з використанням U-критерію Манна — Уїтні, при параметричному — з використанням t-критерію Стьюдента. Результати подані у вигляді медіани з указанням інтерквартального розмаху (25-й та 75-й перцентиль). Із метою з’ясування кореляційних зв’язків визначали критерій r (непараметричний тест Спірмена). Вірогідними вважали показники при р < 0,05.
Роботу виконували на базі комунальної 5-ї міської клінічної поліклініки м. Львова. Лабораторні дослідження проводили в центральній лабораторії Львівської обласної клінічної лікарні, централізованій лабораторії комунальної 5-ї міської клінічної поліклініки, лабораторно-діагностичному центрі UniLab (м. Львів).
Результати та їх обговорення
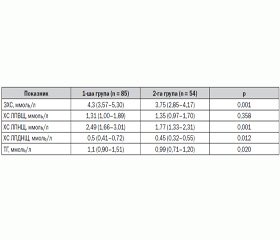
При вивченні показників ліпідного обміну в дітей із МС на тлі абдомінального ожиріння виявили вірогідну різницю з контрольною групою за рівнем атерогенного ліпідного спектра крові: ЗХС, ХС ЛПНЩ, ХС ЛПДНЩ та ТГ (табл. 1).
Рівні ЗХС були в 1,1 раза вищими (p = 0,001), ХС ЛПНЩ — в 1,4 раза вищими (p = 0,001), ХС ЛПДНЩ — в 1,1 раза вищими (p = 0,015), ТГ — в 1,1 рази вищими (p = 0,020) у дітей із МС порівняно з дітьми контрольної групи. Отримані результати вказують на вірогідне підвищення атерогенних ліпідів у дітей із МС і відповідають літературним даним [1, 3, 8, 10, 27].
Згідно з консенсусом IDF (2007) [32], для МС у дітей характерним є зниження ХС ЛПВЩ. У проведеному нами дослідженні не виявлено різниці між рівнем ХС ЛПВЩ у дітей 1-ї групи та групи контролю (р = 0,358).
Установлено, що кількість дітей із нормальними значеннями ЗХС та граничним рівнем суттєво не відрізнялися в 1-й та 2-й групі (р1 = 0,094; p2 = 0,656) (табл. 2). Проте кількість дітей із гіперхолестеринемією (ЗХС більший за 5,0 ммоль/л) у 4,5 раза була більшою в групі дітей із МС порівняно з групою контролю (32,9 та 7,5 %, р = 0,004, відповідно), що відповідає даним літератури [5, 10], усупереч думці, що ЗХС при МС не є постійною ознакою. Нами встановлено, що як за рівнем ЗХС у групі при МС, так і за відсотком дітей із гіперхолестеринемією значущо переважають діти 1-ї групи порівняно з дітьми групи контролю.
Розподіл ХС ЛПНЩ за ранговими величинами показав, що нормальні значення в 1-й та 2-й групі мала приблизно однакова кількість дітей (р = 0,185) (табл. 3).
Високі значення ХС ЛПНЩ вірогідно мали в 9,3 раза більше дітей 1-ї групи (17,6 %), ніж 2-ї групи (1,9 %; p = 0,011). Частка дітей із граничними значеннями ХС ЛПНЩ у дітей 1-ї групи у 2,2 раза (21,2 %) перевищувала відповідний показник 2-ї групи (9,3 %), хоча різниця не досягала рівня вірогідності (р = 0,160). Тобто дітям із МС на тлі абдомінального ожиріння були притаманні високі значення ХС ЛПНЩ.
Нормальні значення ХС ЛПДНЩ мала приблизно однакова кількість дітей із МС (81,2 %) та контрольною групою (92,6 %; р = 0,613). Високі значення ХС ЛПДНЩ у 1-й групі мали у 2,5 раза більше дітей, ніж у групі контролю, — 18,8 і 7,4 % відповідно (р = 0,136).
Низький рівень ХС ЛПВЩ cпостерігався в обох групах приблизно з однаковою частотою (р = 1,0) (табл. 4). Зниження ХС ЛПВЩ було відзначено в 30,6 % дітей 1-ї групи та 31,5 % дітей 2-ї групи. Високі значення ХС ЛПВЩ виявлено в обох групах приблизно з однаковою частотою (37,6 та 37,0 %, р = 1,0, відповідно). Отримані результати не відповідають даним літератури, які вказують на низькі значення ХС ЛПВЩ у 77,8 % дітей із МС [16]. Імовірно, це пов’язано з компенсаторним характером збільшення ХС ЛПВЩ у відповідь на підвищення атерогенних фракцій ХС та ТГ у дитячому віці, що не досягає рівня декомпенсованості, що спостерігаємо в дорослих із МС.
При порівнянні характеру розподілу ТГ за ранговими показниками в групах не виявлено вірогідної різниці (табл. 5). Мала місце тенденція до підвищення кількості дітей із нормальними значеннями ТГ на 11,3 % у 2-й групі порівняно з 1-ю групою (р = 0,613). Гіпертригліцеридемія спостерігалась у 2,5 раза частіше в дітей із МС порівняно з дітьми групи контролю, що відповідає даним літератури [5, 10], але не досягала рівня статистичної вірогідності (р = 0,136).
Аналіз показників атерогенності за співвідношенням атерогенних фракцій холестерину до неатерогенних, показав, що ХС-не-ЛПВЩ (р = 0,001), ЗХС/ХС ЛПВЩ (р = 0,04) та ІА (р = 0,036) були вірогідно вищими в дітей із МС порівняно з дітьми з нормальними масою тіла та артеріальним тиском (табл. 6).
Значення співвідношень ТГ/ХС ЛПВЩ та ТГ/ХС-не-ЛПВЩ в 1-й групі на 5,3 та 10,9 % перевищували показники групи контролю, але рівня статистичної вірогідності не досягали (р1 = 0,55 та р2 = 0,725 відповідно).
Рівень ХС-не-ЛПВЩ у дітей із МС становив 2,95 (2,19–3,69) ммоль/л і був на 24,4 % вищим, ніж у дітей контрольної групи (p = 0,001) (табл. 7). Високі показники ХС-не-ЛПВЩ спостерігались у 9 дітей 1-ї групи (10,5 %) і в жодної дитини 2-ї групи (р = 0,0265). Вірогідно показник ХС-не-ЛПВЩ можна вважати маркером МС у дітей.
Співвідношення ЗХС/ХСЛПВЩ та ІА в дітей 1-ї групи вірогідно перевищували аналогічні показники в дітей 2-ї групи (р1 = 0,040 та р2 = 0,036 відповідно). Відсоток дітей із високим рівнем співвідношення ЗХС/ХС ЛПВЩ виявлено на 4,2 % частіше, із високим ІА на 10,6 % частіше в дітей 1-ї групи, ніж у дітей 2 групи (р1 = 0,621 та р2 = 0,528 відповідно).
Таким чином, установлено, що для ліпідного спектра крові в дітей із МС на тлі абдомінального ожиріння характерні високі рівні ЗХС, ХС ЛПНЩ, ХС ЛПДНЩ, ТГ, проатерогенних ХС-не-ЛПВЩ, співвідношення ЗХС/ХС ЛПВЩ та ІА. Це потрібно брати до уваги при оцінці атерогенних змін ліпідного спектра крові в дітей. Що стосується ХС ЛПВЩ, то вірогідного зниження в дітей 1-ї групи у порівнянні з 2-ю групою не спостерігалось. На нашу думку, високі відносні значення ХС ЛПВЩ у дітей з МС мають компенсаторний характер, як відповідь на підвищення атерогенних фракцій холестерину з метою їх нормалізації і не набувають ще стадії декомпенсованості з критичним зниженням, що відбувається у дорослих пацієнтів із МС.
Висновки
1. Ознаками дисліпідемії в дітей із МС на тлі абдомінального ожиріння потрібно вважати підвищені значення ЗХС, ХС ЛПНЩ, ХС ЛПДНЩ, ТГ та співвідношень ХС-не-ЛПВЩ, ЗХС/ХС ЛПВЩ, ІА, що доцільно використовувати як маркери в діагностиці МС у дітей.
2. Відносне підвищення ХС ЛПВЩ, імовірно, слід вважати компенсаторною реакцією у відповідь на збільшення проатерогенних фракцій холестерину з метою їх нормалізації.
1. Білецький С.В., Казанцева Т.В., Зорій І.А., Петринич О.А. Клініко-біохімічні маркери МС при АГ у дорослих і дітей // Буковинський медичний вісник. — 2008. — Т. 12, № 1. — С. 75-81.
2. Бобрикович О.С., Цимбаліста О.Л. Гіперлептинемія у дітей та підлітків Прикарпаття з проявами метаболічного синдрому // Перинатология и педиатрия. — 2012. — № 3(51). — С. 46-48.
3. Василос Л.В., Арамэ М.Г., Кожокару А.Н., Хородиштяну, Банух А.И., Кирстя О.Н. Атерогенный потенциал крови как предиктор развития артериальной гипертензии у детей, проживающих на экологически неблагополучных территориях Молдовы // Российский кардиологический журнал. — 2013. — № 3. — С. 29-34.
4. Евсевьева М.Е., Мириджанян Э.М., Бабунц И.В. и соавт. Особенности липидного спектра крови и наследственная отягощенность по сердечно-сосудистым заболеваниям у лиц молодого возраста в зависимости от уровня здоровья // Кардиоваскулярная терапия и профилактика. — 2005. — № 4(6). — С. 77-81.
5. Зорій І.А., Білецький С.В., Шевчук Н.М., Крецу Т.М. Клініко-біохімічні маркери метаболічного синдрому в дітей та підлітків // Буковинський медичний вісник. — 2007. — Т. 11, № 2. — С. 40-44.
6. Кравец Е.Б., Самойлова Ю.Г., Матюшева Н.Б., Буланова А.А. и соавт. Метаболический синдром в общеврачебной практике // Бюллетень симбирской медицины. — 2008. — № 1. — С. 80-87, www.ssmu.ru
7. Красноперова О.И., Смирнова Е.Н., Мерзлова Н.Б. Факторы, приводящие к развитию ожирения у детей и способствующие его трансформации в метаболический синдром // Фундаментальные исследования. — 2012. — № 4 (Часть 2). — С. 306-310.
8. Молдахметова Г.А. Клиническое значение метаболического синдрома у больных сосудистыми заболеваниями // Терапевтический вестник. — 2012. — № 1. — С. 4-6.
9. Морено И.Г., Неудахин Е.В., Гурьева Е.Н., Дударева И.С. и соавт. Метаболический синдром у детей и подростков: вопросы патогенеза и диагностики // Педиатрия. — 2010. — № 4(89). — С. 116-119.
10. Полубояринова И.В. Антропометрические, метаболические и гормональные особенности течения ожирения, дебютировавшего в детском, подростковом и репродуктивном возрасте // Международый эндокринологический журнал. — 2010. — № 3(27). — С. 22-27.
11. Соколова Л.К. Метаболический синдром: клиника, критерии диагностики, принципы терапии // Cімейна медицина. — 2009. — № 3. — С. 51-55.
12. Томашевська О.Я. Дисліпідемія та гіперурікемія при метаболічному синдромі // Acta Medica Leopoliensia. — 2007. — Vol. 13, № 1–2. — С. 102-107.
13. Туркина Т.И., Щербакова М.Ю. Особенности дислипидемий у детей // Рациональная фармакотерапия в кардиологии. — 2011. — № 7(1). — С. 65-69.
14. Шляхова Н.В. Роль лептину та адипонектину у формуванні інсулінорезистентності у дітей пубертатного віку, що страждають на ожиріння // Проблеми ендокринної патології. — 2011. — 4. — С. 52-59.
15. Шутова Е.В. Нарушения метаболизма липидов у детей с заболеваниями билиарной системы (Обзор литературы) // Перинатология и педиатрия. — 2010. — № 2(42). — С. 61-62.
16. Andrabi S.M.S., Bhat M.H., Andrabi S.R.S., M.M.A.Kamili M.M.A. et al. Prevalence of MS in 8–18 year old school-going children of Srinagar City of Kashmir India // Ind. J. Endocrinol. Metab. — 2013. — 17(1). — 95-100.
17. Daniels S.R., Greer F.R. Committee of Nutrition. Lipid screening and cardiovascular health in childhood // Pediatrics. — 2008. — 122(1). — 198-208.
18. Dubey S., Kabra M., Bajpai A. et al. Serum leptin levels in obese Indian children relation to clinical and biochemical parameter // Indian Pediatr. — 2007. — 44(4). — 257-262.
19. Eckel R.H., Kahn R., Robertson R.A., Rizza R.A. ADA/AHA Scientific Statement. Preventing cardiovascular disease and diabetes: a call for action from the American Diabetes Association and the American Heart Association // Circulation. — 2006. — 113. — 2943-2946.
20. Eiland L.S., Luttrell P.K. Use of statins for dyslipidemia in the pediatric population // JPPT. — 2010. — 15(3). — 160-172.
21. Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP). Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) // JAMA. — 2001. — 285. — 2486-97.
22. Ginsberg Y.N., McCollum P. The obesity, metabolic syndrome and type 2 diabetes mellitus pandemic: Part 1. Increased cardiovascular disease risk and the importance of atherogenic dyslipidemia in persons with metabolic syndrome and type 2 diabetes mellitus // J. Cardiometab. Syn. — 2009. — 4(2). — 113-119.
23. Jellinger P.S., Smith D.A., Mehta A.E. et al. American Association of Clinical Endocrinologist’ Guidelines for management of dyslipidemia and prevention of atherosclerosis // Endocrine Practice. — 2012. — 18(Supp. 1). — 78 p.
24. Linn S., Fulwood R., Carrol M. et al. Serum total cholesterol: HDL cholesterol ratio in US white and black adults by selected demographic and socioeconomic variables (HANES II) // Am. J. Public. Health. — 1991. — 81. — 2038-1043.
25. McKrindle B.W. Summary of the American Heart Association’s scientific statement on drug Therapy of High — Risk Lipid abnormalities in children and adolescents // Arterioscler. Thromb. Vasc. Biol. — 2007. — 27. — 982-985.
26. McMahan C.A., Gidding S.S., Malcom G.T. et al. Pathological Determinants of atherosclerosis in youth risk scores are associated with early and advanced atherosclerosis // Pediatrics. — 2006. — 118. — 1447-55.
27. Okur I., Tumer L., Ergu F.S., Yesilkaya E. et al. Oxidized low density lipoprotein levels and carotid intima-media thickness as markers of early atherosclerosis in pubertal obese children // J. Ped. End. Metab. — 2012. — 26(7–8). — 657-662.
28. Steinberger J., Daniels S. Obesity, insulin resistance and cardiovascular risk in children: an American Heart Association Scientific Statement from Atherosclerosis, Hypertension, and Obesity in the Young Committee (Council on Cardiovascular Desease in Young) and the Diabetes Committee (Counsil on Nutrition, Physical Activity, and Metabolism) // Circulation. — 2003. — 107. —1448-1453.
29. Svirinsan S.R., Meyers L., Berenson G.S. Predictibility of childhood adiposity and insulin for developing insulin resistance syndrome (syndrome X) in young adulthood: the Bogalusa heart study // Diabetes. — 2002. — 51, 1. — 204-209.
30. Wagner A.M., Perez A., Zapico E., Ordonez-Llanos J. Non-HDL Cholesterol and polipoprotein B in the Dyslipidemic classification of type 2 diabetic patients // Diabetes Care. — 2003. — 26(7). — 2048-2051.
31. Zimmet P., Alberti K.G., Kaufman F.T., et.al. IDF Consensus. The metabolic syndrome in children and adolescents — an IDF consensus report [Text] // Pediat Diabetes. — 2007. — 5. — 299-306.

/17/17.jpg)
/18/18.jpg)
/19/19.jpg)