Журнал «Здоровье ребенка» 5 (56) 2014
Вернуться к номеру
Цефподоксиму проксетил у лікуванні гострих бронхітів бактеріальної етіології в дітей
Авторы: Марушко Ю.В., Гищак Т.В., Шеф Г.Г. - Національний медичний університет ім. О.О. Богомольця, м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Призначення цефподоксиму проксетилу в комплексній терапії дітей із гострим простим бактеріальним бронхітом є високоефективним та асоціюється з віковим ступенем комплайєнсу та низькою частотою виникнення побічних ефектів.
Назначение цефподоксима проксетила в комплексной терапии детей с острым простым бактериальным бронхитом является высокоэффективным и ассоциируется с высокой степенью комплайенса и низкой частотой возникновения побочных эффектов.
Administration of cefpodoxime proxetil in combination treatment of children with acute nonobstructive bacterial bronchitis is highly effective and is associated with high degree of compliance and low incidence of side effects.
цефподоксиму проксетил, діти, гострий бактеріальний бронхіт.
цефподоксима проксетил, дети, острый бактериальный бронхит.
cefpodoxime proxetil, children, acute bacterial bronchitis.
Статья опубликована на с. 29-33
Вступ
На сучасному етапі гострі респіраторні захворювання продовжують очолювати перелік найбільш поширених нозологій серед як дорослого, так і дитячого населення у світі. Серед них найбільш частими є інфекції верхніх дихальних шляхів, захворюваність на які становить у середньому 6–8 епізодів на одну дитину протягом року. Інфекційне ураження нижніх дихальних шляхів у дітей трапляється значно рідше та щорічно становить 5772 (1,72 %) випадки на 100 000 дітей віком до 5 років (Hasan et al., 2014). При цьому, незважаючи на нижчі епідеміологічні показники, інфекційні захворювання нижніх відділів респіраторного тракту є більш небезпечними, оскільки мають тяжчий перебіг та вищу частоту розвитку ускладнень.
Гострий бронхіт відноситься до інфекційних хвороб нижніх відділів респіраторного тракту та характеризується ураженням повітроносних шляхів, починаючи від рівня головних бронхів та закінчуючи приблизно 10-м рівнем поділу бронхіальних гілок (гострий простий бронхіт), може супроводжуватися бронхообструктивним синдромом (гострий обструктивний бронхіт) та залученням у патологічний процес бронхіол (бронхіоліт) [4]. Клінічно гострий бронхіт проявляється спочатку непродуктивним, пізніше — вологим кашлем, жорстким диханням при аускультації легень, симетричними розсіяними сухими або вологими хрипами за відсутності вогнищево-інфільтративних змін у легенях за даними рентгенографії органів грудної порожнини.
У 90 % випадків етіологічним чинником гострого бронхіту в дітей є віруси, найбільш поширеними з яких є віруси грипу А, В, С, парагрипу, аденовірус, респіраторно-синцитіальний вірус та риновірус [4, 10]. Лише кожний десятий випадок гострого бронхіту має бактеріальну природу. Серед бактеріальних збудників найбільше значення мають S.pneumoniaе, M.catarrhalis, H.influenzaе, Chlamydia та Mycoplasma pneumoniaе. Бактеріальне ураження бронхів може перебігати як первинно бактеріальна інфекція або при розвитку вторинного бактеріального інфікування на фоні вірусного бронхіту. Лікування гострого бронхіту бактеріальної етіології вимагає призначення антибактеріальної терапії.
Одним із широко застосовуваних у педіатричній практиці пероральних антибіотиків ряду цефалоспоринів ІІІ покоління є цефподоксиму проксетил (Цефодокс). Препарат порушує синтез компонентів клітинної стінки бактерій та є ефективним стосовно більшості грампозитивних, грамнегативних, аеробних та анаеробних патогенів. Цефодокс випускається у формі суспензії 50 мг/5 мл, 100 мг/5 мл та таблеток 100 та 200 мг. Препарат призначається дітям із 5 місяців у добовій дозі 10 мг/кг (максимальна добова доза — 400 мг) на 2 прийоми. Тривалість застосування залежить від тяжкості захворювання та визначається індивідуально.
Цефподоксиму проксетил є високоактивним щодо Streptococcus pneumoniae, стрептококів групи A (S.pyogenes), групи B (S.agalactiae), груп C, F и G, а також S.mitis, S.sanguis, S.salivarius та Corynebacterium diphtheriae, Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella (Branhamella) catarrhalis, Neisseria meningitidis, Neisseria gonorrhoeae, Escherichia coli, Klebsiella spp. (K.pneumoniae, K.oxytoca), Proteus mirabilis, помірно активним щодо S.aureus та S.epidermidis. Таким чином, спектр дії препарату перекриває практично всі бактеріальні патогени, етіологічно значущі для розвитку захворювань респіраторного тракту та лор-органів. Згідно з даними P.R. Hsueh et al. (2004), цепфодоксим є більш активним щодо Streptococcus pneumoniae, найчастішого збудника гострих респіраторних захворювань бактеріальної етіології, порівняно з іншими пероральними цефалоспоринами (цефіксим, цефуроксим, цефалексин). Крім того, щодо Haemophilus influenzae та Moraxella catarrhalis цепфодоксим є більш дієвим порівняно з цефуроксимом [9]. Наведені дані вказують на актуальність використання саме цефподоксиму проксетилу для антибактеріальної терапії в еру прогресуючого зростання мікробної резистентності до антибактеріальних препаратів.
В Україні існує широкий досвід застосування цефподоксиму проксетилу при лікуванні гострих респіраторних захворювань бактеріальної етіології в дітей. Так О.П. Волосовець та співавт. (2011) опублікували результати мультицентрового дослідження ефективності та переносимості цефподоксиму проксетилу у стартовій терапії нетяжкої позалікарняної пневмонії у 225 дітей віком від 5 місяців до 18 років (ЦЕФ-ПРОСТО) [3]. За даними дослідників, препарат був ефективним у 98,2 % дітей. Прийом антибіотика в 95,5 % випадків переносився добре. У 4,5 % пацієнтів мали місце нудота, діарея, що не призводили до відміни лікування. Алергічних реакцій після застосування цефподоксиму проксетилу в жодному випадку не спостерігалося.
Що стосується терапії захворювань бронхів у педіатричній практиці, то Л.С. Овчаренко та В.Ю. Ткаченко (2013) вивчили ефективність цефподоксиму проксетилу в лікуванні бактеріальних рекурентних бронхітів у дітей із гіперплазією лімфоглоткового кільця [5]. На 5-ту добу використання антибактеріального препарату майже у всіх хворих спостерігалося вірогідне покращення клінічних проявів патології, що дозволило обмежити термін лікування 5 днями. Тільки у 2 дітей терапію було продовжено до 7 днів. Протягом даного терміну в усіх випадках спостерігалася ерадикація патогенної мікрофлори зі слизових оболонок респіраторного тракту пацієнтів. Алергічних та побічних реакцій від застосування цефподоксиму проксетилу в дітей не було. Таким чином, призначення цього препарату при бактеріальному ураженні нижніх дихальних шляхів у дітей, у тому числі при бронхіті, характеризується високою ефективністю та безпечністю застосування.
Досвід показує, що бактеріальні бронхіти в дітей часто перебігають із супутнім ураженням лор-органів. Дані патології можуть ускладнювати одна одну. Так, при бактеріальному бронхіті під час кашлю бронхіальний секрет, що містить збудник, потрапляє до ротоглотки, може потрапляти до носової порожнини, придаткових пазух носа, євстахієвих труб та викликати бактеріальний риніт, тонзиліт, синусит чи отит. З іншого боку, при бактеріальній інфекції лор-органів збудник із секретом може потрапляти в нижні відділи респіраторного тракту з розвитком бронхіту чи пневмонії. Таким чином, унаслідок можливості одночасного перебігу двох патологій при застосуванні цефподоксиму проксетилу в лікуванні бактеріальної інфекції нижніх дихальних шляхів актуальним є питання ефективності даного антибіотика при захворюваннях лор-органів у дітей.
Колективом авторів (Бережний В.В., Козачук В.Г., Орлюк І.Б., Кірнос А.І., 2011) були показані висока ефективність та профіль безпеки використання цефподоксиму проксетилу в комплексній терапії гнійних синуситів у дітей [1]. Подібні результати були отримані О.В. Тяжкою та співавт. (2011) при вивченні ефективності та переносимості даного антибіотика в комплексній терапії гострих респіраторних захворювань, у тому числі гострого отиту, синуситу, фарингіту, загострення хронічного тонзиліту, у пацієнтів дитячого віку [7]. Наведені вище дані вказують на доцільність призначення цефподоксиму проксетилу в складі комплексної терапії бактеріальних інфекцій лор-органів у дітей.
Традиційно актуальним питанням для педіатрів є переносимість терапії дітьми, що визначається частотою та тяжкістю побічних ефектів, алергічних реакцій, впливає на комплайєнс пацієнтів до лікування. Важливим щодо побічної дії, а отже, й стосовно переносимості кожного антибіотика залишається його вплив на кишкову мікрофлору пацієнта. Не є незвичайною практика супровідного призначення лікарями-педіатрами пре- чи пробіотичних препаратів для профілактики виникнення дисбіозу кишечника, що вимагає додаткових матеріальних витрат та призводить до поліпрагмазії. Що стосується цефподоксиму проксетилу, то цей препарат відноситься до групи проліків. В інтактному вигляді цефподоксиму проксетил є неактивним, лише при всмоктуванні через стінку кишечника відбувається його перетворення у власне діючу речовину — цефподоксим. Завдяки вказаним особливостям фармакокінетики значно зменшується негативна дія антибіотика на інтестинальну мікрофлору. Так, Л.Н. Боярська та співавт. (2009) провели дослідження впливу цефподоксиму проксетилу на стан мікрофлори кишечника у 20 дітей віком 1,5–5 років, яким препарат призначався з метою лікування бактеріальної інфекції лор-органів, верхніх та нижніх дихальних шляхів [2]. Цефподоксиму проксетил призначали згідно з інструкцією з використання. Усім хворим перед початком лікування та в динаміці проводили мікробіологічне дослідження калу з метою характеристики стану просвітної мікрофлори товстої кишки. Крім того, оцінювали клінічні прояви дисбіозу кишечника. Результати дослідження показали наявність лише незначних змін у кількісних та якісних характеристиках просвітної мікрофлори кишечника у вигляді дисбіозу 1-го та 2-го ступеня без наявності клінічного еквіваленту на фоні лікування цефподоксиму проксетилом. Дані зміни були транзиторними та швидкоминущими внаслідок здатності кишкового біотопу до саморегуляції. Таким чином, завдяки формі проліків препарат цефподоксиму проксетил незначно впливає на кишкову мікробіоту, що зменшує ризик виникнення дисбіозу кишечника та потребу в супровідному призначенні пре- та пробіотиків.
Крім того, в багатьох дослідженнях була показана відсутність алергічних реакцій при призначенні цефподоксиму проксетилу в дітей [1–3, 5, 7].
Добрий профіль безпеки цефподоксиму проксетилу відображається на високому комплайєнсі хворих до терапії. Так, у дослідженні французьких авторів А. Wollner et al. (2011), у якому вивчався даний показник у пацієнтів дитячого віку при амбулаторному пероральному призначенні антибіотиків, вищий показник комплайєнсу був виявлений стосовно цефподоксиму проксетилу (91,8 %) порівняно з амоксициліном клавуланатом (84,6 %) [11]. При опитуванні батьків пацієнтів причиною такої різниці був визнаний поділ денної дози цефподоксиму проксетилу на два прийоми. Крім того, на думку авторів, це дозволяє досягнути рівних проміжків між прийомами, що сприяє стабільній концентрації антибіотика в крові пацієнтів протягом доби. При цьому рівні проміжки у 8 годин між прийомами антибіотика із триразовим дозуванням здебільшого не витримуються, наслідком чого може бути варіація рівня препарату в крові та зменшення його ефективності.
Отже, цефподоксиму проксетил є високоефективним та безпечним антибактеріальним препаратом у лікуванні гострих респіраторних бактеріальних захворювань у педіатричній практиці. Нашу увагу привернуло дослідження ефективності та безпечності використання даного антибіотика для лікування гострого простого бронхіту бактеріальної етіології в дітей, оскільки даних літератури щодо цього питання обмаль. З огляду на вищезазначене метою нашої роботи стало вивчення ефективності, профілю безпеки та прихильності хворих до терапії при використанні цефподоксиму проксетилу в лікуванні гострого простого бактеріального бронхіту в дітей віком 2–7 років.
Матеріали та методи дослідження
Критерії включення в дослідження
1. Наявність клінічних симптомів гострого простого бронхіту: кашель; жорстке дихання та двосторонні симетричні сухі басові чи вологі велико- або середньопузирчасті хрипи в легенях; < 3 епізодів гострого бронхіту протягом попередніх 12 місяців, включаючи цей випадок.
2. Клініко-лабораторні ознаки бактеріальної етіології захворювання: фебрильна лихоманка протягом ≥ 3 днів або виникнення фебрильної лихоманки на ≥ 3-й день перебігу гострої респіраторної вірусної інфекції, виникнення бронхіту на фоні іншого вогнища бактеріальної інфекції (гострий середній отит, гострий тонзиліт, гострий гнійний синусит); відхаркування слизово-гнійного або гнійного мокротиння; лейкоцитоз крові понад 15,0 • 109/л, зсув лейкоцитарної формули крові вліво (відносна кількість паличкоядерних гранулоцитів ≥ 6 %), ШОЕ ≥ 30 мм/год.
3. Рентгенологічні ознаки, що не суперечать діагнозу «бронхіт»: розширення та/чи деформація коренів легень, посилення легеневого рисунка.
4. Відсутність клініко-рентгенологічних ознак пневмонії.
5. Нетяжкий перебіг захворювання (загальний стан задовільний або середньої тяжкості, відсутність вираженої інтоксикації, відсутність симптомів дихальної недостатності).
6. Відсутність в анамнезі алергічних реакцій на пероральні антибіотики цефалоспоринового ряду.
Критерії виключення
1. Наявність клініко-рентгенологічних симптомів пневмонії: симптоми дихальної недостатності, локальне притуплення перкуторного тону, вогнищеві аускультативні зміни в легенях (локально бронхіальне дихання, асиметричні дрібнопузирчасті хрипи, крепітація), наявність вогнищево-інфільтративних змін у легенях на рентгенограмі органів грудної клітки.
2. Тяжкий стан пацієнта, що вимагає призначення парентеральної антибіотикотерапії.
3. Алергія в анамнезі на пероральні антибіотики цефалоспоринового ряду.
За час дослідження під нашим спостереженням знаходилися 32 дитини віком від 2 до 7 років (у середньому 4,8 року), які відповідали критеріям включення та не мали критеріїв виключення. Хлопчиків було 15 (46,8 %), дівчаток — 17 (53,2 %). У 18 (56,3 %) з них клінічні ознаки бронхіту з’явилися одночасно з виникненням захворювання лор-органів або протягом доби після цього. Гострий ексудативний тонзиліт мав місце в 10 дітей. Дані хворі мали 3–4 бали за шкалою Мак-Айзека, у них були відсутні ознаки гострої респіраторної вірусної інфекції верхніх дихальних шляхів (кон’юнктивіт, ринорея або закладеність носа), також у цих пацієнтів мазок із мигдаликів на бацилу Лефлера був негативним. У 5 дітей супутнім був гострий гнійний синусит, у 3 випадках — гострий середній отит. В інших 14 (43,7 %) хворих фебрильна лихоманка та клінічні ознаки бронхіту виникли на 3–5-й день перебігу гострої респіраторної вірусної інфекції верхніх дихальних шляхів.
Лікування хворих проводилося згідно з відповідним протоколом лікування гострих бронхітів у дітей МОЗ України (Додаток № 2 до Наказу МОЗ України № 18 «Про затвердження Протоколів надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія» від 13.01.2005 р.) з урахуванням бактеріальної етіології захворювання. Терапія супутніх захворювань лор-органів проводилася згідно з відповідними протоколами МОЗ України із залученням дитячого оториноларинголога.
Для лікування гострого простого бактеріального бронхіту (за наявності супутніх захворювань лор-органів) дітям призначали цефподоксиму проксетил (Цефодокс) у вигляді суспензії 50 мг/5 мл або 100 мг/5 мл у добовій дозі 10 мг/кг у 2 прийоми протягом 7 днів. Крім того, проводилася муколітична терапія амброксолом у віковому дозуванні, інгаляційна терапія, за потреби — жарознижувальна терапія парацетамолом або ібупрофеном.
Оцінку динаміки симптомів проводили до призначення лікування, на 3-й та 8-й дні антибіотикотерапії. Для визначення інтенсивності кожного симптому використовували візуальну аналогову шкалу (ВАШ) від 0 до 10 балів, де 0 балів — відсутність симптому, 10 балів — максимальна вираженість згідно з клінічним досвідом дослідника. Вивчали інтенсивність інтоксикаційного синдрому, частоту кашлю, продуктивність кашлю, кількість хрипів при аускультації легень. Повторний загальний аналіз крові проводили на 8-й день від початку лікування.
Для вивчення комплайєнсу до терапії цефподоксиму проксетилом батькам усіх пацієнтів були надані карти для відміток щодо дотримання графіку прийому антибіотика. У 14 графах реєстрували час прийому препарату або причину його пропуску. Отримані дані проходили статистичну обробку із використанням пакета прикладних програм Excel 2010.
Результати дослідження та їх обговорення
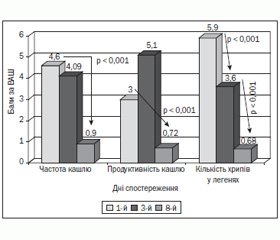
Усі пацієнти завершили дослідження згідно з вимогами дизайну, поданими в «Матеріалах та методах». У 100 % дітей на 3-й день лікування цефподоксиму проксетилом була відсутня лихоманка та інтоксикаційний синдром, що вказувало на ефективність антибіотикотерапії. Динаміка інших клінічних симптомів гострого простого бактеріального бронхіту подана на рис. 1.
/32/32.jpg)
Як видно із рис. 1, середній показник частоти кашлю на 8-й день був вірогідно меншим порівняно з аналогічним показником до призначення терапії. Продуктивність кашлю зросла на 3-й день лікування, що вказувало на розрідження бронхіального секрету та відображало нормальний перебіг гострого простого бронхіту. На 8-й день спостереження продуктивність кашлю була вірогідно меншою, що було розцінено як завершення запального процесу в бронхах та зменшення секреції. Дослідження динаміки кількості хрипів при аускультації легень у хворих на гострий простий бактеріальний бронхіт на фоні лікування цефподоксиму проксетилом показало вірогідне зменшення даного показника вже на 3-й день терапії порівняно з початком лікування, а після 7 днів прийому антибіотика — вірогідне зниження порівняно із середнім показником на 3-й день. Загалом після закінчення антибіотикотерапії в 17 (53,1 %) дітей були клінічно відсутні ознаки бронхіту. У катамнезі на 10-й день спостереження кашлю та хрипів у легенях не спостерігалося в жодного пацієнта. Таким чином, 7-денний курс цефподоксиму проксетилу в дітей із гострим простим бактеріальним бронхітом призводить до ліквідації проявів інтоксикаційного синдрому та лихоманки в усіх дітей уже на 3-й день терапії, нормалізації лабораторних показників крові у всіх, зникнення клінічних проявів бронхіту більше ніж в 1/2 хворих після 7 днів лікування та відсутності клінічних ознак хвороби на 10-й день спостереження в усіх випадках.
Нами не було відмічено алергічних реакцій при прийомі цефподоксиму проксетилу. Дослідження прихильності пацієнтів до лікування показало, що загалом по групі з 448 запланованих прийомів препарату були пропущені лише 2 (0,45 %). Обидва випадки мали місце в однієї дитини через нудоту. Таким чином, лише в 1 (3,1 %) дитини були виявлена побічна дія цефподоксиму проксетилу, що не вимагала повної відміни препарату. Аналіз дотримання батьками розкладу прийому цефподоксиму проксетилу показав, що найбільш часто використовували формальні схеми прийому «8:00–20:00» та «9:00–21:00». При цьому на практиці середній показник інтервалу між прийомами антибіотика по групі становив 11,8 ± 0,1 години. Отже, дворазовий прийом цефподоксиму проксетилу є зручним та асоціюється з майже точним дотриманням 12-годинного інтервалу батьками дітей, що позитивно впливає на підтримання постійної концентрації діючої речовини в плазмі крові пацієнтів.
Висновки
Призначення цефподоксиму проксетилу в комплексній терапії дітей із гострим простим бактеріальним бронхітом протягом 7 днів призводить до ліквідації проявів інтоксикаційного синдрому та лихоманки вже на 3-й день терапії, зникнення клінічних проявів бронхіту більше ніж в 1/2 хворих після 7 днів лікування та відсутності клінічних ознак хвороби на 10-й день спостереження у 100 % пацієнтів.
Антибіотикотерапія з використанням цефподоксиму проксетилу асоціюється з високим показником частоти дотримання графіку прийому препарату (99,55 %), низькою частотою виникнення побічних ефектів у вигляді диспептичних проявів (3,1 %), що не вимагають відміни препарату. Дворазове дозування є зручним, що проявляється у дотриманні батьками точного інтервалу між прийомами антибіотика.
1. Бережной В.В., Козачук В.Г., Орлюк И.Б., Кирнос А.И. Опыт использования препарата цефодокс в комплексной терапии гнойных синуситов у детей // Здоровье Украины. — 2011. — Тематический номер «Педиатрия». — С. 52-53.
2. Боярская Л.Н., Котлова Ю.В., Крыгина А.Н., Берлимова Н.В., Давыдова А.Г., Подлианова Е.И., Герасимчук Т.С. Микробиологическая безопасность цефподоксима проксетила (Цефодокса) при лечении детей с острыми респираторными заболеваниями // Современная педиатрия. — 2009. — № 2. — С. 72-75.
3. Волосовец А.П. и др. Результаты многоцентрового исследования Цеф-Просто (цефподоксима проксетил в стартовой терапии внебольничной пневмонии у детей) в Украине // Здоровье ребенка. — 2011. — № 2 (29).
4. Катилов А.В., Дмитриев Д.В. Бронхиты у детей: современные представления // Дитячий лікар. — 2012. — № 3–4. — С. 18-25.
5. Овчаренко Л.С., Ткаченко В.Ю. Эффективная антибиотикотерапия рекуррентных бактериальных бронхитов у детей с гипертрофией лимфоглоточного кольца // Новости медицины и фармации. — 2013. — № 15.
6. Протокол лікування дітей з гострими бронхітами. Додаток № 2 до Наказу МОЗ України № 18 «Про затвердження Протоколів надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія» від 13.01.2005 р. — Київ, 2005. — 58 с.
7. Тяжка О.В. та ін. Застосування цефподоксиму проксетилу в дитячій практиці // Здоровье Украины. — 2011. — Тематический номер «Педиатрия». — С. 41-42.
8. Hasan et al. Incidence and etiology of acute lower respiratory tract infections in hospitalized children younger than 5 years in rural Thailand // Pediatr. Infect. Dis. J. — 2014. — Vol. 33 (2). — P. e45-52.
9. Hsueh P.R. et al. Multicenter surveillance of antimicrobial resistance of Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarrhalis to 14 oral antibiotics // J. Formos. Med. Assoc. — 2004. — Vol. 103 (9). —P. 664-670.
10. http://emedicine.medscape.com/article/1001332-overview#aw2aab6b2b3aa
11. Wollner A. et al. Acceptability, compliance and schedule of administration of oral antibiotics in outpatient children // Arch. Pediatr. — 2011.