Журнал «Здоровье ребенка» 5 (56) 2014
Вернуться к номеру
Дослідження цитокінового профілю у хворих на ювенільний ревматоїдний артрит при проведенні біологічної терапії
Авторы: Бойко Я.Є. - Західноукраїнський спеціалізований дитячий медичний центр, м. Львів; Львівський національний медичний університет імені Данила Галицького; Чернишов В.П., Омельченко Л.І. - Державна установа «Інститут педіатрії, акушерства і гінекології НАМН України», м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Застосування біологічних препаратів дає можливість знизити активність запального процесу та досягти ремісії у хворих на ювенільний ревматоїдний артрит (ЮРА), які раніше не відповідали на традиційну базисну терапію.
Мета дослідження: удосконалити моніторинг ефективності біологічної терапії хворих на тяжкий ЮРА шляхом дослідження вмісту основних цитокінів у сироватці крові на тлі терапії адалімумабом і тоцилізумабом.
У Західноукраїнському спеціалізованому дитячому медичному центрі впродовж чотирьох років під динамічним спостереженням перебували 105 хворих на ЮРА, у 23 із них застосована біологічна терапія.
При проведенні аналізу динаміки цитокінів через 1, 3, 6 місяців від початку біологічної терапії знижувалися рівні IL-6, sCD25, sTNF-αR1. Рівень IP10 під час проведення біологічного лікування залишався підвищеним. Також виявлено зростання сироваткового рівня TNF-α. Збереження підвищеного рівня IL-6 через 6 місяців від початку біологічної терапії свідчило про неефективність вибраної біологічної терапії. Зміни сироваткового вмісту IL-6 та розчинних рецепторів до цитокінів sTNF-R1 і sCD25 можуть використовуватися для оцінки ефективності біологічної терапії адалімумабом і тоцилізумабом у хворих на ЮРА.
Применение биологических препаратов позволяет снизить активность воспалительного процесса и достичь ремиссии у больных с ювенильным ревматоидным артритом (ЮРА), ранее не отвечающих на традиционную базисную терапию.
Цель исследования: усовершенствовать мониторинг эффективности биологической терапии больных тяжелым ЮРА путем исследования содержания основных цитокинов в сыворотке крови на фоне терапии адалимумабом и тоцилизумабом.
В Западноукраинском специализированном детском медицинском центре в течение четырех лет под динамическим наблюдением находились 105 больных ЮРА, у 23 из них применена биологическая терапия.
При проведении анализа динамики цитокинов через 1, 3, 6 месяцев от начала биологической терапии снижались уровни IL-6, sCD25, sTNF-αR1. Уровень IP10 при проведении биологического лечения оставался повышенным. Также выявлен рост сывороточного уровня TNF-α. Сохранение повышенного уровня IL-6 через 6 месяцев от начала биологической терапии свидетельствовало об ее неэффективности. Изменения сывороточного содержания IL-6 и растворимых рецепторов к цитокинам sTNF-R1 и sCD25 могут использоваться для оценки эффективности биологической терапии адалимумабом и тоцилизумабом у больных ЮРА.
Application of biological preparations provides a possibility to decrease activity of inflammatory process аnd to achieve remission in patients with juvenile rheumatoid arthritis (JRA), who previously did not respond to traditional baseline therapy.
Aim of the investigation: to improve monitoring of biological therapy effectiveness in patients with severe JRA by studying main cytokines level in blood serum against adalimumab and tocilizumab therapy.
In Western-Ukrainian specialized children’s medical centre 105 patients with JRA were under follow-up during four years, biological therapy was used in 23 of them.
Analysis of cytokine dynamics in 1, 3, 6 months after biological therapy initiation shows decrease in IL-6, sCD25 and sTNF-αR1 levels. IP-10 level during biological therapy remained increased. We also detected increased serum TNF-α level. Preserved increase in IL-6 level in 6 months after biological therapy initiation indicated its ineffectiveness. Changes in serum IL-6 and soluble receptors to cytokines sTNF-R1 and sCD25 can be used for evaluating effectiveness of biological therapy with adalimumab and tocilizumab in patients with JRA.
ювенільний ревматоїдний артрит, біологічна терапія, цитокіни.
ювенильный ревматоидный артрит, биологическая терапия, цитокины.
juvenile rheumatoid arthritis, biological therapy, cytokines.
Статья опубликована на с. 34-39
Вступ
Актуальною проблемою сучасної дитячої ревматології є вибір терапії у хворих на тяжкий ювенільний ревматоїдний артрит (ЮРА). Упродовж останніх років відбувся значний поступ у ревматологічній фармакології. Це пов’язано з впровадженням нових технологій, що ґрунтуються на застосуванні блокаторів цитокінів, зокрема IL-6-рецептора та TNF-а, які відповідальні за розвиток запального процесу при ЮРА. Застосування біологічних препаратів дає можливість знизити активність запального процесу, досягти ремісії у тих хворих на ЮРА, що раніше не відповідали на традиційну базисну терапію, і в такий спосіб запобігти подальшій інвалідизації цих пацієнтів [1, 12, 18]. В Україні поки що не накопичено достатнього досвіду застосування препаратів біологічної дії [2]. На сьогодні розробляються рекомендації щодо показань до призначення біологічної терапії, тривалості її проведення. Залишається актуальним пошук біомаркерів як предикторів позитивної відповіді на біологічну терапію та критеріїв її ефективністі. Продовжується вивчення шляхів впливу біологічних препаратів на різні патогенетичні ланки розвитку ЮРА [2, 4, 5, 13, 15, 17, 19].
Відомо, що прозапальні цитокіни IL-6 та TNF-а, які синтезуються різними клітинами, у тому числі макрофагами, Т-лімфоцитами, В-лімфоцитами, синовіальними фібробластами, є ключовими цитокінами у патогенезі ЮРА. Саме тому IL-6 і TNF-а стали першими терапевтичними мішенями [1, 11, 16, 20–22] при лікуванні хворих на ЮРА, у яких застосування базисних і протизапальних препаратів не дало можливості досягти ремісії. В Україні зареєстровані для використання в практиці дитячої ревматології такі блокатори прозапальних цитокінів, як адалімумаб і тоцилізумаб.
Тоцилізумаб — це гуманізовані антитіла до IL-6-рецептора, який блокує утворення комплексу IL-6 з рецептором до IL-6. Встановлено, що ефект тоцилізумабу реалізується через одночасне пригнічення мембранозв’язаної та розчинної форм рецепторів до IL-6. Ефективність тоцилізумабу для лікування системного та поліартикулярного ЮРА доведена у ряді досліджень [6, 12, 15, 18, 21].
Адалімумаб — це людські моноклональні анти-TNF-а-антитіла, які зв’язують TNF-а в організмі та запобігають сполученню TNF-а з його рецептором з появою подальшого цитокінопосередкованого запального процесу [5, 6].
Терапевтична ефективність анти-TNF-а та анти-IL-6-терапії при прогресуванні ЮРА підтверджує роль цих цитокінів у його розвитку та породжує нове розуміння порушень TNF-а- й IL-6-залежного імунітету у хворих із різними клінічними варіантами цього захворювання.
Мета дослідження: удосконалити моніторинг ефективності біологічної терапії хворих на тяжкий ЮРА шляхом дослідження вмісту основних цитокінів у сироватці крові на тлі терапії тоцилізумабом та адалімумабом.
Матеріали та методи
У Західноукраїнському спеціалізованому дитячому медичному центрі впродовж чотирьох років під динамічним спостереженням перебували 105 хворих на ЮРА (53 дівчинки та 52 хлопчики), середній вік на момент обстеження — 11,8 року.
У 23 хворих на тяжкий ЮРА застосована біологічна терапія. Це були діти з прогресуючим поліартикулярним і системним варіантом ЮРА, які мали резистентність до терапії базисними та протизапальними препаратами. У 8 хворих на ЮРА проводилося лікування тоцилізумабом та у 15 хворих — адалімумабом. Усі пацієнти отримували імуносупресивну терапію: група лікованих адалімумабом — метотрексат (13 хворих), група лікованих тоцилізумабом — метотрексат (6 пацієнтів) та циклоспорин А (2 хворі).
Проведено клінічну та лабораторну оцінку активності ЮРА у хворих на тлі терапії тоцилізумабом та адалімумабом до початку лікування та через 1, 3, 6 місяців терапії.
У дослідженні проведено визначення IL-6, розчинного рецептора фактора некрозу пухлини (sTNF-аR1), розчинного рецептора інтерлейкіну-2 (sCD25) та інтерферон-індукованого фактора (ІР10) як маркерів клінічної активності у хворих на ЮРА [1, 3, 8]; TNF-а і IL-6 — як терапевтичних мішеней терапії [10]. Сироватку крові цих хворих відбирали до початку та під час проведення біологічної терапії і заморожували при температурі –70 °C до моменту одноденного проведення дослідження рівнів усіх цитокінів. Дослідження цитокінів проводили імуноферментним методом у лабораторії імунології ДУ «Інститут педіатрії, акушерства і гінекології НАМН України». Використовували комерційні тест-системи BD Biosciences Pharmingen, Сан Діє–го, США. До контрольної групи увійшла 21 практично здорова дитина.
Статистичну оцінку отриманих даних виконували за допомогою пакета Statistic 8.0. Для оцінки різниці між двома незалежними вибірками використовували U-критерій Манна — Уїтні, що не потребує перевірки на нормальність розподілу та придатний для порівняння невеликих вибірок. Для встановлення корелятивних зв’язків визначали рангову кореляцію (критерій Спірмена), що використовується, коли закон розподілу змінних невідомий або не є нормальним.
Результати досліджень
Характеристика хворих на тяжкий ЮРА, у яких визначались сироваткові рівні TNF-а, IL-6, IP10, sCD25, sTNF-аR1 перед початком біологічної терапії тоцилізумабом й адалімумабом, подана у табл. 1.
При порівнянні груп хворих на тяжкий ЮРА, які отримували терапію тоцилізумабом та адалімумабом, можна відзначити, що клінічний стан перед початком терапії був тяжчим у хворих групи терапії тоцилізумабом. У цієї групи хворих на ЮРА захворювання мало триваліший перебіг до початку біологічного лікування (5,1 ± 4,1 року), серйознішими були ушкодження суглобів і більшою кількість артритів. Це корелювало з лабораторними параметрами активності, а саме: з вищими стартовими рівнями швидкості осідання еритроцитів (ШОЕ) — 37,4 ± 10,5 мм/год, С-реактивного білка (СРБ) — 42,0 ± 19,5 мг/л, а також з вищими показниками рівнів цитокінів IL-6 і sCD25 (табл. 1, 2).
У пацієнтів обох груп сироваткові концентрації досліджуваних цитокінів були вищими порівняно з контрольною групою (табл. 2, рис. 1). Виявлено кореляцію між рівнями IL-6 і sCD25, що підкреслює їх роль як показників активності процесу (табл. 2).
Для наочності наводимо отримані результати рівнів цитокінів сироватки крові в абсолютних значеннях у хворих на ЮРА порівняно з показниками у здорових дітей (рис. 1).
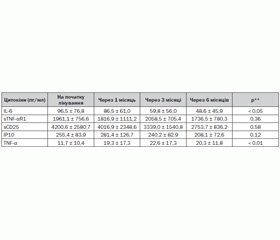
При проведенні аналізу динаміки цитокінів на тлі біологічної терапії можна відзначити, що через 1, 3, 6 місяців від початку біологічної терапії знижувалися рівні IL-6, sCD25, sTNF-аR1 (табл. 3).
Концентрація IP10 під час проведення біологічного лікування залишалася підвищеною порівняно з контрольною групою. Виявлено зростання сироваткового рівню TNF-а під час проведення біологічної терапії.
З метою визначення біомаркерів терапевтичної відповіді на біологічну терапію проаналізували рівні цитокінів до її початку та через 6 місяців від початку лікування у хворих на ЮРА двох груп. До першої групи увійшли дослідження пацієнтів із терапевтичною відповіддю, що була незадовільною та становила ACR 30 %, а до другої — із задовільною терапевтичною відповіддю — ACR 70 % (табл. 4).
У 8 хворих на тяжкий ЮРА (7 хворих на системний ЮРА та одна хвора з поліартритом, яка не відповіла на попереднє лікування адалімумабом) терапія тоцилізумабом привела до покращення. У всіх хворих на системний ЮРА при проведенні терапії тоцилізумабом регресувала гарячка, утримувалися незначні прояви артритів, нормалізувалися рівні ШОЕ і СРБ. Терапевтична відповідь у дітей цієї групи відповідала АСR 30–50 %. В однієї пацієнтки з поліартикулярним варіантом ЮРА була досягнена ремісія ЮРА.
У 14 хворих на тяжкий ЮРА лікування адалімумабом дало покращення, що відповідало АСR 50–70 %, з розвитком наступної ремісії. У 2 хворих утримувалася активність захворювання, результат терапії відповідав АСR 30 %.
У хворих на ЮРА, що погано відповіли на біологічну терапію, спостерігали зростання рівня IL-6 на тлі біологічної терапії. У раніше проведених дослідженнях K. Shimamoto отримані подібні результати, які показали, що в групі пацієнтів із незадовільною відповіддю на біологічну терапію вихідні рівні IL-6 є вірогідно вищими [18]. Однак у нашому дослідженні стартовий рівень IL-6 у двох групах хворих був однаковим. Вихідний рівень прозапального цитокіну sCD25 у хворих із незадовільною терапевтичною відповіддю був вищим порівняно з пацієнтами із задовільною терапевтичною відповіддю. Тому сироватковий рівень sCD25 можна вважати не тільки біомаркером активності у хворих на ЮРА, а також і серологічним предиктором незадовільної відповіді на наступну біологічну терапію.
Виявлено кореляцію рівнів IL-6 та TNF-а з кількістю активних суглобів (табл. 5). Такі сенситивні цитокінові маркери активності, як sCD25, sTNF-аR1, корелювали з іншими лабораторними параметрами запального процесу — ШОЕ і СРБ.
Рівень IFN-gamma індуцибельного білка (IP10) у динаміці лікування залишався підвищеним, але кількість випадків зниження його рівня під впливом лікування корелювала з показником ефективності терапії за АСR 70 % майже в 70 % випадків. Тобто з покращенням результатів лікування випадки зниження IP10 були частішими.
Обговорення результатів
Прозапальні цитокіни TNF-а та IL-6 є ключовими цитокінами у цитокіновій мережі регуляції запального процесу у хворих на ЮРА. Обидва цитокіни у проведеному дослідженні виступали мішенями під час проведення біологічного лікування хворих на тяжкий ЮРА [1, 12, 18].
Рівень TNF-а на тлі терапії не знижувався, а, навпаки, зростав. Подібні результати були також отримані в раніше проведених дослідженнях [12]. Можливо, зростання рівня TNF-а відбувається за рахунок збільшення біологічно неактивного TNF-а під впливом нейтралізуючої дії анти-TNF-а-терапії [1].
Застосування адалімумабу та тоцилізумабу призводило до зниження рівня IL-6, що, можливо, пов’язано зі зниженням загальної активності запального процесу в хворих на ЮРА. У хворих із тяжким рефрактерним перебігом ЮРА, які не відповіли на біологічну терапію, спостерігали зростання рівня IL-6.
При проведенні моніторингового визначення рівнів цитокінів TNF-а, IL-6, IP10, sCD25, sTNF-аR1 та аналізу кореляції цих цитокінів із кількістю артритів, ШОЕ та СРБ отримано дані, які дають можливість вважати, що серологічними маркерами активності ЮРА виступають IL-6, меншою мірою — sTNF-R1 і sCD25.
Оскільки показник рівня TNF-а не корелює з активністю хвороби, питання щодо доцільності визначення рівня TNF-а при проведенні біологічної терапії потребує подальшого вивчення.
Можна припустити, що виявлений суттєво підвищений рівень хемокіну IP10 у хворих на ЮРА (порівняно з контрольною групою) пов’язаний із генетично детермінованою Th1-орієнтацію імунної відповіді та впливом інтерферону-гамма.
Отримані результати свідчать про те, що біологічна терапія має протизапальний ефект, про що свідчить зниження рівнів прозапальних цитокінів. Біологічні препарати впливають на патогенетичні механізми розвитку ЮРА як протизапальні, але не мають суттєвого впливу на генетичні особливості організму пацієнта та зумовлене ними генетично детерміноване переважання Th1-типу імунної відповіді у хворих на ЮРА.
Висновки
1. У хворих на тяжкий ЮРА, які потребували проведення біологічної терапії, виявлено підвищення в сироватці крові рівнів цитокінів TNF-а, IL-6, IP10, sCD25, sTNF-аR1.
2. У хворих на тяжкий ЮРА рівні IL-6 корелювали з клінічною тяжкістю хвороби, кількістю артритів і показниками ШОЕ і СРБ, тому його можна використовувати як маркер активності захворювання. Збереження підвищеного рівня IL-6 через 6 місяців від початку біологічної терапії свідчить про неефективність вибраної біологічної терапії.
3. Високий вихідний рівень sCD25 можна розглядати як предиктор негативної відповіді на майбутню біологічну терапію, однак це потребує подальших досліджень за участі більшої кількості хворих.
4. Зміни сироваткового вмісту IL-6 та розчинних рецепторів до цитокінів (sTNF-R1 і sCD25) можуть використовуватися для оцінки ефективності біологічної терапії адалімумабом і тоцилізумабом у хворих на ЮРА.
1. Бойко Я.Є. Цитокінові маркери активності ювенільного ідіопатичного артриту / Я.Є. Бойко, В.П. Чернишов // Український ревматологічний журнал. — 2012. — № 2. — C. 19-23.
2. Бойко Я.Є. Біологічна терапія ювенільного ревматоїдного артриту: від теорії до практики. Перший досвід застосування адалімумабу у хворих на ювенільний ревматоїдни артрит / Я.Є. Бойко, В.П. Чернишов // Современная педиатрия. — 2012. — № 3(43). — С. 45-52.
3. Бойко Я.Є. Показники цитокінового профілю у хворих на різні клінічні варіанти ювенільного ідіопатичного артриту / Я.Є. Бойко, В.П. Чернишов, Л.І. Омельченко // Современная педиатрия. — 2012. — № 4(44). — С. 61-66.
4. Бойко Я.Є. Сучасне лікування ювенільного ревматоїдного артриту: ера біологічної терапії / Я.Є. Бойко // Рациональная фармакотерапія. — 2012. — № 1(22). — С. 38-48.
5. Adalimumab with or without methotrexate in juvenile rheumatoid arthritis / Lovell D.J., Ruperto N., Goodman S. [et al.] // N. Engl. J. Med. — 2008. — Vol. 359(8). — P. 810-820.
6. American college of rheumatology recommendations for the treatment juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic / T. Beukelman, N.M. Patkar, K.G. Saag [et al.] // Arthritis Care Res. (Hoboken). — 2011. — Vol. 63(4). — P. 465-482.
7. Analysis of SF and plasma cytokines provides insights into the mechanisms of inflammatory arthritis and may predict response to therapy / Helen L. Wright, Roger C. Bucknall, Robert J. Moots, Steven W. Edwards // Rheumatology (Oxford). — 2012. — Vol. 51(3). — P. 451-459.
8. Association between serum inflammatory cytokines and disease activity int juvenile idiopathic arthritis / L.S. Ou, L.C. See, C.J. Wu [et al.] // Clinical Rheumatology. — 2002. — Vol. 21, Issue 1. — P. 52-56.
9. Clinical course and prognostic value of disease activity in the first two years in different subtypes of juvenile idiopathic arthritis / H.M. Albers, D.M. Brinkman, S.S. Kamphuis [et al.] // Arthritis Care Res (Hoboken). — 2010. — Vol. 62(2). — P. 204-212.
10. De Benedetti F. Is systemic juvenile rheumatoid arthritis an interleukin-6 mediated disease? / F. De Benedetti, A. Martini // J. Rheumatol. — 1998. — Vol. 25. — P. 203-207.
11. De Benedetti F.Targeting in the Interleukin-6 Receptor: A new treatment for systemic juvenile idiopathic arthritis? / F. De Benedetti, A. Martini // Arthritis Rheum. — 2005. — Vol. 52. — P. 687-693.
12. Drug free Remission/low disease activity after cessation of tocilizumab (Actemra) Monotherapy (DREAM) study / N. Nishimoto, K. Amano, Y. Hirabayashi [et al.] // Mod. Rheumatol. — 2014. — Vol. 24(1). — P. 17-25.
13. Efficacy and safety of tocilizumab in patients with systemic-onset juvenile idiopathic arthritis: a randomised, doubleblind, placebo-controlled, withdrawal phase III trial / Yokota S., Imagawa T., Mori M. [et al.] // Lancet. — 2008. — Vol. 371(9617). — P. 998-1006.
14. Oligoarticular and poliarticular JIA: epidemiology and pathogenesis / Macaubas C., Nguyen K., MILojevic D. [et al.] // Nat. Rev. Rheumatol. — 2009. — Vol. 5. — P. 616-626.
15. Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis / De Benedetti F., Brunner H.I., Ruperto N. [et al.] // N. Engl. J. Med. — 2012. — Vol. 367(25). — P. 2385-2395.
16. Rooney M. Tumor necrosis factor alpha and its soluble receptors in juvenile chronic arthritis / M. Rooney, H. Varsani, K. Martin, P.R. Lombardl [et al.] // Rheumatol. — 2000. — Vol. 39. — P. 432-438.
17. Serum cytokines in juvenile rheumatoid arthritis. Correlation with convential inflammatiom parametrs and clinical subtypes / Mangge H., Kenzian H., Gallistl S. [et al.] // Arthritis. Rheum. — 1995. — Vol. 3. — P. 211-220.
18. Serum interleukin 6 before and after therapy with tocilizumab is a principal biomarker in patients with rheumatoid arthritis / K. Shimamoto, T. Ito, Y. Ozaki [et al.] // J. Rheumatol. — 2013 Jul. — 40(7). — 1074-81.
19. Textbook of pediatric rheumatology / By J. Cassidy, R. Petty, R.M. Laxer, C.B. Lindsley. — Philadelphia: Saunders Elsevier, 2010. — 6th edn. — 794 p.
20. The pathogenesis of oligoarticular/polyarticular vs systemic juvenile idiopathic arthritis / Yu-Tsan Lin, Chen-Ti Wang, M. Eric Gershwin, Bor-Luen Chiang // Autoimmunity Reviews. — 2011. — Vol. 10. — P. 482-489.
21. Therapeutic efficacy of humanized anti-interleukin-6 receptor antibody in chILdren with systemic-onset juvenile idiopathic arthritis / Yokota Sh., Miyamae T., Imagawa T. [et al.] // Arthr. Rheum. — 2005. — Vol. 52. — P. 818-825.
22. Woo P. Cytokines and juvenile idiopathic arthritis / P. Woo // Curr. Rheumatol. Rep. — 2002. — Vol. 4. — P. 452-457.

/36/36.jpg)
/36/36_2.jpg)
/37/37.jpg)
/38/38.jpg)