Журнал «Здоровье ребенка» 5 (56) 2014
Вернуться к номеру
Частота поліморфних варіантів генів II фази біотрансформації ксенобіотиків GSTM1 і GSTT1 у новонароджених Івано-Франківської області України
Авторы: Горовенко Н.Г., Подольська С.В, Кочерга З.Р. - Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ; ДВНЗ «Івано-Франківський національний медичний університет»
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
З метою визначення алельного поліморфізму генів глутатіон-S-трансфераз GSTT1 та GSTM1 у здорових новонароджених, недоношених дітей та новонароджених із затримкою внутрішньоутробного розвитку проведено молекулярно-генетичне дослідження пуповинної крові. Для визначення індивідуальної реакції геному новонародженого на можливий токсичний вплив використовували мікроядерний тест. Встановлено, що в усіх новонароджених області частота поліморфного варіанта GSTМ1+ була 43,70 %, частота поліморфного варіанта GSTМ1– — 56,30 %. Для гена GSTT1 частота поліморфного варіанта GSTТ1+ та GSTТ1– була 80,67 та 19,33 % відповідно. Позитивний мікроядерний тест у новонароджених був асоційований із поліморфним варіантом GSTМ1– — 71,95 % випадків порівняно з 21,62 % при негативному мікроядерному тесті. У носіїв поліморфного варіанта GSTТ1– у жодному випадку не було виявлено позитивного мікроядерного тесту, у всіх новонароджених із негативним мікроядерним тестом був виявлений алельний варіант GSTT1+. Для новонароджених із негативним мікроядерним тестом характерне переважання (78,38 %) асоціації генотипів GSTM1+/GSTT1+.
С целью определения аллельного полиморфизма генов глутатион-S-трансфераз GSTT1 и GSTM1 у здоровых новорожденных, недоношенных детей и новорожденных с задержкой внутриутробного развития проведено молекулярно-генетическое исследование пуповинной крови. Для определения индивидуальной реакции генома новорожденного на возможное токсическое воздействие использовали микроядерный тест. Установлено, что у всех новорожденных области частота полиморфного варианта GSTМ1+ была 43,70 %, частота полиморфного варианта GSTМ1– — 56,30 %. Для гена GSTT1 частота полиморфного варианта GSTТ1+ и GSTТ1– была 80,67 и 19,33 % соответственно. Положительный микроядерный тест у новорожденных был ассоциирован с полиморфным вариантом GSTМ1– — 71,95 % случаев по сравнению с 21,62 % при отрицательном микроядерном тесте. У носителей полиморфного варианта GSTТ1– ни в одном случае не было выявлено положительного микроядерного теста, у всех новорожденных с отрицательным микроядерным тестом был обнаружен аллельный вариант GSTT1+. Для новорожденных с отрицательным микроядерным тестом характерно преобладание (78,38 %) ассоциации генотипов GSTM1+/GSTT1+
To determine the allelic polymorphism of glutathione-S-transferases genes GSTM1 and GSTT1 in healthy newborns, premature infants and infants with intrauterine growth retardation we conducted molecular genetic study of umbilical cord blood. To determine the individual response of the genome of a newborn on the possible toxic effects we used the micronucleus test. It is found that in all newborns from the region the frequency of polymorphic variant GSTM1+ was 43.70 %, the frequency of GSTM1– polymorphic variant — 56.30 %. For GSTT1 gene frequency of polymorphic variant GSTT1+ and GSTT1– was 80.67 and 19.33 %, respectively. Positive micronucleus test in neonates was associated with polymorphic variants of GSTM1– — 71.95 % of cases compared with 21.62 % for negative micronucleus test. In the carriers of the GSTT1– polymorphic variant in any case there was no evidence of a positive micronucleus test, in all newborns with negative micronucleus test we found allelic variant GSTT1+. Newborns with negative micronucleus test are characterized by predominance (78.38 %) of genotypes GSTM1+/GSTT1+ association.
алельний поліморфізм, детоксикація ксенобіотиків, мікроядерний тест, новонароджені.
аллельный полиморфизм, детоксикация ксенобиотиков, микроядерный тест, новорожденные.
allelic polymorphism, detoxication of xenobiotics, micronucleus test, newborns.
Статья опубликована на с. 50-55
Численними дослідженнями доведено, що токсичні впливи під час внутрішньоутробного й неонатального періодів викликають порушення адаптивних механізмів, патологічні зміни в постнатальному морфогенезі, впливають на частоту мутацій, ризик розвитку патології та стан здоров’я в подальшому житті [1–3]. У ряді випадків новонароджені й діти першого року життя можуть бути більш сприйнятливі до токсичної дії факторів навколишнього середовища й фармакологічного впливу, ніж діти більш старшого віку й дорослі, проте інформація про відмінності генотоксичних ефектів, пов’язаних із віком, статтю та станом здоров’я, обмежена, хоча має велике значення для розробки системи корекції наслідків шкідливої дії факторів навколишнього середовища. В екологічних дослідженнях для моніторингу генотоксичних впливів широко використовується мікроядерний тест, що вважається доведено ефективним на культивованих лімфоцитах, проте більш пізні дослідження продемонстрували значущість досліджень, виконаних на епітеліальних клітинах букального епітелію слизової оболонки порожнини рота, що є більш прийнятним при обстеженні новонароджених, але результатів обстеження саме новонароджених поки що небагато [4–7]. Відмінності результатів, отриманих різними авторами при дослідженні однакових токсичних впливів, пояснюють генетичними особливостями обстежених осіб [8–10]. G. Iarmarcovai, S. Bonassi, A. Botta та співавт. (2008) проаналізували 72 дослідження, присвячені вимірюванню частоти мікроядер у лімфоцитах периферичної крові або букального епітелію та залежності цих показників від поліморфізму генів, продукти яких беруть участь у метаболізмі ксенобіотиків, репарації ДНК та фолатному метаболізмі. Було показано роль поліморфних варіантів генів EPHX, GSTT1 і GSTM1 у модуляції частоти хромосомних ушкоджень у осіб, які зазнали впливу генотоксичних агентів [11]. У подальших дослідженнях V.S. Dhillon, P. Thomas, G. Iarmarcovai та співавт. (2011), D. Mielzynska-Svach, E. Blaszczyk, D. Butkiewicz та співавт. (2013) показали залежність формування мікроядер від функціональної активності генів системи детоксикації ксенобіотиків та необхідність враховувати генотипи обстежених осіб при оцінці токсичних впливів за допомогою мікроядерного тесту [12, 13]. Відомо, що генетично детерміновані функції ферментів детоксикації впливають на чутливість організму до дії негативних факторів довкілля та, як наслідок, можуть підвищувати ризик виникнення багатьох патологічних станів. Особливу увагу дослідників привертає вивчення ферментів родини глутатіон-S-трансфераз (GSTs), що здійснюють кон’югацію сульфгідрильної групи глутатіону з ксенобіотиками або їх метаболітами. Найбільш частими поліморфними варіантами для генів GSTT1 і GSTM1 є великі делеції, що асоційовані з відсутністю ферментативної активності, що робить носіїв таких алелів більш чутливими до несприятливих екзогенних впливів [14]. Таким чином, вивчення алельного поліморфізму генів, які відповідають за активність ферментів, що забезпечують детоксикацію ксенобіотиків, при проведенні мікроядерного тесту як показника генотоксичної дії факторів оточуючого середовища набуває першочергового значення.
Матеріал та методи
Було обстежено 119 новонароджених із різних районів Івано-Франківської області, з них 57 здорових доношених дітей та 62 новонароджені з недоношеністю або затримкою внутрішньоутробного розвитку (ЗВУР). Постнатальну діагностику затримки внутрішньоутробного розвитку плода та недоношеності здійснювали на підставі клінічних даних, антропометричних показників та гестаційного віку [15].
Для визначення індивідуальної реакції геному новонародженого на можливий токсичний вплив використовували мікроядерний тест. Матеріалом для дослідження слугували епітеліальні клітини букального епітелію слизової оболонки середнього шару порожнини рота. Оскільки найбільша насиченість РНК ядерець відмічається в клітинах базального й шипуватого шарів на відміну від поверхневого, клітини останнього в мазку не враховувалися. Повторного взяття зскрібка не допускали, щоб не потрапляли клітини глибших шарів, які мають ознаки недиференційованих епітеліоцитів. Забір матеріалу, виготовлення препаратів із наступним забарвленням за Фьольгеном у модифікації, що дозволяє провести диференційне забарвлення ДНК ядра і РНК ядерець, здійснювали за відповідною методикою (раціоналізаторська пропозиція № 30/2319, 1997). Для аналізу структурних змін хромосомного апарату аналізували не менше 500 клітин від кожної особи.
Матеріалом для молекулярно-генетичного дослідження слугувала пуповинна кров новонароджених. Алельний поліморфізм GSTT1 та GSTM1 генів GSTs визначали із використанням модифікованого протоколу мультиплексної полімеразної ланцюгової реакції за M. Arand, R. Muhlbauer [16]. Ампліфікацію виділеної ДНК проводили в ампліфікаційній суміші з трьома парами специфічних праймерів в автоматичному термоциклері Applied Biosystems 2700 (Великобританія). Ампліфіковані фрагменти розподіляли з використанням горизонтального електрофорезу в 2% агарозному гелі із забарвленням бромистим етидієм. Аналізували отримані амплікони за допомогою трансілюмінатора «Біоком» із подальшим архівуванням у персональному комп’ютері за допомогою відеосистеми ViTran (Російська Федерація). Гомозиготному стану делеційної алелі в особи (нульовому генотипу) відповідала відсутність відповідних ампліфікатів, що свідчило про наявність генотипів GSTT1– та GSTM1–. Для статистичного аналізу отриманих даних використовували критерій x2 Пірсона; за умови, якщо об’єм вибірки не перевищував 10 спостережень, застосовували критерій x2 з поправкою Йєтса (программа Statistiсa 10.0, StatSoft Inc.) та відношення шансів (Odds Ratio — OR).
Результати досліджень та їх обговорення
В результаті аналізу отриманих даних встановлено, що в усіх новонароджених області частота поліморфного варіанта GSTМ1+ становила 43,70 %, частота поліморфного варіанта GSTМ1– — 56,30 %. Для гена GSTT1 частота поліморфних варіантів GSTТ1+ і GSTТ1– становила 80,67 та 19,33 % відповідно, що не відрізняється від частоти, характерної для населення України [17].
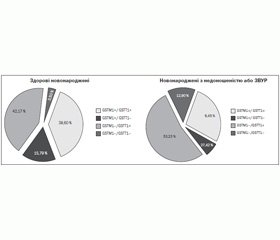
Делеційний варіант гена GSTT1 зустрічався з однаковою частотою в здорових новонароджених і в новонароджених із недоношеністю або ЗВУР — 19,30 та 19,35%. Була виявлена вірогідна різниця між частотами делеційного варіанта гена GSTМ1 у новонароджених із недоношеністю або ЗВУР та здорових новонароджених Івано-Франківської області — 66,13 та 45,61 % відповідно [x2 = 5,08; OR = 2,33 (1,11–4,89), р = 0,0242] для алельного варіанта GSTM1– та 33,87 і 54,39 % — для алельного варіанта GSTM1+ [x2 = 5,08; OR = 0,43 (0,20–0,90), р = 0,0242] (рис. 1).
При порівнянні частот поєднань алельних варіантів генів GSTM1, GSTT1 у здорових новонароджених і новонароджених із недоношеністю або ЗВУР найбільша різниця спостерігалась для поєднань алельних варіантів GSTМ1–/GSTТ1– — 3,50 та 12,90 % відповідно, проте ця різниця, як і для інших поєднань, не була вірогідною (рис. 2).
Була виявлена вірогідна різниця між частотами алелів генів GSTМ1 та GSTТ1 при порівнянні новонароджених, у яких був позитивний чи негативний мікроядерний тест.
Позитивний мікроядерний тест у новонароджених був асоційований із нефункціональним алелем гена GSTM1 — 71,95 % випадків порівняно з 21,62 % при негативному мікроядерному тесті, різниця високовірогідна [x2 = 24,24; OR = 9,30 (3,71–23,31), p = 0,00001] (табл. 1).
При дослідженні асоціацій алельних варіантів гена GSTТ1 з позитивним чи негативним мікроядерним тестом в жодному випадку не було виявлено позитивного мікроядерного тесту в носіїв нефункціонального алеля гена GSTТ1, у всіх новонароджених із негативним мікроядерним тестом був виявлений алельний варіант GSTT1+, різниця вірогідна [x2 = 11,13; p = 0,0009] (табл. 1).
Ця тенденція зберігалась і для поєднань генотипів (табл. 2). У новонароджених із негативним мікроядерним тестом у 78,38 % випадків виявлялось поєднання генотипів GSTM1+/GSTT1+, різниця високовірогідна [x2 = 43,73; OR = 0,04 (0,01–0,11), p = 0,00001]. Для поєднання генотипів GSTM1–/GSTT1+ різниця також була вірогідною [x2 = 5,06; p = 0,0245] (табл. 2). Поєднання генотипів GSTM1+/GSTT1– та GSTM1–/GSTT1– у новонароджених із негативним мікроядерним тестом не були виявлені (різниця вірогідна, табл. 2).
У здорових новонароджених позитивний мікроядерний тест був асоційований із нефункціональним алелем гена GSTM1 у 64,29 % випадків порівняно з 27,59 % при негативному мікроядерному тесті, різниця вірогідна [x2 = 6,33; OR = 4,73 (1,54–14,52), p = 0,0119] (табл. 3). В осіб із нефункціональним алелем гена GSTТ1 позитивний мікроядерний тест виявили в 39,29 % випадків порівняно з 0 % при негативному мікроядерному тесті, різниця вірогідна [x2 = 11,71; p = 0,0006]. Вірогідні відмінності в цій групі виявлені для поєднань алельних варіантів генів GSTM1+/GSTT1+ [x2 = 25,66; OR = 0,01 (0,002–0,12), p = 0,00001], GSTM+/GSTT1– [x2 = 8,78; p = 0,0030] та GSTM1–/GSTT1+ [x2 = 3,96; p = 0,0465] (табл. 4) .
У новонароджених зі ЗВУР і недоношеністю позитивний мікроядерний тест був асоційований із нефункціональним алелем гена GSTM1 у 75,47 % випадків порівняно з 0 % при негативному мікроядерних тесті, відмінності вірогідні [x2 = 15,99; p = 0,0001] (табл. 5).
Для алельних варіантів гена GSTТ1 вірогідні відмінності виявлені не були. Вірогідні відмінності в цій групі виявлені для поєднань алельних варіантів генів GSTM1+/GSTT1+ [x2 = 21,86; p = 0,00001] та GSTM1–/GSTT1+ [x2 = 8,94; p = 0,0028] (табл. 6).
Отримані нами дані продемонстрували асоціацію алельного варіанта GSTМ1– з недоношеністю або ЗВУР в обстежених новонароджених Івано–Франківської області. У роботах ряду авторів досліджувалась функція плаценти — органа, що має велике значення при взаємодії двох організмів — матері й плода. Було показано, що окислювальний стрес, обумовлений головним чином зниженням буферної ємності глутатіонзалежної ланки антиоксидантного захисту в плаценті на тлі інтенсифікації процесів перекисного окислення ліпідів, відіграє ключову роль як патогенетичний фактор дисфункції плаценти. О.М. Беспалова та співавт. (2006) показали, що відносний ризик розвитку плацентарної недостатності та ЗВУР плода в обстежених, у яких виявили генотип GSTM1– у плацентах, був підвищений майже в 3 рази [OR = 2,83 (1,03–7,76)]. Асоціації плацентарної недостатності з нефункціональними алелями генів глутатіон-S-трансфераз виявили також інші автори [18–20].
Таким чином, алельні варіанти генів системи детоксикації ксенобіотиків впливають на реалізацію токсичних впливів. Проте індивідуальна чутливість організму до пошкоджуючої дії факторів навколишнього середовища може залежати від багатьох факторів. Формування мікроядер широко використовується в молекулярній епідеміології як вірогідний біомаркер пошкодження хромосом, нестабільності геному, ризику розвитку патологічних процесів [21]. Доведено, що виникнення мікроядер — це прояв хромосомної нестабільності, викликаний генетичними дефектами та/або реакцією на генотоксичність агентів. У результаті нашого дослідження показана залежність рівня ушкодження хромосомного апарату від генотипу обстежуваного за генами GSTМ1 та GSTТ1. Проведені нами дослідження довели високу діагностичну цінність молекулярно-генетичного тестування в поєднанні з мікроядерним тестом для прогнозування чутливості геному новонародженого до сумарного впливу пошкоджуючих факторів. Раннє виявлення ступеня чутливості організму новонародженого до шкідливої дії факторів навколишнього середовища дозволить враховувати ці індивідуальні особливості при виборі стратегії лікування та профілактики.
Висновки
1. У всіх новонароджених області частота поліморфного варіанта GSTМ1+ була 43,70 %, частота поліморфного варіанта GSTТ1+ — 80,67 %, що не відрізняється від частот, характерних для населення України.
2. Частота мікроядер у клітинах ексфоліативного епітелію новонароджених асоційована з генетичним поліморфізмом генів ІІ фази детоксикації ксенобіотиків.
3. Позитивний мікроядерний тест у новонароджених був асоційований із поліморфним варіантом GSTМ1– — 71,95 % випадків порівняно з 21,62 % при негативному мікроядерному тесті [x2 = 24,24; OR = 9,30 (3,71–23,31), p = 0,00001].
4. У носіїв поліморфного варіанта GSTТ1– в жодному випадку не було виявлено позитивного мікроядерного тесту, у всіх новонароджених із негативним мікроядерним тестом був виявлений алельний варіант GSTT1+ [x2 = 11,13; p = 0,0009].
5. У новонароджених із негативним мікроядерним тестом у 78,38 % випадків виявлялась асоціація генотипів GSTM1+/GSTT1+ [x2 = 43,73; OR = 0,04 (0,01–0,11), p = 0,00001].
6. Поєднання генотипів GSTM1+/GSTT1– та GSTM1–/GSTT1– у новонароджених із негативним мікроядерним тестом не були виявлені [x2 = 5,06; p = 0,0245 та x2 = 3,47; p = 0,0625 відповідно].
1. Gluckman P.D., Hanson M.A. The consequences of being born small — an adaptive perspective // Horm. Res. — 2006. — Vol. 65. — P. 5–14.
2. Somers C.M. Air pollution and mutations in the germline: are humans at risk? / Somers C.M., Cooper D.N. // Hum. Genet. — 2009. — Vol. 125, № 2. — Р. 119–130.
3. Sharp N.P. Evidence for elevated mutation rates in low-quality genotypes / Sharp N.P., Agrawal A.F. // Proc. Natl. Acad. Sci USA. — 2012. — Vol. 109, № 16. — Р. 6142–6146.
4. Scheuplein R., Charnley G., Dourson M. Differential sensitivity of children and adults to chemical toxicity. I. Biological basis // Regul. Toxicol. Pharmacol. — 2002. — Vol. 35, № 3. — P. 429–447.
5. Saenger P., Czernichow P., Hughes I., Reiter E.O. Small for gestational age: short stature and beyond // Endocr. Rev. — 2007. — Vol. 28, № 2. — Р. 219–251.
6. An increased micronucleus frequency in peripheral blood lymphocytes predicts the risk of cancer in humans / Bonassi S., Znaor A., Ceppi M. et al. // Carcinogenesis. — 2007. — Vol. 28, № 3. — Р. 625–631.
7. Micronuclei in neonates and children: effects of environmental, genetic, demographic and disease variables / Holland N., Fucic A., Merlo D.F., Sram R., Kirsch-Volders M. // Mutagenesis. — 2011. — Vol. 26, № 1. — Р. 51–56.
8. Cytokinesis-blocked micronucleus assay as a novel biomarker for lung cancer risk / El-Zein R.A., Schabath M.B., Etzel C.J., Lopez M.S., Franklin J.D., Spitz M.R. // Cancer Res. — 2006. — Vol. 66. — P. 6449–6456.
9. The effect of age, gender, diet and lifestyle on DNA damage measured using micronucleus frequency in human peripheral blood lymphocytes / Fenech M., Bonassi S. // Mutagenesis. — 2011. — Vol. 26, № 1. — Р. 43–49.
10. Micronuclei in Cord Blood Lymphocytes and Associations with Biomarkers of Exposure to Carcinogens and Hormonally Active Factors, Gene Polymorphisms, and Gene Expression: The NewGeneris Cohort / Merlo D.F., Agramunt S., Anna L. et al. // Environ Health Perspect. — 2014. — Vol. 122, № 2. — P. 193–200.
11. Genetic polymorphisms and micronucleus formation: a review of the literature / Iarmarcovai G., Bonassi S., Botta A., Baan R.A., Orsière T. // Mutat. Res. — 2008. — Vol. 658, № 3. — Р. 215–233.
12. Genetic polymorphisms of genes involved in DNA repair and metabolism influence micronucleus frequencies in human peripheral blood lymphocytes / Dhillon V.S., Thomas P., Iarmarcovai G. et al. // Mutagenesis. — 2011. — Vol. 26, № 1. — Р. 33–42.
13. Influence of genetic polymorphisms on biomarkers of exposure and effects in children living in Upper Silesia / Mielzynska-Svach D., Blaszczyk E., Butkiewicz D. et al. // Mutagenesis. — 2013. — Vol. 28, №5. — Р. 591–599.
14. Glutathione transferases / Hayes J.D., Flanagan J.U., Jowsey I.R. // Annu Rev. Pharmacol Toxicol. 2005. — Vol. 45. — Р. 51–88.
15. Наказ МОЗ України № 584 від 29.08.2006 р. «Про затвердження Протоколу медичного догляду за новонародженою дитиною з малою масою тіла при народженні».
16. A multiplex polymerase chain reaction protocol for the simultaneous analysis of the glutathione S-transferase GSTM1 and GSTT1 polymorphisms / M. Arand, R. Muhlbauer, J. Hengstler [et al.] // Anal. Biochem. — 1996. — Vol. 236. — P. 184–186.
17. Горовенко Н.Г. Роль спадкових факторів у розвитку перинатальної патології новонороджених / Н.Г. Горовенко, З.І. Россоха, С.В. Подольська // Сучасна педіатрія. — 2007. — Т.14, № 1. — С. 162–168.
18. Плацентарная недостаточность и полиморфизм генов глютатион-S-трансфераз М1, Т1 и Р1 / Беспалова О.Н., Иващенко Т.Э., Тарасенко О.А., Малышева О.В., Баранов В.С., Айламазян Э.К. // Журнал акушерства и женских болезней. — 2006. — Т. LV, № 2. — С. 25–31.
19. Перинатальные исходы плацентарной недостаточности в зависимости от генотипов глутатион-S-трансфераз / Будюхина О.А., Барановская Е.И., Даниленко Н.Г., Левданский О.Д., Воропаев Е.В., Осипкина О.В., Румянцева О.А. // Репродуктивное здоровье в Беларуси. — 2010. — № 2. — С. 59–68.
20. Genetic, Biochemical, and Environmental Factors Associated with Pregnancy Outcomes in Newborns from the Czech Republic / Rossner P. Jr., Tabashidze N., Dostal M. et al. // Environ Health Perspect. — 2011. — Vol. 119, № 2. — P. 265–271.
21. Сычева Л.П., Журков В.С., Рахманин Ю.А., Ревазова Ю.А. Применение полиорганного микроядерного теста в эколого-генетических исследованиях // Полиорганный микроядерный тест в эколого-гигиенических исследованиях / Под ред. Ю.А. Рахманина, Л.П. Сычевой. — М.: Гениус, 2007. — С. 277–286.

/52/52.jpg)
/53/53.jpg)
/52/52_2.jpg)
/53/53_2.jpg)
/54/54.jpg)