Международный эндокринологический журнал 5 (61) 2014
Вернуться к номеру
Зміни структури і функції серця за умов інсулінорезистентності при синдромі тиреотоксикозу
Авторы: Юзвенко Т.Ю. - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Кардиология, Эндокринология
Разделы: Клинические исследования
Версия для печати
У статті наведені результати вивчення впливу підвищеної тиреоїдної функції на тлі інсулінорезистентності на показники структури і функції серця. Встановлено, що при підвищенні функції щитоподібної залози основною нозологічною формою ураження міокарда у пацієнтів без супутньої серцево-судинної патології є розвиток метаболічної ендокринної кардіоміопатії. Особливістю ураження серця при синдромі тиреотоксикозу є відсутність кардіосклеротичних, міокардитичних та ішемічних процесів. Особливостями клінічних, інструментальних і лабораторних змін у пацієнтів з підвищеною функцією щитоподібної залози є суб’єктивна маніфестація, тенденція до розвитку систолічної артеріальної гіпертензії, виражена гіполіпідемія, тенденція до гіперглікемії. Проявами електричної дисфункції міокарда при гіпертиреозі є збільшення частоти серцевих скорочень, виражена тенденція до підвищення аритмогенезу (здебільшого шлуночкового типу), порушення процесів реполяризації шлуночків і переважання електричної негомогенності міокарда як передсердь, так і шлуночків. Морфофункціональні зміни серця при синдромі тиреотоксикозу проявляються збільшенням розмірів його порожнин, маси міокарда лівого шлуночка, пришвидшеним розслабленням останнього. Ураження серця при тиреотоксикозі характеризується збільшенням тривалості і дисперсії інтервалу QTc, що свідчить про порушення процесів реполяризації міокарда, і збільшенням його електричної негомогенності, що може бути предиктором ризику розвитку шлуночкових порушень ритму. Зміни серцевої діяльності при тиреотоксикозі у пацієнтів чоловічої статі характеризуються більшою вираженістю електрофізіологічних і морфофункціональних змін міокарда порівняно з пацієнтами жіночої статі.
В статье приведены результаты изучения влияния повышенной тиреоидной функции на фоне инсулинорезистентности на показатели структуры и функции сердца. Установлено, что при повышении функции щитовидной железы основной нозологической формой поражения миокарда у пациентов без сопутствующей сердечно-сосудистой патологии является развитие метаболической эндокринной кардиомиопатии. Особенность поражения сердца при синдроме тиреотоксикоза — отсутствие кардиосклеротических, миокардитических и ишемических процессов. Особенностями клинических, инструментальных и лабораторных изменений у пациентов с повышенной функцией щитовидной железы являются субъективная манифестация, тенденция к развитию систолической артериальной гипертензии, выраженная гиполипидемия, тенденция к гипергликемии. Проявлениями электрической дисфункции миокарда при гипертиреозе являются увеличение частоты сердечных сокращений, выраженная тенденция к повышению аритмогенеза (в основном желудочкового типа), нарушение процессов реполяризации желудочков и преобладание электрической негомогенности миокарда как предсердий, так и желудочков. Морфофункциональные изменения сердца при синдроме тиреотоксикоза проявляются увеличением размеров его полостей, массы миокарда левого желудочка, ускоренным расслаблением последнего. Поражение сердца при тиреотоксикозе характеризуется увеличением длительности и дисперсии интервала QTc, что свидетельствует о нарушении процессов реполяризации миокарда, и повышением его электрической негомогенности, что может быть предиктором риска развития желудочковых нарушений ритма. Изменения сердечной деятельности при тиреотоксикозе у пациентов мужского пола характеризуются большей выраженностью электрофизиологических и морфофункциональных изменений миокарда по сравнению с пациентами женского пола.
The article presents the findings of the study on the effect of increased thyroid function on the background of insulin resistance on the performance of the structure and function of the heart. It has been found that in increased thyroid function, main nosological form of myocardial damage in patients without concomitant cardiovascular disease is the development of metabolic endocrine cardiomyopathy. Feature of heart disorder in thyrotoxicosis syndrome is an absence of cardosclerotic, myocarditic and ischemic processes. Features of clinical, instrumental and laboratory changes in patients with elevated thyroid function are subjective manifestation, trend towards the development of systolic hypertension, expressed hypolipidemia, tendency to hyperglycemia. Manifestations of electrical dysfunction of the myocardium in hyperthyroidism are increased heart rate, expressed trend towards increase of arrhythmogenesis (mainly ventricular type), disturbance of ventricular repolarization and the prevalence of electrical inhomogeneity of the myocardium of both atria and ventricles. Morphofunctional changes of the heart in thyrotoxicosis syndrome manifest by increase in the size of its cavities, left ventricular mass, rapid relaxation of the latter. Heart disease in thyrotoxicosis is characterized by an increase in the duration and dispersion of QTc interval, which indicates a violation of myocardial repolarization, and increase in its electrical inhomogeneity, which can be a predictor of the risk of ventricular arrhythmias. Changes in cardiac function at thyrotoxicosis in male patients are characterized by greater severity of electrophysiological and morphofunctional changes in the myocardium compared to female patients.
тиреотоксикоз, інсулінорезистентність, функція міокарда.
тиреотоксикоз, инсулинорезистентность, функция миокарда.
thyrotoxicosis, insulin resistance, myocardial function.
Статья опубликована на с. 22-26
Стан інсулінорезистентності, який супроводжується зниженням чутливості периферичних тканин до біологічної дії інсуліну, трапляється не лише при цукровому діабеті 2-го типу, а й при інших захворюваннях з порушеннями обміну речовин, зокрема при синдромі тиреотоксикозу [1]. Найчастішим проявом дисфункції щитоподібної залози (ЩЗ) є розвиток вторинної ендокринної кардіоміопатії [2]. Надмірна секреція тиреоїдних гормонів супроводжується патологічними змінами у багатьох органах і системах. Одним з найтяжчих ускладнень дифузного токсичного зоба (ДТЗ), що визначає прогноз захворювання, є тиреотоксичне серце. Цей термін включає гіперфункцію, гіпертензію, дистрофію міокарда з подальшим кардіосклерозом і серцевою недостатністю [3].
Отримати об’єктивні дані стосовно частоти гіпертиреоїдної кардіоміопатії доволі складно у зв’язку з відсутністю уніфікованих критеріїв діагностики. За результатами проведених досліджень реально видається можливим розглянути лише окремі прояви кардіоміопатії, до яких належать фібриляція передсердь і серцева недостатність [4]. Диференціальна діагностика функціональних і органічних уражень міокарда при порушенні функції ЩЗ із прогнозуванням розвитку серцевої недостатності залишається актуальною і потребує динамічного вивчення усього спектра клінічних проявів ураження серцево-судинної системи на тлі тиреоїдної дисфункції.
В різних дослідженнях існують суперечності стосовно впливу гормонів ЩЗ на процеси реполяризації міокарда. Широко відомо, що гіпотиреоз характеризується збільшенням часу реполяризації, що проявляється подовженням інтервалу QT [5, 6]. Дані про вплив надлишку гормонів ЩЗ на ці процеси досить неоднозначні [7]. У доступній літературі також немає переконливих відомостей про стійкі кореляційні залежності наведених порушень механічної і електричної функції міокарда від метаболічних зсувiв, притаманних синдрому тиреотоксикозу.
Метою проведеного дослідження була оцінка впливу підвищеної тиреоїдної функції на тлі інсулінорезистентності на показники структури і функції серця.
Матеріали і методи дослідження
Під спостереженням перебували 52 хворі, які зверталися по амбулаторну медичну допомогу і перебували на обстеженні в Українському науково–практичному центрі ендокринної хірургії, трансплантації ендокринних органів і тканин. Основним критерієм виключення з дослідження була наявність в анамнезі серцево-судинної патології. Всі пацієнти були розподілені на 3 групи. До першої групи увійшли 19 пацієнтів з явним гіпертиреозом, до другої — 17 осіб із субклінічним гіпертиреозом, до третьої (контроль) — 16 осіб в стані еутиреозу. У всіх обстежених відзначався стан інсулінорезистентності. У пацієнтів із синдромом тиреотоксикозу (n = 19) причинами розвитку цього порушення функції були ДТЗ (73,7 %), багатовузловий токсичний зоб (21,1 %) і токсична аденома ЩЗ (5,2 %). Середній вік обстежених осіб з гіпертиреозом становив 43,2 ± 1,3 року.
Інсулінорезистентність визначали за величиною індексу НОМА, який обчислювався за формулою: глюкоза натще (ммоль/л) х інсулін натще (мкОД/мл) / 22,5. Наявність інсулінорезистентності визначали при рівні НОМА ≥ 3,0.
Рівень тиреотропного гормону (ТТГ), вільного тироксину (вТ4), вільного трийодтироніну (вТ3), антитіл до рецептора ТТГ (АТ до рТТГ) у сироватці крові натще визначали імуноферментним методом за допомогою реактивів фірми DRG (Німеччина) на автоматичному аналізаторі iEMS Reader MF фірми ThermoLabsystems (Фінляндія). Визначення рівня глюкози в сироватці крові проводили колориметричним методом на автоматичному біохімічному аналізаторі Sapphire-400, Tokyo Boeki L.T.D. p використанням реагентiв Elitech diagnostics виробництва Seppim S.A.S. (Франція). Для оцінки змін обміну речовин, які супроводжують порушення функції ЩЗ, досліджували показники ліпідограми (загальний холестерин, ліпопротеїни низької, дуже низької і високої щільності, тригліцериди, коефіцієнт атерогенності), лужної фосфатази, загального білка, білірубіну, y-глутамілтрансферази, креатинфосфокінази.
Електрокардіографічне дослідження (ЕКГ) проводили у 12 відведеннях на стандартних електрокардіографах. Оцінювали частоту серцевих скорочень (ЧСС), наявність екстрасистол, ішемічних змін. З метою інтегральної оцінки процесів реполяризації міокарда проводили аналіз амплітуди зубців Т і розрахунок середньої амплітуди зубців Т у грудних відведеннях. Серед показників негомогенності реполяризації міокарда шлуночків вивчали інтервал QT і коригований інтервал QT (QTc), який обчислювали за формулою Базетта (QTс = QT / RК1/2 при RR < 1000 мс). Як показник негомогенності процесів реполяризації передсердь оцінювали інтервал PQ і його дисперсію (PQd).
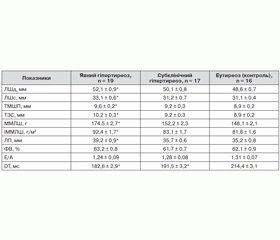
Оцінку морфометричних показників лівого шлуночка (ЛШ), діастолічної і скоротливої функції міокарда ЛШ серця проводили шляхом дослідження ехокардіографії на ультразвукових сканерах у стандартних режимах. Оцінювали кінцевий систолічний розмір, кінцевий діастолічний розмір, товщину міжшлуночкової перегородки (ТМШП) і задньої стінки (ТЗС) в діастолу, фракцію викиду (ФВ), масу міокарда лівого шлуночка (ММЛШ) та індекс маси міокарда лівого шлуночка (ІММЛШ). Для вивчення діастолічної функції досліджували такі параметри трансмітрального кровотоку: максимальні швидкості раннього діастолічного наповнення (Е) і наповнення в систолу передсердь (А), час уповільнення кровотоку раннього діастолічного наповнення діастоли ЛШ (DT).
Статистична обробка матеріалу виконувалася на персональному комп’ютері з використанням стандартного пакета програм прикладного статистичного аналізу (Statistica for Windows v. 6.0). Для статистичної обробки отриманих даних застосовували t-критерій Стьюдента, ранговий U-критерій Вілкоксона — Манна — Уїтні, критерій Пірсона і метод Фішера та інші. Критичний рівень вірогідності нульової статистичної гіпотези дорівнював 0,05.
Результати дослідження та їх обговорення
При аналізі отриманих лабораторних та інструментальних результатів нами не знайдено даних, які б свідчили про розвиток кардіосклеротичних чи ішемічних процесів в міокарді. Нами не зареєстровано випадків розвитку хронічної серцевої недостатності і значущих порушень серцевого ритму. Тому можна стверджувати, що всі наявні суб’єктивні ознаки, об’єктивні дані, структурні і функціональні зміни міокарда у пацієнтів із синдромом тиреотоксикозу мали вторинний характер і були відображенням метаболічної ендокринної кардіоміопатії (за класифікацією Всесвітньої організації охорони здоров’я, 1995).
Вік пацієнтів з групи гіпертиреозу (явного і субклінічного) в середньому становив 43,2 ± 1,3 року, в контрольній групі з еутиреозом — 41,9 ± 1,2 року (р > 0,05). Тому виявлені нами зміни з боку серцево-судинної системи залежать не від віку, а від порушення функції ЩЗ. Групи були порівнянними за статтю (р > 0,05). Тривалість захворювання в групах із синдромом тиреотоксикозу становила в середньому 0,98 ± 0,07 року.
Враховуючи, що основним критерієм об’єднання пацієнтів в групи був рівень гормонів ЩЗ, при порівнянні груп гіпертиреозу і еутиреозу були отримані значущі відмінності за вмістом ТТГ і тиреоїдних гормонів (табл. 1).
При оцінці скарг обстежених пришвидшене серцебиття і задишка при фізичному навантаженні відзначалися вірогідно частіше у пацієнтів з групи тиреотоксикозу порівняно з контрольною групою.
Аналіз антропометричних даних (iндексу маси тiла) виявив значущі відмінності між пацієнтами з групи гіпертиреозу і контролю (rs = 0,31; р < 0,05).
При оцінці артеріального тиску (АТ) у пацієнтів з гіпертиреозом середній систолічний АТ (САТ) становив 136,2 ± 2,8 мм рт.ст., діастолічний АТ — 83,1 ± 1,7 мм рт.ст. За рівнем САТ встановлено вірогідні відмінності групи з гіпертиреозом порівняно з контрольною групою (р < 0,05). Аналіз біохімічних параметрів (ліпідограма, показники вуглеводного обміну, функціонального стану печінки і нирок) не продемонстрував вірогідних відмінностей між групами обстежених.
При проведенні ЕКГ у пацієнтів з гіпертиреозом було виявлено збільшення тривалості коригованого інтервалу QT, як мінімального, так і максимального, що вірогідно відрізняло їх від пацієнтів з нормальною функцією ЩЗ. Дисперсія тривалості коригованого інтервалу QT була вірогідно вища в групі явного гіпертиреозу порівняно з групою контролю (p < 0,05) (табл. 2).
При порівняльному аналізі підгрупи з явним гіпертиреозом була виявлена значуща тенденція до збільшення варіабельностi інтервалу PQ (р < 0,05).
Отже, нами встановлено, що надлишок гормонів ЩЗ призводить до порушення процесів реполяризації шлуночків і переважання електричної негомогенності міокарда як передсердь, так і шлуночків.
При оцінці морфометричних і гемодинамічних показників у пацієнтів з тиреотоксикозом було виявлено тенденцію до збільшення розмірів порожнин лівого передсердя (ЛП) і ЛШ, потовщення задньої стінки ЛШ міжшлуночкової перегородки. Всі зазначені зміни перебували у верхніх межах норми. За показником кінцевого діастолічного розміру і кінцевого систолічного розміру ЛШ, товщиною міжшлуночкової перегородки, розміром лівого передсердя були виявлені вірогідні відмінності від показників пацієнтів з групи еутиреозу. Звертає на себе увагу факт приросту кінцевого систолічного розміру ЛШ у хворих з гіпертиреозом, що вказує на тенденцію до зниження його скоротливої функції (табл. 3).
У пацієнтів з явним гіпертиреозом виявлено збільшення маси міокарда ЛШ (174,5 ± 2,7 г) та ІММЛШ (92,4 ± 1,7 г/м2), що вірогідно відрізняло цих пацієнтів від пацієнтів інших груп (р < 0,05) і свідчило про розвиток гіпертрофії міокарда ЛШ.
Крім цього, відзначалася тенденція до приросту швидкості пізнього наповнення ЛШ (А) (63,2 ± 1,2 см/с) порівняно з групою контролю (60,9 ± 1,4 см/с) (р > 0,05). Показник часу уповільнення кровотоку раннього діастолічного наповнення ЛШ (DT) також залишався нормальним (182,6 ± 2,9 мс), але при цьому відзначалося вірогідне зменшення DT порівняно з пацієнтами з нормальною функцією ЩЗ (р < 0,001).
При ехокардіографічному дослідженні вірогідно частіше виявляли мітральну недостатність в групі явного тиреотоксикозу — у 12 пацієнтів (63,2 %) порівняно з 6 пацієнтами (37,5 %) з групи еутиреозу (р < 0,05).
Отже, явний гіпертиреоз супроводжується вірогідним збільшенням розмірів порожнин серця, маси міокарду ЛШ порівняно з пацієнтами з нормальною функцією ЩЗ. Також звертає на себе увагу факт укорочення фази раннього наповнення ЛШ, що свідчить про пришвидшене його розслаблення у пацієнтів з підвищеною функцією ЩЗ.
При вивченні особливостей впливу надлишку гормонів ЩЗ на електрокардіографічні показники залежно від статі у чоловіків була виявлена більша ЧСС (96,5 ± 3,9 уд/хв), ніж у жінок (86,1 ± 3,5 уд/хв). Також відзначалося збільшення амплітуди зубців Т у чоловіків (3,5 ± 0,1 мм) порівняно з аналогічним показником у жінок (2,8 ± 0,1 мм). Ці зміни можуть свідчити про більшу вираженість активності симпатичної нервової системи при надлишку тиреоїдних гормонів у пацієнтів чоловічої статі.
Відмінностей за тривалістю коригованих інтервалів QT (QTc min і QTc max) та їх дисперсії (QTcd) отримано не було. Однак для чоловіків характерний коротший інтервал QTc, і гіпертиреоз супроводжувався більш значущим його подовженням. Вивчення показників ехокардіографії пацієнтів з явним гіпертиреозом підтвердило наявність гіпертрофії міокарда ЛШ і у чоловіків, і у жінок.
При проведенні кореляційного аналізу в групі явного гіпертиреозу сильні зв’язки виявлялися не лише з Т4, а й з Т3. При цьому найсильніші негативні кореляції вмісту периферичних тиреоїдних гормонів виявлені з розміром ЛШ в діастолу і показниками діастолічного розслаблення ЛШ. Крім цього, Т3 позитивно корелював з PQd (r = 0,61; р < 0,05) і ЧСС (r = 0,57; р < 0,05), а T4 — з амплітудою зубця Т (r = 0,58; р < 0,05). Нами не було отримано кореляційних зв’язків між рівнем гормонів ЩЗ і показниками реполяризації шлуночків (QTc). Ці показники, а також показники гомогенності реполяризації шлуночків мали сильні кореляційні зв’язки з результатами оцінки трансмітрального кровотоку і масою міокарда ЛШ.
Як бачимо, при діагностицi тиреотоксичної кардіоміопатії слід звертати увагу на ранні неспецифічні клінічні прояви, враховуючи той факт, що ураження серцевого м’яза може траплятися і при субклінічних формах гіпертиреозу.
Для оцінки гомогенності процесів реполяризації як прогностичного маркера виникнення передсердних і шлуночкових порушень ритму у пацієнтів з гіпертиреозом в практичній діяльності доцільно визначати дисперсію інтервалу PQ і коригованого інтервалу QT.
Результати дослідження вказують на важливість інформованості сімейних лікарів про необхідність ранньої діагностики морфофункціональних та електрофізіологічних змін серцево-судинної системи у пацієнтів з підвищеною функцією ЩЗ.
Висновки
1. За наявності субклінічного або явного гіпертиреозу у більшості випадків не діагностуються такі класичні форми ураження серцевого м’яза, як кардіосклероз і міокардит, а домінуючою кардіальною нозологією є метаболічна тиреоїдна кардіоміопатія.
2. Особливостями клінічних, інструментальних і лабораторних змін у пацієнтів з підвищеною функцією щитоподібної залози є суб’єктивна маніфестація, тенденція до систолічної артеріальної гіпертензії, виражена гіполіпідемія і тенденція до гіперглікемії.
3. Проявами електричної дисфункції міокарда при гіпертиреозі є збільшення ЧСС, виражена тенденція до підвищення аритмогенезу (здебільшого шлуночкового типу), порушення процесів реполяризації шлуночків і переважання електричної негомогенності міокарда як передсердя, так і шлуночків.
4. Морфофункціональні зміни серця при гіпертиреозі проявляються збільшенням розмірів його порожнин, маси міокарда ЛШ, пришвидшеним розслабленням ЛШ. Ураження серця при гіпертиреозі характеризується збільшенням тривалості і дисперсії інтервалу QTc, що свідчить про порушення процесів реполяризації міокарда, і збільшенням його електричної негомогенності, що може бути предиктором ризику розвитку шлуночкових порушень ритму.
5. Зміни серцевої діяльності при гіпертиреозі характеризуються статевим диморфізмом: для пацієнтів чоловічої статі характерна більша вираженість електрофізіологічних і морфофункціональних змін міокарда порівняно з пацієнтами жіночої статі.
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тиреоидология: Руководство. — М.: Медицина, 2007. — 816 с.
2. Карась А.С. Щитовидная железа и сердце / Карась А.С., Обрезан А.Г. // Клиническая и экспериментальная тиреоидология. — 2009. — № 3. — С. 37–42.
3. Паньків В.І. Практична тиреоїдологія. — Донецьк, 2011. — 224 c.
4. Brenta G. Diabetes and thyroid disorders // British Journal of Diabetes and Vascular Disease. — 2010. — Vol. 10(4). — P. 172–177.
5. Cappola A.R., Fried L.P., Arnold A.M. et al. Thyroid status, cardiovascular risk, and mortality in older adults // JAMA. — 2006 — Vol. 295, № 9. — P. 1033–1041.
6. Flynn R.W., McDonald T.M., Jung R.T. et al. Mortality and vascular outcomes in patients treated for thyroid dysfunction // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91, № 6. — P. 2159–2164.
7. Rezzonico J., Niepomniszcze H., Rezzonico M. et al. The association of insulin resistance with subclinical thyrotoxicosis // Thyroid. — 2011. — Vol. 21, № 9. — P. 945–949.

/24/24.jpg)
/24/24_2.jpg)