Журнал «Актуальная инфектология» 3 (4) 2014
Вернуться к номеру
Визначення кількісного вмісту HBsAg у сироватці крові під час комплексного моніторингу хронічного гепатиту В у ВІЛ-інфікованих пацієнтів
Авторы: Мороз Л.В. - Вінницький національний медичний університет ім. М.І. Пирогова; Мельник Т.О. - Вінницький національний медичний університет ім. М.І. Пирогова; КЗ «Вінницький обласний центр профілактики та боротьби зі СНІДом»; Матковський І.А. - Вінницький національний медичний університет ім. М.І. Пирогова; КЗ «Вінницький обласний центр профілактики та боротьби зі СНІДом»
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
У роботі подано результати вивчення кількісного вмісту HBsAg у пацієнтів із коінфекцією ВІЛ/хронічний гепатит В у зіставленні з наявністю/відсутністю ДНК вірусу гепатиту В та рівнем аланінаміно-трансферази в крові. Було встановлено, що у хворих із поєднаною інфекцією ВІЛ/хронічний гепатит В, які отримують лікування, відсутність ДНК вірусу гепатиту В вірогідно пов’язана із зниженням рівня HBsAg, особливо із збільшенням тривалості лікування. При зіставленні з показником аланінамінотрансферази було виявлено, що рівень HBsAg суттєво збільшений лише в пацієнтів, які не отримують противірусного лікування та мають показник аланінамінотрансферази, вищий за норму. Отже, кількісне визначення сироваткового HBsAg можна вважати вірогідним додатковим критерієм для моніторингу лікування хворих на коінфекцію ВІЛ/хронічний гепатит із застосуванням нуклеоз(т)идних інгібіторів зворотної транскриптази.
В работе представлены результаты изучения количественного содержания HBsAg у пациентов с коинфекцией ВИЧ/хронический гепатит В в сопоставлении с наличием/отсутствием ДНК вируса гепатита В и уровнем аланинаминотрансферазы в крови. Было установлено, что у больных с сочетанной инфекцией ВИЧ/хронический гепатит В, которые получают лечение, отсутствие ДНК вируса гепатита В достоверно связано со снижением уровня HBsAg, особенно при увеличении длительности лечения. При сопоставлении с показателем аланинаминотрансферазы выявлено, что уровень HBsAg существенно увеличен только у пациентов, которые не получают противовирусного лечения и имеют показатель аланинаминотрансферазы выше нормы. Таким образом, количественное определение сывороточного HBsAg можно считать достоверным дополнительным критерием для мониторинга лечения больных коинфекцией ВИЧ/хронический гепатит В с применением нуклеоз(т)идных ингибиторов обратной транскриптазы.
The paper presents the results of quantitative content of HBsAg investigation in patients with HIV/chronic hepatitis В coinfection compared with the presence/absence of hepatitis В virus DNA and alanine aminotransferase level in the blood. It has been found that in patients with HIV/chronic hepatitis В coinfection, who receive treatment, the absence of hepatitis В virus DNA is significantly associated with a reduced HBsAg level, and especially with increasing duration of treatment. When compared with the content of alanine aminotransferase, it has been revealed that HBsAg level significantly increased only in patients who did not receive antiviral treatment and have alanine aminotransferase level above normal. Thus, quantification of serum HBsAg can be considered as reliable additional criterion for monitoring the treatment of patients with HIV/chronic hepatitis В coinfection using nucleoside reverse transcriptase inhibitors.
коінфекція ВІЛ/хронічний гепатит В, кількісний вміст HBsAg, ДНК вірусу гепатиту В, нуклеоз(т)идні інгібітори зворотної транскриптази.
коинфекция ВИЧ/хронический гепатит В, количественное содержание HBsAg, ДНК вируса гепатита В, нуклеоз(т)идные ингибиторы обратной транскриптазы.
HIV/chronic hepatitis В coinfection, quantitative content of HBsAg, hepatitis В virus DNA, nucleoside reverse transcriptase inhibitors.
Статья опубликована на с. 27-30
Вступ
Поширеність хронічного вірусного гепатиту В у світі становить 350–400 млн осіб (за даними ВООЗ, 1,49 на 100 тис. населення). В Україні, за оціночними даними, рівень інфікування населення вірусом гепатиту В (HBV) становить 2–7 % [11]. ВІЛ-інфекцією уражені понад 33 млн осіб на планеті, тоді як в Україні зареєстровано понад 200 тис. [1] ВІЛ-інфікованих та хворих на СНІД. У зв’язку зі спільністю шляхів передачі ВІЛ та гепатиту В, домінуванням статевого шляху дедалі актуальнішим стає питання коінфекції ВІЛ/хронічний гепатит В (ВІЛ/ХГВ).
Рівень HBsAg є відображенням транскриптивної активності ковалентно замкненої ДНК (cccDNA). Він є важливим маркером, що не лише виявляє інфікування, але може також застосовуватись у прогнозуванні клінічних наслідків та результатів лікування ХГВ [3, 9, 16].
Доступна на сьогодні терапія ХГВ має забезпечити такий ступінь пригнічення вірусу, що призведе до ремісії за біохімічними показниками, покращення гістологічних показників та запобігання ускладненням [7]. Ідеальним кінцевим показником є вірусологічна відповідь на лікування — ДНК HBV в сироватці крові не виявляється, а також зникнення HBsAg та сероконверсії, що, однак, нечасто досягається при застосуванні сучасних препаратів для лікування вірусного гепатиту В. Припинення виявлення HBsAg у сироватці крові до початку цирозу асоціюється з покращенням прогнозу, зниженням ризику розвитку цирозу [15, 17].
Зникнення HBsAg у пацієнтів із HBеAg-негативним ХГВ, які отримують лікування нуклеоз(т)идними інгібіторами зворотної транскриптази (НІЗТ), спостерігається протягом перших 4–5 років терапії [2, 8, 17].
У хворих із коінфекцією ВІЛ/ХГВ відбувається взаємний вплив вірусів. З одного боку, імунодефіцит призводить до збільшення вірусного навантаження HBV, що, у свою чергу, індукує фіброз або веде до реактивації вірусу гепатиту В, а з іншого боку, відновлення імунітету може призвести до розвитку тяжкого захворювання печінки [14, 18]. Як зазначалось раніше, вагомим для моніторингу ХГВ та прогнозування наслідків лікування є кількісне визначення сироваткового HBsAg поряд із рівнем ДНК HBV, як вказано в провідних міжнародних рекомендаціях [8, 15]. Однак питання моніторингу рівнів сироваткового HBsAg у хворих на ХГВ, які отримують терапію нуклеоз(т)идними інгібіторами зворотної транскриптази, а надто у хворих із коінфекцією ВІЛ/ХГВ, вивчалось менше [10].
Тому метою даного дослідження було визначення динаміки вмісту HBsAg у сироватці крові хворих на коінфекцію ВІЛ/ХГВ під впливом високоактивної антиретровірусної терапії (ВААРТ).
Матеріали та методи
У дослідження було включено 58 пацієнтів із коінфекцією ВІЛ/ХГВ, які перебували на диспансерному обліку в КЗ «Вінницький центр профілактики та боротьби зі СНІДом», серед яких 56,9 % становили чоловіки та 43,1 % — жінки. Середній вік обстежених пацієнтів становив 35,70 ± 1,42 року, серед них 33 (56,9 %) чоловіки віком 38,70 ± 1,25 року та 25 (43,1 %) жінок віком 31,60 ± 1,29 року.
Усі пацієнти були розподілені на три групи: хворі на ВІЛ/ХГВ, які не отримували лікування, хворі на ВІЛ/ХГВ, які отримували лікування менше 6 міс., та хворі на ВІЛ/ХГВ, які отримували лікування понад 6 міс. Середня тривалість лікування в групі хворих, які отримували лікування менше 6 місяців, становила 4,3 ± 0,3 місяця, а в групі хворих, які отримували лікування понад 6 місяців, становила 24,8 ± 3,7 місяця.
Діагноз ВІЛ-інфекція було встановлено на підставі наявності антитіл до ВІЛ із проведенням подальшої верифікації методом імуноферментного аналізу та виявлення ВІЛ у плазмі крові методом полімеразної ланцюгової реакції (ПЛР), клінічних та епідеміологічних даних. Діагноз ХГВ було встановлено на підставі визначення HBsAg, ДНК HBV методом ПЛР, клінічних та епідеміологічних даних. Додатково було проведено тестування крові хворих на антитіла до HCV та HDV для того, щоб виключити з дослідження пацієнтів, інфікованих іншими парентеральними гепатитами.
Хворі, які входили до груп лікування, отримували нуклеоз(т)идні інгібітори зворотної транскриптази, що входили в схеми ВААРТ із подвійною активністю щодо ВІЛ та ХГВ, а саме: тенофавір (TDF) + емтрицитабін (FTC).
Усім хворим було здійснено: кількісне визначення HBsAg (МО/мл), наявності ДНК HBV (МО/мл), рівня (АЛТ) (Од/л). Кількісне визначення HBsAg у сироватці крові виконувалось методом імунохемілюмінесценції за допомогою тест-системи HBsAg Architect Kit (6C36) компанії Abbott Laboratories із використанням автоматичного аналізатора Architect (чутливість — 0,05 МО/мл). Визначення ДНК HBV проводилось методом ПЛР із використанням тест-системи «АмплиСенс® HBV-FL» за допомогою системи ПЛР у реальному часі Bio-Rad iQ-5 (чутливість — 50 МО/мл). Визначення активності АЛТ проводилось кінетичним методом за допомогою автоматичного біохімічного аналізатора Vitalab Flexor (референтне значення — до 41 Од/л).
Статистична обробка отриманих результатів проводилась за допомогою пакета програм Statistica 6.0 із використанням параметричних і непараметричних методів оцінки отриманих результатів.
Результати
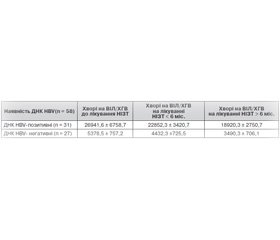
Згідно з отриманими нами результатами (табл. 1), до лікування визначався вірогідно вищий рівень НBsAg в осіб із наявністю ДНК HBV у сироватці крові. Даний показник був у 5 разів вищий, ніж у хворих із коінфекцією, у крові яких не було виявлено ДНК HBV. Така тенденція зберігалася й під час лікування: особи, у крові яких визначалась ДНК HBV, мали в 5,1 та 5,4 раза вищий рівень НBsAg порівняно із тими, у кого ДНК HBV не визначалась, через 6 місяців та у строки понад 6 місяців відповідно.
Проведення терапії із застосуванням НІЗТ призводило до поступового зниження сироваткового рівня НBsAg в обох групах. Так, серед ДНК HBV-позитивних осіб даний показник зменшився в 1,17 та у 1,42 раза через 6 місяців та в строки понад 6 місяців від початку лікування відповідно. Ще більш суттєве зниження рівня НBsAg спостерігалося в ДНК HBV-негативних хворих — у 1,21 та 1, 54 раза.
Наступним кроком нашого дослідження було визначення рівнів HBsAg у сироватці крові хворих із коінфекцією залежно від біохімічної активності (табл. 2).
Встановлено, що сироватковий рівень HBsAg був вірогідно вищим у групі хворих із початковою підвищеною біохімічною активністю, незважаючи на лікування (р < 0,001). Так, на початку лікування він був вищим в 1,7 раза, при лікуванні менше 6 місяців — у 2,2 раза та при лікуванні понад 6 місяців — у 2,5 раза.
Обговорення результатів
Після проведених досліджень із визначення кількісного рівня сироваткового HBsAg, ДНК HBV та рівня АЛТ у хворих на коінфекцію ВІЛ/ХГВ встановлено, що серед ДНК HBV-позитивних пацієнтів визначається вірогідно вищий (р < 0,001) середній показник сироваткового HBsAg порівняно із ДНК HBV-негативними хворими як на початку, так і впродовж терапії. Даний результат подібний до того, що був отриманий Р. Marcellin et al. щодо ВІЛ-негативних хворих на ХГВ [15]. Тобто більший термін лікування із застосуванням НІЗТ за умови відсутності ДНК вірусу гепатиту В у крові характеризується більш низькими рівнями сироваткового HBsAg із тенденцією до сероконверсії за HBsAg [6, 10, 18].
Отримані результати додатково підтверджуються даними табл. 2, у якій показано, що сироваткові рівні HBsAg доцільно зіставляти з показником АЛТ: у пацієнтів із рівнем АЛТ, що перевищує норму, визначається вищий середній показник сироваткового HBsAg (р < 0,001), що відповідає даним літературних джерел [7, 17].
Висновки
У ДНК HBV-позитивних пацієнтів із коінфекцією визначається в 5 разів вищий середній показник сироваткового HBsAg порівняно з ДНК HBV-негативними хворими.
У коінфікованих спостерігається поступове зниження рівня сироваткового HBsAg у 1,17–1,54 раза під впливом тривалої терапії НІЗТ, незважаючи на наявність або відсутність ДНК HBV.
Кількісне визначення сироваткового HBsAg може застосовуватись не тільки з метою моніторингу природного перебігу ХГВ, але також і як маркер ефективності противірусної терапії.
1. ВІЛ-інфекція в Україні. Інформаційний бюлетень. — 2014. — № 40. — С. 3–13.
2. Гепатит В и ВИЧ-инфекция: тактика ведения пациентов с коинфекцией [Электронный ресурс] / Клинический протокол для Европейского региона ВОЗ (обновленная версия) // Всемирная организация здравоохранения. — 2011. — Режим доступа к протоколу: http// www.euro.who.int/PubRequest?language=Russian.
3. Дудина К.Р. Динамическое определение количественного содержания HBsAg в крови в сопоставлении с уровнем вирусной нагрузки у пациентов с хронической HBV-моноинфекцией / К.Р. Дудина, О.О. Знойко, С.А. Шутько и др. // РЖГГК. — 2011. — № 4. — С. 37–42.
4. Наказ МОЗ України № 551 «Клінічний протокол антиретровірусної терапії ВІЛ-інфекції у дорослих та підлітків» від 12.07.2010 р. — 189 с.
7. Максимов С.Л. Маркеры хронического гепатита В у больных ВИЧ-инфекцией и подходы к терапии / С.Л. Максимов, С.П. Царенко, А.В. Кравченко и др. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2010. — Т. XX, № 5. — С. 22–26.
8. Ahn H.A. Quantification of HBsAg: Basic virology for clinical practice / Edited by Sang Hoon Ahn // World Journal of Gastroenterology. — 2011. — Vol. 17(3). — P. 283–289.
9. Audsley J. Factors associated with elevated ALT in an International HIV/HBV co-infected cohort on long-term HAART / Jennifer Audsley, Eric C. Seaberg, Joe Sasadeusz et al. // PLoS one. — 2011. — Vol. 6(11). — P. 1–7.
10. Brook G. British HIV Association guidelines for the management of co-infection with HIV-1 and hepatitis B or C virus / G. Brook, J. Main, M. Nelson et al. // HIV Medicine. — 2010. — Vol. 11. — P. 1–30.
11. Brunetto M.R. A new role for an old marker, HBsAg / Maurizia Rossana Brunetto // Journal of Hepatology. — 2010. — Vol. 52. — P. 475–477.
12. Buti M. Quantification of hepatitis B virus HBsAg: clinical implications / Buti M., Rodríguez Frías F., Esteban R. // Medicina Clinica. — 2012. — Vol. 138(11). — P. 483–488.
13. Emiroglu N. Viral hepatitis burden and policy directions in the European region of WHO / Nedret Emiroglu // Summit Conference on Hepatitis B and C. — 14–15 October 2010. — Brussels. — 20 p.
12. Kosi L. Five-year on-treatment efficacy of lamivudine-, tenofovir- and tenofovir + emtricitabine-based HAART in HBV-HIV–coinfected patients / Kosi L., Reiberger T., Payer B.A. et al. // Journal of Viral Hepatitis. — 2012. — Vol. 19(11). — P. 801–810.
13. Miailhes P. Impact of highly active antiretroviral therapy (HAART) on the natural history of hepatitis B virus (HBV) and HIV coinfection: relationship between prolonged efficacy of HAART and HBV surface and early antigen seroconversion / Miailhes P., Trabaud M.A., Pradat P. et al. // Clinical Infectious Diseases. — 2007. — Vol. 45(5). — P. 624–632.
14. Mallet V. The impact of human immunodeficiency virus on viral hepatitis / Vincent Mallet, Anaıs Vallet-Pichard, Stanislas Pol et al. // Liver International. — 2011. — Vol. 1. — P. 135–139.
15. Marcellin P., Buti M., Gane E.J., Krastev Z., Flisiak R., Germanidis G. et al. Five years of treatment with tenofovir DF (TDF) for chronic hepatitis B (CHB) infection is associated with sustained viral suppression and significant regression of histological fibrosis and cirrhosis // Hepatology. — 2011. — 54. — 1011A.
16. Martinot-Peignoux M. The role of HBsAg quantification for monitoring natural history and treatment outcome / Michelle Martinot-Peignoux, Martine Lapalus, Tarik Asselah et al. // Liver International. — 2013. — Vol. 1. — P. 125–132.
17. Papatheodoridis G. EASL Clinical Practice Guidelines: Management of chronic hepatitis B virus infection / G. Papatheodoridis, M. Buti, M. Cornberg et al. // Journal of Hepatology. — 2012. — Vol. 57. — Р. 16–185.
18. Pol S. Management of HBV in immunocompromised patients / Stanislas Pol // Liver International. — 2013. — Vol. 1. — P. 182–187.

/18/18.jpg)