Журнал «Актуальная инфектология» 3 (4) 2014
Вернуться к номеру
Роль Clostridium perfringens у формуванні синдрому ураження кишечника у дітей та можливості медикаментозної корекції
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
У роботі показано особливості перебігу клостридіозу, зумовленого Clostridium perfringens, у дітей різних вікових груп з урахуванням титру збудника у фекаліях та патогенетично обґрунтовано можливості етіотропної терапії.
В работе показаны особенности течения клостридиоза, вызванного Clostridium perfringens, у детей разных возрастных групп с учетом титра возбудителя в фекалиях и патогенетически обоснованы возможности этиотропной терапии.
The article showed the features of clostridiosis course, caused by Clostridium perfringens, in children of different age groups taking into account the dose of pathogen in feces and pathogenetically grounded possibilities of etiological therapy.
клостридіоз, діти, ніфуратель.
клостридиоз, дети, нифуратель.
clostridiosis, children, nifuratelum.
Статья опубликована на с. 12-14
Клостридіоз — це гостра антропонозна анаеробна інфекція, для якої характерним є ентеральний шлях інфікування.
Клостридії (лат. clostridium) — рід грампозитивних спороносних бактерій, що дуже поширені у ґрунті, випорожненнях людей та тварин. Клостридії входять до складу нормальної мікрофлори людини [1, 2], проте деякі види клостридій можуть бути причиною захворювань. У калі здорових людей виявляються такі титри клостридій:
— у дітей віком до 1 року — до 103 КУО/г;
— у дітей віком понад 1 рік і дорослих віком до 60 років — до 105 КУО/г;
— у дорослих віком понад 60 років — до 106 КУО/г [2, 3].
Підвищена концентрація клостридій указує на процеси гниття, що відбуваються в кишковому тракті, за рахунок яких організм перевантажується токсичними продуктами реакцій обміну речовин. Унаслідок однотипного харчування, недостатності травлення і процесів всмоктування накопичується надмірна кількість живильних речовин (білка, жирів) [4, 5]. Особливістю клостридій і захворювань, викликаних ними, є вироблення токсинів і формування симптомів, пов’язаних із ними [2, 6].
Clostridium perfringens можуть викликати харчову токсикоінфекцію, причиною якої є продукований Clostridium perfringens токсин. Отруєння токсином клостридій виникає після вживання продуктів (м’ясних продуктів домашнього виготовлення, м’ясних та рибних консервів), що містили високий титр клостридій (Cl.perfringens) і токсинів, вироблених означеними мікроорганізмами. У кишечнику токсини пошкоджують слизову оболонку, порушують функцію всмоктування, при проникненні в кров досягають різних органів-мішеней та вступають у зв’язок із мітохондріями клітин печінки, нирок, селезінки, легенів. Токсини ушкоджують також судинну стінку, що супроводжується геморагічними явищами. Захворювання характеризується тяжким перебігом і високою летальністю [3, 4, 7].
Метою роботи було вивчення зв’язку різних концентрацій Clostridium perfringens у фекаліях хворих на гострі кишкові інфекції (ГКІ) дітей різного віку з характером перебігу захворювання та можливостей корекції патологічних зсувів, що виникли.
Матеріали та методи дослідження
Для реалізації поставленої мети нами було проведено ретроспективний аналіз історій хвороб 71 дитини, які отримували лікування з приводу ГКІ в обласній інфекційній клінічній лікарні Запорізької облдержадміністрації і при дослідженні калу яких було виділено Clostridium perfringens у різних концентраціях.
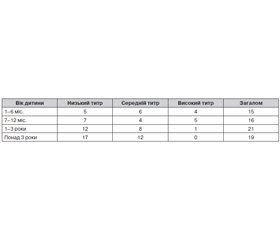
Серед обстежених було 40 дівчаток (56,3 %) та 31 хлопчик (43,7 %). За віком діти групи спостереження були розподілені так: 15 хворих були віком 1–6 міс. (21,1 %), 16 — 7–12 місяців (22,5 %), 21 — 1–3 роки (29,6 %) та 19 — 3–6 років (26,8 %).
Проведено аналіз особливостей перебігу ГКІ залежно від наявності Clostridium perfringens та концентрації збудника. При цьому за низьку кількість Clostridium perfringens у фекаліях визнавали титр до 103 КУО/г, середню — 104–105 КУО/г, високу — понад 105 КУО/г.
Всі діти групи спостереження пройшли поглиблене клініко-біохімічне обстеження з вивченням показників загального аналізу крові, рівня креатиніну та сечовини, натрію і калію крові, білірубіну, його фракцій та АЛТ, ацетону сечі тощо. Крім того, фекалії дітей, які знаходилися під нашим спостереженням, крім загальноприйнятого бактеріологічного дослідження, піддавалися визначенню титру наявної умовно-патогенної флори.
Статистична обробка отриманих результатів виконана методами варіаційної статистики, прийнятими в медицині, із застосуванням критеріїв Стьюдента та Фішера.
Результати та їх обговорення
Кількість дітей різного віку, які перебували під нашим спостереженням, із різним титром Cl.perfringens наведена в табл. 1. Як видно з даних табл. 1, у загальній популяції досліджуваних дітей домінували хворі, які мали низький та середній титр Cl.perfringens у фекаліях.
Індивідуальний аналіз перебігу захворювання у дітей усіх вікових груп показав, що зростання титру Cl.perfringens у фекаліях супроводжувалося збільшенням тяжкості перебігу гострої кишкової інфекції. Проте цей факт по-різному відбивався на клінічній картині хвороби.
У переважної більшості дітей раннього віку захворювання починалося з неспокою (52; 100 %) та болю в животі (52; 100 %). Швидко наростала загальна слабкість (52; 100 %), випорожнення частішали до 20 разів на добу, ставали рясними, водянистими (48; 92,3 %), інколи набували вигляду рисового відвару (4; 7,7 %). Рясна блювота й рідкі випорожнення призводили до вираженого зневоднення (характерне лице, зморшкувата шкіра кистей, складки шкіри, що не розправляються, ціаноз, афонія, сухість слизових оболонок, судоми й ін.) у переважної більшості хворих (48; 92,3 %) перших 3 років життя. Слід зазначити, що вираженість діарейного синдрому в цій групі дітей напряму залежала від кількості Cl.perfringens у фекаліях пацієнтів (r = 0,78). Отже, наявність Cl.perfringens у фекаліях дітей раннього віку є несприятливим фактором для прогнозу захворювання насамперед через посилення діарейного синдрому та зневоднення.
У той же час у дітей віком від 3 до 6 років, інфікованих Cl.perfringens, захворювання на ГКІ частіше перебігало за типом токсикоінфекції (18; 94,7 %). У дебюті переважно відмічали повторне багаторазове блювання (18; 94,7 %) та підвищення температури тіла (19; 100 %) і лише на 2-гу — 3-тю добу — розвиток діарейного синдрому, що посилював явища токсикозу (15; 78,9 %). Слід зауважити, що при отруєннях, викликаних токсинами клостридій типів Е і F, розвивався некротичний ентерит (сильні болі в животі, нудота, блювота, рідкі випорожнення з домішкою крові). При цьому захворювання мало дуже тяжкий перебіг. Таким чином, інфікування Cl.perfringens дітей особливо раннього віку є небезпечним фактором, що суттєво погіршує перебіг ГКІ переважно за рахунок специфічного токсиносинтезування.
Терапія дітей, які перебували під нашим спостереженням, проводилася традиційно за 3 напрямками: етіотропним, патогенетичним та симптоматичним. Патогенетична терапія передбачала комплекс заходів, спрямованих на дезінтоксикацію та регідратацію дитини, призначення етеросорбентів. Антибактеріальну терапію проводили у вікових дозах всередину або внутрішньовенно з урахуванням толерантності до ентеральної загрузки та тяжкості перебігу захворювання. Вибір антибактеріального препарату базувався на знанні того факту, що всі штами Cl.perfringens мають високу чутливість до ванкоміцину (друга лінія), а більшість — до метронідазолу (перша лінія), уреїдопеніцилінів, карбапенемів, цефалоспоринів 2–3-го покоління (друга лінія).
У той же час слід зазначити, що препарати першої лінії мають певні недоліки, що можуть проявитися небажаними явищами під час терапії. Тому пошук нових препаратів, які можливо за певних умов використовувати як стартову терапію, є актуальним. З огляду на це нашу увагу привернув препарат Макмірор. Препарат має малу частоту побічних явищ (добра переносимість у межах 98 %), практично не викликає дискомфорту з боку шлунково-кишкового тракту (що дуже важливо для дітей в умовах його ураження) та алергічних реакцій. У хімічній формулі ніфурателю є тіоефірна група, завдяки якій суттєво розширюється спектр протимікробної і протипротозойної дії препарату і не формується резистентність до нього. На відміну від метронідазолу і фуразолідону, в елімінації яких бере участь печінка, Макмірор практично повністю елімінується нирками й не мобілізує дезінтоксикаційні резерви печінки. Період напіввиведення препарату достатньо великий, що дозволяє застосовувати Макмірор 2 рази на добу. Препарат застосовують дорослим по 400 мг (2 табл.) 2–3 рази/добу, дітям — із розрахунку 15 мг/кг 2 рази/добу.
Висновки
1. Зростання титру Cl.perfringens у фекаліях супроводжується збільшенням тяжкості перебігу гострої кишкової інфекції.
2. Наявність Cl.perfringens у фекаліях дітей раннього віку є несприятливим фактором для прогнозу захворювання насамперед через посилення діарейного синдрому та зневоднення.
3. Застосування Макмірору як стартової терапії клостридіозу (при можливості ентеральної терапії) є перспективним та патогенетично обґрунтованим.
1. Андрейчин М.А. Бактериальные диареи / М.А. Андрейчин, О.Л. Ивахив. — К.: Здоров’я, 1998. — 412 c.
2. Han S.H. Epidemiology and Clinical Features of Toxigenic Culture-confirmed Hospital-onset Clostridium difficile Infection: A Multicenter Prospective Study in Tertiary Hospitals of South Korea / Han S.H., Kim H., Lee K., Jeong S.J., Park K.H., Song J.Y., Seo Y.B., Choi J.Y., Woo J.H., Kim W.J., Kim J.M. // J. Med. Microbiol. — 2014 Sep 3. pii: jmm.0.070672-0. doi: 10.1099/jmm.0.070672-0. [Epub ahead of print]/
3. Іванько О.Г. Кишковий клостридіоз як проблема сучасної педіатрії / О.Г. Іванько, О.А. Радутна, М.В. Пацера // Педіатрія, акушерство та гінекологія. — 2007. — № 4. — С. 119.
4. Kassam Z. Inflammatory Bowel Disease Cause-specific Mortality: A Primer for Clinicians / Kassam Z., Belga S., Roifman I., Hirota S., Jijon H., Kaplan G.G., Ghosh S., Beck P.L. // Inflamm. Bowel. Dis. — 2014 Sep 2. [Epub ahead of print].
5. Гаркуша С.Є. Деякі гістологічні та гістохімічні зміни в легенях поросят, які загинули від кишкового клостридіозу / С.Є. Гаркуша // Вісн. Полтав. держ. аграр. акад. — 2010. — № 4. — С. 116–117.
6. Stanley D. Differential Responses of Cecal Microbiota to Fishmeal, Eimeria and Clostridium perfringens in a Necrotic Enteritis Challenge Model in Chickens / Stanley D., Wu S.B., Rodgers N., Swick R.A., Moore R.J. // PLoS One. — 2014 Aug. 28. — 9(8). — e104739. doi: 10.1371/journal.pone.0104739. eCollection 2014.
7. Сидорчук Л.І. Колонізаційна резистентність слизової оболонки дистального відділу тонкої кишки спленектомованих білих щурів / Л.І. Сидорчук // Буков. мед. вісн. — 2011. — Т. 15, № 1. — С. 150–154.

/22/22.jpg)