Журнал «Травма» Том 15, №4, 2014
Вернуться к номеру
Динаміка концентрації молекул середньої маси в пацієнтів із тяжкою поєднаною торакальною травмою в гострому періоді травматичної хвороби
Авторы: Ступницький М.А., Жуков В.І., Горбач Т.В., Павленко А.Ю., Білецький О.В. - Харківський національний медичний університет, кафедра біохімії
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
До речовин, що відповідають за розвиток ендотоксикозу за різних патофізіологічних станів, відносяться молекули середньої маси. Метою даної роботи було дослідження динаміки концентрації фракцій молекул середньої маси в плазмі крові пацієнтів із тяжкою поєднаною торакальною травмою в гострому періоді травматичної хвороби. Обстежені 73 пацієнти чоловічої статі віком від 20 до 68 років із тяжкою поєднаною травмою грудної клітки. Пацієнти були розподілені на 2 групи: пацієнти, які видужали, та пацієнти з летальним кінцем травматичної хвороби. Забір крові виконували в 3 етапи: на 1-шу — 2-гу, 3-тю — 4-ту та 5–6-ту добу після травми. Молекули середньої маси визначали в плазмі крові пацієнтів спектрофотометричним методом. У пацієнтів, які видужали, динаміка концентрації, пептидної фракції та фракції з ароматичними групами характеризується зростанням на 1-шу — 2-гу добу після травми з подальшою нормалізацією. У пацієнтів із летальним кінцем травматичної хвороби протягом усього раннього посттравматичного періоду зберігається більш значний рівень ендогенної інтоксикації порівняно з групою пацієнтів, які видужали. Динаміка ароматичної фракції молекул середньої маси зазнає більш значних коливань протягом раннього посттравматичного періоду, особливо в групі пацієнтів із летальним кінцем травматичної хвороби, що, найімовірніше, пов’язано з більш складними механізмами їх детоксикації. Концентрації фракцій молекул середньої маси здатні відображати ступінь ендогенної інтоксикації, а також можуть слугувати додатковими маркерами оцінки прогнозу в пацієнтів із тяжкою поєднаною торакальною травмою.
К веществам, которые ответственны за развитие эндотоксикоза при разных патофизиологических состояниях, относятся молекулы средней массы. Целью данной работы было исследование динамики концентрации фракций молекул средней массы в плазме крови пациентов с тяжелой сочетанной торакальной травмой в остром периоде травматической болезни. Обследованы 73 пациента мужского пола в возрасте от 20 до 68 лет с тяжелой сочетанной травмой грудной клетки. Пациенты были разделены на 2 группы: пациенты, которые выздоровели, и пациенты с летальным концом травматической болезни. Забор крови выполняли в 3 этапа: на 1–2-е, 3-и — 4-е и 5–6-е сутки после травмы. Молекулы средней массы определяли в плазме крови пациентов спектрофотометрическим методом. У пациентов, которые выздоровели, динамика концентрации, пептидной фракции и фракции с ароматическими группами характеризуется ростом на 1–2-е сутки после травмы с последующей нормализацией. У пациентов с летальным результатом травматической болезни на протяжении всего раннего посттравматического периода сохраняется более значительный уровень эндогенной интоксикации по сравнению с группой пациентов, которые выздоровели. Динамика ароматической фракции молекул средней массы испытывает более значительные колебания на протяжении раннего посттравматического периода, особенно в группе пациентов с летальным результатом травматической болезни, что, вероятнее всего, обусловлено более сложными механизмами их детоксикации. Уровни фракций молекул средней массы способны отображать степень тяжести эндогенной интоксикации, а также могут служить дополнительными маркерами оценки прогноза у пациентов с тяжелой сочетанной торакальной травмой.
The substances which are responsible for the development of endotoxicosis in various pathophysiological conditions include average weight molecules. The objective of this work was to study the dynamics of the concentration of average weight molecules fractions in the blood plasma of patients with severe concomitant thoracic injury in the acute period of traumatic disease. The study involved 73 male patients aged 20 to 68 years with severe concomitant injury of the chest. Patients were divided into 2 groups: patients who have recovered and patients with a fatal outcome of traumatic disease. Blood sampling was carried out in 3 stages: on the 1st — 2nd, 3rd — 4th and 5th — 6th days after the injury. Average weight molecules were measured in the blood plasma of patients using spectrophotometric method. In patients who have recovered the dynamics of the concentration, peptide fractions and fractions with aromatic groups is characterized by growth on the 1st — 2nd days after injury with subsequent normalization. In patients with a fatal outcome of traumatic disease throughout the early post-traumatic period, endogenous intoxication was more severe in comparison with the group of patients who have recovered. Dynamics of the aromatic fraction of average weight molecules is experiencing more significant fluctuations during the early post-traumatic period, especially in patients with a fatal outcome of traumatic disease that is most likely due to more complex mechanisms of their detoxification. Concentrations of average weight molecules fractions can display the severity of endogenous intoxication, and can also serve as additional markers of prognosis in patients with severe concomitant thoracic injury.
молекули середньої маси, поєднана торакальна травма.
молекулы средней массы, сочетанная торакальная травма.
average weight molecules, concomitant thoracic injury.
Статья опубликована на с. 46-50
Вступ
Серед причин летальності працездатного населення політравма посідає перше місце [3, 16]. За даними ВООЗ, щорічно від політравми гине близько 2 мільйонів людей [7]. Торакальний компонент ушкодження в пацієнтів із політравмою реєструється до 93 % випадків у разі дорожньо-транспортних пригод, що обумовлює поліваріабельність і тяжкість перебігу травматичної хвороби [4, 10].
Період ранніх проявів травматичної хвороби характеризується розвитком органних порушень з наступною ескалацією в поліорганну недостатність у зв’язку з маніфестацією синдрому системної запальної відповіді, основною причиною якого вважають ендогенну інтоксикацію [6, 13]. Відбувається вивільнення ендогенних внутрішньо- та зовнішньоклітинних молекул, специфічно утворених у зв’язку з пошкодженням тканин, що активують імунні клітини та спричиняють розвиток запальної відповіді надмірної інтенсивності з наступними небажаними наслідками для травмованого організму [17, 18]. До таких речовин, що відповідають за розвиток ендотоксикозу за різними пітофізіологічними станами, відносяться білкові токсини — молекули середньої маси (МСМ). Це продукти білкового протеолізу внаслідок деструкції клітин і загальної спрямованості метаболізму у відповідь на гостру травму (катаболізм), що мають різноманітну біологічну активність, сприяють підвищенню в’язкості крові, порушенням мікроциркуляції, формуванню структурних ії функціональних змін біологічних мембран [5], гіпоксії та синдрому інтоксикації [11, 14]. З іншого боку, низькомолекулярні олігопептиди мають широкий спектр біологічної дії та координують виконання біологічних функцій різними органами та тканинами, можуть впливати на репаративні процеси в тканинах організму, доведена антиоксидантна властивість середньомолекулярних пептидів [8]. Клінічна картина порушень метаболізму яскраво не проявляється, особливо на ранніх етапах свого розвитку. Тому діагностика порушеного метаболізму, як правило, є запізнілою. Це приводить до констатації фактів за умов глибоко порушених і часто необоротних змін, що впливають на результат захворювання. Саме тому діагностику ендогенної інтоксикації вважають непростою і не повністю вирішеною проблемою [12].
Метою даної роботи було дослідження динаміки концентрації МСМ у плазмі крові пацієнтів із тяжкою поєднаною торакальною травмою в гострому періоді травматичної хвороби.
Матеріали та методи
Обстежені 73 пацієнти чоловічої статі віком від 20 до 68 років із тяжкою поєднаною травмою грудної клітки, які перебували у відділенні анестезіології та інтенсивної терапії для пацієнтів із поєднаною травмою Харківської міської клінічної лікарні швидкої та невідкладної медичної допомоги імені проф. О.І. Мещанінова з 01.08.2008 по 01.12.2010 року. Для дослідження обирались пацієнти з поєднаною закритою травмою грудної клітки за наявності внутрішньогрудних об’ємів, удару легень, серця, переломів ребер. Пацієнти були розділені на 2 групи: 1-ша — пацієнти, які видужали, та 2-га — пацієнти з летальним кінцем травматичної хвороби. Характеристику груп пацієнтів подано в табл. 1.
Усі пацієнти отримували інтенсивну інфузійно-трансфузійну, знеболюючу, протизапальну, антибактеріальну та метаболічну терапію, профілактику стресових виразок шлунково-кишкового тракту відповідно до тяжкості стану та отриманих пошкоджень. Забір крові виконували в 3 етапи: 1-й — 1-ша — 2-га доба (10,75–33,5 години після травми); 2-й — 3-тя — 4-та доба (48–75,2 год) та 3-й — 5–6-та доба (97–122 год). Контрольну групу становили 15 здорових добровольців чоловічої статі тієї ж вікової групи. МСМ у плазмі крові визначали спектрфотометричним методом [2] в УФ-діапазоні 254 нм (пептидна фракція) та 280 нм (фракція з ароматичними групами) [9] і виражали в умовних одиницях, що кількісно дорівнюють показнику екстинкції. Статистичну обробку даних проводили за допомогою програми GraphPad Prism 5.03. Вірогідність різниці між групами визначали за допомогою тесту Mann — Whitney. Аналіз статистичної вірогідності різниці якісних ознак проводили за допомогою х2-тесту для тренду. Вірогідно значимою вважали різницю за умов P < 0,005. Дані подані як середнє арифметичне ± стандартна похибка.
Результати та їх обговорення
Як видно з табл. 1, не було виявлено відмінності між групами пацієнтів за віком, а також за типом отриманої політравми згідно з анатомічною класифікацією, проте існує вірогідна відмінність за тяжкістю отриманих пошкоджень згідно зі шкалою ISS. Пацієнти в групі з летальним результатом травматичної хвороби мали значно вищі показники тяжкості політравми.
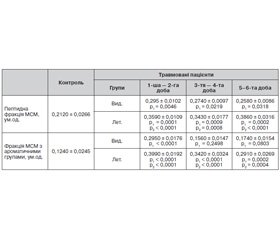
Уже на 1-шу — 2-гу добу після травми виявлено вірогідне зростання концентрації пептидної фракції МСМ у плазмі крові пацієнтів, які видужали, на 39,15 % порівняно з контрольною групою (табл. 2).
У подальшом, на 3-тю — 4-ту та 5–6-ту добу, спостерігається тенденція до нормалізації цього показника з наступним наближенням до значення норми. Відмінна ситуація складається в групі пацієнтів, у яких травматична хвороба закінчилась летально. На 1-шу — 2-гу добу після травми відмічено вірогідне зростання концентрації пептидної фракції МСМ на 69,33 % порівняно з групою контролю, що одночасно вірогідно вище на 21,69 % від показника, який отримали в групі пацієнтів, які видужали. На 3-тю — 4-ту добу виявлено незначне зниження концентрації пептидної фракції МСМ у групі пацієнтів із летальним кінцем до рівня, на 61,79 % вірогідно вищого від контрольних значень, що також вірогідно вище на 25,18 % від показника, який отримали в групі пацієнтів, які видужали, на 3-тю — 4-ту добу після травми. На відміну від пацієнтів, які видужали, у пацієнтів із летальним кінцем спостерігається різке вірогідне підвищення цього показника на 5–6-ту добу після травми на 82,07 % порівняно з групою контролю, що одночасно на 49,61 % вище від показника групи пацієнтів, які видужали.
Дещо відмінною виглядає динаміка концентрації фракції МСМ з ароматичними групами. На 1-шу — 2-гу добу після травми в групі пацієнтів, які видужали, відмічається вірогідне зростання у 2,37 раза порівняно з групою контролю. На 3-тю — 4-ту та 5–6-ту добу після травми в цій групі пацієнтів спостерігається зниження цього показника до нормальних значень, не було отримано вірогідно відмінного показника від контролю. У пацієнтів із летальним кінцем на 1-шу — 2-гу добу після травми виявлено вірогідне зростання концентрації фракції МСМ з ароматичними групами в 3,22 раза порівняно з групою контролю, що одночасно на 35,25 % вище порівняно зі значенням, отриманим в групі пацієнтів, які видужали. На 3-тю — 4-ту та 5–6-ту добу після травми спостерігається тенденція до повільного зниження даного показника, проте його значення залишаються вірогідно підвищеними відносно контролю — у 2,76 та 2,35 раза відповідно, що одночасно вірогідно вище значень, отриманих у групі пацієнтів, які видужали, — у 2,19 раза на 3-тю — 4-ту добу та на 67,24 % — на 5–6-ту добу після травми.
Ендогенну інтоксикацію визначають як неспецифічний за більшістю клініко-біохімічних й імунологічних проявів синдром невідповідності між утворенням і виведенням як продуктів нормального обміну, так і речовин порушеного метаболізму [12]. Неоднорідну динаміку концентрації різних фракцій МСМ можна пояснити наявністю різних систем організму, що відповідають за елімінацію ендогенних токсинів. Відомо, що гідрофільні низько- та середньомолекулярні речовини видаляються нирками, через шкіру, шлунково-кишковий тракт у вигляді розчинів. Гідрофобні низько- та середньомолекулярні речовини транспортуються білками та клітинами плазми крові в печінку та легені, де біотрансформуються монооксигеназною системою або зазнають змін в реакціях кон’югації з наступним видаленням через нирки, шкіру, шлунково-кишковий тракт. Окрім того, останні можуть зв’язуватися з білками плазми крові, набувати властивостей гаптенів і поглинатись клітинами імунної системи [1].
Поступовий розвиток дисфункції органів може бути відповідальним за порушення процесів елімінації токсинів із плазми крові [15]. За умов зниження функціональних можливостей органів, відповідальних за елімінацію токсичних речовин, зберігаються високі концентрації молекул середньої маси: пептидної фракції в разі розвитку гострого пошкодження нирок, дисфункції шлунково-кишкового тракту та ароматичної фракції — дисфункції печінки, легень. Порушення з боку імунної системи роблять свій окремий внесок у розвиток ендогенної інтоксикації [13–15]. З одного боку, можливі порушення елімінації токсичних речовин, з іншого — на фоні гіперактивності імунної системи, посилення процесів автоагресії та розвитку септичних ускладнень зростає продукція молекул середньої маси. Неспроможність управління інтеграцією таких процесів і визначає концепцію ендогенної інтоксикації, представляючи її як відображення наслідків порушення мікро- та макроциркуляції, газообміну та кисневого «бюджету», імунітету та протиінфекційного захисту [12].
Висновки
1. У пацієнтів, які видужали, динаміка концентрації, пептидної фракції та фракції з ароматичними групами МСМ характеризується зростанням на 1-шу — 2-гу добу після травми з подальшою тенденцією до нормалізації.
2. У пацієнтів із летальним кінцем травматичної хвороби протягом раннього посттравматичного періоду починаючи з 1–2-ї доби після травми зберігається більш значний рівень ендогенної інтоксикації порівняно з групою пацієнтів, які видужали.
3. Динаміка ароматичної фракції МСМ зазнає більш значних коливань протягом раннього посттравматичного періоду, особливо в групі пацієнтів із летальним кінцем травматичної хвороби, що, найімовірніше, пов’язано з більш складними механізмами їх детоксикації.
4. Показники концентрації МСМ здатні відображати тяжкість ендогенної інтоксикації, а також можуть слугувати додатковими маркерами оцінки прогнозу в пацієнтів із тяжкою поєднаною торакальною травмою.
1. Лабораторная диагностика синдрома эндогенной интоксикации (методические рекомендации) / В.М. Аксенова, В.Ф. Кузнецов, Ю.Н. Маслов [и др.]. — Пермь, 2005. — 39 с.
2. Габриэлян Н.И. Опыт использования показателя средних молекул в крови для диагностики нефрологических заболеваний у детей / Н.И. Габриэлян, В.И. Липатова // Лабораторное дело. — 1984. — № 3. — С. 138-140.
3. Политравма: хирургия, травматология, анестезиология, интенсивная терапия / Ф.С. Глумчер, П.Д. Фомин, Е.Г. Педаченко [и др.]. — К.: ВСИ «Медицина», 2012. — 736 с.
4. Гур’єв С.О. Проблеми надання медичної допомоги постраждалим внаслідок дорожньо-транспортних пригод / С.О. Гур’єв, С.П. Сацик // Травма. — 2012. — Т. 13, № 2. — С. 27-29.
5. Добротина Н.А. Характеристика функционального состояния мембран эритроцитов при эндогенной интоксикации у больных хроническими распространенными дерматозами / Н.А. Добротина, Т.В. Копытова, Н.А. Щелчкова // Фундаментальные исследования. — 2010. — № 2. — С. 39-44.
6. Калинкин О.Г. Травматическая болезнь / О.Г. Калинкин // Травма. — 2013. — Т. 14, № 3. — С. 59-65.
7. Поєднана травма: дожити до світанку (проблемна стаття) / О.В. Лінчевський, Д.В. Мясніков, А.В. Макаров [та ін.] // Травма. — 2012. — Т. 13, № 2. — С. 98-102.
8. Никольская В.А. Влияние окислительного стресса in vitro на уровень молекул средней массы в сыворотке крови и гемолизате эритроцитов sus scrofa / В.А. Никольская // Экосистемы, их оптимизация и охрана. — 2011. — № 4. — С. 123-126.
9. Синяченко О.В. Современные аспекты анализа синовиальной жидкости / О.В. Синяченко // Український ревматологічний журнал. — 2008. — Т. 2, № 32. — С. 30-39.
10. Усенко Л.В. Современные аспекты интенсивной терапии политравмы с превалированием торакальной травмы на догоспитальном и госпитальном этапах / Л.В. Усенко, О.В. Белоцерковец // Медицина неотложных состояний. — 2008. — № 6. — С. 35-37.
11. Диагностика эндотоксического синдрома у детей с гнойной хирургической инфекцией / П.И. Чупров, В.Л. Красилов, Б.Ю. Уханов [и др.] // Астраханский медицинский журнал. — 2008. — Т. 3, № 1. — С. 26-32.
12. Шано В.П. Синдром эндогенной интоксикации / В.П. Шано, Е.А. Кучер // Острые и неотложные состояния в практике врача. — 2011. — № 1. — С. 35-41.
13. Штейнле А.В. Патологическая физиология и современные принципы лечения тяжелых сочетанных травм (часть 1) / А.В. Штейнле // Сибирский медицинский журнал. — 2009. — Т. 1, № 3. — С. 119-127.
14. A Review of metabolic staging in severely injured patients / M. Aller, J. Arias, A. Alonso-poza [et al.] // Scand. J. Trauma. Resusc. Emerg. Med. — 2010. — Vol. 18, № 27. doi: 10.1186/1757-7241-18-27.
15. Systemic inflammation and liver injury following hemorrhagic shock and peripheral tissue trauma involve functional TLR9 signaling on bone marrow-derived cells and parenchymal cells / R. Gill, X. Ruan, C.L. Menzel [et al.] // Shock. — 2011. — Vol. 35, № 2. — P. 164-170. doi: 10.1097/SHK.0b013e3181eddcab.
16. O doente politraumatizado grave Implicações da Ruralidade na Mortalidade, Incapacidade e Qualidade de Vida / E. Gomes, D. Moreira, D. Chalo [et al.] // Acta Med. Port. — 2011. — Vol. 24, № 1. — P. 81-90.
17. Trauma is danger / P.F. Hwang, N. Porterfield, D. Pannell [et al.] // J. Transl. Med. — 2011. — Vol. 9, № 92. doi:10.1186/1479-5876-9-92.
18. Isolated blunt chest injury leads to transient activation of circulating neutrophils / T. Visser, F. Hietbrink, K.M. Groeneveld [et al.] // Eur. J. Trauma Emerg. Surg. — 2011. — Vol. 37. — P. 177-184. doi: 10.1007/s00068-010-0041-x.

/47/47.jpg)
/48/48.jpg)