Журнал «Здоровье ребенка» 6 (57) 2014
Вернуться к номеру
Назофарингеальне носійство Streptococcus рneumoniae у вихованців будинків дитини: серотиповий репертуар та чутливість до антимікробних препаратів
Авторы: Чернишова Л.І., Гільфанова А.М., Бондаренко А.В. - Кафедра дитячих інфекційних хвороб та дитячої імунології НМАПО імені П.Л. Шупика; Яновська В.В., Глушкевич Т.Г. - Бактеріологічна лабораторія ДЗ «Український центр контролю та моніторингу захворювань МОЗ України», м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Наведені результати першого в Україні дослідження частоти назофарингеального носійства пневмокока у здорових дітей до 5 років, які виховувались у будинках дитини. Показано, що серед дітей даної когорти спостерігалася практично тотальна колонізація носоглотки пневмококом (95,6 %). Домінували серотипи19F (54,8 %), 6A/B (22,5 %), 14 (4,8 %) і 23F (3,2 %). Відмічалась висока частота резистентності пневмокока до антимікробних препаратів.
Представлены результаты первого в Украине исследования частоты назофарингеального носительства пневмококка у здоровых детей до 5 лет, воспитывающихся в домах ребенка. Показано, что среди детей данной когорты наблюдалась практически тотальная колонизация носоглотки пневмококком (95,6 %). Доминировали серотипы 19F (54,8 %), 6A/B (22,5 %), 14 (4,8 %) и 23F (3,2 %). Отмечалась высокая частота резистентности пневмококка к антимикробным препаратам.
The article presents the results of the first in Ukraine investigation on the prevalence of nasopharyngeal pneumococcus carriage in healthy children up to 5 years, living in children’s homes. It is shown that the children of this cohort reported almost total nasopharyngeal colonization with pneumococcus (95.6 %). Serotypes 19F (54.8 %), 6A/B (22.5 %), 14 (4.8 %) and 23F (3.2 %) have dominated. High resistance of pneumococcus to antimicrobial agents was shown.
назофарингеальне носійство, пневмокок, будинок дитини.
назофарингеальное носительство, пневмококк, дом ребенка.
nasopharyngeal carriage, pneumococcus, children’s home.
Статья опубликована на с. 9-14
Вступ
Відомо, що Streptococcus pneumoniae залишається провідною причиною дитячої смертності у світі (O’Brien K.L., 2009). Всесвітньою організацією охорони здоров’я (ВООЗ) було підраховано, що у 2008 році пневмокок був відповідальний більше ніж за півмільйона смертей у дітей до 5 років; понад 90 % цих смертей трапились у країнах, що розвиваються (ВООЗ, 2013). S.pneumoniae є однією з основних причин таких інвазивних захворювань, як пневмонія, гнійний менінгіт, бактеріємія, а також гострого середнього отиту, синуситу та інших захворювань різної локалізації у всіх вікових групах по всьому світі (Dagan, 2009; Farha T., Thomson A.H., 2005; CDC, 2010). Вважається, що пневмокок є частиною нормальної мікрофлори носоглотки (O’Brien K.L., 2003). Хоча назофарингеальне носійство пневмокока зазвичай є безсимптомним, у деяких випадках воно стає першим кроком у розвитку бактеріального захворювання (Bogaert D., 2004). Пневмококова інфекція практично не виникає без попередньої колонізації носоглотки збудником (Taketo Otsuka, 2013). Носоглотка виступає як основний резервуар, де відбувається селекція стійких до антибіотиків штамів пневмокока (Bogaert D., 2004).
Назофарингеальне носійство пневмокока вважається важливим джерелом горизонтального поширення цього збудника в суспільстві, що передається здебільшого повітряно-крапельним шляхом (ВООЗ, 2012). Висока частота пневмококової колонізації, що коливається в межах від 27 % у розвинених країнах до 85 % у країнах, що розвиваються, і високий індекс скупченості притаманні маленьким дітям, ця група вважається основним резервуаром та найбільш важливим вектором для горизонтального поширення пневмококів у суспільстві (Tzanakaki G., 2007; Tyrrell G.J. et al., 2009; Stancil J.M., 2009; Soley C., 2009; Kadioglu A., 2008; ВООЗ, 2012). Найбільш вразливими є діти, які виховуються в закритих дитячих колективах, зокрема в будинках дитини. По-перше, вони мають підвищений ризик пневмококових захворювань через супутні хронічні захворювання; по-друге, часто госпіталізуються та отримують антибіотики (Дмитраченко Т.І., 2013). За даними Міністерства охорони здоров’я (МОЗ), станом на 2014 рік в Україні налічується 46 будинків дитини, у яких проживає до 5 тисяч дітей.
Згідно з рекомендаціями Центру контролю захворювань Сполучених Штатів (CDC, 2010), підвищений ризик пневмококових інфекцій мають діти з хронічними хворобами серця (уродженими вадами серця та серцевою недостатністю з ціанозом) та легень (вроджені аномалії, бронхіальна астма, муковісцидоз, бронхоектатична хвороба та ін.), цукровим діабетом першого типу, назальною ліквореєю та встановленим кохлеарним імплантом, діти з анатомічною або функціональною аспленією, імунодефіцитними станами (ВІЛ-інфіковані; пацієнти з хронічною хворобою нирок і нефротичним синдромом; хворі, які потребують лікування імуносупресивними препаратами чи застосування променевої терапії, включаючи злоякісні новоутворення, лейкемію, лімфому та хворобу Ходжкіна, трансплантацію кісткового мозку та органів; діти з уродженим імунодефіцитом, включаючи дефіцит В- і Т-лімфоцитів, комплементу, порушення фагоцитозу). До вразливого контингенту щодо пневмококової інфекції, якому, згідно з Наказом МОЗ України від 16.09.2011 № 595, показана додаткова імунізація проти пневмокока за станом здоров’я, належать діти з хронічними захворюваннями печінки та хворі на туберкульоз (інфікування мікобактеріями туберкульозу).
Імунізація є найбільш надійним та ефективним засобом профілактики пневмококової інфекції. Основними захисними антигенами S.pneumoniae є полісахариди капсули, проте їх різноманітність (93 типи, описані на даний час) є серйозною перешкодою на шляху розробки вакцини. Зареєстровані в Україні пневмококові кон’юговані вакцини (ПКВ) включають серотипи, що визнані найбільш актуальними для виникнення інвазивних пневмококових захворювань по всьому світі (CDC, 2010) та з більшою ймовірністю, ніж інші, пов’язані зі стійкістю до ліків (ВООЗ, 2012). Використання ПКВ у дітей призводить до одночасного зниження інвазивних пневмококових захворювань та носійства вакцинальних серотипів пневмокока (Fleming-Dutra K.E., 2014). Зниження назофарингеального носійства пневмокока є ключовим фактором непрямих ефектів впровадження вакцинації та створення популяційного захисту (Ray G.T., 2009). Згідно з «Типовим положенням про будинок дитини» (Наказ МОЗ України № 123 від 18.05.98 р.), одним з основних його завдань є проведення планових профілактичних та оздоровчих заходів, у т.ч. вакцинації.
Власні дані про серотиповий пейзаж S.pneumoniae, отримані під час регіональних досліджень, можуть бути важливим інструментом епідеміологічного контролю, що дозволяє прогнозувати ефективність вакцин та оцінювати їх вплив на сероепідеміологію пневмокока в країні (Rodgers G.L., 2009; Маянский А.Н., 2010; Techasaensiri C., 2010; Miller E., 2011).
З огляду на обґрунтовану доцільність вивчення регіональних особливостей поширення носійства та серотипового репертуару пневмокока у різних контингентів дітей, можливість впровадження універсальної вакцинації проти пневмокока в Україні метою нашого дослідження стало вивчення рівня назофарингеального носійства S.pneumoniae у вихованців будинків дитини, розподілу серотипів пневмокока та його чутливості до антимікробних препаратів.
Матеріали і методи дослідження
Дизайн дослідження. Для досягнення поставленої мети обстежено 68 дітей, які відповідали таким критеріям включення: мали вік від 6 місяців до 4 років 11 місяців 30 днів (або 60 місяців) на день скринінгу; були здоровими, тобто не мали на момент обстеження ознак гострого респіраторного захворювання та/або інших гострих захворювань (станів) та/або загострення хронічного захворювання (хвороби); не знаходились в інкубаційному періоді гострих інфекційних захворювань. Перевірялись такі критерії виключення: лікування антибіотиками впродовж 1 місяця; історія вакцинації будь-якою пневмококовою вакциною.
Клінічні дослідження проводились у період із жовтня по листопад 2013 року на базі 3 будинків дитини Києва та Київської області. Протокол дослідження пройшов етичну експертизу й отримав схвальний висновок. Законні представники дітей підписали форму інформованої згоди на участь у дослідженні.
У кожної залученої до дослідження дитини збирались паспортні дані, анамнез, уточнювались дані про захворювання, які ймовірно міг викликати пневмокок (гострий середній отит, пневмонія, бактеріальний менінгіт, сепсис) та медичні стани або хронічні захворювання, що асоційовані з підвищеним ризиком пневмококових інфекцій, з’ясовувалась тривалість перебування дитини в будинку дитини. Обстеження дітей проводилось за загальноприйнятою методикою клінічного дослідження.
Забір матеріалу для мікробіологічного дослідження. Зразки слизу з носоглотки у дітей бралися однократно методом глибокого трансназального мазка за допомогою двох стерильних ватних тампонів на тонкій алюмінієвій основі, один із яких (для бактеріологічного дослідження) поміщався в транспортне середовище Еймса, а інший (для ПЛР-дослідження) — у транспортне середовище для зберігання та транспортування респіраторних мазків. Протягом 24 годин зразки слизу доставлялись до лабораторії з дотриманням температурних вимог.
Мікробіологічне дослідження. Для культивації S.pneumoniae використовували 5% кров’яний і «шоколадний» агар. Посіви підлягали інкубації в термостаті з підвищеним вмістом СО2 в атмосфері (5–10 %) за температури 37 °С протягом 18–24 год. Пневмокок ідентифікували на основі морфологічних та культуральних властивостей, а також за допомогою оптохінового тесту і тест-систем STREPTOtest-16.
У випадку отримання негативного результату бактеріологічного дослідження виділялась ДНК з первинного матеріалу за допомогою набору реактивів «ДНК-сорб-АМ» з подальшим проведенням полімеразної ланцюгової реакції у реальному часі за допомогою набору реактивів Neisseria meningitidis/H.influenzae/S.pneumoniae-FL.
Позитивні зразки типували методом мультиплексної ПЛР з електрофоретичною детекцією в агарозному гелі. Для ампліфікації використовували реакційну суміш «ПЦР-смесь-2 red» з трифосфатами та праймери до 15 серотипів S.pneumoniae: 1, 3, 4, 5, 6А, 6В, 6С, 7F, 9V, 14, 18C, 19A, 19F, 20, 23F.
Чутливість до антимікробних препаратів визначалась диско-дифузійним методом на середовищі Мюллера — Хінтона з додаванням 5% дефібринованої крові. Використовували диски з антимікробними препаратами: еритроміцин (15 мкг), азитроміцин (15 мкг), левофлоксацин (5 мкг), ципрофлоксацин (5 мкг), ко-тримоксазол (1,25/23,75 мкг), хлорамфенікол (30 мкг). Процедуру постановки дослідів, облік та інтерпретацію результатів здійснювали згідно з наказом МОЗ України від 05.04.2007 № 167. Рутинний скринінг на чутливість до пеніциліну проводився диском з 1 мкг оксациліну. Штами S.pneumoniae із зоною затримки росту 20 мм і більше розцінювались як чутливі до пеніциліну та всіх b-лактамних антибіотиків. Штами пневмокока, що були резистентними (стійкими) або проміжними (помірно стійкими) до 3 чи більше класів антибіотиків, вважались мультирезистентними.
Використовувались такі методи статистичного аналізу: порівняння поширеності назофарингеального носійства пневмокока у двох незалежних вибірках із використанням параметричного критерію Z; з метою аналізу впливу різних медико-соціальних факторів на частоту колонізації носоглотки пневмококом використовувались таблиці спряженості та критерій x2 Пірсона. Вибіркові параметри, що наводяться далі в статті, мають такі позначення: Q1 та Q3 — нижній і верхній квартилі (25-й і 75-й процентилі), 95% ДІ — довірчий інтервал для вірогідності 95 %, Z — критерій Z, x2– критерій хі-квадрат для v ступенів свободи, р — досягнутий рівень значимості. Критичне значення рівня значимості приймалося рівним 5 %. Отримані в процесі дослідження дані були оброблені методом математичної статистики за допомогою стандартних пакетів програм Microsoft Excel та IBM SPSS Statistics 20.
Результати та їх обговорення
Під спостереженням знаходились 41 хлопчик та 27 дівчаток. Медіана віку становила 26 місяць, причому вік 50 % дітей знаходився у проміжку від 12 до 40 місяців (Q1 і Q3).
За допомогою бактеріологічного методу вдалось виділити 32 культури S.pneumoniae. Додаткове проведення ПЛР дозволило ідентифікувати ще 33 штами. Отже, використання методу ПЛР допомогло у 2 рази підвищити виявлення дітей, носоглотка яких колонізована пневмококом. Таким чином, всього було виявлено 65 носіїв пневмокока, і частота його назофарингеального носійства становила 95,6 % (95 % ДІ: 90,7; 100).
Аналізуючи вплив віку на частоту носійства пневмокока, жодної закономірності виявлено не було, а різниця в показниках швидше за все була випадковою. Відмінність у частоті носійства залежно від гендерної приналежності була статистично не значимою (Z = 0,89; p > 0,2).
При порівнянні будинків дитини, розміщених у різних районах Київської області, виявилось, що відмінність у поширеності носійства пневмокока в них була неістотною (x2(2) = 0,08; p > 0,5), тому отримані дані можна екстраполювати на інші заклади такого типу. Будинок дитини № 2 Київської області мав флігельний тип забудови корпусів для створення умов проживання, наближених до домашніх. Проте такий організаційний хід не мав переваг перед централізованим типом забудови, який був у будинках дитини № 1 та № 3, щодо запобігання колонізації носоглотки дітей патогенними бактеріями.
Частота носоглоткового носійства пневмокока не залежала від тривалості (стажу) перебування дитини в закритому колективі. Серед 4 дітей, які перебували в будинках дитини близько місяця, усі були носіями пневмокока. Отже, профілактичні заходи щодо пневмококової інфекції повинні проводитись відразу після надходження дитини до дитячого закладу. Також слід враховувати, що більшість дітей (76 %) потрапили в закриті дитячі колективи до двох років. Діти такого віку особливо сприйнятливі до інфекцій через вікові особливості гуморального набутого імунітету, тому для специфічної профілактики пневмококової інфекції можуть використовуватись лише кон’юговані вакцини.
Серед вихованців будинків дитини 39,7 % мали підвищений ризик пневмококової інфекції: 29,4 % дітей мали вроджену ваду серця, 2,9 % — рецидивний бронхіт, 2,9 % були тубінфікованими, ще у 4,4 % дітей спостерігалось поєднання захворювань (вродженої вади серця та рецидивного бронхіту — 2,9 %, вродженої вади серця та тубінфікування — 1,5 %).
Двоє з 42 дітей з відомим анамнезом життя (2,4 %) мали в минулому гострий гнійний середній отит, обидва епізоди якого трапились до дворічного віку під час перебування в будинку дитини. В обох дітей епізод отиту розвинувся протягом перших двох місяців перебування в закритому колективі. У 7 з 43 дітей (16,3 %) була в анамнезі позагоспітальна пневмонія, причому 86 % випадків припадали на перший рік життя. Виявилось, що 71 % пневмоній розвинулись у дітей безпосередньо в будинку дитини, причому у 100 % випадків протягом перших трьох місяців перебування в закладі. Тобто «новобранці» віком до 1 року мають найвищий шанс захворіти на пневмонію та гострий середній отит. Близько половини дітей, які мали в анамнезі пневмонію або гострий середній отит, належали до групи ризику щодо пневмококової інфекції.
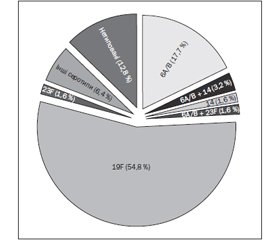
Для вивчення розподілу серотипів було протиповано 62 штами пневмокока. Репертуар серотипів пневмококів, виділених у дітей з будинків дитини наведений на рис. 1.
/12/12.jpg)
Як видно з рис. 1, у будинках дитини відмічався вузький серотиповий репертуар. Всього було ідентифіковано 4 різних серотипи: 19F (54,8 %), 6A/B (22,5 %), 14 (4,8 %) і 23F (3,2 %). У 5 % носіїв пневмокока зустрічалось поєднання відразу 2 серотипів: 6А/В + 14 (3,2 %), 6А/В + 23F (1,6 %). Носоглотка 80,8 % носіїв колонізована серотипами, що відповідальні за розвиток інвазивних пневмококових захворювань та входять до ПКВ. Серотиповий репертуар залежно від будинку дитини представлений на рис. 2.
Відмічена відмінність у розподілі серотипів пневмокока залежно від закладу, у якому виховуються діти. Найбільша серотипова варіабельність штамів пневмокока спостерігалась у будинку дитини столиці, найменша — у будинку дитини № 3 (м. Боярка). При оцінці даних діаграми видно, що в будинку дитини № 3 100 % дітей були носіями штамів, асоційованих з інвазивними пневмококовими інфекціями. Серотип 19F домінував у закладах Київської області, у столичному будинку дитини він на 8 % поступався серотипам 6А/В.
Оскільки носоглотка переважної кількості дітей, які виховуються в будинках дитини, колонізована серотипами, асоційованими зі стійкістю до ліків, ми проаналізували рівень резистентності пневмококів до найбільш актуальних антимікробних препаратів (рис. 3).
2/3 штамів пневмокока були резистентні до пеніциліну. Це означає, що у разі реалізації носоглоткового носійства пневмокока в захворювання лише третина дітей може отримувати b-лактамні антибіотики без додаткового визначення мінімальної інгібуючої концентрації та з очікуваним позитивним ефектом.
Як препарат вибору для лікування пневмококової інфекції широко застосовується азитроміцин. Проте існує висока загроза його неефективного використання майже в кожної 4-ї дитини, яка проживає в будинку дитини.
Враховуючи високі показники резистентності, такі антибактеріальні препарати, як еритроміцин, ципрофлоксацин та ко-тримоксазол, не повинні застосовуватись як системно, так і місцево у разі розвитку бактеріальної інфекції (кон’юнктивіту, аденоїдиту), ймовірно, спричиненої пневмококом.
Як препарати резерву при лікуванні пневмококової інфекції у дітей, які проживають у будинку дитини, можуть застосовуватись хлорамфенікол та левофлоксацин, оскільки 94 % штамів пневмококів зберігають до них чутливість.
Більше половини (56 %) штамів пневмокока виявились мультирезистентними. Поширеність резистентних до антибіотиків штамів пневмокока залежно від колективу подана на рис. 4.
/13/13.jpg)
Як видно з рис. 4, чутливість пневмокока до антимікробних препаратів залежить від конкретного закладу. Загрозлива ситуація спостерігається в будинках дитини Київської області, оскільки найбільш уживані в педіатричній практиці b-лактамні антибіотики можуть бути неефективними при лікуванні пневмококової інфекції у дітей, які там проживають. Натомість у столичному будинку дитини відмічається високий рівень резистентності до азитроміцину, що ставить під сумнів доцільність його подальшого застосування в дітей із даного закладу. Очевидно, що в закладах закритого типу слід здійснювати рутинний контроль за антимікробною резистентністю патогенів із метою раціоналізації антибіотикотерапії.
Помічено, що резистентність пневмокока до певного антимікробного препарату корелювала з його серотипом. Так, 86,4 % усіх пеніцилін-резистентних штамів, 89,5 % штамів пневмокока, стійких до еритроміцину, та 66,7 % штамів, стійких до азитроміцину, належали до серотипу 19F. Щодо штамів, резистентних до ципрофлоксацину, то 60 % також належали до серотипу 19F, а 32 % — до 6А/В. Переважна більшість мультирезистентних штамів пневмокока (83 %) належали до серотипу 19F, ще 11 % штамів були безкапсульними (нетипованими), і лише 1 штам (5,5 %) — серотипу 6.
Вивчаючи катамнез дітей протягом 2 місяців, ми виявили, що у 2 носіїв пневмокока розвинувся гострий середній отит. В 1 дитини, яка була носієм пневмокока 19F серотипу, діагностовано 2 епізоди гнійного середнього отиту; хлопчик надійшов у будинок дитини 3 місяці тому. Ще в 1 дитини, яка належала до групи ризику щодо пневмококової інфекції та була носієм капсульного штаму пневмокока, серотип якого не належав до числа 15 (що ідентифікувались у даному дослідженні), спостерігалось 2 епізоди гострого катарального середнього отиту.
У двох дітей розвинувся гострий бронхіт, лікування якого вимагало госпіталізації та призначення антибіотиків. Одна дитина перебувала в закладі 3 місяці і була носієм пневмокока серотипу 19F, інша — належала до групи ризику, проживала в будинку дитини понад 2 роки та була колонізована капсульним пневмококом, серотип якого не вдалось встановити. Через 1,5 місяця від моменту встановлення факту носійства пневмокока, що належав до серотипу 19F, у 7-місячної дитини з групи ризику розвинулась рентгенологічно підтверджена пневмонія, що потребувала стаціонарного лікування. Тобто за перший та другий місяці спостереження відповідно у 6,8 та 12,5 % носіїв пневмокока виникли захворювання, що можуть бути асоційовані з S.pneumoniae.
Отже, з даних анамнезу та катамнезу дітей із будинків дитини випливає, що специфічну профілактику пневмококової інфекції необхідно проводити в максимально короткі строки після надходження дитини до закритого закладу, особливо це стосується дітей перших двох років життя. Слід застосовувати кон’ юговані пневмококові вакцини.
Проте в дітей із групи ризику, у яких за час спостереження виникли захворювання, що найчастіше викликаються пневмококом, носоглотка була колонізована капсульними бактеріями, що не належали до серотипів, включених до складу ПКВ. Тому дітей із групи ризику слід додатково прищеплювати полісахаридною 23-валентною вакциною.
У багатьох дослідженнях показано, що вакцинація є дієвим інструментом подолання антибіотикорезистентності (CDC, 2010), що надзвичайно актуально для закладів закритого типу. Вакцинація знижує рівень носоглоткового носійства S.pneumoniae, що допомагає попередити передачу пневмокока від дитини до дитини. Даний ефект допоможе захистити дітей, які не досягли двох місяців, та тих, хто тимчасово не може бути щеплений через хворобу.
Висновки
1. Колонізація носоглотки S.pneumoniae у дітей до 5 років, які проживають у будинках дитини, становить 95,6 % (95% ДІ: 90,7; 100).
2. Вік, стать та тривалість перебування дитини в закритому колективі не впливають на частоту носійства пневмокока в носоглотці, так само як і місце розташування дитячого будинку.
3. Пневмококи, виділені в дітей із закритих колективів, характеризуються вузьким репертуаром серотипів. Домінують серотипи 19F (54,8 %), 6A/B (22,5 %), 14 (4,8 %) та 23F (3,2 %).
4. Штами пневмококів, виділених із носоглотки вихованців будинків дитини, відзначаються високою резистентністю до антимікробних препаратів: пеніциліну (69 %), еритроміцину (60 %), азитроміцину (22 %), ципрофлоксацину (78 %), ко-тримоксазолу (59 %). Більше половини (56 %) штамів пневмокока є мультирезистентними.
5. Найбільш вразливими щодо розвитку пневмококової інфекції серед дітей із дитячих будинків є «новобранці», тривалість перебування яких у колективі не перевищує 3 місяці, та діти з групи ризику.
6. Діти, які виховуються в будинках дитини, є вразливою когортою, що потребує проведення імунопрофілактики пневмококовою кон’югованою вакциною у найкоротші строки від часу надходження до закладу. Дітей із групи підвищеного ризику слід додатково прищеплювати полісахаридною 23-валентною вакциною.
Подяки. Автори висловлюють подяку адміністрації та медичному персоналу будинків дитини (Лимар Т.В., Помаз Г.М., Власенко Н.О.), медичним сестрам, які проводили забір матеріалу (Прикащиковій Н.Г, Шиманській О.А., Драпой О.В.), та лаборантам (Скорині О.О., Шумаковій Л.Л.) за допомогу у проведенні досліджень.
1. O’Brien K.L., Wolfson L.J., Watt J.P. et al. Hib and Pneumococcal Global Burden of Disease Study Team. Burden of disease caused by Streptococcus pneumonia in children younger than 5 years: global estimates // Lancet. — 2009. — Vol. 379. — Р. 893-902.
2. World Health Organization and UNICEF. Global immunization data. October 2012. Available at: http://www.who.int/immunization_monitoring/Global_Immunization_Data.pdf.p.2. Accessed February 4, 2013.
3. Dagan R. New insights on pneumococcal disease: What we have learned over the past decade // Vaccine. — 2009. — № 27. — Р. 3-5.
4. Farha T., Thomson A.H. The burden of pneumonia in children in the developed world // Paediatr. Respir. Rev. — 2005. — № 6(2). — Р. 76-82.
5. CDC. Prevention of Pneumococcal Disease Among Infants and Children — Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP) // MMWR. — 2010. — № 59 (No. RR-11). Available at http://www.cdc.gov
6. O’Brien K.L., Nohynek H. World Health Organization Pneumococcal Vaccine Trials Carriage Working Group. Report from a WHO Working Group: standard method for detecting upper respiratory carriage of Streptococcus pneumonia // The Pediatric Infectious Disease Journal. — 2003. — Vol. 22. — P. e1-11.
7. Bogaert D., De Groot R., Hermans P.W. Streptococcus pneumoniacolonization: the key to pneumococcal disease // Lancet Infectious Disease. — 2004. — № 4. — Р. 144-154.
8. Taketo Otsuka, Bin Chang et al. Individual Risk Factors Associated With Nasopharyngeal Colonization With Streptococcus pneumonia and Haemophilus influenza: A Japanese Birth Cohort Study // The Pediatric Infectious Disease Journal. — 2013. — Vol. 32. — № 7. — P. 709-714.
9. World Health Organization. Pneumococcal vaccines WHO position paper — 2012 // Weekly epidemiological record. — 2012. — Vol. 87. — № 14. — P. 129-144.
10. Tzanakaki G., Mastrantonio P. Aetiology of bacterial meningitis and resistance to antibiotics of causative pathogens in Europe and in the Mediterranean region // Int. J. Antimicrob. Agents. — 2007. — № 29(6). — Р. 621-629.
11. Tyrrell G.J., Lovgren M., Chui N., Minion J., Garg S., Kellner J.D. et al. Serotypes and antimicrobial susceptibilities of invasive Streptococcus pneumoniae pre- and post-seven valent pneumococcal conjugate vaccine introduction in Alberta, Canada, 2000–2006 // Vaccine. — 2009. — № 27. — Р. 3553-3560.
12. Stancil J.M., Peters T.R., Givner L.B., Poehling K.A. Potential Impact of Accelerating the Primary Dose of Pneumococcal Conjugate Vaccine in Infants // Arch. Pediatr. Adolesc. Med. — 2009. — № 163(5). — Р. 422-425.
13. Soley C., Arguedas A. Understanding the link between pneumococcal serotypes and invasive disease // Vaccine. — 2009. — № 27. — Р. 19-21.
14. Kadioglu A., Weiser J.N., Paton J.C., Andrew P.W. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease // Nat. Rev. Microbiol. — 2008. — № 6(4). — Р. 288-301.
15. Fleming-Dutra K.E., Congil L. et al. Systematic Review of the Effect of Pneumococcal Conjugate Vaccine Dosing Schedules on Vaccine-type Nasopharyngeal Carriage // The Pediatric Infectious Disease Journal. — 2014. — Vol. 33. — № 1. — P. 152-160.
16. Ray G.T., Pelton S.I., Klugman K.P. et al. Cost-effectiveness of pnrumococcal conjugate vaccine: an update after 7 years of use in the United States // Vaccine. — 2009. — № 27. — P. 6483-6494.
17. Rodgers G.L., Arguedas A., Cohen R., Dagan R. Global serotype distribution among S.pneumonia isolates causing otitis media in children: potential implications for pneumococcal conjugate vaccines // Vaccine. — 2009. — № 27. — С. 3802-3810.
18. Techasaensiri C., Messina A.F., Katz K., Ahmad N., Huang R., McCracken G.H., Jr. Epidemiology and evolution of invasive pneumococcal disease caused by multidrug resistant serotypes of 19A in the 8 years after implementation of pneumococcal conjugate vaccine immunizationin Dallas, Texas // Pediatr. Infect. Dis. J. — 2010. — № 29(4). — С. 294-300.
19. Miller E., Andrews N.J., Waight P.A., Slack M.P., George R.C. Herd immunity and serotype replacement 4 years after seven-valent pneumococcal conjugate vaccination in Englandand Wales: an observational cohort study // Lancet Infect. Dis. — 2011. — № 11(10). — Р. 760-768.
20. Маянский А.Н. Стрептококки: микробиология и патология // Вопросы диагностики в педиатрии. — 2010. — № 1. — С. 9-19.

/12/12_2.jpg)